Abstract
临床上,已将深部脑刺激(DBS)技术成功应用于治疗多种脑部疾病。近年的研究推测,DBS 技术使用的电脉冲高频刺激(HFS)可以改变神经元动作电位的病理性节律发放,这可能是 DBS 治疗脑部疾病的重要机制之一,但是这种推测尚需实验数据的证实。本文在已麻醉的大鼠海马 CA1 区的输入轴突束薛氏侧支(Schaffer collaterals)施加时长为 1 min、频率为 100 Hz 的 HFS,并分析刺激下游 CA1 区的锥体神经元和中间神经元的锋电位,考察两种神经元的节律性动作电位发放的变化情况。结果显示,麻醉大鼠 CA1 区的场电位存在明显的 θ 节律,且在顶树突层尤其明显,而神经元锋电位与 θ 节律存在锁相关系。与此基线记录相比较,在 HFS 期间,锥体神经元的锋电位与顶树突层 θ 节律的锁相值从 0.36 ± 0.12 显著减小至 0.06 ± 0.04(P < 0.001,配对 t 检验,N = 8);中间神经元锋电位的锁相值也从 0.27 ± 0.08 减小至 0.09 ± 0.05(P < 0.01,配对 t 检验,N = 8)。两类神经元与胞体层 θ 节律的锁相关系也有类似改变。此结果表明,对轴突束施加 HFS 可以消除下游神经元动作电位发放与场电位 θ 节律之间的锁相关系,改变神经元的节律性发放模式。这种现象产生的机制可能是 HFS 诱导的轴突传导障碍,此发现对于深入研究 DBS 的作用机制具有重要的意义。
Keywords: 高频电刺激, 锋电位, 节律性发放, θ 节律, 锁相
Abstract
Deep brain stimulation (DBS) has been successfully used to treat a variety of brain diseases in clinic. Recent investigations have suggested that high frequency stimulation (HFS) of electrical pulses used by DBS might change pathological rhythms in action potential firing of neurons, which may be one of the important mechanisms of DBS therapy. However, experimental data are required to confirm the hypothesis. In the present study, 1 min of 100 Hz HFS was applied to the Schaffer collaterals of hippocampal CA1 region in anaesthetized rats. The changes of the rhythmic firing of action potentials from pyramidal cells and interneurons were investigated in the downstream CA1 region. The results showed that obvious θ rhythms were present in the field potential of CA1 region of the anesthetized rats. The θ rhythms were especially pronounced in the stratum radiatum. In addition, there was a phase-locking relationship between neuronal spikes and the θ rhythms. However, HFS trains significantly decreased the phase-locking values between the spikes of pyramidal cells and the θ rhythms in stratum radiatum from 0.36 ± 0.12 to 0.06 ± 0.04 (P < 0.001, paired t-test, N = 8). The phase-locking values of interneuron spikes were also decreased significantly from 0.27 ± 0.08 to 0.09 ± 0.05 (P < 0.01, paired t-test, N = 8). Similar changes were obtained in the phase-locking values between neuronal spikes and the θ rhythms in the pyramidal layer. These results suggested that axonal HFS could eliminate the phase-locking relationship between action potentials of neurons and θ rhythms thereby changing the rhythmic firing of downstream neurons. HFS induced conduction block in the axons might be one of the underlying mechanisms. The finding is important for further understanding the mechanisms of DBS.
Keywords: high frequency stimulation, spike, rhythmic firing, θ rhythm, phase-locking
引言
深部脑刺激(deep brain stimulation,DBS)技术在临床上已成功用于治疗帕金森氏症和癫痫等神经系统疾病,近年来,它对于难治性强迫症和抑郁症等精神疾病的治疗效果也逐渐显现[1-3]。临床研究结果表明,DBS 的电脉冲频率达到 90 Hz 以上时才能取得较好的疗效,因此也被称为高频电刺激(high frequency stimulation,HFS)[4]。但是,HFS 用于疾病治疗的生理机制还没有完全明确,阻碍了 DBS 临床应用的快速发展[5-6]。
目前,有关 HFS 机制的假说主要分为抑制作用、兴奋作用和调制作用 3 种。作为神经外科损毁手术的替代方法,在早期,HFS 的作用被推测为抑制神经元的活动。持续的 HFS 可能激活抑制性神经回路[7],或者可能导致兴奋性突触的神经递质耗竭[8],从而产生抑制作用。但是许多动物实验和数学模型仿真等的研究结果都表明,HFS 具有兴奋作用,可以提高某些神经元动作电位的发放率[9]。而近来的研究又表明,HFS 具有调制神经元活动的作用,包括对于各种神经元动作电位发放模式的调制、对于局部场电位的调制等[10-13]。这种调制作用可能诱导出新的神经元活动节律,取代病理性活动,从而获得治疗效果。
脑内神经元动作电位的发放与局部场电位(local field potentials,LFP)节律之间往往存在锁相关系,从而形成神经元的节律性发放。这种节律性发放即有生理性的,在神经信息的编码和解码过程中具有重要作用[14];也有病理性的,是许多脑疾病的特征表现。例如,海马 CA1 区神经元的发放与 LFP 的 θ 节律之间存在明显的锁相关系,这种锁相关系不仅与记忆的形成有关[15],也与癫痫的形成有关[16]。此外,帕金森氏症的特征之一也是神经元产生异常的节律性发放[17]。有研究表明,HFS 除了引起神经元动作电位发放率的变化之外,还可以抑制病理性的节律发放[10, 18-19]。由于神经元的发放节律与 LFP 节律相关;因此我们推测,HFS 可能通过改变两者之间的锁相关系来调节神经元的活动。
为了验证此推测,本文在麻醉大鼠海马 CA1 区的输入轴突束薛氏侧支(Schaffer collaterals,下文统称为:Schaffer 侧支)上施加 HFS,考察下游 CA1 区胞体层细胞外记录的单细胞动作电位[即锋电位(spike)]及其与 LFP 的 θ 节律之间的锁相关系的变化情况,分析 HFS 对锋电位节律性发放的影响。本文的研究结果或可为今后探究 DBS 的作用机制提供一些新的信息。
1. 材料与方法
1.1. 动物手术与电极植入
本实验采用成年雄性 Sprague-Dawley 大鼠共 8 只(260~400 g),购自中国浙江省医学科学院实验动物中心),腹腔注射乌拉坦(urethane),剂量为 1.25 g/kg。麻醉后,固定于脑立体定位仪上。切开大鼠鼻部皮肤,在鼻骨上固定两颗不锈钢螺钉,用作参考电极和接地电极。
切开大鼠头部皮肤,除去部分颅骨后,植入记录电极和刺激电极。记录电极采用 16 通道双列微电极阵列(Poly2,Neuro-Nexus Technologies 公司,美国)植入至海马 CA1 区,定位是前卤后 3.5 mm,旁开 2.7 mm,大脑皮层表面向下深度约 2.5 mm。刺激电极采用双极同芯电极(CBCSG75,FHC 公司,美国),植入至海马 CA1 区的输入通路 Schaffer 侧支,定位为前卤后 2.2 mm,旁开 2.0 mm,大脑皮层表面向下深度约 2.8 mm[12]。
在 Schaffer 侧支上施加单脉冲刺激可以在下游胞体层和顶树突层分别诱发群峰电位(population spike,PS)和兴奋性突触后场电位,根据记录电极阵列上记录到的波形特征,选择胞体层和顶树突层的通道信号(两层次间距约为 0.4 mm),用于分析锋电位和 θ 节律[13]。
1.2. 记录与刺激
记录电极采集到的信号通过 16 通道放大器(3600,A-M System 公司,美国)放大 100 倍,频率范围为 0.3~5 000 Hz。然后通过 PowerLab 多通道采集系统(ML880,ADInstruments 公司,澳大利亚)以 20 kHz 的频率进行采样(模/数转换分辨率为 16 位),数据存入硬盘,用于离线分析。本文将此记录信号称为原始信号。
脉冲刺激由单通道隔离式刺激器(2100,A-M System 公司,美国)产生,是脉宽为 0.1 ms 的双相电流型脉冲。脉冲强度为 0.3~0.5 mA,频率为 100 Hz,HFS 时长为 1 min。
1.3. 锋电位的分析
取记录电极上位于 CA1 区胞体层的 4 个相邻通道的记录信号[20],用于分析神经元的锋电位。首先,应用线性插值法去除 HFS 期间的刺激伪迹[13]。然后,利用 PowerLab 配套的数据分析软件 Labchart 7.0(ADInstruments Inc.,澳大利亚)将去伪迹后的信号进行高通滤波,截止频率为 500 Hz,去除原始信号中的低频场电位,得到多单元锋电位信号(multiple unit activity,MUA)。再利用阈值法检测 MUA 中的锋电位,阈值设为信号标准差的 3~5 倍[21]。最后,采用锋电位波形的主成分和幅值作为特征参数,利用锋电位分类软件 SpikeSort3D(Neuralynx Inc.,美国)完成 4 通道锋电位的分类。并且根据锥体神经元和中间神经元锋电位的波形特征,确定锋电位归属的神经元类型[20, 22]。本文下面将分类之前的多单元锋电位简称为 MUA。
1.4. 锋电位发放与场电位节律之间关系的分析
为了研究海马 CA1 区神经元锋电位发放与 LFP 的 θ 节律之间的锁相关系,选择位于胞体层和顶树突层的各一个通道的记录信号,将两通道信号进行带通滤波(2~5 Hz),提取麻醉状态下大鼠海马 CA1 区的 θ 节律信号[14]。
然后,采用区间统计法分析锋电位与 θ 节律之间的锁相关系[23]:将每个 θ 节律的周期 T 对应至 0°~360° 圆周上(设 θ 节律的峰点为 0°),并计算各周期 T 内每个锋电位发放时刻所对应的相位角 αi(1 ≤ i ≤ n,n 为锋电位个数),采用圆分布统计法计算锋电位相位角的均值和标准差[24]。
锋电位与 θ 节律之间锁相关系的强弱用锁相值(phase-locking value)来评估,设为 r。r 的计算公式为[25]:
 |
1 |
r 取值为 0~1。r 值越接近于 1,表示锋电位与 θ 节律之间的锁相关系越强;反之,r 值越接近 0,则锁相关系越弱。
利用瑞利检验(Rayleigh test)判断锋电位与 θ 节律之间是否锁相。也就是,对于单峰分布,计算概率值:
 |
2 |
当 P < 0.01 时,认为相位角 αi 的分布不均匀,即神经元的锋电位与 θ 节律之间存在明显的锁相关系。
实验数据均以均值 ± 标准差表示,采用配对 t 检验来判断 HFS 期间与 HFS 前基线记录数据之间的差别是否具有统计学意义。
2. 结果
2.1. 神经元锋电位发放与场电位 θ 节律之间的锁相关系
如图 1 左图所示,海马 CA1 区的胞体层和顶树突层都存在 θ 节律,且顶树突层 LFP 的 θ 节律较明显。胞体层的 MUA 与两层次上的 θ 节律之间都存在锁相关系。由于胞体层和顶树突层的 θ 节律之间存在约 150° 的相位差,如图 1 右图所示,因此图中示例的中间神经元 MUA 的发放分别集中于胞体层 θ 节律的下降相和顶树突层 θ 节律的上升相。对于胞体层的 θ 节律(若峰点设为 0°),锋电位的相位平均角为 123° ± 70°(n = 939),锁相值 r = 0.26;对于顶树突层的 θ 节律(若峰点设为 0°),锋电位的相位平均角为 274° ± 60°(n = 939),锁相值 r = 0.35。为了清楚地显示锋电位与 θ 节律之间的相位关系,图 1 右图重复显示了 2 个 θ 周期的数据。
图 1.

Phase-locking relationship between the neuronal spikes and the θ rhythms in the hippocampal CA1 region
海马 CA1 区神经元锋电位与 θ 节律之间的锁相关系
8 只大鼠的实验数据统计结果显示,锥体神经元在胞体层 θ 节律上的平均发放相位角为 197° ± 55°,锁相值 r = 0.32 ± 0.14;在顶树突层上的平均发放相位角为 341° ± 75°,锁相值 r = 0.36 ± 0.12。中间神经元的锋电位在胞体层 θ 节律上的平均发放相位角为 116° ± 58°,锁相值 r = 0.24 ± 0.14,在顶树突层上的平均发放相位角为 278° ± 49°,锁相值 r = 0.27 ± 0.08。两类神经元的锋电位发放与 θ 节律之间都存在明显的锁相关系(P < 0.001)。
这些结果表明,在乌拉坦麻醉状态下的基线记录中,海马 CA1 区胞体层和顶树突层上均存在明显的 θ 节律,且它们之间存在一定的相移。神经元锋电位的发放与两层次的 θ 节律均存在明显的锁相关系。接下来我们研究 HFS 是否会改变这种锁相关系。
2.2. HFS 对于神经元锋电位发放锁相关系的影响
如图 2 所示,在 Schaffer 侧支上施加时长为 1 min 、频率为 100 Hz 的 HFS(图中用阴影表示),期间 MUA 增加,顶树突层的 θ 节律明显减弱,而胞体层的 θ 节律变化不明显。在分析 HFS 期间锋电位与 θ 节律之间的锁相关系时,为了避免 HFS 起始处诱发的群峰电位的干扰[12, 20],取 HFS 后期的 45 s 信号用于刺激期间的锋电位分析。相应地,取 HFS 之前 45 s 基线信号作为对照。同时为了避开紧随 HFS 结束后的锋电位消失的静息期[20],取 HFS 结束 2 min 之后的 45 s 的信号来考察恢复状态。
图 2.
Effects of HFS on LFP θ rhythms and neuronal spikes
HFS 对于场电位 θ 节律和神经元锋电位发放的影响
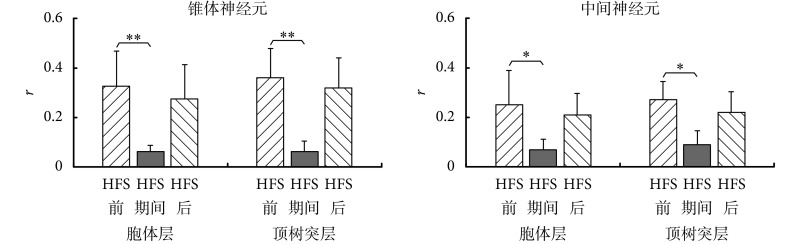
如图 3 所示,HFS 前 MUA 的发放在 LFP 的 θ 周期中锁相关系明显。但是,在 HFS 期间,虽然神经元发放率增加,MUA 与 θ 节律之间的锁相关系却不再明显。HFS 结束后又恢复锁相关系。8 只大鼠的实验数据统计结果显示,HFS 期间锥体和中间两类神经元的锋电位与 θ 节律的锁相值 r 显著减小。如图 4 所示,锥体神经元的锋电位与胞体层 θ 节律之间的锁相值 r = 0.06 ± 0.03,明显小于 HFS 前的 r = 0.32 ± 0.14(P < 0.001);与顶树突层 θ 节律之间的锁相值 r = 0.06 ± 0.04,也明显小于 HFS 前的 r = 0.36 ± 0.12(P < 0.001)。类似地,对于中间神经元的锋电位,HFS 期间它们与胞体层 θ 节律之间的锁相值 r = 0.07 ± 0.04 小于 HFS 前的 r = 0.24 ± 0.14(P < 0.01);与顶树突层的 θ 节律之间的锁相值 r = 0.09 ± 0.05 也小于 HFS 前的 r = 0.27 ± 0.08(P < 0.01)。HFS 结束 2 min 后,两类神经元锋电位与 θ 节律之间的锁相关系都恢复,如 图 4 所示。
图 3.

Effects of HFS on MUA,θ rhythms as well as the phase-locking relationship between them
HFS 对 MUA、θ 节律以及两者锁相关系的影响
图 4.
HFS changes the phase-locking relationships between neuronal spikes and θ rhythms
HFS 改变两种神经元锋电位与 θ 节律之间的锁相关系
*P < 0.01, **P < 0.001,paired t-test,N = 8
*P < 0.01, **P < 0.001,配对 t 检验,N = 8
由于胞体层的 θ 节律与顶树突层的 θ 节律之间存在较为固定的相位差,如图 1 所示,因此锋电位与两 θ 节律的锁相值比较接近。
此结果表明,HFS 期间锥体神经元和中间神经元锋电位的发放与 θ 节律之间的锁相关系都有所减弱,神经元的 θ 节律发放消失。
3. 讨论
本文的研究结果表明,海马 CA1 区输入轴突束 Schaffer 侧支上的 HFS 可以消除神经元动作电位发放与场电位 θ 节律之间的锁相关系,改变下游神经元的节律性发放,其中的可能机制分析如下文所述。
首先,HFS 导致的 CA1 区 θ 节律的减弱可能是原因之一。HFS 期间场电位的 θ 节律(特别是顶树突层的 θ 节律)被明显抑制,如图 2、图 3 所示。这种抑制可能由 HFS 阻断了上游与下游之间信息传播引起的。有研究表明,海马 CA1 区场电位的 θ 节律是多种机制作用的结果,包括来自上游 CA3 区神经元群体的节律性活动和来自嗅皮层的输入,也包括锥体神经元顶树突的电压依赖性钙离子流的作用等[14, 26-28]。而且,如图 1 所示,基线记录信号的顶树突层 θ 节律的幅值明显大于胞体层,表明上游 CA3 区对于顶树突层的输入可能有较大贡献。本文 HFS 的作用位点(Schaffer 侧支)就是 CA3 区锥体神经元至 CA1 区顶树突的传输通路,而 HFS 可以导致轴突的传导阻滞现象,阻止上游信息传导至下游。这种传导阻滞的可能原因是 HFS 产生轴突细胞膜外钾离子浓度的升高。由于轴突束的膜外空间狭小,轴突兴奋时外流的钾离子积累起来,膜外过高的钾离子浓度使得轴突产生去极化阻滞[29-30]。由此可见,Schaffer 侧支上的 HFS 可能隔离了上游 CA3 区的 θ 节律振荡,使得 CA1 区顶树突层的 θ 节律明显减弱[13],进而减弱场电位节律对于神经元发放的调制作用,引起锋电位节律性发放的消失。
其次,HFS 期间刺激脉冲的调制作用可能是神经元锋电位发放模式改变的另一个原因。轴突上的 HFS 在阻断上游与下游之间的信息传导的同时,其中的脉冲仍然可以引起轴突产生某种兴奋,并沿着轴突传播至下游,引起下游 CA1 区神经元的发放增加,如图 2 所示,并且改变下游神经元的发放模式[12, 20]。因此,如图 3、图 4 所示,当锋电位的发放受到频率为 100 Hz 的 HFS 的调制时,可以产生均匀分布的时间序列,消除低频的 θ 节律发放。
综上所述,轴突上的 HFS 对于下游神经元的调节可能由双重作用引起。一方面,HFS 引起的轴突传导阻滞切断了上游原有节律性信息的传播;另一方面,HFS 中包含的刺激脉冲对于下游神经元产生了新的调制作用。在这种双重作用下,CA1 区神经元的 θ 节律发放消失。由于轴突相比神经元其他结构的兴奋阈值要低,更容易被脉冲刺激激活[31];因此,本文有关轴突 HFS 的研究结果可能对于不同刺激位点的 DBS 都具有普遍意义。而且,鉴于帕金森氏症和癫痫等疾病都与神经元群体同步的节律性发放增强有关[32-33],因此本文的发现对于促进 DBS 的临床应用可能具有重要意义。
Funding Statement
国家自然科学基金资助项目(30970753)
References
- 1.Pouratian N, Thakkar S, Kim W, et al Deep brain stimulation for the treatment of Parkinson's disease: efficacy and safety. Degener Neurol Neuromuscul Dis. 2012;(2):6–17. doi: 10.2147/DNND.S25750. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Lega B C, Halpern C H, Jaggi J L, et al Deep brain stimulation in the treatment of refractory epilepsy: update on current data and future directions. Neurobiol Dis. 2010;38(3):354–360. doi: 10.1016/j.nbd.2009.07.007. [DOI] [PubMed] [Google Scholar]
- 3.Mayberg H S, Lozano A M, Voon V, et al Deep brain stimulation for Treatment-Resistant depression. Neuron. 2005;45(5):651–660. doi: 10.1016/j.neuron.2005.02.014. [DOI] [PubMed] [Google Scholar]
- 4.Birdno M J, Kuncel A M, Dorval A D, et al Stimulus features underlying reduced tremor suppression with temporally patterned deep brain stimulation. J Neurophysiol. 2012;107(1):364–383. doi: 10.1152/jn.00906.2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Chiken S, Nambu A Mechanism of deep brain stimulation: inhibition, excitation, or disruption? Neuroscientist. 2016;22(3):313–322. doi: 10.1177/1073858415581986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Udupa K, Chen R The mechanisms of action of deep brain stimulation and ideas for the future development. Prog Neurobiol. 2015;133:27–49. doi: 10.1016/j.pneurobio.2015.08.001. [DOI] [PubMed] [Google Scholar]
- 7.Alhourani A, Mcdowell M M, Randazzo M J, et al Network effects of deep brain stimulation. J Neurophysiol. 2015;114(4):2105–2117. doi: 10.1152/jn.00275.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Iremonger K J, Anderson T R, Hu Bin, et al Cellular mechanisms preventing sustained activation of cortex during subcortical high-frequency stimulation. J Neurophysiol. 2006;96(2):613–621. doi: 10.1152/jn.00105.2006. [DOI] [PubMed] [Google Scholar]
- 9.Deniau J M, Degos B, Bosch C, et al Deep brain stimulation mechanisms: beyond the concept of local functional inhibition. Eur J Neurosci. 2010;32(7):1080–1091. doi: 10.1111/j.1460-9568.2010.07413.x. [DOI] [PubMed] [Google Scholar]
- 10.McConnell G C, So R Q, Hilliard J D, et al Effective deep brain stimulation suppresses low-frequency network oscillations in the basal ganglia by regularizing neural firing patterns. J Neurosci. 2012;32(45):15657–15668. doi: 10.1523/JNEUROSCI.2824-12.2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Rosenbaum R, Zimnik A, ZHENG Fang, et al Axonal and synaptic failure suppress the transfer of firing rate oscillations, synchrony and information during high frequency deep brain stimulation. Neurobiol Dis. 2014;62(2):86–99. doi: 10.1016/j.nbd.2013.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Feng Zhouyan, Zheng Xiaojing, Yu Ying, et al Functional disconnection of axonal fibers generated by high frequency stimulation in the hippocampal CA1 region in-vivo . Brain Res. 2013;1509(7):32–42. doi: 10.1016/j.brainres.2013.02.048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yu Ying, Feng Zhouyan, Cao Jiayue, et al Modulation of local field potentials by high-frequency stimulation of afferent axons in the hippocampal CA1 region. J Integr Neurosci. 2016;15(1):1–17. doi: 10.1142/S0219635216500011. [DOI] [PubMed] [Google Scholar]
- 14.Buzsáki G Theta oscillations in the hippocampus. Neuron. 2002;33(3):325–340. doi: 10.1016/s0896-6273(02)00586-x. [DOI] [PubMed] [Google Scholar]
- 15.Rutishauser U, Ross I B, Mamelak A N, et al Human memory strength is predicted by theta-frequency phase-locking of single neurons. Nature. 2010;464(7290):903–907. doi: 10.1038/nature08860. [DOI] [PubMed] [Google Scholar]
- 16.Kitchigina V, Popova I, Sinelnikova V, et al Disturbances of septohippocampal theta oscillations in the epileptic brain: reasons and Consequences. Exp Neurol. 2013;247(3):314–327. doi: 10.1016/j.expneurol.2013.01.029. [DOI] [PubMed] [Google Scholar]
- 17.Singh A, Mewes K, Gross R E, et al Human striatal recordings reveal abnormal discharge of projection neurons in Parkinson's disease. Proc Natl Acad Sci U S A. 2016;113(34):9629–9634. doi: 10.1073/pnas.1606792113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Dorval A D, Russo G S, Hashimoto T, et al Deep brain stimulation reduces neuronal entropy in the MPTP-primate model of Parkinson's disease. J Neurophysiol. 2008;100(5):2807–2818. doi: 10.1152/jn.90763.2008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.McConnell G C, So R Q, Grill W M Failure to suppress low-frequency neuronal oscillatory activity underlies the reduced effectiveness of random patterns of deep brain stimulation. J Neurophysiol. 2016;115(6):2791–2802. doi: 10.1152/jn.00822.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Feng Zhouyan, Wang Zhaoxiang, Guo Zheshan, et al High frequency stimulation of afferent fibers generates asynchronous firing in the downstream neurons in hippocampus through partial block of axonal conduction. Brain Res. 2017;1661:67–78. doi: 10.1016/j.brainres.2017.02.008. [DOI] [PubMed] [Google Scholar]
- 21.Vargas-Irwin C E, Donoghue J P Automated spike sorting using density grid contour clustering and subtractive waveform decomposition. J Neurosci Methods. 2007;164(1):1–18. doi: 10.1016/j.jneumeth.2007.03.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Barthó P, Hirase H, Monconduit L, et al Characterization of neocortical principal cells and interneurons by network interactions and extracellular features. J Neurophysiol. 2004;92(1):600–608. doi: 10.1152/jn.01170.2003. [DOI] [PubMed] [Google Scholar]
- 23.Klausberger T, Márton L F, Baude A, et al Spike timing of dendrite-targeting bistratified cells during hippocampal network oscillations in vivo . Nat Neurosci. 2004;7(1):41–47. doi: 10.1038/nn1159. [DOI] [PubMed] [Google Scholar]
- 24.Berens P CircStat: a MATLAB toolbox for circular statistics. J Stat Softw. 2009;31(1):1–21. [Google Scholar]
- 25.Lowet E, Roberts M J, Bonizzi P, et al Quantifying neural oscillatory synchronization: a comparison between spectral coherence and Phase-Locking value approaches. PLoS One. 2016;11(1):e0146443. doi: 10.1371/journal.pone.0146443. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Lee M G, Chrobak J J, Sik A, et al Hippocampal theta activity following selective lesion of the septal cholinergic system. Neuroscience. 1994;62(4):1033–1047. doi: 10.1016/0306-4522(94)90341-7. [DOI] [PubMed] [Google Scholar]
- 27.Kamondi A, Acsády L, Wang X J, et al Theta oscillations in somata and dendrites of hippocampal pyramidal cells in vivo: activity-dependent phase-precession of action potentials . Hippocampus. 1998;8(3):244–261. doi: 10.1002/(SICI)1098-1063(1998)8:3<244::AID-HIPO7>3.0.CO;2-J. [DOI] [PubMed] [Google Scholar]
- 28.Buzsáki G, Moser E I Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat Neurosci. 2013;16(2):130–138. doi: 10.1038/nn.3304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Meeks J P, Mennerick S Selective effects of Potassium elevations on glutamate signaling and action potential conduction in hippocampus. J Neurosci. 2004;24(1):197–206. doi: 10.1523/JNEUROSCI.4845-03.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Bellinger S C, Miyazawa G, Steinmetz P N Submyelin Potassium accumulation May functionally block subsets of local axons during deep brain stimulation: a modeling study. J Neural Eng. 2008;5(3):263–274. doi: 10.1088/1741-2560/5/3/001. [DOI] [PubMed] [Google Scholar]
- 31.Ranck J B Which elements are excited in electrical stimulation of mammalian central nervous system: a review. Brain Res. 1975;98(3):417–440. doi: 10.1016/0006-8993(75)90364-9. [DOI] [PubMed] [Google Scholar]
- 32.Lehnertz K, Bialonski S, Horstmann M T, et al Synchronization phenomena in human epileptic brain networks. J Neurosci Methods. 2009;183(1):42–48. doi: 10.1016/j.jneumeth.2009.05.015. [DOI] [PubMed] [Google Scholar]
- 33.Rubchinsky L L, Park C, Worth R M Intermittent neural synchronization in Parkinson’s disease. Nonlinear Dyn. 2012;68(3):329–346. doi: 10.1007/s11071-011-0223-z. [DOI] [PMC free article] [PubMed] [Google Scholar]