Abstract
右心室(RV)衰竭已成为左心室辅助装置(LVAD)治疗的一种致命并发症。由 LVAD 引起的双心室搏动的不同步是引发 RV 功能障碍的重要因素。本文采用数值方法研究 LVAD 的控制模式对左、右心室搏动同步性的影响。数值结果表明:左心室(LV)与 RV 的收缩持续时间在无泵模式下没有显著差异(分别为 48.52% 和 51.77%)。连续模式下,LV 收缩期明显短于 RV 收缩期(LV vs. RV:24.38% vs. 49.16%)和无泵模式的 LV 收缩期。搏动模式下,LV 收缩期明显短于 RV 收缩期(LV vs. RV:28.38% vs. 50.41%)但长于连续模式的 LV 收缩期。反搏动模式中的 LV、RV 收缩期差异较小(LV vs. RV:43.13% vs. 49.23%),而 LV 收缩期短于无泵模式,并且长于连续模式。与连续和搏动模式相比,由反搏动模式提供的收缩期转速(RS)降低显著地校正了 LV 收缩持续时间,连续模式下缩短的收缩持续时间在反搏动模式下被校正为 LV 和 RV 之间的重新同步。因此,本文认为 LV 和 RV 收缩的再同步有助于预防 RV 功能障碍。总之,使用在收缩期间降低 RS 的反搏动模式有望用于由 LVAD 引起的双心室搏动不同步的临床校正。
Keywords: 左心室辅助装置, 右心室衰竭, 同步性, 反搏动模式
Abstract
Right ventricular (RV) failure has become a deadly complication of left ventricular assist device (LVAD) implantation, for which desynchrony in bi-ventricular pulse resulting from a LVAD is among the important factor. This paper investigated how different control modes affect the synchronization of pulse between LV (left ventricular) and RV by numerical method. The numerical results showed that the systolic duration between LV and RV did not significantly differ at baseline (LVAD off and cannula clamped) (48.52% vs. 51.77%, respectively). The systolic period was significantly shorter than the RV systolic period in the continuous-flow mode (LV vs. RV: 24.38% vs. 49.16%) and the LV systolic period at baseline. The LV systolic duration was significantly shorter than the RV systolic duration in the pulse mode (LV vs. RV: 28.38% vs. 50.41%), but longer than the LV systolic duration in the continuous-flow mode. There was no significant difference between the LV and RV systolic periods in the counter-pulse mode (LV vs. RV: 43.13% vs. 49.23%). However, the LV systolic periods was shorter than the no-pump mode and much longer than the continuous-flow mode. Compared with continuous-flow and pulse mode, the reduction in rotational speed (RS) brought out by counter-pulse mode significantly corrected the duration of LV systolic phase. The shortened duration of systolic phase in the continuous-flow mode was corrected as re-synchronization in the counter-pulse mode between LV and RV. Hence, we postulated that the beneficial effects on RV function were due to re-synchronizing of RV and LV contraction. In conclusion, decreased RS delivered during the systolic phase using the counter-pulse mode holds promise for the clinical correction of desynchrony in bi-ventricular pulse resulting from a LVAD and confers a benefit on RV function.
Keywords: left ventricular assist device, right ventricle failure, synchronization, counter-pulse mode
引言
作为心脏移植的桥梁或目标治疗手段,旋转式左心室辅助装置(left ventricular assist device,LVAD)有效提高了终末期心力衰竭患者的心脏功能和生活质量[1-4]。相比于搏动型 LVAD,由于患者并发症的减少和预后的改善,连续型 LVAD 目前被广泛应用[5]。对于接受 LVAD 治疗的患者,有 10%~30% 的病例发生右心室衰竭[6]。Chow 等[7]发现对正常心脏行 LVAD 时,左室压下降 90%,而右室功能却不受影响。Moon 等[8]的研究发现行 LVAD 时,右室收缩力有一定减低。Farrar 等[9]在右心室功能障碍的模型上行 LVAD 时发现,右室每搏功和心输出量明显减少。国内研究者在右心功能不全时行 LVAD 后,发现右心室最大收缩压及其一阶导数明显下降,而在右心功能正常时,除肺动脉压有所下降外,上述血流动力学指标无明显变化。因此认为,原已存在的右心功能不全是 LVAD 治疗中右心室衰竭的主要原因。
在生理上,LVAD 对右心室功能的影响具有双重性[10-11]。LVAD 卸载使左心室压下降,进而降低了肺动脉压,减轻右心室后负荷,对右心室功能有利[12]。然而,相关研究表明左心室几何形状的变化,特别是由室间隔(ventricular septal,VS)移位引起的变化将导致 RV 收缩性降低[13],进而引发右心室衰竭。VS 移位发生在 LVAD 治疗期间,尤其在 LVAD 处于过度辅助时[11]。此外,研究表明,心室间非同步搏动的形成与 LV 几何形态的改变有关,心室间非同步搏动会导致心功能下降[14]。患有右心室衰竭的 LVAD 患者通常伴随多器官功能衰竭[15],因此他们需要高血流支持。高血流的支持意味着 LVAD 的转速升高,而转速的增加会加剧 RV 功能障碍,从而导致全身性血流减少。如果 LVAD 患者对右心室功能障碍的药物治疗无反应,则需要进行二次手术以植入右心室辅助装置[16]。理想情况下,LVAD 不仅应满足最大血流量灌注需求,还应综合考虑对 RV 功能的影响。
Arakawa 等[17]认为在 LVAD 辅助期间,尤其是室间隔的变化可以控制 RV 功能。因此,他们为离心式 LVAD 提出了反博模式并开展了动物实验。结果表明,这种与心跳同步的驱动模式通过在收缩期期间减少转速抑制了室间隔向左心室偏移且显著改变了正常山羊的冠状动脉血流,有利于改善 VS 和 RV 功能。
生理上,自然心脏的左、右心室几乎是同时进行收缩和舒张的。左、右心室之间有着解剖结构和功能上的密切联系,两者之间共有一个室间隔。由于 LVAD 的卸载作用,左心室内压力下降。左心室压下降可使室间隔向左心室侧移位,引起左心室几何形态的改变,包括左心室容积下降,进而导致左、右心室的非同步搏动。若心室间长期处于非同步搏动的状态,将会影响心室射血分数,导致心功能下降,造成右心室功能障碍。目前,由于 LVAD 卸载,心室间相互作用的变化规律,其控制模式对心室间搏动同步性的影响规律尚未完全清楚。因此,本文基于 LVAD 和心血管系统的耦合模型,采用数值仿真的方法探索 LVAD 控制模式对双心室搏动同步性的影响以及左、右心室间血流动力学变化规律,初步探讨右心衰竭的原因,为预防右心衰竭提供理论依据。
1. 方法
1.1. LVAD 和心血管系统的耦合模型
人体血液循环系统具有高度动态特性,是一个非线性、时变和不连续的系统。心血管系统的建模仿真以血流动力学为基础,结合人体生理学知识,利用流体网络与电学网络的相似性,建立相应的等效电路模型。离心泵作为 LVAD 采用并联的方式桥接于左心室和主动脉之间。在本课题组[18]的前期研究工作中已提出该离心泵数学模型。采用集总参数的心血管系统模型,包括左、右心脏,体循环和肺循环。心脏周期性的收缩和舒张可用血压-容积关系来描述,采用 Suga 等[19]提出的时变心室弹性模型。体循环和肺循环的动脉及静脉系统采用经典的弹性腔 Windkessel 四元件模型,描述了血管对血流的阻力、顺应性以及惯性。数值模型的仿真在 Matlab 软件中实现,在数值仿真中,将左心室收缩的最大弹性系数 Emax 降低至健康状态下的一半,来模拟左心衰状态。
LVAD 与心血管系统耦合模型的等效电路如图 1 所示。等效电路中的电阻、电感和电容分别表示血流阻力、血液惯性和血管对血液的顺应性。心血管系统中的血压、血流类比为等效电路中的电压和电流。其中 H 为血泵的扬程(压差),根据泵数学模型可得到关于泵转速的函数。此外,X13(t)表示泵流量,电阻 Ri 和电感 Li 表示心脏泵进口套管的血流阻力和惯性,出口套管的血流阻力和惯性由 Ro、Lo 表示。电阻 RK 是抽吸元件模型,用于模拟 LVAD 的异常工况。图中 X(t)表示状态变量,其生理意义以及模型参数见表 1、表 2[20]。
图 1.
Equivalent circuit diagram of heart pump and cardiovascular coupling system
心脏泵和心血管耦合系统等效电路图
表 1. The state variables of cardiovascular system.
心血管系统集总参数模型状态变量
| 变量 | 符号 | 单位 | 生理意义 |
| X1(t) | LVP | mm Hg | 左心室压 |
| X2(t) | AOP | mm Hg | 主动脉压 |
| X3(t) | AP | mm Hg | 体循环系统动脉压 |
| X4(t) | SVP | mm Hg | 体静脉压 |
| X5(t) | RAP | mm Hg | 右心房压 |
| X6(t) | RVP | mm Hg | 右心室压 |
| X7(t) | PAP | mm Hg | 肺动脉压 |
| X8(t) | PP | mm Hg | 肺循环系统动脉压 |
| X9(t) | PVP | mm Hg | 肺静脉压 |
| X10(t) | LAP | mm Hg | 左心房压 |
| X11(t) | AF | mL/s | 主动脉流量 |
| X12(t) | PF | mL/s | 肺动脉流量 |
表 2. The parameters of cardiovascular system.
心血管系统集总参数模型参数列表
| 参数 | 数值 | 生理意义 | |
| 电阻/ (mm Hg·s·mL−1) |
Rm | 0.005 | 二尖瓣阻力 |
| Ra | 0.001 | 主动脉瓣阻力 | |
| Rao | 0.045 | 主动脉特性阻力 | |
| Rs | 1 | 体循环动脉阻力 | |
| Rsv | 0.005 | 体循环静脉阻力 | |
| Rt | 0.005 | 三尖瓣阻力 | |
| Rpt | 0.001 | 肺动脉瓣阻力 | |
| Rpa | 0.015 | 肺动脉特性阻力 | |
| Rp | 0.1 | 肺循环动脉阻力 | |
| Rpv | 0.005 6 | 肺循环静脉阻力 | |
| 顺应性/ (mL·mm Hg−1) |
Cla | 时变 | 左心房顺应性 |
| Clv | 时变 | 左心室顺应性 | |
| Cao | 0.5 | 主动脉顺应性 | |
| Cs | 1.33 | 体循环动脉顺应性 | |
| Csv | 2.518 1 | 体循环静脉顺应性 | |
| Cra | 时变 | 右心房顺应性 | |
| Crv | 时变 | 右心室顺应性 | |
| Cpa | 1.6 | 肺动脉顺应性 | |
| Cp | 5.8 | 肺循环动脉顺应性 | |
| Cpv | 30 | 肺循环静脉顺应性 | |
| 惯性/ (mm Hg·s2·mL−1) |
Ls | 0.000 5 | 主动脉血液惯性 |
| Lp | 0.000 2 | 肺动脉血液惯性 | |
| 瓣膜 | Dm | 二极管模型 | 二尖瓣 |
| Da | 二极管模型 | 主动脉瓣 | |
| Dt | 二极管模型 | 三尖瓣 | |
| Dp | 二极管模型 | 肺动脉瓣 |
根据基尔霍夫定律建立耦合模型的状态方程组,描述了心血管系统血流动力学的瞬态变化过程。以心动周期中的心室舒张末期为仿真起点,赋予状态变量初值,考虑到数据的精度,仿真步长设置为 Δt = 0.000 1 s。则状态变量的值表示为:
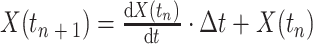 |
1 |
其中,X(tn)表示此时刻状态变量的值,X(tn + 1)表示下一时刻状态变量的值。
1.2. 研究方案
自然心脏的周期性收缩和舒张受起搏传导系统控制。窦房结是心脏的起搏点,起搏脉冲通过结间束使右、左心房先后收缩,分别将血液灌入右、左心室,并将其产生的激动脉冲传导至房室结,再经房室束左、右束支传导至浦肯野纤维网使左、右心室几乎同时被兴奋而产生机械收缩,将血液分别泵入主动脉和肺动脉。然而,LVAD 的耦合及其不同的控制模式将会对左、右心室收缩的同步性产生不同的影响。因此,本文以无泵辅助模式(心衰状态)作为对照组,研究 LVAD 的 3 种控制模式对左、右心室搏动同步性的影响(见图2)。
图 2.
The diagram of study
研究方案
本文将 LV 和 RV 收缩持续时间(%)定义为等容收缩期和各个心室的射血期之和除以 RR 间期,心动周期的收缩期和舒张期分别定义为 RR 间期的前 33% 和后 67%。仿真中,心率设置为静息状态下的 75 次/分,则心动周期为 0.8 s。心室等容收缩期间,房室瓣和动脉瓣均处于关闭状态,心室暂时成为一个封闭的腔,心室收缩不改变心室的容积,且室内压急剧升高;射血期间,心室压高于动脉压。因此,根据心室的等容收缩期和射血期的血流动力学特点,在仿真得到的压力和容积数据中,统计符合等容收缩期和射血期特点的数据,计算 LV 和 RV 的收缩持续时间。LVAD 的 3 种控制模式设置如图 3 所示。三种控制模式为:① 连续模式,即设置泵转速恒定为 2 700 r/min;② 搏动模式,即在收缩期增加转速为 2 800 r/min,舒张期降低转速为 2 300 r/min;③ 反搏动模式,即在收缩期降低转速为 2 200 r/min,舒张期增加转速为 2 700 r/min。
图 3.

LVAD control modes
LVAD 控制模式
2. 结果
图 4、图 5 为数值结果。如图 4 所示,在 LVAD 辅助(连续、搏动和反搏动模式)下,主动脉压(aortic pressure,AOP)均明显升高。其中,连续模式下,左心室压(left ventricular pressure,LVP)降低,且 LVP 持续低于 AOP。AOP 在连续模式和反搏动模式中变化较为平缓,搏动性较低,但在搏动模式中,AOP 的搏动性得到改善。与无泵模式相比,由于 LVAD 的卸载作用,LVAD 模式的左心室舒张末期压力降低,即减小了左心室负荷。RV 压力波形在三种模式中没有显著差异。
图 4.
LVP, RVP and AOP waveforms
LVP、RVP 和 AOP 波形图
图 5.
P-V loops of LV and RV
LV、RV 的 P-V 环
图 5 中的 LVV 和 RVV 分别表示左心室容积(left ventricular volume,LVV)和右心室容积(right ventricular volume,RVV)。如图 5 所示,与无泵模式相比,LVAD 模式的左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)显著降低,右心室舒张末期容积(right ventricular end-diastolic volume,RVEDV)均有所增加,表明三种控制模式均实现左心室卸载,但同时增加了右心室负荷。连续模式下,左心 P-V 环左移明显,RVEDV 最大,这说明连续模式对左心室的卸载作用最大,同时对右心室负荷的增加也达到最大。与连续模式相比,反搏动模式和搏动模式下的 LVEDV(前负荷)增加,后者更显著;而这两种模式下的 RVEDV 减小,与 LVEDV 的变化规律相反,这说明 LVEDV 与 RVEDV 的变化是互补的。左心室收缩末期压力—容积关系曲线(end-systolic pressure-volume relation,ESPVR)可反映心室收缩能力。在 LVAD 辅助下,反搏动模式的 ESPVR 斜率最大;同样地,表 3 中的左心室收缩压变化率峰值,即 dP/dtmax 也达到最大。说明反搏动模式下的左心室收缩能力最强,而连续模式的左心室收缩力最弱。
表 3. Relevant parameters per mode.
每种模式下的相关参数
| 血流动力学参数 | 无泵模式 | 连续模式 | 搏动模式 | 反搏动模式 |
| 平均主动脉压/mm Hg | 70.05 | 89.18 | 83.35 | 87.45 |
| 平均肺动脉压/mm Hg | 15.01 | 15.17 | 15.04 | 15.13 |
| 主动脉压搏动系数 | 0.38 | 0.04 | 0.13 | 0.08 |
| 肺动脉压搏动系数 | 0.54 | 0.58 | 0.55 | 0.57 |
| 左心室压变化率峰值/(mm Hg·s-1) | 746 | 537 | 578 | 590 |
图 6 表明,控制模式会影响 LV 与 RV 的收缩持续时间。LV 与 RV 的收缩持续时间在无泵模式下分别为 48.52% 和 51.77%,差异较小。连续模式下,LV 收缩期明显短于 RV 收缩期(LV vs. RV:24.38% vs. 49.16%)和无泵模式的 LV 收缩期。搏动模式下,LV 收缩期明显短于 RV 收缩期但长于连续模式的 LV 收缩期(LV vs. RV:28.38% vs. 50.41%)。反搏动模式中的 LV、RV 收缩期差异较小(LV vs. RV:43.13% vs. 49.23%),而 LV 收缩期短于无泵模式,并且长于连续模式。总之,LV 收缩持续时间在连续模式下最短,而在反搏动模式中得到明显校正。
图 6.
Systolic duration of LV and RV
LV、RV 的收缩持续时间
如图 7 所示,LVAD 辅助期间,平均主动脉血流量(aortic flow,AF)和平均肺动脉血流量(pulmonary artery flow,PF)均高于无泵模式。相对于连续模式,搏动和反搏动模式可跟随心动周期改变转速,使系统主动脉流量与肺动脉流量相差较小,有助于维持左、右心输出量的平衡。
图 7.
Left and right cardiac output
左、右心输出量
表 3 表明,平均肺动脉压在四种模式中无明显差异,而在 LVAD 辅助下,系统的平均主动脉压均有所提高。与无泵模式相比,LVAD 模式均降低了主动脉压搏动系数。其中,搏动模式由于其在收缩期增加转速,舒张期降低转速,主动脉压搏动系数有提高,但仍然低于无泵模式;连续模式和反搏动模式下的搏动系数较低。可见,LVAD 模式虽然提高了压力灌注,但却降低了系统的搏动性。
3. 讨论与分析
自然心脏的搏动具有同步性。在每个心动周期中,心房和心室的活动按一定的次序和时程先后进行,即左、右两个心房的活动是同步进行的,左、右两个心室的活动也是同步进行的。这种同步性确保了心脏各部分之间的协同工作,有效发挥泵血功能。然而,机械循环辅助装置的加入会打破这种同步性,进而影响右心室功能甚至发展为右心室衰竭。Arakawa 等[17]应用超声心动图观察到室间隔在连续模式下向左心室移动。这种室间隔移位会加剧右心室功能障碍,但在反搏动模式下室间隔的移位被校正。本文采用数值研究的方法,在 Arakawa 等的研究基础上,从血流动力学的角度研究不同的 LVAD 控制模式对双心室结构和功能的影响。
LV 等容收缩时,室内压急剧升高,当超过 AOP 后,主动脉瓣开放,等容收缩期结束,进入射血期。在连续模式下,由于 LVAD 的转速在心动周期内恒定不变,其对左心室的卸载作用较强,导致 LVP 持续低于 AOP,LV 仅有等容收缩期而无射血期。因此,LV 收缩持续时间显著减少且小于 RV 的收缩持续时间,如图 6 所示。这种不同步不利于左、右心室的协同工作,可能会导致 RV 功能障碍。长期以来,采用连续模式辅助的患者出现胃出血、主动脉充盈不足等并发症归因于该模式导致的搏动性下降[21]。从数值结果看,连续模式导致的左右心室的不同步可能也是导致这类并发症的原因之一。与连续模式相比,搏动模式和反搏动模式均可提升 LV 的收缩持续时间,但后者更明显。反搏动模式在收缩期降低转速,减少卸载;舒张期增加转速,增加了动脉舒张压。因此,与连续模式相比,反博动模式下 LVAD 在收缩期的卸载作用降低可缓解室间隔向左移位,从而增加 LV 的收缩期。同时,在心室前负荷、收缩力和心率都不变的情况下,如果大动脉血压增高,等容收缩期室内压的峰值将增高,可使 LV 等容收缩期延长。搏动模式在收缩期提高转速,使得 LVAD 卸载作用加强,这可能是搏动模式校正同步性的作用低于反博动模式的原因。总之,三种控制模式中,反搏动模式可提高左心室的收缩持续时间,有助于维持双心室搏动的同步性。
此外,对比了三种模式下的左、右心输出量。连续模式下,主动脉流量与肺动脉流量相差较大。若 LVAD 长期工作在连续模式,由于左、右心输出量不匹配而导致体循环和肺循环的血容量不平衡,从而破坏血液循环系统的稳定性。反搏动模式下的左、右心输出量相差较小,这可能与其调整 LV 与 RV 的收缩同步性有关。此外,与连续模式相比,反搏动模式的速度调制可使主动脉瓣随心动周期有序开通和关闭,维持主动脉瓣的生物活性。然而,反搏动模式也降低了主动脉压的搏动系数,不利于血压的搏动灌注。若转速设置不当,可能会因收缩期转速下降而使泵出口与主动脉的压力梯度反向发生反流现象,增加患者出现左心室增大以及血损等并发症的风险。搏动模式下搏动系数最大,左右心输出量相差最小,但心输出量低于连续模式和反博动模式。
心室的 P-V 环可用于评价自然心室的做功以及 LVAD 的卸载能力。从图 5 心室 P-V 环的变化可知,在连续模式下左心室 P-V 环左移明显,而右心室 P-V 环右移,表明左心室容积显著减小,验证了 Arakawa 等所发现的室间隔明显左移的现象。连续模式下,LV 收缩期明显短于 RV 收缩期(LV vs. RV:24.38% vs. 49.16%);反搏动模式中的 LV、RV 收缩期差异较小(LV vs. RV:43.13% vs. 49.23%),而 LV 收缩期短于无泵模式并长于连续模式。表明反搏动模式校正了 LV 缩短的收缩期,使之趋于与右心室收缩同步。本组结果间接验证了 Arakawa 等的动物实验中,连续模式下室间隔的左移位造成左、右心室收缩的非同步性,而这种非同步性在反搏动模式中得到明显校正。相对于 Arakawa 等直接观察室间隔的变化,本文通过不同控制模式下的 P-V 环、心室压、动脉压等参数的变化,来分析 LV 收缩持续时间的变化和左右心的同步性。针对 LVAD 控制模式对双心室搏动同步性的影响,研究发现,反搏动模式能最大限度地维持双心室搏动的同步性,从而降低并发右心室衰竭的风险。
本文目前只进行了数值研究,比较了 LVAD 不同的控制模式对双心室搏动同步性的影响。连续模式下,由于转速恒定,其卸载作用最强,结果使左心室收缩持续时间显著减少,造成了双心室的非同步搏动。搏动模式和反搏动模式都采用了速度调制,其中反搏动模式通过在收缩期降低转速,从而降低其在收缩期的卸载作用,使左心室缩短的收缩持续时间得到明显校正,使左心室和右心室的收缩重新同步。在这三种模式中,反搏动模式优化了左心室卸载,校正了左心室的收缩期,对预防右心室衰竭具有潜在的应用价值。本研究目前还存在一定的缺陷,在数值仿真中,对急性缺血性右心功能不全的模拟受到限制,并未对右心功能不全的情况进行比较,且本文还未通过实验手段进行验证。后续研究方向应该基于动物模型,分别在右心功能正常和右心功能不全的情况下行 LVAD,研究左心辅助对右心功能的影响。然而,LVAD 不同的控制模式对原已存在功能损坏的右心室的影响,以及优化 LVAD 的控制模式以减小 LVAD 对右心室的不良影响,仍是后续研究的难点。
4. 结论
本文认为 LVAD 卸载是 LV 与 RV 收缩不同步的主要原因,而控制模式可以通过改变心室的负荷影响系统的同步性。在连续模式下 LV 的收缩持续时间显著减少,导致左、右心室收缩的不同步。反搏动模式通过降低收缩期的转速,优化了左心室卸载,显著校正了 LV 收缩持续时间。本研究发现,连续模式下 LV 缩短的收缩持续时间在反搏动模式下被校正为 LV 和 RV 之间的重新同步,有利于预防右心室功能障碍。因此,本文推测这种对 RV 功能的有利影响是由 LV 和 RV 收缩的再同步引起的。总之,反搏动模式在维持双心室搏动的同步性方面具有优势。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金(51677082,51805218)
The National Natural Science Foundation of China
References
- 1.Wang Y, Koenig S C, Wu Z J, et al Sensorless physiologic control, suction prevention, and flow balancing algorithm for rotary biventricular assist devices. IEEE Trans Control Syst Technol. 2017;27(2):717–729. [Google Scholar]
- 2.Volkovicher N, Kurihara C, Critsinelis A Outcomes in patients with advanced heart failure and small body size undergoing continuous-flow left ventricular assist device implantation. J Artif Organs. 2018;21(1):31–38. doi: 10.1007/s10047-017-0988-z. [DOI] [PubMed] [Google Scholar]
- 3.Demirozu Z T, Arat N, Kucukaksu D S Fine-tuning management of the Heart Assist 5 left ventricular assist device with two- and three-dimensional echocardiography. Cardiovasc J Afr. 2016;27(4):208–212. doi: 10.5830/CVJA-2015-083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.龙东平, 薛建荣, 云忠 心室辅助装置血泵内血栓控制研究进展. 中国胸心血管外科临床杂志. 2020;27(10):1235–1241. [Google Scholar]
- 5.Slaughter M S, Rogers J G, Milano C A, et al Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med. 2009;361(23):2241–2251. doi: 10.1056/NEJMoa0909938. [DOI] [PubMed] [Google Scholar]
- 6.Ng B C, Salamonsen R F, Gregory S D, et al Application of multiobjective neural predictive control to biventricular assistance using dual rotary blood pumps. Biomed Signal Process Control. 2018;39:81–93. doi: 10.1016/j.bspc.2017.07.028. [DOI] [Google Scholar]
- 7.Chow E, Farrar D J Effects of left ventricular pressure reductions on right ventricular systolic performance. Am J Physiol Heart Circ Physiol. 1989;257(6 Pt 2):H1878–85. doi: 10.1152/ajpheart.1989.257.6.H1878. [DOI] [PubMed] [Google Scholar]
- 8.Moon M R, Castro L J, DeAnda A, et al Right ventricular dynamics during left ventricular assistance in closed-chest dogs. Ann Thorac Surg. 1993;56(1):54–67. doi: 10.1016/0003-4975(93)90402-4. [DOI] [PubMed] [Google Scholar]
- 9.Farrar D J, Chow E, Compton P G, et al Effects of acute right ventricular ischemia on ventricular interactions during prosthetic left ventricular support. J Thorac Cardiovasc Surg. 1991;102(4):588–595. doi: 10.1016/S0022-5223(20)31431-8. [DOI] [PubMed] [Google Scholar]
- 10.Omoto T, Tanabe H, Laria P, et al Right ventricular performance during left ventricular unloading conditions: the contribution of the right ventricular free wall. J Thorac Cardiovasc Surg. 2002;50(1):16–20. doi: 10.1055/s-2002-20158. [DOI] [PubMed] [Google Scholar]
- 11.Park C H, Nishimura K, Kitano M, et al Right ventricular performance is impaired by full assist of left heart bypass: analysis of right ventricular performance against change in afterload in heart failure models. ASAIO J. 1994;40(3):M303–M308. doi: 10.1097/00002480-199407000-00013. [DOI] [PubMed] [Google Scholar]
- 12.Kitano M, Nishimura K, Hee P C, et al Right ventricular function evaluated by volumetric analysis during left heart bypass in a canine model of postischemic cardiac dysfunction. J Thorac Cardiovasc Surg. 1995;109(4):796–803. doi: 10.1016/S0022-5223(95)70363-2. [DOI] [PubMed] [Google Scholar]
- 13.Daly R C, Chandrasekaran K, Cavarocchi N C, et al Ischemia of the interventricular septum. A mechanism of right ventricular failure during mechanical left ventricular assist. J Thorac Cardiovasc Surg. 1992;103(6):1186–1191. doi: 10.1016/S0022-5223(19)34886-X. [DOI] [PubMed] [Google Scholar]
- 14.杨新娟, 王秉臣, 崔炜 慢性心力衰竭患者双心室收缩同步性与其结构研究. 中国心血管杂志. 2006;11(4):257–260. doi: 10.3969/j.issn.1007-5410.2006.04.006. [DOI] [Google Scholar]
- 15.Yoshioka D, Sakaguchi T, Saito S, et al Predictor of early mortality for severe heart failure patients with left ventricular assist device implantation: significance of INTERMACS level and renal function. Circ J. 2012;76(7):1631–1638. doi: 10.1253/circj.CJ-11-1452. [DOI] [PubMed] [Google Scholar]
- 16.Aissaoui N, Morshuis M, Schoenbrodt M, et al Temporary right ventricular mechanical circulatory support for the management of right ventricular failure in critically ill patients. J Thorac Cardiovasc Surg. 2013;146(1):186–191. doi: 10.1016/j.jtcvs.2013.01.044. [DOI] [PubMed] [Google Scholar]
- 17.Arakawa M, Nishimura T, Takewa Y, et al Novel control system to prevent right ventricular failure induced by rotary blood pump. J Artif Organs. 2014;17(2):135–141. doi: 10.1007/s10047-014-0757-1. [DOI] [PubMed] [Google Scholar]
- 18.王芳群, 徐庆, 吴振海, 等 基于左心辅助的血液循环系统的控制研究. 生物医学工程学杂志. 2016;33(6):1075–1083. doi: 10.7507/1001-5515.20160172. [DOI] [PubMed] [Google Scholar]
- 19.Suga H, Sagawa K Instantaneous pressure-volume relationships and their ratio in the excised, supported canine left ventricle. Circ Res. 1974;35(1):117–126. doi: 10.1161/01.RES.35.1.117. [DOI] [PubMed] [Google Scholar]
- 20.Korakianitis T, Shi Y Numerical simulation of cardiovascular dynamics with healthy and diseased heart valves. J Biomech. 2006;39(11):1964–1982. doi: 10.1016/j.jbiomech.2005.06.016. [DOI] [PubMed] [Google Scholar]
- 21.Bozkurt S Arterial pulsatility and aortic valve function under continuous flow left ventricular assist device support, continuous speed vs. varying speed pump assistance. Ann Biomed Eng. 2015;43:1727–1737. doi: 10.1007/s10439-014-1204-4. [DOI] [PubMed] [Google Scholar]








