Abstract
下壁心肌梗死的早期检测是降低下壁心肌梗死死亡率的重要手段。针对现有的下壁心肌梗死检测存在模型结构复杂、特征冗余的问题,本文提出一种下壁心肌梗死检测算法。该方法与临床病理信息相结合,提取心电信号Ⅱ、Ⅲ和 aVF 三个导联中的 QRS 波段和 ST-T 波段的峰值、面积以及 ST 的斜率等特征,并由遗传算法依据单个特征以及特征之间的离散度进行判断,选择区分度较大的特征送入支持向量机(SVM),实现下壁心肌梗死检测。本文采用德国国家计量学研究所(PTB)诊断心电数据库对该方法进行验证,准确率为 98.33%。本文方法有效地利用心电信号形态学特征实现了下壁心肌梗死的检测,符合临床医生诊断以及下壁心肌梗死心电信号特异性改变的特点,适合临床广泛推广以及便携式设备应用的实现。
Keywords: 下壁心肌梗死, 心电图, 形态学特征, 遗传算法
Abstract
Early accurate detection of inferior myocardial infarction is an important way to reduce the mortality from inferior myocardial infarction. Regrading the existing problems in the detection of inferior myocardial infarction, complex model structures and redundant features, this paper proposed a novel inferior myocardial infarction detection algorithm. Firstly, based on the clinic pathological information, the peak and area features of QRS and ST-T wavebands as well as the slope feature of ST waveband were extracted from electrocardiogram (ECG) signals leads Ⅱ, Ⅲ and aVF. In addition, according to individual features and the dispersion between them, we applied genetic algorithm to make judgement and then input the feature with larger degree into support vector machine (SVM) to realize the accurate detection of inferior myocardial infarction. The proposed method in this paper was verified by Physikalisch-Technische Bundesanstalt (PTB) diagnostic electrocardio signal database and the accuracy rate was up to 98.33%. Conforming to the clinical diagnosis and the characteristics of specific changes in inferior myocardial infarction ECG signal, the proposed method can effectively make precise detection of inferior myocardial infarction by morphological features, and therefore is suitable to be applied in portable devices development for clinical promotion.
Keywords: inferior myocardial infarction, electrocardiogram, morphological characteristics, genetic algorithm
引言
据《中国心血管病报告 2018》统计,我国心血管疾病患病人数达 2.9 亿,其中急性心肌梗死患者占比为 3.8%。下壁心肌梗死在急性心肌梗死中最为广泛,具有发病率高、死亡率高的特点[1]。阿司匹林作为预防心血管疾病的广泛使用的药物,其收益往往被服药带来的其他风险抵消,因此可能不适用于心血管疾病的一级预防[2]。《急性心肌梗死的早期治疗与临床研究》中指出在发病 12 h 内进行心电图检查并且开通闭塞冠状动脉、恢复血流,可控制心肌梗死面积[3]。越早采用经皮冠状动脉介入治疗使得冠状动脉再通,患者获益就越多[4],因此下壁心肌梗死的早期诊断至关重要。临床中心电图(electrocardiogram,ECG)反映了心脏不同部位生理性能变化,是早期诊断下壁心肌梗死最简单有效的方式[5-7]。因此,基于心电图的下壁心肌梗死早期诊断受到越来越多的学者关注。
目前,在下壁心肌梗死检测研究中,Liu 等[8]基于 12 导联的心电信号提出了多特征分支卷积神经网络(Multiple-Feature-Branch Convolutional Neural Network,MFB-CNN)检测模型,每个导联对应一个分支学习,每个特征分支包含独立的卷积层和池化层,通过 softmax 全局连通对所有特征进行汇总,完成下壁心肌梗死的检测。这种通过深度学习进行超细化特征提取的方式增加了计算的复杂度,依靠大量的数据作为支撑,需要消耗过多的运算时间。Reasat 等[9]将原始的心电信号进行了降采样处理,由原始的 1 000 Hz 降采样为 64 Hz,放入搭建好的浅层卷积神经网络自动检测下壁心肌梗死,最终的准确率、敏感度和特异性在 80% 以上,该算法利用降采样的方法减少了输入信号的维度从而降低了模型的复杂度,但是信号降采样的同时会导致信息丢失,使得算法精度下降。在这一领域,本研究团队[10]也利用密集连接卷积网络做出了有效尝试,虽然取得了不错的实验精度,但由于网络特性需将研究对象集中到单心拍数据以减少冗余度,与此同时需要大量的数据对有效特征自动提取,从而导致计算量的增加,使得该方法在便携式智能终端应用实现中存在一定局限性。
人工设计并提取有效特征避免了神经网络时间复杂度较高的问题。Sharma 等[11]依据多尺度小波变换下的心电信号协方差矩阵特征值不同的特性,提取 72 个特征对下壁心肌梗死进行检测,准确率达到 96%。该方法采用小波变换对信号进行时频域转换,提取不同的特征完成检测,然而过多维数特征中存在相关性较小的特征,对最终检测结果产生过了拟合的影响。Acharya 等[12]对十二导联心电信号中每个导联使用小波变换,对变换后的每层小波系数提取小波熵、能量熵等十二种特征熵值,经过t检验筛选至 47 个特征时得到了较好的准确率。但是该方法的筛选过程中没有考虑特征之间的相互关系,从而导致筛选结果不充分。Sharma 等[13]使用平稳小波变换将Ⅱ、Ⅲ和 aVF 三个导联心电信号予以分解,提取样本熵等特征,采用 GainRatio 方法对特征进行筛选,利用支持向量机(support vector machine,SVM)和 K 近邻算法(K-nearest neighbor,KNN)进行分类,结果正确率仅有 81.71%,算法所得分类精度较低。
基于上述问题,本文提出了基于形态学的下壁心肌梗死检测算法。该算法直接使用数据库中连续时长的心电信号,避免了心电信号降采样过程中信息丢失的问题,更加贴近临床中直接获取的心电数据,根据下壁心肌梗死心电信号发生的特异性改变,提取心电信号中Ⅱ、Ⅲ和 aVF 三个导联的面积、斜率、均值、方差、峰度、偏斜度、斜率等 13 个特征,利用遗传算法筛选出区分度比较大的特征组合,解决了特征维数较多的问题,最后利用 SVM 对筛选特征进行分类,以实现对下壁心肌梗死的自动诊断。
1. 方法
本文提出的下壁心肌梗死的检测算法主要由三部分组成:心电信号的预处理、形态特征的提取和特征的筛选及分类。原始十二导联的信号通过小波变换去除基线漂移等噪声;选取下壁心肌梗死对应导联提取特征;采用遗传算法对冗余特征进行筛选,导入 SVM 分类器完成对下壁心肌梗死的检测。
1.1. 数据及预处理
本文采用德国国家计量署提供的数字化心电数据库(Physikalisch-Technische Bundesanstalt,PTB)收录的心电数据[14],该数据包括 90 条下壁心肌梗死患者心电信号记录以及 80 条正常心电信号记录,每条记录包含常规 12 导联和 3 条 Frank 导联(网址为:https://physionet.org/physiobank/database/ptbdb/)。本文读取了 PTB 诊断心电数据库中的 60 条健康受试者数据和 60 条下壁心肌梗死患者数据作为比较试验的验证集。每条数据取 10 s 时长的信号作为本文的实验数据集,随机选取 30 条健康心电信号与 30 条下壁心肌梗死的心电信号作为训练集,其余的心电信号作为本文测试集。本文采用基于 DB6 小波基的离散小波变换去除原始信号中的噪声,得到干净信号[15]。
1.2. 特征提取
在心电信号中,不同的导联对应心脏不同部位,不同部位心肌梗死对应不同罪犯血管,因此对罪犯血管的判断具有一定的挑战性。在临床中,下壁心肌梗死在心电信号中表现为坏死区存在病理性 Q 波、ST 段压低以及 T 波直立并增高等变化,损伤区 ST 段弓背性抬高,缺血区 T 波倒置等特征,因此形态特征是下壁心肌梗死检测的重要依据。
1.2.1. 导联信息的提取
心脏是一个立体结构,如图 1 所示,在不同位置放置电极片组成心电图中不同的导联,心脏每个部位的电位变换都可以由多个导联共同表示。下壁心肌梗死对应的罪犯血管多来自于右冠状动脉、左回旋支以及前降支心血管,该部位血管对应导联为Ⅱ、Ⅲ和 aVF 三个导联[16-17],Ⅱ、Ⅲ和 aVF 三个导联对于下壁心肌梗死的检测更加具有指向性,因此本文选择Ⅱ、Ⅲ和 aVF 三个导联进行特征提取,对冗余导联进行剔除。
图 1.
Correspondence map of heart part and lead
心脏部位与导联对应图
1.2.2. 形态特征的提取
完整的心动周期是由 P、QRS、ST 段和 T 波组成,其中 ST 段和 T 波并称为 ST-T 波段,ST-T 从 QRS 终点开始,到 T 波结束而结束。下壁心肌梗死和正常的心电信号在不同导联的形态如图 2 所示,正常心电信号以及下壁心肌梗死的心电信号形态有显著的差别。与正常心电信号相比,下壁心肌梗死多出现病理性 Q 波、ST 波段抬高和 T 波倒置等表现。
图 2.

Heartbeat waveform of Ⅱ,Ⅲ and aVF leads of normal ECG and myocardial infarction ECG
Ⅱ、Ⅲ和 aVF 导联正常与心肌梗死心拍波形图
在特征提取的过程中,心电信号记为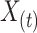 ,使用 Pan-Tompkins 算法对信号的 QRS 波段进行标注[18],其中 QRS 波段的起始点为
,使用 Pan-Tompkins 算法对信号的 QRS 波段进行标注[18],其中 QRS 波段的起始点为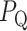 ,终点为
,终点为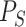 ,QRS 峰值大小即 R 峰为
,QRS 峰值大小即 R 峰为 。根据一个心电信号的完整心动周期以及和数据库采样频率的对应关系进行 ST-T 波段的标注。该数据库中所选实验数据采样频率为 1 000 Hz,在一个完整的心动周期中 ST 波段占时为 0~0.15 s,T 波时长为 0.1~0.15 s[19],因此取 R 峰后的 400 个样本点选为 T 波的终点,记为
。根据一个心电信号的完整心动周期以及和数据库采样频率的对应关系进行 ST-T 波段的标注。该数据库中所选实验数据采样频率为 1 000 Hz,在一个完整的心动周期中 ST 波段占时为 0~0.15 s,T 波时长为 0.1~0.15 s[19],因此取 R 峰后的 400 个样本点选为 T 波的终点,记为 ,在 ST-T 段取波段中最值为 T 波峰值,峰值大小记为
,在 ST-T 段取波段中最值为 T 波峰值,峰值大小记为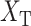 ,对应点为
,对应点为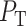 。信号各波段的标注如图 3 所示。
。信号各波段的标注如图 3 所示。
图 3.
Each band label of ECG signal
心电信号各个波段标注
下壁心肌梗死在心电图上的表现主要为 ST 段弓背性上升、T 波倒置以及病理性 Q 波等,特征变化主要集中在 QRS 复合波以及 ST-T 波段。本文提取 QRS 复合波以及 ST-T 波段的峰值、面积、均值以及斜率以表征心电信号形态,反映形态学的变化以及心肌细胞和心脏的状态。其中 QRS 复合波段面积和均值分别如式(1)、(2)所示,峰值取 R 峰以及 T 波最值点。斜率取 QRS 波终点与 ST-T 波段峰值两点的比值如式(3)所示:
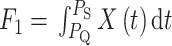 |
1 |
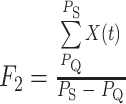 |
2 |
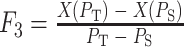 |
3 |
标准差反映了数据分散程度,表现了整个波段的形态改变。以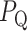 为起始点,
为起始点,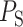 为终止点,QRS 复合波段每个幅值的标准差取值如式(4)所示:
为终止点,QRS 复合波段每个幅值的标准差取值如式(4)所示:
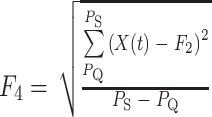 |
4 |
偏斜度以及峰度根据波段中偏态值的大小以及该波段尖度的大小反映两个波段峰值的形态变化,可表现出病理性 Q 波以及异常 ST 段的改变。以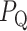 为起始点,
为起始点,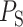 为终止点,QRS 复合波段偏斜度以及峰度的取值如式(5)、(6)所示:
为终止点,QRS 复合波段偏斜度以及峰度的取值如式(5)、(6)所示:
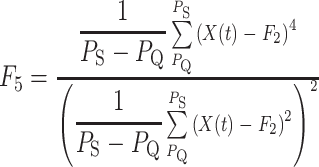 |
5 |
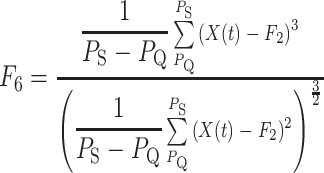 |
6 |
同理依照上述方法将取值区间更替为以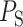 为起始点、以
为起始点、以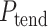 为终止点的 ST-T 数据段即可得到 ST-T 波段的各个特征,针对每条心电数据的Ⅱ、Ⅲ和 aVF 三个导联分别提取以上特征,完成对所有特征的提取。
为终止点的 ST-T 数据段即可得到 ST-T 波段的各个特征,针对每条心电数据的Ⅱ、Ⅲ和 aVF 三个导联分别提取以上特征,完成对所有特征的提取。
1.3. 特征筛选
不同导联中对同一波段的病理性特征表现存在一定差异,在下壁心肌梗死的检测过程中,如图 2 所示,不同导联的 ST 段发生病变的形态变化幅度也不同,因此需要从所有的特征中筛选出对于分类有益比例高的特征。本文使用遗传算法对下壁导联中提取的Ⅱ、Ⅲ和 aVF 三个导联的 ST 的斜率以及 QRS、ST-T 两个波段的标准差、均值、面积、偏斜度、峰度和峰值共 39 个形态学特征进行筛选,将区分度较低的特征剔除,保留区分度较大的特征,从而提高下壁心肌梗死的检测精度。
遗传算法把提取的特征编码为一条染色体[20],在本文中所有特征描述为一条由 39 个 0/1 字符组成的字符串,0 代表该特征没有被选中,1 代表该特征被选中。当筛选 d 个特征时,这样的染色体共有 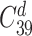 种。优化的目标被描述成适应度函数,每一条染色体对应一个适应度值
种。优化的目标被描述成适应度函数,每一条染色体对应一个适应度值 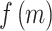 ,选择最大适应度值对应的特征作为本文特征筛选结果。为保证筛选后特征的鲁棒性,实验在 120 条提取特征后的数据中选取 30 条正常数据以及 30 条下壁心肌梗死数据,共 60 条数据作为训练集进行特征筛选。
,选择最大适应度值对应的特征作为本文特征筛选结果。为保证筛选后特征的鲁棒性,实验在 120 条提取特征后的数据中选取 30 条正常数据以及 30 条下壁心肌梗死数据,共 60 条数据作为训练集进行特征筛选。
本文取类间的离散度以及类内离散度的比值作为本文的适应函数。取下壁心肌梗死信号离散度  以及正常心电信号的离散度
以及正常心电信号的离散度 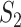 的平均值作为类内离散度取值
的平均值作为类内离散度取值 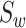 。其中
。其中 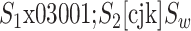 分别如式(7)~(9)所示:
分别如式(7)~(9)所示:
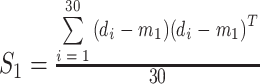 |
7 |
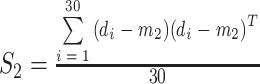 |
8 |
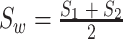 |
9 |
其中 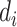 在式(7)和式(8)中分别为下壁心肌梗死和正常心电信号的 30 条数据,
在式(7)和式(8)中分别为下壁心肌梗死和正常心电信号的 30 条数据,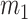 为 30 条下壁心肌梗死心电信号每个特征的均值向量,
为 30 条下壁心肌梗死心电信号每个特征的均值向量,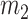 为 30 条正常心电信号每个特征的均值向量,
为 30 条正常心电信号每个特征的均值向量, 的取值分别如式(10)、(11)所示:
的取值分别如式(10)、(11)所示:
 |
10 |
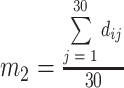 |
11 |
全局每个特征的均值向量 及类间离散度大小分别如式(12)、(13)所示:
及类间离散度大小分别如式(12)、(13)所示:
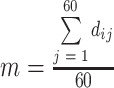 |
12 |
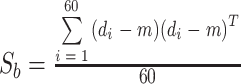 |
13 |
当且仅当类内离散度取最小值且类间离散度取得最大值时对特征的筛选才达到最优值,故本文适应度  取值如式(14)所示:
取值如式(14)所示:
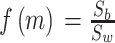 |
14 |
对于本文中的 39 个形态学特征,染色体中随机初始化选择一定量特征,重复多次试验,在试验中得到多条染色体的初代种群 M,每条染色体都互不相同。计算种群 M 种的适应度 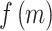 ,经过比较计算之后,得到每条染色体的最大适应度值。通过初代种群的交叉、变异和重复迭代最终获得全局最优的适应度
,经过比较计算之后,得到每条染色体的最大适应度值。通过初代种群的交叉、变异和重复迭代最终获得全局最优的适应度 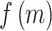 ,进而完成特征筛选。
,进而完成特征筛选。
1.4. SVM 分类器
SVM 是一种基于统计学习原理的单层高度非线性网络。它能够正确地对潜在的或不清晰的可观察模式进行分类。与其他分类器不同的是,SVM 可以将结构风险最小化。在 SVM 的训练过程中,最大限度地提高了模式到超平面的距离。一般情况下,模式是不可线性分离的,因此需要进行非线性核变换。本文采用径向基核函数将数据映射为高维函数,SVM 的性能受超参数(惩罚参数和核参数)的影响,这些参数决定了 SVM 的支持向量个数和最大裕度。对于 SVM,设(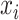 ,
,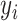 )为样本,决策函数
)为样本,决策函数  为:
为:
 |
15 |
其中 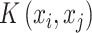 是核函数,
是核函数,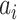 表示拉格朗日乘子,b 是 SVM 的偏置函数。
表示拉格朗日乘子,b 是 SVM 的偏置函数。
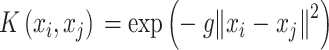 |
16 |
对于核函数,g 代表核函数的超参数。
在参数调优运算过程中,先在大范围内粗略寻找最优参数,再根据指定的范围进行细致的寻优来得到最优的参数值,从而快速和精准地定位到最优参数,实现对提取特征的检测,完成对正常心电信号和下壁心肌梗死信号的分类。
2. 结果和讨论
2.1. 评价指标
本文采用准确率(Accuracy)、敏感度(Sensitivity)和特异性(Specificity)三个参数对检测结果进行评估。三个参数具体定义式如式(17)~(19)所示:
 |
17 |
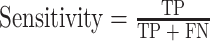 |
18 |
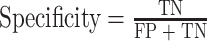 |
19 |
其中 TP(true positive)代表了实际为下壁心肌梗死且被分类器划分为下壁心肌梗死的样本数;TN(true negative)为代表了实际为正常心电信号且被分类器划分为正常心电信号的样本数;FN(false negative)代表了实际为下壁心肌梗死但被分类器划分为正常心电信号的样本数;FP(false positive)为代表了实际为正常心电信号但被分类器划分为下壁心肌梗死的样本数。
2.2. 特征筛选分类结果
本文采用遗传算法对特征进行筛选,根据适应度  选取区分度较大的特征组合进行实验。实验分别对每个维度的特征进行筛选,不同维度特征下的适应度以及分类结果如表 1 所示,在特征总数为 26 的时候取得最大适应值 0.545,此时检测的准确率、敏感度以及特异性分别为 98.33%、100% 以及 96.67%。在 60 条待测数据中对 59 条数据实现了正确的检测,其中敏感度更是达到 100%,达到较好的检测结果。
选取区分度较大的特征组合进行实验。实验分别对每个维度的特征进行筛选,不同维度特征下的适应度以及分类结果如表 1 所示,在特征总数为 26 的时候取得最大适应值 0.545,此时检测的准确率、敏感度以及特异性分别为 98.33%、100% 以及 96.67%。在 60 条待测数据中对 59 条数据实现了正确的检测,其中敏感度更是达到 100%,达到较好的检测结果。
表 1. Detection of inferior myocardial infarction with diffe rent characteristics.
不同特征数的下壁心肌梗死检测
| 特征数 | 适应度 | Accuracy(%) | Sensitivity(%) | Specificity(%) |
| 39 | / | 96.67% | 96.67% | 96.67% |
| 28 | 0.429 | 93.33% | 96.67% | 90.00% |
| 27 | 0.505 | 95.00% | 100% | 90.00% |
| 26 | 0.545 | 98.33% | 100% | 96.67% |
| 25 | 0.523 | 96.67% | 96.67% | 96.67% |
| 24 | 0.491 | 95.00% | 93.33% | 96.67% |
为证明存在一定冗余特征以及特征筛选的必要性,本文与未经过筛选的结果进行对比。未经过特征筛选的实验组,其准确率、敏感度以及特异性分别为 96.67%、96.67% 和 96.67%。在 60 条检测的结果中,对 58 条数据实现了正确的检测,但仍然存在一定的冗余特征,对正检率造成影响。
下壁心肌梗死导致Ⅱ、Ⅲ和 aVF 三个导联心电信号发生病理性变化,但每个导联之间的变化程度并不相同。经过遗传算法对特征进行筛选,筛选出的特征如表 2 所示,包括Ⅱ导联筛选出的 9 个特征、Ⅲ导联筛选出的 8 个特征以及 aVF 导联筛选出的 9 个特征。由表 2 可以看出心电信号中的标准差、偏斜度以及峰度在正常心电信号与下壁心肌梗死信号存在较大差异。在面积、均值以及峰值中,ST-T 峰值变化在检测过程中差异比较明显,这是下壁心肌梗死心电信号 ST-T 波段中 T 波倒置所导致。均值和面积在不同导联的两个波段的变化程度也存在一定的差异性。大部分的下壁心肌梗死为右冠状动脉堵塞所致[21],表现为下壁心肌梗死心电信号在Ⅱ导联 ST-T 波段变化幅度相比于Ⅲ导联更为明显,本文在Ⅱ导联的 ST-T 波段筛选出的特征数目上也略高于Ⅲ导联,与文献[21]中病变信号特征表征一致。
表 2. Effective feature after screening.
筛选后的有效特征
| 导联 | 面积 | 均值 | 峰值 | 标准差 | 偏斜度 | 峰度 | 斜率 | |||||||||||
| QRS | ST-T | QRS | ST-T | QRS | ST-T | QRS | ST-T | QRS | ST-T | QRS | ST-T | |||||||
| Ⅱ | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||||||||
| Ⅲ | √ | √ | √ | √ | √ | √ | √ | √ | ||||||||||
| aVF | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||||||||
2.3. 与其他方法检测精度的比较
将本文提出的基于形态学特征检测的方法与现有的下壁心肌梗死检测方法的结果进行对比,如表 3 所示。与基于深度学习模型实现检测的算法比较,本文的实验结果明显优于文献[8-9],但是略低于文献[10]中 99.95% 的正确率。文献[10]构建密集卷积神经网络检测下壁心肌梗死,依靠大量单心拍标记样本提取深层次特征信息,不可避免地增加了计算的复杂度。文献[9]在对数据进行下采样后,采用浅层 CNN 网络,但依然依赖大量标记数据实现特征提取。相比于此类算法,本文的方法无需通过大量的数据进行训练,并且没有进行下采样处理,保留了完整的原始信息。
表 3. Comparison of detection results of inferior myocardial infarction.
下壁心肌梗死检测结果对比
与依据心电特性提取特征的检测算法比较,本文在准确率、敏感度和特异性方面均明显优于文献[11-13]的下壁心肌梗死检测结果。与文献[11-13]中经过时频域转换提取特征的方法相比,形态学特征更加具有医学指征性,能够较为直观地反映心电信号的差异,因此能够更好地满足下壁心肌梗死检测的临床要求,实现下壁心肌梗死的准确检测。
2.4. 与其他方法时间复杂度的比较
本文采用时间复杂度衡量不同实验方法,算法中语句执行次数多,花费时间就越长。将一个算法中语句执行的次数记为  ,其中 n 为语句规模的大小,引入辅助函数
,其中 n 为语句规模的大小,引入辅助函数  使得
使得 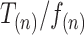 的极限值为非零常数,且
的极限值为非零常数,且  的系数项为 1,则时间复杂度如式(20)所示:
的系数项为 1,则时间复杂度如式(20)所示:
 |
20 |
在本文算法中,只需对每个输入的样本提取经过特征筛选后的 26 个特征,不存在高阶运算,因此 为 26,
为 26,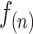 为 1,时间复杂度为
为 1,时间复杂度为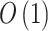 。
。
在深度学习检测的算法中,卷积神经网络在下壁心肌梗死的检测中取得较好的结果。文献[6-8]中也均是基于卷积神经网络进行改进从而实现对下壁心肌梗死的检测。对于卷积神经网络,每个卷积层的时间复杂度为 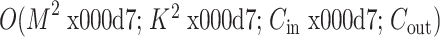 ,其中M为卷积核输出特征的边长,K 为每个卷积核的边长,
,其中M为卷积核输出特征的边长,K 为每个卷积核的边长, 为输入通道个数,
为输入通道个数,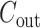 为输出通道个数[22]。因此整个卷积神经网络的时间复杂度为
为输出通道个数[22]。因此整个卷积神经网络的时间复杂度为 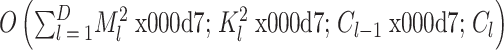 ,其中 D 为卷积层的个数。通过比较可以看出本文算法在时间复杂度的计算中远小于卷积神经网络的运算,从而具有更好的时效性。
,其中 D 为卷积层的个数。通过比较可以看出本文算法在时间复杂度的计算中远小于卷积神经网络的运算,从而具有更好的时效性。
3. 结论
本文选用下壁心肌梗死医学指征的Ⅱ、Ⅲ和 aVF 三个导联原始心电信号,避免了在信号降采样中信息丢失的问题,根据临床检测依据进行形态学特征提取。在提取的特征中,针对相同波段在不同导联中对病理性特征表现程度不同的问题,采用遗传算法对模型检测贡献最大的特征组合进行筛选,最后使用 SVM 对筛选后的特征进行分类并得到较好的结果。该方法运算简单,准确率较高,无论在临床环境中或者是便携式设备中引入该方法,都可以帮助医生快速诊断下壁心肌梗死,使患者尽快得到治疗。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家重点研发计划(No.2017YFB1401200);国家自然科学基金资助项目(61673158,61703133);河北省自然科学基金资助项目(F2018201070);河北省青年拔尖人才项目(BJ2019044);河北大学研究生创新资助项目(hbu2020ss064)
Ministry of Science and Technology of the People's Republic of China; National Natural Science Foundation of China; Hebei Provincial Natural Science Foundation Committee; Hebei education department; Hebei University
Contributor Information
洪瑞 王 (Hongrui WANG), Email: hongrui@hbu.edu.cn.
秀玲 刘 (Xiuling LIU), Email: liuxiuling121@hotmail.com.
References
- 1.胡盛寿, 高润霖, 刘力生, 等 《中国心血管病报告2018》概要. 中国循环杂志. 2019;34(03):209–220. doi: 10.3969/j.issn.1000-3614.2019.03.001. [DOI] [Google Scholar]
- 2.李婷婷, 聂志超, 田甜, 等 阿司匹林用于心血管疾病一级预防的Meta分析. 中国循证医学杂志. 2019;19(10):1187–1194. [Google Scholar]
- 3.郑雯, 荣阳, 马殿忠, 等 急性心肌梗死的早期治疗与临床研究. 中国医药指南. 2016;14(16):175–176. [Google Scholar]
- 4.车千秋, 王琼英, 梁宇博, 等 血管内超声与冠状动脉造影指导的经皮冠状动脉介入治疗左主干病变有效性和安全性的Meta分析. 中国循证医学杂志. 2020;20(1):71–78. [Google Scholar]
- 5.颜红兵, 傅向华, 李春洁, 等 ST段抬高型急性心肌梗死院前溶栓治疗中国专家共识. 中国介入心脏病学杂志. 2018;26(4):181–190. doi: 10.3969/j.issn.1004-8812.2018.04.001. [DOI] [Google Scholar]
- 6.Stout K K, Daniels C J, Aboulhosn J A, et al 2018 AHA/ACC guideline for the management of adults with congenital heart disease. J Am Coll Cardiol. 2019;73(12):e81–e192. doi: 10.1016/j.jacc.2018.08.1029. [DOI] [PubMed] [Google Scholar]
- 7.Lundergan C F, Ross A M, Mccarthy W F, et al Predictors of left ventricular function after acute myocardial infarction: Effects of time to treatment, patency, and body mass index. Am Heart J. 2001;142(1):43–50. doi: 10.1067/mhj.2001.116076. [DOI] [PubMed] [Google Scholar]
- 8.Liu W, Huang Q, Chang S, et al Multiple-feature-branch convolutional neural network for myocardial infarction diagnosis using electrocardiogram. Biomed Signal Proces. 2018;45:22–32. doi: 10.1016/j.bspc.2018.05.013. [DOI] [Google Scholar]
- 9.Reasat T, Shahnaz C. Detection of inferior myocardial infarction using shallow convolutional neural networks//2017 IEEE Region 10 Humanitarian Technology Conference (R10-HTC). Dhaka: IEEE, 2017: 718-721.
- 10.熊鹏, 薛彦平, 刘明, 等 基于密集连接卷积神经网络的下壁心肌梗死检测. 生物医学工程学杂志. 2020;37(1):142–149. doi: 10.7507/1001-5515.201904028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Sharma L N, Tripathy R K, Dandapat S Multiscale energy and eigenspace approach to detection and localization of myocardial infarction. IEEE Trans Biomed Eng. 2015;62(7):1827–1837. doi: 10.1109/TBME.2015.2405134. [DOI] [PubMed] [Google Scholar]
- 12.Acharya U R, Fujita H, Sudarshan V K, et al Automated detection and localization of myocardial infarction using electrocardiogram: a comparative study of different leads. Knowl-Based Syst. 2016;99(1):146–156. [Google Scholar]
- 13.Sharma L D, Sunkaria R K Inferior myocardial infarction detection using stationary wavelet transform and machine learning approach. Signal Image Video Process. 2017;12(2):199–206. [Google Scholar]
- 14.Goldberger A L, Amaral L A N, Glass L, et al PhysioBank, PhysioToolkit, and PhysioNet: components of a new research resource for complex physiologic signals. Circulation. 2000;101(23):e215–e220. doi: 10.1161/01.cir.101.23.e215. [DOI] [PubMed] [Google Scholar]
- 15.刘秀玲, 乔磊, 杨建利, 等 改进小波阈值法用于心电信号去噪. 生物医学工程学杂志. 2014;31(3):511–515. doi: 10.7507/1001-5515.20140095. [DOI] [PubMed] [Google Scholar]
- 16.Smith S. 急性心肌梗死心电图快速判读: 再灌注治疗循环手册. 天津: 天津科技翻译出版公司, 2004: 139-149.
- 17.李洪奇 急性心肌梗死心电图诊断分析. 世界最新医学信息文摘. 2017;17(28):146–148. [Google Scholar]
- 18.Pan J, Tompkins W J A real-time QRS detection algorithm. IEEE Trans Biomed Eng. 1985;32(3):230–236. doi: 10.1109/TBME.1985.325532. [DOI] [PubMed] [Google Scholar]
- 19.李露. 心电信号ST段分析研究. 重庆: 重庆大学, 2007.
- 20.辛宇, 童孟军, 华宇婷 一种基于最优特征选择改进的遗传算法. 传感技术学报. 2018;31(11):131–136. [Google Scholar]
- 21.田江华, 卢广平, 张海澄, 等 体表心电图在急性下壁心肌梗死中的定位诊断价值. 中国心血管杂志. 2018;23(6):477–480. doi: 10.3969/j.issn.1007-5410.2018.06.010. [DOI] [Google Scholar]
- 22.He K, Sun J. Convolutional neural networks at constrained time cost// 2015 IEEE Conference on Computer Vision and Pattern Recognition (CVPR). Boston: IEEE, 2015: 5353-5360.




