Good practices for the development of budget impact models at regional level
Introduction:
The present work aims to discuss the current scenario of procedures and regulations regarding budget impact analysis/models (BIA/BIM) at regional level in Italy and to provide a standardized approach and detailed recommendations for developing these analyses.
Method:
A systematic review of the literature was conducted in order to collect existing guidelines or specific regional procedures for budget impact analysis in Italy. All the records were analysed in qualitative terms according to a pre-specified analytical framework, based on the ISPOR BIA guidelines. At the end of the analysis, a consensus questionnaire was developed to establish agreed approaches and to provide possible solutions to any critical issues. A list of 39 statements was developed. The survey was distributed to 69 experts who rated their level of agreement with each statement on a 5-point Likert scale. Consensus was predefined as more than 66% of the panel agreeing/disagreeing with any given statement.
Results:
Sisty-nine experts answered the questionnaire; a total of 30/39 statements achieved consensus. There was agreement on most of the statements. Time horizon to consider and costs were the issues on which no agreement was found. The results allowed the working group to define a list of good practices.
Conclusion:
While the structure and development of BIM are now well-known and well-applied at national level, there remains a great diversity of management of BIM tools at regional level. Consensus was reached among participating experts, as to the main characteristics, determinants and features of regional BIA/BIM in the perspective of the Italian payer.
Keywords: Best practices, Budget impact analysis, ISPOR
Introduzione
In uno scenario che vede ormai ampiamente diffuso l’utilizzo delle analisi di Budget Impact (BIA) come strumento per informare i decisori riguardo all’impatto finanziario nel breve/medio periodo dell’introduzione di una tecnologia nel contesto sanitario nazionale o regionale, rimangono poco chiari la metodologia e gli aspetti informativi che i decisori intendono considerare per l’attuazione delle politiche sanitarie da adottare. Se, da una parte, le Linee Guida AIFA (1) per lo sviluppo delle BIA all’interno dei dossier prezzo e rimborso (P/R) hanno ormai fatto chiarezza almeno a livello nazionale sui farmaci, un’elevata variabilità rimane sulle metodologie adeguate da utilizzare a livello regionale o locale, in riferimento sia ai farmaci che ai dispositivi (2,3,4). Tale eterogeneità può rappresentare una criticità nel dialogo tra i due principali interlocutori in questa tipologia di analisi a livello regionale o locale (farmacia ospedaliera – azienda farmaceutica/dispositivi).
Attraverso il coinvolgimento di un gruppo multiprofessionale di esperti, il capitolo italiano dell’International Society for Pharmacoeconomics and Outcomes Research (ISPOR) si è proposto di realizzare un progetto che, partendo dall’esplorazione delle attuali prassi adottate a livello regionale, arrivi a individuare le good practice nello sviluppo delle BIA adattate al contesto regionale o locale.
L’intero documento è stato sviluppato considerando l’approccio schematico proposto dalle Linee guida dell’ISPOR (5,6), che prevedono la realizzazione di 6 step metodologici nella costruzione di una BIA.
Metodi
Il progetto si è articolato in tre fasi e ha coinvolto un gruppo di lavoro (GdL) di giovani ricercatori e professionisti con esperienza a più livelli nell’ambito sanitario e uno Steering Commitee di esperti che ha supervisionato il documento, oltre un panel di 70 esperti chiamati a esprimere il proprio accordo sulle raccomandazioni proposte dal gruppo.
Le tre fasi operative hanno riguardato:
Fase 1: Analisi di scenario;
Fase 2: Identificazione delle good practice;
Fase 3: Raggiungimento di un consensus.
Nella prima fase, il GdL, composto da farmacisti ospedalieri, membri dell’accademia e giovani professionisti dipendenti di società di consulenza, di aziende farmaceutiche e di dispositivi, ha condotto un’analisi delle Linee Guida disponibili a livello nazionale e internazionale effettuando una revisione a livello regionale al fine di rilevare la disponibilità di documenti di indirizzo metodologico o informativo sullo sviluppo di BIA per farmaci o dispositivi medici in ciascuna Regione.
Per la revisione metodologica si è deciso di seguire i 6 step già proposti da Mauskpof et al., ridefiniti nel 2017 (7) e già parte di entrambe le Linee Guida prese in analisi.
Gli step fanno riferimento a: 1) caratterizzazione della popolazione; 2) orizzonte temporale; 3) scenari di confronto; 4) stima di costo delle tecnologie; 5) stime di costo su modificazioni degli algoritmi di trattamento; 6) rappresentazione dei risultati.
Sempre utilizzando i 6 step proposti da ISPOR come criterio di riferimento, il GdL ha quindi individuato le possibili good practice condivise per lo sviluppo tecnico delle BIA considerando sia gli aspetti metodologici che quelli informativi necessari per poter prendere decisioni informate a livello regionale e locale.
Nella seconda fase, le good practice proposte sono state revisionate e validate da uno Steering Commitee composto da esperti nazionali e regionali e sottoposte, attraverso un questionario di consenso, a un panel allargato di esperti (associati all’ISPOR e ad altre società scientifiche) al fine di rilevare il grado di accordo sulle good practice e di definire raccomandazioni sullo sviluppo delle analisi di budget impact a livello regionale. Il processo per la definizione del consenso è stato effettuato attraverso l’utilizzo del metodo Delphi (8,9); sono stati definiti 39 statement relativi ai diversi step metodologici e un panel di 69 esperti è stato chiamato, nel mese di ottobre 2022, a esprimere il proprio grado di accordo o disaccordo su ogni statement utilizzando una scala Likert a 5 punti, con punteggio da 1 a 5 (1, fortemente in disaccordo; 2, in disaccordo; 3, d’accordo; 4, perlopiù d’accordo; e 5, fortemente d’accordo) (10). I risultati sono stati espressi come percentuale di intervistati che hanno valutato ogni elemento come 1 o 2 (disaccordo) o come 3, 4 o 5 (accordo). Un consenso positivo è stato raggiunto in caso di accordo superiore al 66%, un consenso negativo in caso di disaccordo superiore al 66% e il consenso non è stato raggiunto quando la somma per il disaccordo o l’accordo era inferiore al 66%.
Risultati
Nell’analisi delle Linee Guida disponibili a livello nazionale e internazionale si è tenuto conto tanto delle indicazioni relative ai farmaci quanto, ove presenti, di quelle relative ai dispositivi medici (11,12,13).
La Tabella I riporta, in sintesi, il confronto tra le indicazioni fornite da ISPOR e AIFA.
TABELLA I -. Confronto linee guida ISPOR – AIFA.
| ISPOR | AIFA | |
|---|---|---|
| Caratteristiche della popolazione | Includere l’intera popolazione eleggibile al nuovo trattamento nell’orizzonte temporale considerato, tenendo conto della dinamicità dovuta a eventuali restrizioni di accesso e a cambiamenti dello schema terapeutico e delle durate di trattamento, del rallentamento della malattia o della riduzione della mortalità. | Considerare la popolazione oggetto della specifica richiesta di rimborsabilità. La popolazione deve essere coerente con il numero prevedibile di soggetti interessati al trattamento, inclusivo sia degli eventuali pazienti prevalenti che di quelli incidenti. |
| Spacchettare la popolazione eleggibile in sottogruppi in base alla gravità della malattia, alle comorbidità, all’età, al sesso, all’etnia e ad altre caratteristiche. | Esplorare l’eterogeneità della popolazione mediante analisi per sottogruppo nell’ambito delle analisi di sensibilità. | |
| Orizzonte temporale | Può variare da 1 a 5 anni, in base alle esigenze del budget holder. | Almeno di 2 anni. |
| Scenari di confronto | Lo scenario base riguarda i trattamenti in essere nella popolazione eleggibile che possono considerare la sola gestione acuta della malattia o trattamenti alternativi alla nuova opzione terapeutica. | Confrontare il farmaco con lo SoC appropriato al contesto assistenziale italiano, In assenza di alternative terapeutiche di raccomanda di considerare la BSC. |
| Nello scenario di confronto, stimare l’uptake di pazienti che la nuova tecnologia sanitaria sarà in grado di raggiungere e, inoltre, eventuali effetti sulla popolazione. | Per ciascun anno dell’orizzonte temporale considerato, riportare la distribuzione delle quote di mercato nello scenario 1, senza il Farmaco, e nello scenario 2, in cui il Farmaco viene progressivamente inserito nel mercato. | |
| Stima di costo delle tecnologie | Le tipologie di costo da considerare dipendono dalla prospettiva adottata, che varia in funzione del budget holder. I dati di costo delle tecnologie sanitarie devono corrispondere al costo di acquisizione, somministrazione e monitoraggio della tecnologia. I costi legati agli eventi avversi legati ai farmaci o alla malattia devono essere inclusi e presentati in una voce di costo separata. Sono raccomandati dati real life sull’utilizzo di risorse e costi. | Le tipologie di costo da considerare dipendono dallo specifico ambito terapeutico d’impiego del farmaco. |
| Se non sono disponibili i costi effettivi di acquisizione, si possono usare prezzi pubblicamente visibili prevedendo nel modello l’opportunità di includere sconti. | Per calcolare il costo dei trattamenti farmacologici occorre applicare il prezzo EXF pubblicato in Gazzetta Ufficiale, al netto delle riduzioni di legge (con l’eccezione dei farmaci innovativi). | |
| Stime di costo su modificazioni degli algoritmi di trattamento | L’intervento considerato nell’analisi può alterare la fruizione dei servizi sanitari e, quindi, la capacità del sistema nella gestione della patologia. È utile descrivere questo impatto sull’uso dei servizi sanitari, in ragione delle possibili implicazioni per la pianificazione del sistema sanitario, indipendentemente dall’impatto sul budget reale nel breve periodo. | Nel caso base includere esclusivamente i costi diretti sanitari coerentemente con la prospettiva del SSN. I costi diretti sanitari a carico del SSN possono essere stimati mediante l’utilizzo delle tariffe nazionali vigenti, laddove disponibili, o sulla base di studi condotti ad hoc in centri italiani. |
| Rappresentazione dei risultati | Presentare i cambiamenti nell’utilizzo delle risorse, nella gestione degli eventi avversi e nella gestione della malattia per trattamento e per periodo. Il costo totale e il costo disaggregato andrebbero presentati in una tabella separata e per ogni periodo dell’orizzonte temporale. | Riportare i risultati dell’analisi di impatto sul budget farmaceutico e sul budget del SSN complessivo in termini di costi incrementali e di costi evitati, per ciascun anno dell’orizzonte temporale considerato. Presentare anche l’impatto del prodotto in termini di outcome sanitari riportando una stima degli eventi sanitari evitati/addizionali e i relativi costi differenziali per il SSN negli orizzonti temporali considerati. |
| Presentare i risultati delle analisi di sensibilità mediante tabelle o figure. I diagrammi tornado rappresentano un modo semplice per visualizzare i driver rilevanti della BIA. | Presentare i risultati dell’analisi di sensibilità relativamente sia agli input considerati che alle assunzioni effettuate al fine di valutare l’impatto dell’incertezza sui risultati dell’analisi di budget impact. |
Rispetto ai modelli regionali, l’analisi ha reso possibile reperire documenti guida per lo sviluppo di BIM su Farmaci in 12 Regioni (Lombardia, Veneto, Emilia-Romagna, Marche, Umbria, Campania, Molise, Puglia, Basilicata, Calabria, Sicilia e Sardegna) mentre solo 6 Regioni (Liguria, Lombardia, Veneto, Toscana, Campania e Puglia) hanno documenti riferiti a BIA specifiche per dispositivi medici.
Al fine di fornire un elemento di comparazione tra le Linee Guida Regionali e la Linea Guida Nazionale dettata da AIFA, è stato definito un parametro comparativo settando un valore pari al 100% relativamente agli adempimenti degli step metodologici identificati all’interno delle Linee Guida. Per ogni Regione analizzata, è stata rilevata una percentuale di coerenza con quanto richiesto dalle Linee Guida AIFA (Tabb. II e III).
TABELLA II -. Mappa linee guida farmaci al 01/01/2023.
| Linee Guida (% su 8 step) | STEP | Metodi | 1° | 2° | 3° | 4° | 5° | 6° | Altro |
|---|---|---|---|---|---|---|---|---|---|
| 100% | ITALIA | X | X | X | X | X | X | X | X |
| 0% | Piemonte | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Valle d’Aosta | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Liguria | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Lombardia | X | X | X | X | X | X | X | X |
| 0% | Trentino-Alto Adige | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Veneto | X | X | X | X | X | X | X | X |
| 0% | Friuli-Venezia Giulia | ND | ND | ND | ND | ND | ND | ND | ND |
| 25% | Emilia-Romagna | ND | X | ND | X | ND | ND | ND | ND |
| 0% | Toscana | ND | ND | ND | ND | ND | ND | ND | ND |
| 88% | Marche | X | X | X | X | X | X | X | X |
| 63% | Umbria | X | X | ND | X | X | ND | X | ND |
| 0% | Lazio | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Campania | X | X | X | X | X | X | X | X |
| 0% | Abruzzo | ND | ND | ND | ND | ND | ND | ND | ND |
| 63% | Molise | ND | X | ND | X | X | ND | X | X |
| 63% | Puglia | X | X | X | X | ND | ND | ND | X |
| 63% | Basilicata | ND | X | ND | X | X | ND | X | X |
| 75% | Calabria | ND | X | X | X | X | ND | X | X |
| 100% | Sicilia | X | X | X | X | X | X | X | X |
| 63% | Sardegna | ND | X | ND | X | X | X | ND | X |
TABELLA III -. Mappa linee guida dispositivi medici al 01/01/2023.
| Linee Guida (%) | Step | Metodi | 1° | 2° | 3° | 4° | 5° | 6° | Altro |
|---|---|---|---|---|---|---|---|---|---|
| 0% | ITALIA | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Piemonte | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Valle d’Aosta | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Liguria | X | X | X | X | X | X | X | X |
| 100% | Lombardia | X | X | X | X | X | X | X | X |
| 0% | Trentino-Alto Adige | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Veneto | X | X | X | X | X | X | X | X |
| 0% | Friuli-Venezia Giulia | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Emilia-Romagna | ND | ND | ND | ND | ND | ND | ND | ND |
| 75% | Toscana | X | X | X | X | X | ND | X | ND |
| 0% | Marche | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Umbria | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Lazio | ND | ND | ND | ND | ND | ND | ND | ND |
| 100% | Campania | X | X | X | X | X | X | X | X |
| 0% | Abruzzo | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Molise | ND | ND | ND | ND | ND | ND | ND | ND |
| 63% | Puglia | X | X | X | X | ND | ND | ND | X |
| 0% | Basilicata | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Calabria | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Sicilia | ND | ND | ND | ND | ND | ND | ND | ND |
| 0% | Sardegna | ND | ND | ND | ND | ND | ND | ND | ND |
Consensus
La votazione ha visto, in totale, il raggiungimento del consenso per il 74% degli statement. Si è deciso di non sottoporre a ulteriore votazione i 10 item che non hanno raggiunto un consenso positivo o negativo ritenendo che tale risultato riflettesse le criticità legate al disallineamento tra le soluzioni ritenute metodologicamente più corrette e la loro reale applicabilità nel contesto regionale.
Nella Tabella IV sono riportati tutti gli statement e le relative percentuali di voto e di seguito vengono riportati i risultati sintetizzati e raggruppati secondo i 6 step metodologici.
TABELLA IV -. Risultati consensus.
| Statement | Non accordo (1-2) | Accordo (3-5) |
|---|---|---|
| Ritengo che in un’analisi di budget impact regionale la prospettiva da considerare sia quella del Servizio Sanitario Nazionale | 25% | 75% |
| Ritengo che in un’analisi di budget impact regionale la prospettiva da considerare sia quella del Servizio Sanitario Regionale | 6% | 94% |
| Ritengo che in un’analisi di budget impact regionale la prospettiva da considerare sia quella dell’ospedale | 29% | 71% |
| Ritengo che in un’analisi di budget impact regionale la prospettiva da considerare sia quella sociale (inclusione dei costi indiretti) | 25% | 75% |
| Nell’individuazione della popolazione eleggibile al nuovo trattamento si devono considerare tutti i pazienti residenti, incidenti e prevalenti, secondo dati epidemiologici e real world, al netto della mobilità regionale | 13% | 87% |
| Nell’individuazione della popolazione eleggibile al nuovo trattamento si devono considerare tutti i pazienti, incidenti e prevalenti, secondo dati epidemiologici e real world comprensivi della mobilità regionale | 25% | 75% |
| Nell’individuazione della popolazione eleggibile al nuovo trattamento si devono considerare tutti i pazienti, incidenti e prevalenti, esclusivamente secondo dati epidemiologici derivanti dalla letteratura internazionale | 57% | 43% |
| Ritengo che l’orizzonte temporale da considerare in una BIA sia pari a 1 anno | 80% | 20% |
| Ritengo che l’orizzonte temporale da considerare in una BIA sia pari a 2 anni | 57% | 43% |
| Ritengo che l’orizzonte temporale da considerare in una BIA sia pari a 1-5 anni con impatti per singolo anno | 25% | 75% |
| Ritengo che l’orizzonte temporale da considerare in una BIA sia pari a 1-3 anni con impatti per singolo anno | 10% | 90% |
| Ritengo che l’orizzonte temporale da considerare in una BIA sia pari a 3 anni | 28% | 71% |
| In merito agli scenari di confronto da includere in una BIA, ritengo che il competitor da considerare vada individuato secondo indicazione AIFA | 17% | 83% |
| In merito agli scenari di confronto da includere in una BIA, ritengo che il competitor vada individuato in base a Linee Guida nazionali e AIFA | 4% | 96% |
| In merito agli scenari di confronto da includere in una BIA, ritengo che nell’individuazione del competitor vadano prese in considerazione le integrazioni proposte dall’ente (pubblico o privato) che sviluppa il modello | 35% | 65% |
| In merito agli scenari di confronto da includere in una BIA, ritengo che nell’individuazione del competitor è utile coinvolgere Key Opinion Leader clinici del territorio | 17% | 83% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo di gara al netto dell’IVA | 28% | 72% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo di gara al lordo dell’IVA | 46% | 54% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo ex-factory (netto –5% –5%) | 32% | 68% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo ex-factory (lordo –5% –5%) | 57% | 43% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo di gara e solo laddove non disponibile il prezzo ex-factory (netto) | 36% | 64% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo di gara e solo laddove non disponibile il prezzo ex-factory (lordo) | 51% | 49% |
| Per quanto riguarda la stima del costo della tecnologia, ritengo appropriato considerare il prezzo ex-factory (netto –5% –5%) netto sconti confidenziali | 28% | 72% |
| Per quanto riguarda la stima del costo della tecnologia ritengo appropriato considerare il prezzo ex-factory (lordo –5% –5%) netto sconti confidenziali | 51% | 49% |
| Per le stime di costo delle modificazioni dell’algoritmo di trattamento, ritengo corretto che siano inseriti solo i costi diretti sanitari | 38% | 62% |
| Per le stime di costo delle modificazioni dell’algoritmo di trattamento ritengo corretto che siano inseriti solo i costi diretti sanitari e non sanitari | 29% | 71% |
| Per le stime di costo delle modificazioni dell’algoritmo di trattamento ritengo corretto che siano inseriti: i costi diretti sanitari nel caso base e i costi non sanitari e i costi indiretti solo nell’analisi di scenario | 16% | 84% |
| Per le stime di costo delle modificazioni dell’algoritmo di trattamento ritengo corretto che siano inseriti tutti i costi, diretti e indiretti | 20% | 80% |
| Nella rappresentazione dei risultati di una BIA deve essere presente la differenza assoluta tra il costo nel mondo con e senza il farmaco | 13% | 87% |
| Nella rappresentazione dei risultati di una BIA deve essere presente un’analisi di sensitività deterministica (DSA) a una via | 16% | 84% |
| Nella rappresentazione dei risultati di una BIA deve essere presente un grafico tornado che rappresenti i risultati della DSA | 13% | 87% |
| Nella rappresentazione dei risultati di una BIA, devono essere presenti gli effetti sugli outcome di salute ottenuti grazie all’introduzione del nuovo farmaco | 9% | 91% |
| Ritengo che a supporto di una BIA debba essere sempre presente l’analisi di HTA | 13% | 87% |
| Ritengo che a supporto di una BIA debba essere sempre presente l’analisi di HTA o, se non disponibile, un’analisi di costo utilità | 7% | 93% |
| Ritengo che a supporto di una BIA debba essere sempre presente ogni ulteriore studio farmaco-economico, se disponibile | 9% | 91% |
| Ritengo che la BIA debba essere sempre richiesta per le seguenti tipologie di farmaci classificati TN1 da AIFA (Nuovo principio attivo, Farmaco Orfano, Estensione di indicazione o Riclassificazione) | 3% | 97% |
| Ritengo che la BIA debba essere sempre richiesta per le seguenti tipologie di farmaci classificati TN5 da AIFA (Medicinali e/o indicazioni terapeutiche in Lista ai sensi della Legge 648/96) | 20% | 80% |
| Ritengo che la BIA debba essere sempre richiesta per le seguenti tipologie di farmaci classificati TN2 e TN3 da AIFA: TN2 (Nuova associazione di principi attivi, Nuova AIC, Variazione di posologia, Farmaco-copia), TN3 (Farmaco biosimilare, farmaco equivalente, estensione di indicazione di biosimilare o equivalente) | 20% | 80% |
| Ritengo che la BIA debba essere richiesta con i soli impatti di spesa farmaceutica per farmaci classificati TN2 o TN3 (escludendo altri costi diretti sanitari) | 36% | 64% |
Caratterizzazione della popolazione: per quanto riguarda il primo step metodologico hanno raggiunto un consenso positivo gli item che indicano la necessità di considerare tutti i pazienti residenti, incidenti e prevalenti. Il tema della mobilità regionale resta aperto, anche se il consenso è maggiore (87% vs 75%) rispetto all’opportunità di considerare i pazienti al netto della mobilità.
Orizzonte temporale: anche in questo caso sono diverse le possibilità che incontrano un consenso positivo da parte del panel: la proposta delle Linee Guida ISPOR (da 1 a 5 anni) così come un orizzonte pari a 3 anni raggiungono un consenso positivo (75% e 71%), ma si segnala che la proposta di definire come periodo da considerare nell’analisi un orizzonte da 1 a 3 anni, con impatti per singolo anno, vede il 90% del panel esprimersi con un consenso positivo.
Scenari di confronto: la maggior parte dei votanti concorda nel ritenere che nell’individuazione del competitor da considerare vada fatto riferimento alle indicazioni AIFA e, a larga maggioranza (96%), che si debbano considerare anche le Linee Guida nazionali. La possibilità di coinvolgere KOL del territorio vede il raggiungimento di un consenso positivo dell’83%, a conferma dell’importanza di avere un riferimento sulla realtà clinica e sulle prassi in atto nel territorio.
Stima del costo della tecnologia: si registra un consenso positivo rispetto alla possibilità di considerare il prezzo di gara al netto dell’IVA, e il prezzo ex-factory netto –5% –5% al netto degli sconti confidenziali. I restanti item non hanno raggiunto consenso.
Stime di costo su modificazioni degli algoritmi di trattamento: si registra un consenso positivo per i 3 item che propongono un’alternativa all’inclusione dei soli costi diretti nelle stime di costo delle modificazioni all’algoritmo di trattamento. C’è un ampio margine (84%) di accordo rispetto alla proposta di includere i costi diretti sanitari nel caso base e i costi non sanitari e i costi indiretti solo nell’analisi di scenario.
Rappresentazione dei risultati: tutti gli item dello statement relativo alla rappresentazione dei risultati raggiungono un ampio consenso positivo evidenziando che tutti gli elementi proposti dovrebbero, nell’opinione dei votanti, essere inclusi nella rappresentazione dei risultati dell’analisi.
Discussione
L’obiettivo del progetto era, come detto in apertura, quello di provare a individuare possibili best practice che andassero nella direzione di uniformare, per quanto possibile, gli approcci regionali e le diverse indicazioni sulle modalità corrette di sviluppo di una BIA.
Pur riconoscendo i limiti di questo studio e la difficoltà, per alcuni step, a individuare un’indicazione univoca, riteniamo che quanto emerso da questo documento possa rappresentare un primo passo nella direzione auspicata.
Il primo punto su cui il GdL si è soffermato è stato quello della prospettiva da utilizzare per l’analisi. Il consensus su questo punto ha rispecchiato quanto emerso dall’analisi dei documenti regionali: è infatti indubbia l’utilità di considerare le diverse prospettive (Sistema Sanitario Nazionale, prospettiva sociale, prospettiva del singolo ospedale), tuttavia, guardando alla reale applicabilità del modello, considerare in primo luogo la prospettiva del Sistema Sanitario Regionale appare la soluzione più percorribile e funzionale agli obiettivi di una BIA.
Tra i punti che hanno visto maggiore divisione all’interno del panel dei votanti va segnalato l’orizzonte temporale: se infatti la soluzione proposta da ISPOR nelle Linee Guida (5 anni) appare ottimale a livello teorico, rischia di essere poco percorribile da un punto di vista pratico. D’altra parte, considerando un orizzonte a 1 anno come possibile nel caso di dispositivi o aree terapeutiche specifici, in generale la scelta maggiormente percorribile sembra essere quella di un orizzonte da 1 a 3 anni con impatti sul singolo anno.
Anche il tema relativo alle stime di costo rappresenta una questione aperta che ha visto il panel dividersi sui diversi statement proposti.
Gli ultimi statement del questionario facevano, infine, riferimento agli ulteriori documenti da includere nella BIA e alle categorie di farmaci per i quali richiedere l’analisi.
Si è registrato un ampio grado di accordo rispetto alla necessità di includere nella BIA l’analisi di HTA e, laddove questa non fosse disponibile, un’analisi di costo utilità od ogni ulteriore studio farmaco-economico disponibile. Questo consentirebbe non solo un’analisi delle conseguenze finanziarie della nuova tecnologia, ma permetterebbe anche una valutazione economica in grado di supportare la tecnologia in analisi dal punto di vista scientifico.
Le categorie di farmaci per le quali il panel ritiene corretta la richiesta di un’analisi di budget impact sono le seguenti: farmaci classificati da AIFA: TN1 (Nuovo principio attivo, Farmaco Orfano, Estensione di indicazione o Riclassificazione), TN2 (Nuova associazione di principi attivi, Nuova AIC, Variazione di posologia, Farmaco-copia), TN3 (Farmaco biosimilare, farmaco equivalente, estensione di indicazione di biosimilare o equivalente) e TN5 (Medicinali e/o indicazioni terapeutiche in Lista ai sensi della Legge 648/96) (14).
Un ultimo aspetto da sottolineare riguarda la scelta di un panel allargato di stakeholder per il consensus che, ovviamente, possono essere ritenuti portatori di interessi diversi. Tuttavia, tra gli obiettivi dichiarati dell’ISPOR Italy Rome Chapter c’è proprio quello di far colloquiare tutti gli stakeholder e dare voce ai diversi portatori di interesse. In questo lavoro, lo Steering Committee e i gruppi di lavoro erano formati da professionalità provenienti da accademia, aziende farmaceutiche, aziende di dispositivi, pagatori regionali e nazionali. Tutti hanno contribuito a portare la propria prospettiva all’interno del documento. A nostro avviso, questo approccio consente di calare la teoria economica e finanziaria dell’accademia all’interno della quotidianità delle valutazioni regionali fatte dai farmacisti considerando anche le necessità di una visione allargata dei prodotti richiesta dalle aziende che sviluppano molecole che non possono essere valutate sui soli parametri del prezzo “più basso”. Di conseguenza, la scelta di un panel allargato per stabilire un consensus è una conseguenza della visione generale dell’ISPOR Italy Rome Chapter che vuole rendere le metodologie economiche realizzabili e applicabili al contesto real world.
Nella Tabella V, in sintesi, vengono riportate le proposte del GdL integrate con i risultati del consensus tra i Soci (secondo il grado di accordo – consenso positivo ottenuto), mentre, nei Materiali Supplementari, vengono riportate delle proposte di template di tabelle e grafici da riportare all’interno dei dossier regionali (Materiale Supplementare). Ovviamente, la BIA, al contrario delle valutazioni economiche, è uno strumento che non può prescindere da un’associazione precisa al capitolo di spesa sanitaria a cui afferisce la tecnologia oggetto di stima. Ciò significa che la standardizzazione delle procedure e le buone pratiche proposte potrebbero non essere sempre semplici da applicare e che potrebbe essere necessaria una specifica differenziazione a seconda del tipo di tecnologia e del livello di analisi (macro o hospital based).
TABELLA V -. Le best practice.
| prospettiva dell’analisi | Considerare come prospettiva il Sistema Sanitario Regionale |
| ■ Se possibile tenere conto anche delle altre prospettive (SSN, Ospedale, Sociale) | |
| Caratterizzazione della popolazione | Considerare i pazienti incidenti e prevalenti, facendo riferimento ai residenti e utilizzando per le stime dati real world validati da KOL locali |
| ■ Laddove possibile considerare anche la mobilità regionale | |
| Orizzonte temporale | Considerare come orizzonte temporale un range da 1 a 3 anni, con impatti per singolo anno |
| ■ È considerato appropriato anche considerare un orizzonte temporale di 3 anni o da 1 a 5 anni con impatti per singolo anno | |
| Scenari di confronto | Per l’individuazione del competitor fare riferimento a quanto indicato da AIFA, integrato in base all’indicazione terapeutica e a ulteriori analisi effettuate su base regionale o attraverso il coinvolgimento di Key Opinion Leader locali. Per la distribuzione dei pazienti da considerare è raccomandato l’utilizzo di dati di real world e, se possibile, l’inserimento anche delle opzioni di trattamento future che si renderanno disponibili nel corso del follow-up di analisi |
| Stima del costo della tecnologia | Si raccomanda l’utilizzo dello schema AIFA modificato e di considerare come riferimento per il costo il prezzo di gara o, se non disponibile, il prezzo ex-factory |
| ■ Considerare i prezzi reali sostenuti dal SSR escludendo tutti gli sconti anche se non trasparenti e al netto dell’IVA | |
| Stime costo su modificazioni algoritmi trattamento | Si raccomanda di considerare esclusivamente i costi diretti sanitari per la stima delle modificazioni di gestione del paziente con l’introduzione delle nuove tecnologie sanitarie |
| ■ Laddove possibile includere anche costi indiretti e costi diretti non sanitari almeno nell’analisi di scenario | |
| Rappresentazione dei risultati | Si raccomanda di riportare i dati di spesa annua nei due scenari di analisi distinti per anno di analisi e voce di spesa riportando la differenza assoluta di tale spesa tra il mondo con la tecnologia sanitaria in analisi e senza la tecnologia sanitaria in analisi |
| ■ Utilizzare un template uniforme alle good practice proposte e ai 6 step metodologici suggeriti | |
| Altro | Includere nella BIA l’analisi di HTA e, laddove questa non fosse disponibile, un’analisi di costo utilità od ogni ulteriore studio di valutazione economica disponibile |
Conclusioni
Attraverso il questionario proposto, il GdL ha inteso sollecitare una riflessione nei Soci ISPOR in merito alla possibilità di individuare, a livello regionale, una metodologia condivisa nello sviluppo delle analisi di budget impact.
Il presente lavoro ha avviato un processo di riflessione e confronto sulle prassi attualmente in uso nelle diverse Regioni nell’ottica di integrare i vari modelli al fine di individuare buone prassi condivisibili.
Le indicazioni emerse dal consensus rappresentano un primo tentativo in questa direzione, pur lasciando aperte alcune questioni relative al possibile “disallineamento” tra le soluzioni che appaiono più appropriate da un punto di vista metodologico e la loro reale applicabilità nel contesto regionale (p. es., inclusione di tutti i costi diretti e indiretti nel modello).
Disclosures
Conflict of interest: The authors declare no potential conflict of interest with respect to the research, authorship and/or publication of this article. The authors declare the following competing interests:
Francesco Attanasio,, Alberto Bortolami, Pier Luigi Canonico, Marco Cicoira, Caterina Donati, Fabrizio Gemmi, Andrea Marcellusi, Andrea Marinozzi, Francesco Saverio Mennini, Carolina Moreno, Sara Mucherino, Angela Ragonese, Chiara Roni, Pierluigi Russo, Francesco Russoniello, Claudia Simonelli, Matteo Zanuzzi declare no conflict of interest.
Amalia Antenori is an employee and minor shareholder of Eli Lilly, Italy Spa;
Matteo Ferrario is an employee of Roche Spa;
Ruggero Lasala is member of the Comitato Unico di Ricerca e Formazione at SIFO;
Giovanna Scroccaro receives honoraria for lectures;
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Supplementary material A - Template proposti per sottomissione dossier regionali
Step 1 -. Caratterizzazione della popolazione (le percentuali sono a titolo di esempio).

Step 2/3 -. Orizzonte temporale e scenario di confronto (le percentuali sono a titolo di esempio) : Rappresentazione tabellare della patient share dei pazienti all’interno delle alternative terapeutiche disponibili a livello regionale/locale.
| Scenario mondo senza | |||
|---|---|---|---|
| Trattamento | Anno 1 | Anno 2 | Anno 3 |
| Farmaco A | 92% | 94% | 95% |
| Farmaco B | 8% | 6% | 5% |
| Farmaco C | 0% | 0% | 0% |
| Totale | 100% | 100% | 100% |
| Scenario mondo con | |||
|---|---|---|---|
| Trattamento | Anno 1 | Anno 2 | Anno 3 |
| Farmaco A | 89% | 86% | 83% |
| Farmaco B | 7% | 4% | 1% |
| Farmaco C | 4% | 10% | 16% |
| Totale | 100% | 100% | 100% |
| Pazienti | ||
|---|---|---|
| Anno 1 | Anno 2 | Anno 3 |
| 1.125 | 1.200 | 1.279 |
| 97 | 83 | 71 |
| 0 | 0 | 0 |
| 1.222 | 1.282 | 1.350 |
| Pazienti | ||
|---|---|---|
| Anno 1 | Anno 2 | Anno 3 |
| 1.090 | 1.105 | 1.114 |
| 82 | 48 | 16 |
| 50 | 130 | 220 |
| 1.222 | 1.282 | 1.350 |
Step 4 -. Stima del costo della tecnologia.
| Comparatore 1 | Comparatore 2 | Prodotto | ||||
|---|---|---|---|---|---|---|
| PA | PA | PA | PA | PA | PA | |
| ATC V livello | ||||||
| Specialità | ||||||
| Confezione | ||||||
| Pezzo di gara/EXF | ||||||
| Dose raccomandata in RCP | ||||||
| Costo die/ciclo(durata)/mese paziente RW | ||||||
| Durata del trattamento (giorni, cicli, mesi, etc) | ||||||
| Numero confezioni per la durata del trattamento | ||||||
| Costo per la durata del trattamento per paziente | ||||||
Step 5 -. Stime di costo su modificazioni degli algoritmi di trattamento (le percentuali ed il nome delle variabili sono a titolo di esempio) : Proposta tabelle parametri epidemiologici e di rischio utilizzati nel modello (caso-base e parametri utilizzati nell’analisi di sensibilità).
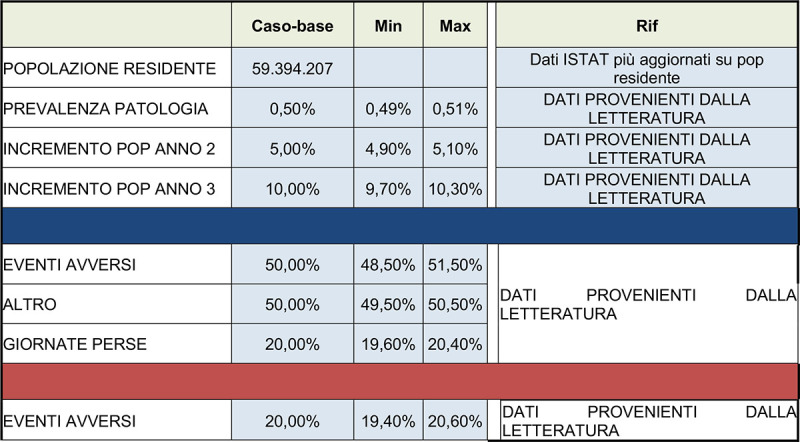
|
Step 6 -. Rappresentazione dei risultati : Proposta di rappresentazione dei risultati economici e di impatto della spesa (i valori riportati sono a puro titolo di esempio.
| Anno 1 | |||
| Voci di costo | Mondo Senza | Mondo Con | Budget Impact |
| Farmaci | € 5.410.757 | € 4.829.432 | -€ 581.325 |
| Ospedalizzazioni | € 30.730.954 | € 29.613.601 | -€ 1.117.353 |
| Altri costi diretti | € 1.845.250 | € 1.601.773 | -€ 243.478 |
| Costi diretti | € 37.986.961 | € 36.044.806 | -€ 1.942.155 |
| Anno 2 | |||
| Voci di costo | Mondo Senza | Mondo Con | Budget Impact |
| Farmaci | € 6.017.038 | € 5.316.557 | -€ 700.481 |
| Ospedalizzazioni | € 34.018.200 | € 32.660.410 | -€ 1.357.790 |
| Altri costi diretti | € 2.052.012 | € 1.758.628 | -€ 293.384 |
| Costi diretti | € 42.087.250 | € 39.735.595 | -€ 2.351.655 |
| Anno 3 | |||
| Voci di costo | Mondo Senza | Mondo Con | Budget Impact |
| Farmaci | € 6.691.442 | € 5.896.891 | -€ 794.551 |
| Ospedalizzazioni | € 37.977.490 | € 36.506.979 | -€ 1.470.512 |
| Altri costi diretti | € 2.282.007 | € 1.949.223 | -€ 332.784 |
| Costi diretti | € 46.950.940 | € 44.353.093 | -€ 2.597.847 |
Supplementary material B:
Tabella A1 - . Sintesi delle evidenze disponibili a livello regionale su BIA farmaci.
| STEP metodologici | Metodi | 1° | 2° | 3° | 4° | 5° | 6° | Altro |
|---|---|---|---|---|---|---|---|---|
| ITALIA1 | 1. Approccio statico standard o modello dinamico
2. Prospettiva del SSN nel caso base 3. Riferimento alle LG ISPOR (Sullivan et al., 2014) |
1. Popolazione oggetto della specifica richiesta di rimborsabilità nel caso-base
2. Popolazione inclusiva sia degli eventuali pazienti prevalenti che degli incidenti. 3. Analisi di sensibilità: analisi per sottogruppo |
≥2 anni | 1. SoC o BSC
2. Quote di mercato con Scenario 1: senza il Farmaco; Scenario 2: con il Farmaco |
1. Dipendenti dall'ambito terapeutico d’impiego del farmaco.
2. Prezzo EXF pubblicato in Gazzetta Ufficiale, al netto delle riduzioni di legge (escl eccezioni e.g. F.innovativi) |
Costi diretti sanitari | 1. Costi incrementali e costi evitati, per ciascun anno dell’orizzonte temporale considerato.
2. Analisi di sensibilità relativamente sia agli input considerati, sia alle assunzioni effettuate 3. Stima degli eventi sanitari evitati/addizionali ed i relativi costi differenziali per il SSN negli orizzonti temporali considerati. |
CEA/CUA |
| Piemonte | ND | ND | ND | ND | ND | ND | ND | ND |
| Valle d'Aosta | ND | ND | ND | ND | ND | ND | ND | ND |
| Liguria | ND | ND | ND | ND | ND | ND | ND | ND |
| Lombardia2 | Prospettiva del SSN nel caso base | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile al trattamento |
3 anni | SoC | NS | 1. Costi diretti sanitari
2. Costi diretti sanitari non a carico del SSN e non sanitari 3. Costi indiretti |
Risultati tabellari dell’analisi di impatto sul budget farmaceutico | Letteratura disponibile/CEA/CU A/Certificazioni |
| Trentino-Alto Adige | ND | ND | ND | ND | ND | ND | ND | ND |
| Veneto3 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia
2. Stima della popolazione candidabile al trattamento |
1 anno | SoC | 1. Prezzo EXF al netto delle riduzioni di legge e sconti negoziati, ma al lordo di IVA al 10%
2. Accordi negoziali specifici (MEA) |
Costi diretti sanitari | Risultati tabellari dell’analisi di impatto sul budget farmaceutico. | Ufficio HTA (Ing. Clinico, Statistico e farmacista + clinico supporto) / CEA |
| Friuli-Venezia Giulia | ND | ND | ND | ND | ND | ND | ND | ND |
| Emilia-Romagna | NS | 1. Inquadramento generale della patologia
2. Stima della popolazione candidabile al trattamento |
NS | SoC | NS | NS | NS | NS |
| Toscana | ND | ND | ND | ND | ND | ND | ND | ND |
| Marche4 | 1. Prospettiva del SSN nel caso base
2. Riferimento alle LG Nazionali/Internazi onali |
1. Inquadramento generale della patologia
2. Stima della popolazione candidabile al trattamento |
2 anni | SoC | Costo del farmaco valutando l’impatto sulla pratica clinica, sulla prescrizione e sulla spesa farmaceutica rispetto allo SoC | 1. Costi diretti sanitari
2. Costi diretti sanitari non a carico del SSN e non sanitari 3. Costi indiretti |
1. Risultati dell’analisi di impatto sul budget farmaceutico e sul budget SSR
2. Risultati dell’analisi di sensibilità |
Report HTA/CEA/CUA |
| Umbria5 | Prospettiva del SSR nel caso base | Inquadramento generale della patologia | NS | SoC | 1. Costo terapia;
2. Costo per singolo paziente del trattamento proposto comparato al costo dei trattamenti Standard |
ND | Previsione di impatto/carico assistenziale per il SSR. | ND |
| Lazio | ND | ND | ND | ND | ND | ND | ND | ND |
| Campania6 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile al trattamento |
3 anni | SoC | 1. Costo per singolo paziente del nuovo farmaco
2. Costo per singolo paziente del Comparatore 3. Spesa del nuovo farmaco vs Comparatore 4. Durata della terapia 5. Dose prescritta |
1. Costi diretti sanitari
2. Costi diretti sanitari non a carico del SSN e non sanitari 3. Costi indiretti |
1. Risultati dell’analisi di impatto sul budget farmaceutico e sul budget SSR
2. Risultati dell’analisi di sensibilità 3. Fabbisogno annuale del SSR espresso in unità per singolo dosaggio |
Report HTA/CEA/CUA |
| Abruzzo | ND | ND | ND | ND | ND | ND | ND | ND |
| Molise7 | NS | 1. Inquadramento generale della patologia
2. Stima della popolazione candidabile al trattamento |
NS | SoC | 1. Prezzo del farmaco
2. Durata della terapia 3. Dose prescritta |
NS | Risultati dell’analisi di impatto sul budget farmaceutico e sul budget SSR | CEA |
| Puglia8 | ND | ND | ND | ND | ND | ND | ND | ND |
| Basilicata9 | NS | Inquadramento generale della patologia ed epidemiologia | NS | SoC | Prezzo reale al netto della scontistica riservata dall’azienda farmaceutica alle strutture del SSR. | NS | Risultati dell’analisi di impatto sul budget SSR; Previsione dei costi paziente /anno. | Studi registrativi e post-registrativi |
| Calabria10 | NS | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile al trattamento |
3 anni | SoC | 1. Costo per singolo paziente del nuovo farmaco
2. Costo per singolo paziente del Comparatore 3. Spesa del nuovo famaco vs Comparatore 4. Durata della terapia 5. Dose prescritta 6. Prezzo EXF + eventuale sconto o MEA |
NS | Analisi di budget impact SSR Proiezione della spesa annuale a livello regionale e per centro | Studi clinici/CEA |
| Sicilia11 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile al trattamento |
3 anni | SoC | 1. Costo per singolo paziente del nuovo farmaco
2. Costo per singolo paziente del Comparatore 3. Spesa del nuovo famaco vs Comparatore 4. Durata della terapia 5. Dose prescritta 6. Prezzo EXF + sconto confidenziale e differenza rispetto ad eventuale trattamento disponibile |
Costi diretti sanitari | Analisi di budget impact SSR Proiezione della spesa annuale a livello regionale e per centro | Studi clinici/CEA/Report HTA/Trials sperimentali/Linee Guida disponibili |
| Sardegna12 | NS | Inquadramento generale della patologia | NS | SoC | Prezzo EXF + sconto confidenziale riservato | Costi diretti sanitari | NS | Letteratura disponibile/RCP |
Abbreviazioni: BSC, Best supportive care; CEA, Cost-effectiveness analysis; CUA, Cost-utility analysis; EXF, ex-factory; HTA, Health technology assessment; MEA, menaged entry agreements; ND, Non Disponibile; NS, Non Specificato; RCP, riassunto delle caratteristiche del prodotto; SoC, Standard o Care
Tabella A2 – Sintesi delle evidenze disponibili su BIA dispositivi medici.
| STEP metodologici | Metodi | 1° | 2° | 3° | 4° | 5° | 6° | Altro |
|---|---|---|---|---|---|---|---|---|
| ITALIA | ND | ND | ND | ND | ND | ND | ND | ND |
| Piemonte | ND | ND | ND | ND | ND | ND | ND | ND |
| Valle d'Aosta | ND | ND | ND | ND | ND | ND | ND | ND |
| Liguria13 | Prospettiva della struttura ospedaliera nel caso base | "1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile all’uso del DM |
1 anno | SoC | Costi annuali aggiuntivi o risparmiati | Costi diretti sanitari | 1. Risultati dell’analisi di sensibilità
2. Discutere limitazioni ai metodi/approcci usati o fonti di bias |
Letteratura disponibile/CEA/CU A |
| Lombardia14 | Prospettiva del SSN nel caso base | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile all’uso del DM |
3 anni | SoC | NS | 1. Costi diretti sanitari
2. Costi diretti sanitari non a carico del SSN e non sanitari 3. Costi indiretti |
Risultati tabellari dell’analisi di impatto sul budget farmaceutico | Letteratura disponibile/CEA/CU A/Certificazioni |
| Trentino-Alto Adige | ND | ND | ND | ND | ND | ND | ND | ND |
| Veneto15 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia
2. Stima della popolazione candidabile all’uso del DM |
1 anno | SoC | 1. Costo unitario del nuovo DM
2. Costo unitario del DM Comparatore |
Costi diretti sanitari | Risultati tabellari dell’analisi di impatto sul budget farmaceutico. | Ufficio HTA (Ing. Clinico, Statistico e farmacista + clinico supporto) |
| Friuli-Venezia Giulia | ND | ND | ND | ND | ND | ND | ND | ND |
| Emilia-Romagna | ND | ND | ND | ND | ND | ND | ND | ND |
| Toscana16 | Prospettiva della struttura ospedaliera nel caso base | 1.Inquadramento generale della patologia
2. Stima della popolazione candidabile all’uso del DM |
1 anno | SoC | 1. Costo unitario del nuovo DM
2. Costo unitario del DM Comparatore |
NS | Fabbisogno annuale del DM (numero di pezzi) | NS |
| Marche | ND | ND | ND | ND | ND | ND | ND | ND |
| Umbria | ND | ND | ND | ND | ND | ND | ND | ND |
| Lazio | ND | ND | ND | ND | ND | ND | ND | ND |
| Campania17 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia ed epidemiologia
2. Stima della popolazione candidabile all’uso del DM |
1 anno | SoC | 1. Costo unitario del nuovo DM
2. Costo unitario del DM Comparatore |
Costi diretti sanitari | rappresentazione dei risultati attraverso l’espressione del fabbisogno annuale | Studi farmacoeconomici disponibili/certificaz ioni |
| Abruzzo | ND | ND | ND | ND | ND | ND | ND | ND |
| Molise | ND | ND | ND | ND | ND | ND | ND | ND |
| Puglia18 | Prospettiva del SSR nel caso base | 1. Inquadramento generale della patologia
2. Stima della popolazione candidabile all’uso del DM |
1 anno | SoC | NS | NS | NS | CEA/CUA/BIA |
| Basilicata | ND | ND | ND | ND | ND | ND | ND | ND |
| Calabria | ND | ND | ND | ND | ND | ND | ND | ND |
| Sicilia | ND | ND | ND | ND | ND | ND | ND | ND |
| Sardegna | ND | ND | ND | ND | ND | ND | ND | ND |
Abbreviazioni: CEA, Cost-effectiveness analysis; CUA, Cost-utility analysis; HTA, Health technology assessment; ND, Non Disponibile; NS, Non Specificato; SoC, Standard of care.
D.M. 2 agosto 2019. Linee guida per la compilazione del dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale.
DELIBERAZIONE N° XI / 2509 del 26/11/2019. Giunta Regionale
Allegato A al Decreto n. 089 del 09 SET. 2020
CRAT - Deliberazione n. 182 del 25/02/2019. Allegato 1 Modulo per la richiesta di inserimento in ptor di un nuovo farmaco o di nuove indicazioni
DD N. 6212 del 25/06/2019. Elenco Terapeutico Ospedaliero Regionale.
Allegati 1 e 2 in Delibera di Giunta Regionale 31 marzo 2021, n. 130
Prontuario Terapeutico Ospedaliero Regionale (P.T.O.R.). Aggiornamento: Dicembre 2021. Allegato 2: Modulo per la richiesta di farmaci non compresi nel prontuario terapeutico ospedaliero regionale"
Deliberazione del Direttore Generale N. 185/2020 in materia di Dispositivi Medici - Agenzia Regionale per la Salute ed il Sociale (A.Re.S.S.)
MODELLO DI PROPOSTA DI INSERIMENTO DI NUOVO FARMACO IN PRONTUARIO TERAPEUTICO REGIONALE (PTR) - Dipartimento Politiche della Persona, Regione Basilicata
DECRETO N. 70 DEL 08/07/2022. Allegato 7 in Approvazione aggiornamento periodico Prontuario Terapeutico Regionale (PTR), GIUGNO 2021 - Dipartimento Tutela della Salute e Politiche Sanitarie e Servizi Sociali e Socio Sanitari, Regione Calabria".
D.A. n1592/2017 - Aggiornamento del modulo per la richiesta di inserimento in PTORS di un nuovo prodotto farmaceutico o di una nuova indicazione terapeutica - Assessorato della Salute, Regione Siciliana
Regolamento Commissione PTR del 10.12.2009 – ‘Schema di richiesta di inserimento di un nuovo farmaco - Assessorato Dell’igiene E Sanita’ E Dell’assistenza Sociale, Commissione Prontuario Terapeutico Regionale (PTR)
Allegato 1 alla Delibera n. 43 del 20/02/2019. mini-HTA delle Tecnologie (AdHopHTA)
DELIBERAZIONE N° XI / 2509 del 26/11/2019. Giunta Regionale
Allegato A al Decreto n. 089 del 09 SET. 2020
Richiesta di acquisto di dispositivi medici - modulo 1. Commissione Regionale di Valutazione delle Tecnologie ed Investimenti Sanitari
Allegato 3 in Delibera di Giunta Regionale 31 marzo 2021, n. 130
Deliberazione del Direttore Generale N. 185/2020 in materia di Dispositivi Medici - Agenzia Regionale per la Salute ed il Sociale (A.Re.S.S.)
Bibliografia
- 1.Linee guida per la compilazione del dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale ai sensi del d.m. 2 agosto 2019. Versione 1.0 - 2020. [(Accessed March; 2023 )]; Online [Google Scholar]
- 2.Ravasio R, Girolomoni G, Gorla R. Analisi di budget impact del biosimilare di etanercept: lo scenario italiano. Glob Reg Health Technol Assess. 2018;5:1–12. doi: 10.33393/grhta.2018.444. [DOI] [Google Scholar]
- 3.Basile M, Somaini L, Cicchetti A. Analisi di Budget Impact della formulazione depot di buprenorfina a rilascio prolungato per la gestione di pazienti affetti da disturbo da uso di oppiacei. Glob Reg Health Technol Assess. 2021;8:96–104. doi: 10.33393/grhta.2021.2237. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bini C, Mennini FS, Marcellusi A, Paoletti M, Tomino C. Analisi di impatto di budget di un nuovo sistema di cura in pazienti affetti da malattia di Parkinson. Glob Reg Health Technol Assess. 2022;9:91–98. doi: 10.33393/grhta.2022.2413. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Mauskopf JA, Sullivan SD, Annemans L et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on good research practices--budget impact analysis. Value Health. 2007;10(5):336–347. doi: 10.1111/j.1524-4733.2007.00187.x. PubMed [DOI] [PubMed] [Google Scholar]
- 6.Sullivan SD, Mauskopf JA, Augustovski F et al. Budget impact analysis-principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value Health. 2014 Jan-Feb;17(1):5–14. doi: 10.1016/j.jval.2013.08.2291. PubMed [DOI] [PubMed] [Google Scholar]
- 7.Hasson F, Keeney S, McKenna H. Research guidelines for the Delphi survey technique. J Adv Nurs. 2000;32(4):1008–1015. PubMed [PubMed] [Google Scholar]
- 8.Giannarou L, Zervas E. Using Delphi technique to build consensus in practice. Int J Bus Sci Appl Manag. 2014;9:65–82. [Google Scholar]
- 9.Mauskopf J. Stephanie R. Earnshaw, Anita Brogan, Sorrel Wolowacz, Thor-Henrik Brodtkorb. Budget-Impact Analysis of Health Care Interventions. A Practical Guide. Springer International Publishing AG;; 2017. [DOI] [Google Scholar]
- 10.Tastle WJ, Wierman MJ, Dumdum UR. Ranking ordinal scales using the consensus measure. Issues Inf Syst. 2005;6(2):96–102. [Google Scholar]
- 11.Drummond M, Griffin A, Tarricone R. Economic evaluation for devices and drugs--same or different? Value Health. 2009;12(4):402–404. doi: 10.1111/j.1524-4733.2008.00476_1.x. PubMed [DOI] [PubMed] [Google Scholar]
- 12.Taylor RS, Iglesias CP. Assessing the clinical and cost-effectiveness of medical devices and drugs: are they that different? Value Health. 2009;12(4):404–406. doi: 10.1111/j.1524-4733.2008.00476_2.x. PubMed [DOI] [PubMed] [Google Scholar]
- 13.Tarricone R, Callea G, Ogorevc M, Prevolnik Rupel V. Improving the Methods for the Economic Evaluation of Medical Devices. Health Econ. 2017;26(suppl 1):70–92. doi: 10.1002/hec.3471. PubMed [DOI] [PubMed] [Google Scholar]
- 14.Gazzetta Ufficiale della Repubblica Italiana. Serie Generale n. 300 del 23.12.1996. [(Accessed March; 2023 )]; Online [Google Scholar]


