Abstract
外泌体是活细胞分泌的直径为 30~100 nm 的囊泡,是细胞间信息交流的重要媒介。近年来研究发现,外泌体不仅可作为疾病诊断的生物标志,而且可作为天然的药物传递载体。外泌体能够负载的治疗物质包括小分子化合物、蛋白质、寡核苷酸等。外泌体独特的生物兼容性、高稳定性、肿瘤靶向性使其在未来肿瘤治疗中有很大的利用价值。虽然外泌体具有传递生物活性分子的潜在优势,但是目前人们对于外泌体的认知和将其作为理想的药物载体之间尚有很大差距。本文简单介绍了外泌体的功能及组成,重点总结并归纳外泌体作为药物载体的潜在优势及挑战,以期为外泌体作为药物载体的开发提供新的思路。
Keywords: 药物传递系统, 细胞外囊泡, 外泌体
Abstract
Exosomes are nanoscale vectors with a diameter of 30~100 nm secreted by living cells, and they are important media for intercellular communication. Recent studies have demonstrated that exosomes can not only serve as biomarkers for diagnosis, but also have great potential as natural drug delivery vectors. Exosomes can be loaded with therapeutic cargos, including small molecules, proteins, and oligonucleotides. Meanwhile, the unique biological compatibility, high stability, and tumor targeting of exosomes make them attractive in future tumor therapy. Though exosomes can effectively deliver bioactive materials to receptor cells, there is a wide gap between our current understanding of exosomes and their application as ideal drug delivery systems. In this review, we will briefly introduce the function and composition of exosomes, and mainly summarize the potential advantages and challenges of exosomes as drug carriers. Finally, this review is expected to provide new ideas for the development of exosome-based drug delivery systems.
Keywords: drug delivery systems, extracellular vesicles, exosomes
引言
外泌体(exosomes)是细胞在正常或病理状态都能分泌的一类细胞外囊泡(extracellular vesicles,EVs),最初曾被认为是细胞产生的垃圾[1]。随着研究的深入,逐渐发现外泌体在细胞间通信中扮演着十分重要的角色。目前对于外泌体的研究涉及包括肿瘤的发生发展、侵袭转移机制、肿瘤诊断标志物以及药物传递系统等诸多方面[2-4]。在已有的研究基础上,本研究团队首次探索了 γδT 细胞来源的外泌体作为抑癌微小 RNA(microRNAs,miRNAs)的传递载体,及其在肿瘤治疗中潜在的应用价值。研究结果表明,γδ T 细胞外泌体具有直接的抗肿瘤效应和间接的肿瘤免疫促进效应,是一种较为理想的核酸药物传递载体[5]。
现有的药物载体,如人工制造的脂质体能在体内引起蓄积毒性和免疫原性,因此限制了此类药物载体的广泛应用。外泌体作为一种天然的药物传递载体,具有生物兼容性、高稳定性、肿瘤靶向性的显著优势,已受到了国内外学者越来越多的关注,但是要将其转化为临床应用,还需要完善很多的问题。本文就目前外泌体作为药物载体的应用及存在的问题予以综述,并对此药物传递载体的前景进行展望,旨在为今后外泌体作为药物传递系统的开发和临床应用奠定基础。
1. 外泌体的组成及功能
1.1. 外泌体的组成及提取
外泌体膜内包被各种生物活性分子,是细胞间信号交流的重要介质,更是自身负载大分子物质并参与全身运输的天然载体[6]。澳大利亚拉筹伯大学(la trobe university,LTU)创建了外泌体蛋白、RNA、脂质数据库(exosomes protein,RNA and lipid database,ExoCarta)(网址为:http://exocarta.org/credits),该数据库统计了外泌体中包含的 9 769 种蛋白质,1 116 种脂质,3 408 种 mRNAs 和 2 838 种 miRNAs,可为相关领域研究提供样本资源。
外泌体的组成及结构如图 1 所示。外泌体内含有 DNA、miRNAs、mRNA、长链非编码 RNA(long noncoding RNA,LncRNA)、酶、蛋白质和细胞代谢物等。除此之外,外泌体膜表面还镶嵌大量蛋白分子。为了分析其内部组成,目前已经开发出 5 大类外泌体提取方法:① 基于超速离心的分离方法;② 基于外泌体大小的滤过方法;③ 基于免疫亲和性的分离方法;④ 基于外泌体沉降试剂盒的提取方法;⑤ 基于微流体技术的分离方法[7]。不同的提取方法各有利弊,而方法的选用则取决于外泌体在具体实验中的应用目的。
图 1.
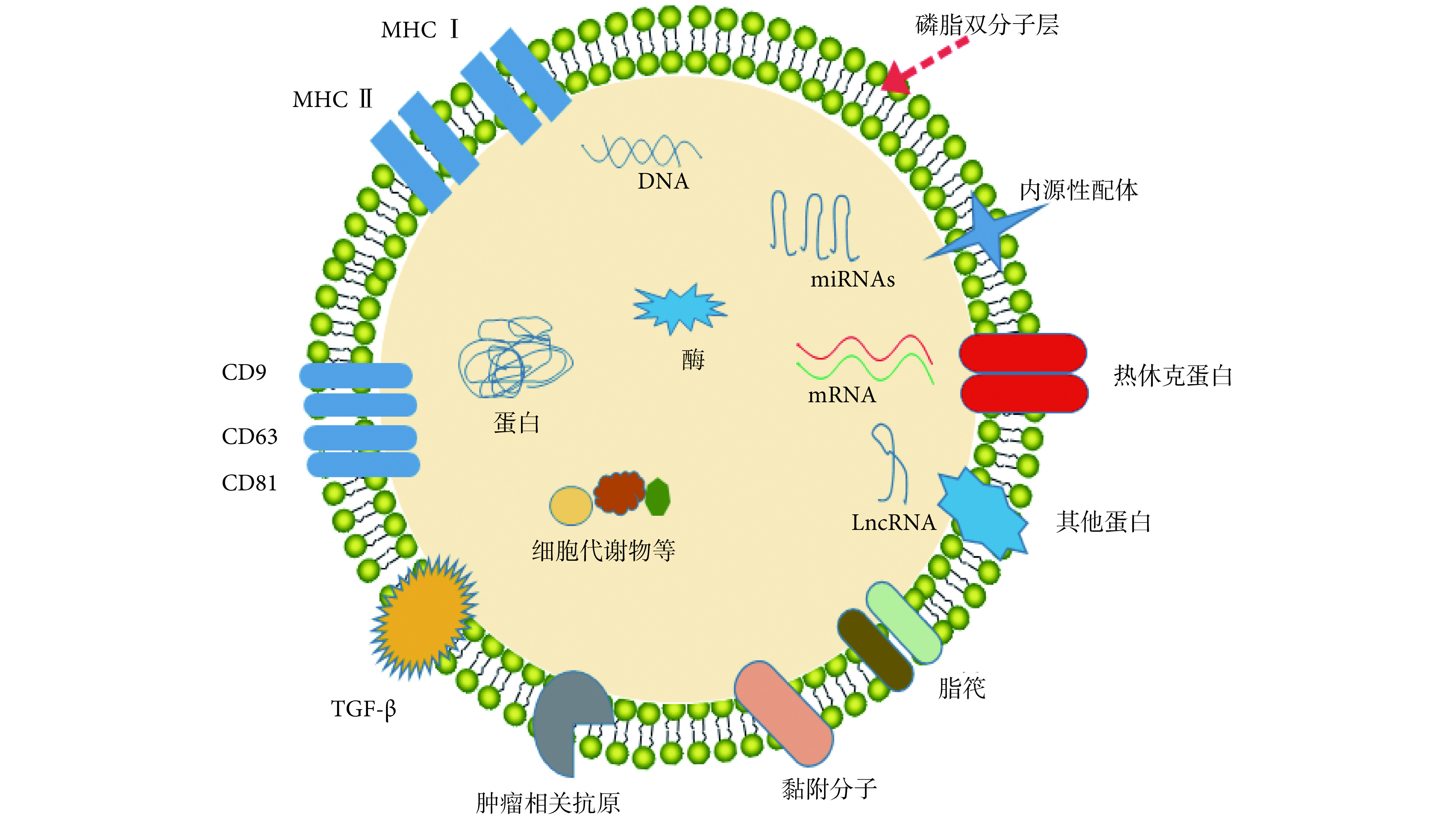
Composition of exosomes
外泌体的组成
1.2. 外泌体的功能
外泌体的主要功能是进行细胞间信息交流,一般是通过传递膜表面或腔内的生物分子来进行细胞间信号传递,从而调节细胞的正常生理功能[8]。不同的外泌体在调控肿瘤细胞增殖的作用中功效不同:一方面,来自于成熟树突细胞(dendritic cells,DCs)外泌体的脂肪酸二十二碳六烯酸和溶磷脂酰胆碱能增强 DCs 的抗原提呈能力,从而抑制肿瘤细胞增殖[9];另一方面,肿瘤细胞产生的外泌体传递致瘤 miRNAs 显著促进肿瘤细胞增殖,同时此类外泌体中携带的高含量的前列腺素和转化生长因子-β(transforming growth factor-β,TGF-β)能促进肿瘤细胞免疫逃逸[3]。Crewe 等[10]最近报道了内皮细胞能够将细胞外生物分子包裹进 EVs,进而 EVs 能携带生物分子传递到脂肪组织中。此类纳米级药物传递系统的膜表面蛋白直接与受体细胞接触,因此在体内靶向识别目标组织和促进药物递送方面具有重要作用。有研究表明,当以非肿瘤细胞来源的外泌体作为载体输送抗癌药物时,抗癌药产生的相应副作用比无载体抗癌药的副作用更小,且药物利用率较高[11]。不同来源的外泌体具有不同的生理作用,作为药物传递载体的外泌体应是正常细胞产生的具有特定性质的囊泡。
2. 外泌体作为药物载体的挑战
2.1. 作为药物载体的外泌体来源
虽然大多数细胞都能产生外泌体,但不是所有细胞来源的外泌体都适合作为药物载体。作为药物载体的外泌体应该具有严格的质量标准,具体指标包括:外泌体表面蛋白种类以及细胞的产出能力等。DCs 来源的外泌体可用于免疫治疗,因其富含组织相容复合物(major histocompatibility complex,MHC),包括 MHC -I 和 MHC -II,以及 T 细胞共刺激分子,能在体内激活 T 淋巴细胞,进而抑制肿瘤细胞增殖[12]。因上述 DCs 来源的外泌体具有相应的免疫治疗作用,研究者在小鼠宫颈癌的治疗研究上已取得一定进展[13]。间充质干细胞(mesenchymal stem cells,MSCs)产生的外泌体也可作为药物载体。Mendt 等[14]建立了以药品生产质量管理规范(good manufacturing practice,GMP)为标准的基于生物反应器的大规模临床级外泌体的生产方法。他们利用骨髓来源的 MSCs 生产 GMP 标准的外泌体,并通过体内外实验证明 GMP 标准的外泌体对鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)的抑制作用,从而提高了胰腺癌小鼠的存活率。除以上细胞外,γδT 细胞、自然杀伤细胞(natural killer cell,NK)、肿瘤细胞等均有研究报道可作为载药级别外泌体的细胞来源[15-16];此外,由乳腺细胞分泌的牛奶中,也含有可作为载体的外泌体[17]。如何选择不同来源的母细胞是目前外泌体递药系统存在的问题之一。由于外泌体能继承母细胞的部分生物学特点并发挥相应的功能,因此不同来源的外泌体具有异质性。现阶段,个性化给药能提供较好的解决方案,因此可以根据疾病种类和负载药物的类型选择合适的外泌体母细胞。外泌体药物传递系统开发流程如图 2 所示。
图 2.
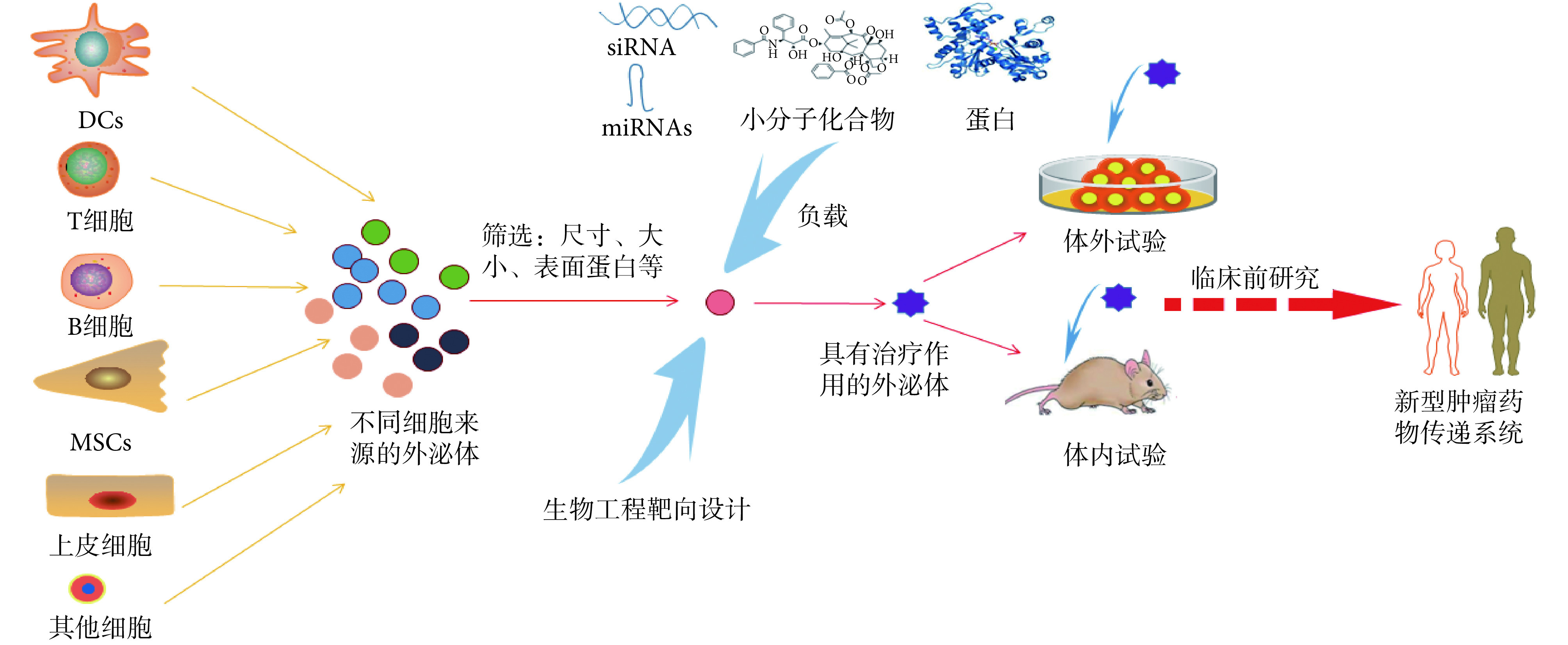
Development process of exosomes-based drug delivery systems
外泌体药物传递系统开发流程
2.2. 外泌体的靶向设计
某些细胞来源的外泌体本身具有一定的内在靶向性,如中枢神经细胞来源的外泌体能通过血脑屏障,靶向特定的神经元[18],如缺氧肿瘤细胞来源的外泌体倾向于向缺氧肿瘤组织内募集[19]。另外,外泌体的外源靶向性还可通过在外泌体膜表面设计与靶细胞特异性结合的抗体、配体或受体来实现。比如,以生物工程技术修饰 DCs 使其表达融合蛋白,建立溶酶体相关膜蛋白 2 b(lysosomal associated membrane protein 2b,Lamp2b)融合狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)的融合蛋白。Lamp2b 是外泌体的跨膜蛋白,RVG 是一种神经元特异性糖蛋白,以上两种蛋白的融合表达赋予了外泌体识别和靶向神经元、小胶质细胞、少突胶质细胞的功能[20]。通过生物工程方法将分化群 3(cluster of differentiation 3,CD3)抗体和表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体同时表达于外泌体表面。分化群(cluster of differentiation,CD)是指来自不同实验室的单克隆抗体所识别的同一分化抗原归为一个分化群,每一 CD 分子代表一种或一类分化抗原,从 CD1 开始依序编号。经过修饰的外泌体可以同时识别 EGFR 阳性的肿瘤细胞和 CD3 阳性 T 细胞,因此赋予了 CD3 阳性 T 细胞对肿瘤细胞特异性结合的能力[21]。通过基因工程技术表达设计锚蛋白重复蛋白(designed ankyrin repeat protein,DARPin)于外泌体表面,借助 DARPin 与人类表皮生长因子受体 2(human epidermalgrowth factor receptor-2,HER2)的特异性结合,实现外泌体对 HER2 阳性乳腺癌细胞靶向识别的目的[22]。外源靶向性增强措施依赖于靶细胞表面存在特异性标志物,利用生物工程技术在外泌体膜表面表达与这一标志物特异性结合的分子,从而增加外泌体的靶向性。
2.3. 外泌体的生产方法
将外泌体递药系统转化为临床应用,需要高质量且高产量的外泌体供给。目前大规模生产外泌体的方法主要是自发生产和非自发生产[23]。自发生产通过依赖中空纤维生物反应器为细胞生长提供高表面积比,进而支持高密度的细胞自发释放外泌体[24-25]。研究表明,自发生产方式时间成本较高,14 d 内 106 个细胞只能释放 5 μg 外泌体,因此不适于工业化生产[24]。非自发生产方式主要通过增加外部刺激条件来触发细胞释放大量外泌体,非自发生产方式可分为三类:① 生物刺激;② 化学刺激;③ 物理刺激。
血清饥饿处理细胞和缺氧处理细胞是最简单的生物刺激方式。Sun 等[26]发现,血清饥饿处理的人骨髓瘤细胞能释放 2.5 倍的外泌体,缺氧条件下肺癌和乳腺癌细胞的外泌体释放量也增加[27-28]。除此之外,肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素 8(interleukin-8,IL-8)和白细胞三烯 B4(leukotriene B4,LTB4)等细胞因子能活化细胞并诱导其分泌大量外泌体[29]。化学刺激主要是利用细胞松弛素 B 抑制肌动蛋白的聚合从而促进外泌体的释放[30-31]。除此之外,Momen-Heravi 等[32]发现乙醇能增加肝癌细胞释放 10 倍量的外泌体。化学刺激和细胞因子刺激的生产方法虽然能在短时间内获得大量外泌体,但是由于生物活性剂的加入,生产的外泌体残留大量生物活性剂,需要进一步的纯化。物理刺激不需要加入任何刺激分子,通过对细胞施加物理和机械应力诱导外泌体分泌。Jo 等[33]和 Piffoux 等[34]利用微流控装置在层流中通过剪切应力诱导外泌体释放,高剪切应力刺激显著增加了细胞的外泌体产量。
2.4. 外泌体的药物装载方法
目前外泌体的药物装载方法可分为三类:① 前装载方法;② 后装载方法;③ 其他装载方法。前装载方法是首先将药物加载到母细胞中,随后外泌体形成并包裹药物分泌到细胞外。目前常用的方法如转染、共孵育等属于前装载[35-36]。后装载方法是直接将药物加载到外泌体中,例如孵育、电穿孔、超声、挤出、冻融循环等[37-40]。其他加载方法主要是通过生物工程修饰母细胞来实现。Li 等[41]报道了一种工程化外泌体,通过人抗原 R(human antigen R,HuR)与 CD9 序列的融合来修饰母细胞。修饰后的细胞表达融合蛋白 HuR-CD9,由于 HuR 对 RNA 具有超高亲和力,且 CD9 是外泌体的跨膜蛋白,因此母细胞产生的外泌体能主动增加 RNA 的装载量。不同装载方法具有不同的装载效率,方法的选择取决于装载药物类型。例如,Kim 等[39]报道了 3 种不同的装载方法下(室温孵育、电穿孔及超声),紫杉醇在外泌体中的装载效率为: 室温孵育 < 电穿孔 < < 超声。Haney 等 [40]以 4 种不同的装载方法考察过氧化氢酶在外泌体中的装载效率,得到以下结果: 常温孵育 < 冻融循环 < 超声≈挤压。综上,不同的装载方法决定外泌体对药物的装载量。而药物装载效率也取决于外泌体的来源细胞。Kanchanapally 等 [42]利用共同孵育的方法将阿霉素加载到 3 种不同细胞来源(胰腺癌细胞、胰腺星状细胞、巨噬细胞)的外泌体中,结果发现胰腺癌细胞外泌体的装载效率最高,其他两者次之。虽然外泌体的药物装载方法种类较多且装载效率也各有高低,但是相对于人工制造脂质体的高效工业化生产,外泌体的药物装载效率是极低的。针对外泌体的种类和被装载药物的性质来制定优化的装载方案是提高外泌体药物装载效率的关键。
2.5. 外泌体作为药物载体的应用实例
外泌体能够装载的治疗物质包括小分子化合物、蛋白质、寡核苷酸等。作为小分子化合物载体,外泌体装载姜黄素、紫杉醇、阿霉素等主要是用于抗肿瘤研究[43-45]。外泌体作为核酸分子的药物载体主要用于基因治疗。外泌体装载小干扰 RNA(small interfering RNA,siRNA)和 miRNAs 用于治疗相关疾病的研究则较多[46-48]。最近的研究表明,外泌体装载核酸分子再联合化学治疗手段,能减弱癌细胞对抗肿瘤药物的耐药性[49]。外泌体内部和表面都含有大量的蛋白质分子,这些蛋白分子既能提供与受体细胞表面配体结合的位点,也可作为其他治疗方式的辅助手段[50]。例如,Haney 等[40]开发了一种基于外泌体的抗氧化剂和过氧化氢酶传递系统。Hong 等[45]设计了基于外泌体的透明质酸酶和阿霉素的共传递纳米系统,透明质酸酶通过溶解肿瘤微环境的细胞外基质,进而增强了外泌体的肿瘤渗透效应和药物递送效率。
3. 外泌体作为药物传递系统的优势
3.1. 生物兼容性
外泌体作为药物载体与现有的人工制造脂质体相比的优势在于其良好的生物兼容性。目前,脂质体是 siRNA 和其他 RNA 的主要递送装置。脂质体能在人体内引起毒性免疫应答,对肝脏等器官造成蓄积毒性,不能达到良好的预期效果。外泌体具有更好的生物兼容性,能克服脂质体所引起的免疫原性和体内蓄积毒性的缺点。Kamerkar 等[51]利用外泌体递送 siRNA 阻止 KRAS 突变蛋白产生。研究结果显示,相较于脂质体,静脉注射负载 siRNA 的外泌体能更好地抑制 KRAS 蛋白表达,且在体内无免疫原性。Usman 等[52]利用电穿孔技术将反义寡核苷酸导入红细胞来源的外泌体,结果显示,外泌体装载反义寡核苷酸对乳腺癌细胞有显著抑制作用且在体内无免疫原性。外泌体与其他 RNA 药物递送载体(如腺病毒、慢病毒、逆转录病毒、脂质体)相比无免疫原性和细胞毒性,表现出良好的生物兼容性。
3.2. 生物稳定性
外泌体作为药物载体的优势之一,是具有生物稳定性。抗原提呈细胞来源的外泌体能表达膜结合补体调控因子 CD55 和 CD59,用以增强体内循环的稳定性。研究显示,外泌体即使暴露在炎性环境下仍然具有较长的体内循环时间[53]。外泌体膜表面表达的 CD47 分子能保护外泌体远离单核巨噬细胞系统,从而避免被清除,因此也增加了外泌体在体内的循环时间[51]。大量的研究证明,纳米颗粒因其尺寸较小(≤ 100 nm),能通过增强渗透和保留效应(enhanced permeability and retention effect,EPR)达到对肿瘤组织的靶向聚集[54]。外泌体的尺寸在 30~100 nm 之间,对肿瘤组织的靶向作用同样遵循 EPR 效应。此外,聚乙二醇修饰的外泌体的体内循环时间能达到 60 min 以上[55]。聚乙二醇修饰的外泌体通过延长体内清除时间显著提高外泌体在体内的生物稳定性,使外泌体作为药物载体的研究更具有前景。
3.3. 靶向性
某些细胞来源的外泌体具有内在靶向功能。例如,中枢神经细胞来源的外泌体能通过血脑屏障,靶向特定的神经元;缺氧肿瘤细胞来源的外泌体倾向于向缺氧肿瘤组织内募集[18-19]。生物分布的研究结果也表明,外泌体在肿瘤组织中的聚集取决于母细胞种类。因此研究对特定组织或细胞具有靶向作用的外泌体时,需考虑其来源细胞对靶向效率的影响[14]。Zhuang 等[43]将负载姜黄素的 EVs 通过鼻腔给药方式传递到小鼠大脑,结果表明 EVs 对血脑屏障有良好的穿透性。该研究成果为脑部肿瘤靶向制剂的开发提供了新的思路。除了这些内生的靶向通路,人们也可以通过生物工程设计具有靶向功能的外泌体药物递送系统。
4. 存在问题的总结与展望
虽然外泌体作为药物载体具有生物兼容性、稳定性和内在靶向性等潜在优势,但是外泌体在药物递送中的应用研究才刚刚起步,尚有以下问题需要解决:① 选择何种细胞作为外泌体的供体;② 如何修饰外泌体的靶向性;③ 如何提高药物装载效率;④ 如何实现外泌体的大量生产。针对这些问题本文介绍了相应的解决办法和改进策略。
外泌体药物递送系统不能提供一个普适的递药策略,这是由外泌体的异质性决定的[56]。研究者必须根据所传递治疗物质的类型、目标组织的特点等进行针对性的策略调整。尽管有临床前实验数据表明,使用外泌体作为药物载体能达到靶向治疗的目的,但要真正为临床所用,对外泌体的体内运输机制及其生产质量控制标准的研究十分重要。
综上所述,通过对外泌体的组成和功能的简单介绍,以及对其作为药物载体存在的问题以及潜在优势的重点总结,期望本文可为后续关于外泌体作为药物载体的相关研究提供可借鉴的思路。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金面上项目(81672690,81772900,81872196,81972541)
References
- 1.Théry C, Zitvogel L, Amigorena S Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2(8):569–579. doi: 10.1038/nri855. [DOI] [PubMed] [Google Scholar]
- 2.Zhu Guiquan, Tang Yaling, Li Ling, et al Abstract 1547: tumor-derived macrophage migration inhibitory factor and interleukin-6 cooperated in hypoxic accumulation of CD11b+Gr-1+ myeloid cells. Cancer Research. 2013;73(8 suppl):1547. [Google Scholar]
- 3.Li Ling, Li Chao, Wang Shaoxin, et al Exosomes derived from hypoxic oral squamous cell carcinoma cells deliver miR-21 to normoxic cells to elicit a prometastatic phenotype. Cancer Res. 2016;76(7):1770–1780. doi: 10.1158/0008-5472.CAN-15-1625. [DOI] [PubMed] [Google Scholar]
- 4.Li L, Cao B, Liang X, et al Microenvironmental oxygen pressure orchestrates an anti- and pro-tumoral γδ T cell equilibrium via tumor-derived exosomes. Oncogene. 2019;38(15):2830–2843. doi: 10.1038/s41388-018-0627-z. [DOI] [PubMed] [Google Scholar]
- 5.Li L, Lu S, Liang X, et al γδTDEs: an efficient delivery system for miR-138 with anti-tumoral and immunostimulatory roles on oral squamous cell carcinoma. Mol Ther Nucleic Acids. 2019;14:101–113. doi: 10.1016/j.omtn.2018.11.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Piffoux M, Silva A K, Wilhelm C, et al Modification of extracellular vesicles by fusion with liposomes for the design of personalized biogenic drug delivery systems. ACS Nano. 2018;12(7):6830–6842. doi: 10.1021/acsnano.8b02053. [DOI] [PubMed] [Google Scholar]
- 7.Li Pin, Kaslan M, Lee S H, et al Progress in exosome isolation techniques. Theranostics. 2017;7(3):789–804. doi: 10.7150/thno.18133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Cesi G, Walbrecq G, Margue C, et al Transferring intercellular signals and traits between cancer cells: extracellular vesicles as “homing pigeons”. Cell Commun Signal. 2016;14(1):13. doi: 10.1186/s12964-016-0136-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pitt J M, André F, Amigorena S, et al Dendritic cell-derived exosomes for cancer therapy. J Clin Invest. 2016;126(4):1224–1232. doi: 10.1172/JCI81137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Crewe C, Joffin N, Rutkowski J M, et al An endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 2018;175(3):695–708. doi: 10.1016/j.cell.2018.09.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Namee N M, O'driscoll L Extracellular vesicles and anti-cancer drug resistance. Biochimica et Biophysica Acta-Reviews on Cancer. 2018;1870(2):123–136. doi: 10.1016/j.bbcan.2018.07.003. [DOI] [PubMed] [Google Scholar]
- 12.Tian H, Li Wei Dendritic cell-derived exosomes for cancer immunotherapy: hope and challenges. Annals of translational medicine. 2017;5(10):221. doi: 10.21037/atm.2017.02.23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chen Shisheng, Lv Mingfen, Fang Shan, et al Poly(I: C) enhanced anti-cervical cancer immunities induced by dendritic cells-derived exosomes. Int J Biol Macromol. 2018;113:1182–1187. doi: 10.1016/j.ijbiomac.2018.02.034. [DOI] [PubMed] [Google Scholar]
- 14.Mendt M, Kamerkar S, Sugimoto H, et al Generation and testing of clinical-grade exosomes for pancreatic cancer. JCI insight. 2018;3(8):99263. doi: 10.1172/jci.insight.99263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Zhu L, Oh J M, Gangadaran P, et al Targeting and therapy of glioblastoma in a mouse model using exosomes derived from natural killer cells. Front Immunol. 2018;9:824. doi: 10.3389/fimmu.2018.00824. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 16.Guo M, Wu F, Hu Guorong, et al Autologous tumor cell-derived microparticle-based targeted chemotherapy in lung cancer patients with malignant pleural effusion. Sci Transl Med. 2019;11(474):eaat5690. doi: 10.1126/scitranslmed.aat5690. [DOI] [PubMed] [Google Scholar]
- 17.Aqil F, Munagala R, Jeyabalan J, et al Milk exosomes-natural nanoparticles for siRNA delivery. Cancer Lett. 2019;449:186–195. doi: 10.1016/j.canlet.2019.02.011. [DOI] [PubMed] [Google Scholar]
- 18.Shi M, Sheng Lifu, Stewart T, et al New Windows into the brain: central nervous system-derived extracellular vesicles in blood. Prog Neurobiol. 2019;175:96–106. doi: 10.1016/j.pneurobio.2019.01.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Jung K O, Jo H, Yu J H, et al Development and MPI tracking of novel hypoxia-targeted theranostic exosomes. Biomaterials. 2018;177:139–148. doi: 10.1016/j.biomaterials.2018.05.048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Alvarez-Erviti L, Seow Y, Yin Haifang, et al Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 2011;29(4):341–345. doi: 10.1038/nbt.1807. [DOI] [PubMed] [Google Scholar]
- 21.Cheng Q, Shi Xiaojing, Han Menglu, et al Reprogramming exosomes as nanoscale controllers of cellular immunity. J Am Chem Soc. 2018;140(48):16413–16417. doi: 10.1021/jacs.8b10047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Limoni S K, Moghadam M F, Moazzeni S M, et al Engineered exosomes for targeted transfer of siRNA to HER2 positive breast cancer cells. Appl Biochem Biotechnol. 2019;187(1):352–364. doi: 10.1007/s12010-018-2813-4. [DOI] [PubMed] [Google Scholar]
- 23.Piffoux M, Nicolás-Boluda A, Mulens-Arias V, et al Extracellular vesicles for personalized medicine: the input of physically triggered production, loading and theranostic properties. Adv Drug Deliv Rev. 2019;138:247–258. doi: 10.1016/j.addr.2018.12.009. [DOI] [PubMed] [Google Scholar]
- 24.Whitford W, Ludlow J W, Cadwell J S Continuous production of exosomes. Genetic Engineering & Biotechnology News. 2015;35(16):34. [Google Scholar]
- 25.Watson D C, Bayik D, Srivatsan A, et al Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 2016;105:195–205. doi: 10.1016/j.biomaterials.2016.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Sun Li, Wang Hongxiang, Zhu Xiaojian, et al Serum deprivation elevates the levels of microvesicles with different size distributions and selectively enriched proteins in human myeloma cells in vitro . Acta Pharmacol Sin. 2014;35(3):381–393. doi: 10.1038/aps.2013.166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Wysoczynski M, Ratajczak M Z Lung cancer secreted microvesicles: underappreciated modulators of microenvironment in expanding tumors. International Journal of Cancer. 2009;125(7):1595–1603. doi: 10.1002/ijc.24479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.King H W, Michael M Z, Gleadle J M Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 2012;12(1):421. doi: 10.1186/1471-2407-12-421. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Headland S E, Jones H R, D'sa A S, et al Cutting-edge analysis of extracellular microparticles using ImageStream(X) imaging flow cytometry. Sci Rep. 2014;4(1):5237. doi: 10.1038/srep05237. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Pick H, Schmid E L, Tairi A P, et al Investigating cellular signaling reactions in single attoliter vesicles. J Am Chem Soc. 2005;127(9):2908–2912. doi: 10.1021/ja044605x. [DOI] [PubMed] [Google Scholar]
- 31.Mao Z, Cartier R, Hohl A, et al Cells as factories for humanized encapsulation. Nano Lett. 2011;11(5):2152–2156. doi: 10.1021/nl200801n. [DOI] [PubMed] [Google Scholar]
- 32.Momen-Heravi F, Bala Shashi, Kodys K, et al Exosomes derived from alcohol-treated hepatocytes horizontally transfer liver specific miRNA-122 and sensitize monocytes to LPS. Sci Rep. 2015;5(1):9991. doi: 10.1038/srep09991. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Jo W, Jeong D, Kim J, et al Microfluidic fabrication of cell-derived nanovesicles as endogenous RNA carriers. Lab Chip. 2014;14(7):1261–1269. doi: 10.1039/C3LC50993A. [DOI] [PubMed] [Google Scholar]
- 34.Piffoux M, Silva A K, Lugagne J B, et al Extracellular vesicle production loaded with nanoparticles and drugs in a trade-off between loading, yield and purity: towards a personalized drug delivery system. Advanced biosystems. 2017;1(5):e1700044. doi: 10.1002/adbi.201700044. [DOI] [PubMed] [Google Scholar]
- 35.Batrakova E V, Kim M S Using exosomes, naturally-equipped nanocarriers, for drug delivery. Journal of Controlled Release. 2015;219:396–405. doi: 10.1016/j.jconrel.2015.07.030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Lee J, Kim J, Jeong M, et al Liposome-based engineering of cells to package hydrophobic compounds in membrane vesicles for tumor penetration. Nano Lett. 2015;15(5):2938–2944. doi: 10.1021/nl5047494. [DOI] [PubMed] [Google Scholar]
- 37.Sun Dongmei, Zhuang Xiaoying, Xiang Xiaoyu, et al A novel nanoparticle drug delivery system: the anti-inflammatory activity of curcumin is enhanced when encapsulated in exosomes. Molecular Therapy. 2010;18(9):1606–1614. doi: 10.1038/mt.2010.105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Tian Yanhua, Li Suping, Song Jian, et al A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials. 2014;35(7):2383–2390. doi: 10.1016/j.biomaterials.2013.11.083. [DOI] [PubMed] [Google Scholar]
- 39.Kim M S, Haney M J, Zhao Yuling, et al Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells. Nanomedicine: Nanotechnology, Biology and Medicine. 2016;12(3):655–664. doi: 10.1016/j.nano.2015.10.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Haney M J, Klyachko N L, Zhao Yuling, et al Exosomes as drug delivery vehicles for Parkinson's disease therapy. J Control Release. 2015;207:18–30. doi: 10.1016/j.jconrel.2015.03.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Li Z, Zhou Xueying, Wei Mengying, et al In vitro and in vivo RNA inhibition by CD9-HuR functionalized exosomes encapsulated with miRNA or CRISPR/dCas9 . Nano Lett. 2019;19(1):19–28. doi: 10.1021/acs.nanolett.8b02689. [DOI] [PubMed] [Google Scholar]
- 42.Kanchanapally R, Deshmukh S K, Chavva S R, et al Drug-loaded exosomal preparations from different cell types exhibit distinctive loading capability, yield, and antitumor efficacies: a comparative analysis. Int J Nanomedicine. 2019;14:531–541. doi: 10.2147/IJN.S191313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Zhuang X, Xiang X, Grizzle W, et al Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain. Mol Ther. 2011;19(10):1769–1779. doi: 10.1038/mt.2011.164. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Agrawal A K, Aqil F, Jeyabalan J, et al Milk-derived exosomes for oral delivery of paclitaxel. Nanomedicine: Nanotechnology, Biology and Medicine. 2017;13(5):1627–1636. doi: 10.1016/j.nano.2017.03.001. [DOI] [PubMed] [Google Scholar]
- 45.Hong Y, Nam G, Koh E, et al Exosome as a vehicle for delivery of membrane protein therapeutics, PH20, for enhanced tumor penetration and antitumor efficacy. Adv Funct Mater. 2018;28(17):1801301. doi: 10.1002/adfm.201801301. [DOI] [Google Scholar]
- 46.Bellavia D, Raimondo S, Calabrese G A, et al Interleukin 3-receptor targeted exosomes inhibit in vitro and in vivo chronic myelogenous leukemia cell growth . Theranostics. 2017;7(5):1333–1345. doi: 10.7150/thno.17092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Momen-Heravi F, Bala S, Bukong T, et al Exosome-mediated delivery of functionally active miRNA-155 inhibitor to macrophages. Nanomedicine: Nanotechnology, Biology and Medicine. 2014;10(7):1517–1527. doi: 10.1016/j.nano.2014.03.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Darband S G, Mirza-aghazadeh-attari M, Kaviani M, et al Exosomes: natural nanoparticles as bio shuttles for RNAi delivery. J Control Release. 2018;289:158–170. doi: 10.1016/j.jconrel.2018.10.001. [DOI] [PubMed] [Google Scholar]
- 49.Bose R J, Kumar S U, Zeng Y, et al Tumor cell-derived extracellular vesicle-coated nanocarriers: an efficient theranostic platform for the cancer-specific delivery of anti-miR-21 and imaging agents. ACS Nano. 2018;12(11):10817–10832. doi: 10.1021/acsnano.8b02587. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Yang B, Chen Yu, Shi J Exosome biochemistry and advanced nanotechnology for next-generation theranostic platforms. Adv Mater. 2019;31(2):e1802896. doi: 10.1002/adma.201802896. [DOI] [PubMed] [Google Scholar]
- 51.Kamerkar S, Lebleu V S, Sugimoto H, et al Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature. 2017;546(7659):498–503. doi: 10.1038/nature22341. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Usman W M, Pham T C, Kwok Y Y, et al Efficient RNA drug delivery using red blood cell extracellular vesicles. Nat Commun. 2018;9(1):2359. doi: 10.1038/s41467-018-04791-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Armstrong J P, Holme M N, Stevens M M Re-engineering extracellular vesicles as smart nanoscale therapeutics. ACS Nano. 2017;11(1):69–83. doi: 10.1021/acsnano.6b07607. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Yang Y, Tai Xiaowei, Shi Kairong, et al A new concept of enhancing immuno-chemotherapeutic effects against B16F10 tumor via systemic administration by taking advantages of the limitation of EPR effect. Theranostics. 2016;6(12):2141–2160. doi: 10.7150/thno.16184. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Kooijmans S, Fliervoet L A L, van der Meel R, et al PEGylated and targeted extracellular vesicles display enhanced cell specificity and circulation time. J Control Release. 2016;224:77–85. doi: 10.1016/j.jconrel.2016.01.009. [DOI] [PubMed] [Google Scholar]
- 56.Shen Wen, Guo Kaizhu, Adkins G B, et al A single extracellular vesicle (EV) flow cytometry approach to reveal EV heterogeneity. Angew Chem Int Ed Engl. 2018;57(48):15675–15680. doi: 10.1002/anie.201806901. [DOI] [PMC free article] [PubMed] [Google Scholar]


