Abstract
目的
探讨四连接同源激酶1(FJX1)在胃癌(GC)中的表达以及与预后生存的关系,研究FJX1在胃癌进展中的作用及机制。
方法
采用TCGA和GEO数据库胃癌队列分析FJX1在胃癌组织和正常胃黏膜组织中的表达情况,并分析FJX1表达与预后生存的相关性。通过免疫组化检测FJX1在胃癌组织中的蛋白表达水平,并分析FJX1蛋白表达与临床病理参数及预后的相关性。通过生物信息学探讨FJX1在胃癌中的潜在作用途径。采用慢病毒载体构建FJX1过表达和FJX1沉默的胃癌细胞株。采用免疫印记方法检测FJX1差异表达对增殖相关蛋白表达的影响,并采用CCK-8法检测FJX1对细胞增殖的影响。采用免疫印记方法检测FJX1差异表达细胞中PI3K和AKT的蛋白表达及磷酸化蛋白表达。采用裸鼠成瘤实验检测FJX1对肿瘤增殖的影响。
结果
生物信息学分析及免疫组化结果显示,与正常胃黏膜组织相比,胃癌组织中的FJX1的mRNA和蛋白表达均显著增高(P < 0.05)。此外,FJX1的mRNA和蛋白水平高表达与胃癌患者不良预后相关(P < 0.05),并且FJX1高表达是胃癌不良预后的独立危险因素(P < 0.05)。FJX1主要表达于胃癌细胞胞质,与Ki67表达呈正相关(R=0.34,P < 0.05),并且FJX1表达水平与胃癌患者的CA199水平、肿瘤浸润深度(pT)和淋巴结转移(pN)相关(P < 0.05)。Western blot显示FJX1能促进增殖相关蛋白Ki67和PCNA的表达,CCK8实验结果证实FJX1能调控胃癌细胞增殖(P < 0.05)。基因集富集分析(GSEA)结果显示PI3K/AKT途径可能是FJX1的潜在分子作用机制,Western blot结果显示FJX1能促进PI3K和AKT磷酸化蛋白的表达。裸鼠移植瘤结果表明,FJX1能促进胃癌细胞在裸鼠体内的增殖(P < 0.05)。
结论
FJX1在胃癌组织中高表达并与胃癌不良预后相关,能够通过PI3K/AKT信号途径促进胃癌细胞的增殖,有潜力成为胃癌的预后生物标志物和治疗靶点。
Keywords: 四连接同源激酶1, 胃癌, 增殖, 生存预后
Abstract
Objective
To investigate the expression of four-jointed box kinase 1 (FJX1) in gastric cancer (GC), its correlation with survival outcomes of the patients, and its role in GC progression.
Methods
The expression level of FJX1 in GC tissues and normal gastric mucosal tissues and its correlation with the survival outcomes of GC patients were analyzed using TCGA and GEO database GC cohort. Immunohistochemistry was used to detect FJX1 expression level in clinical specimens of GC tissue, and its correlations with the patients' clinicopathological parameters and prognosis were analyzed. Bioinformatic analysis was performed to identify the potential pathways of FJX1 in GC. The effects of FJX1 overexpression or FJX1 silencing on GC cell proliferation and expressions of proliferation-related proteins, PI3K, AKT, p-PI3K, and p-AKT were evaluated using CCK-8 assay and Western blotting. The effect of FJX1 overexpression on GC cell tumorigenicity was evaluated in nude mice.
Results
GC tissues showed significantly higher expressions of FJX1 mRNA and protein compared with normal gastric mucosa tissues (P < 0.05). The high expression of FJX1 was associated with poor prognosis of GC patients (P < 0.05) and served as an independent risk factor for poor survival outcomes in GC (P < 0.05). FJX1 was expressed mainly in the cytoplasm of GC cells in positive correlation with Ki67 expression (R=0.34, P < 0.05), and was correlated with CA199 levels, depth of tumor infiltration and lymph node metastasis of GC (P < 0.05). In the cell experiment, FJX1 level was shown to regulate the expressions of Ki67 and PCNA and GC cell proliferation (P < 0.05). Gene set enrichment analysis indicated that the PI3K/AKT pathway potentially mediated the effect of FJX1, which regulated the expressions of PI3K and AKT and their phosphorylated proteins. In nude mice, FJX1 overexpression in GC cells significantly promoted the growth of the transplanted tumors (P < 0.05).
Conclusion
FJX1 is highly expressed in GC tissues and is correlated with poor prognosis of GC patients. FJX1 overexpression promotes GC cell proliferation through the PI3K/AKT signaling pathway, and may serve as a potential prognostic biomarker and therapeutic target for GC.
Keywords: four-jointed box kinase 1, Gastric cancer, proliferation, survival prognosis
胃癌(GC)是世界上最常见的胃肠道恶性肿瘤之一,并且随着人口老龄化的加剧,胃癌发病率也在逐年上升[1-4]。虽然手术切除是治疗胃癌的有效方法,在化疗及免疫治疗等方面的突破也改善了胃癌生存率,但胃癌患者的预后仍然很差,5年生存率仅约为20%[5-7]。胃癌患者普遍预后不良的原因除胃癌癌细胞异常活跃的增殖、广泛的转移和治疗耐药性外,还源于对胃癌分子发病机制的了解有限,缺乏及时的诊断和灵敏的预后监测指标[8]。因此,探索胃癌发病和进展的分子机制,发现可用于胃癌诊断和预后监测的生物标志物,将有助于胃癌的临床治疗。
四连接同源激酶1(FJX1)已被报道在人类各器官的上皮结构中表达,但该基因的确切分子功能仍未得到充分研究[9, 10]。最近的研究指出FJX1在癌症发病机制中扮演着致癌基因的作用,为研究该基因的功能提供了一个新的线索[11]。有研究证实FJX1是鼻咽癌的致癌基因,其在鼻咽癌组织中表达水平升高并促进了鼻咽癌细胞的增殖[12]。亦有研究提出FJX1可参与结直肠癌的进展过程,并证实FJX1的表达水平与结直肠癌患者的生存期相关[13]。这些研究提示FJX1可能是一个与细胞增殖相关的致癌基因,但遗憾的是,目前FJX1在胃癌病理过程中的角色及其作用机制仍未得到充分研究。
因此,本研究尝试探讨FJX1在胃癌病理过程中的作用及其可能的作用途径。我们首先证实FJX1是胃癌的致癌基因,具备潜在的诊断及判断胃癌患者预后的能力。其次,我们发现FJX1可能通过调节PI3K/AKT信号通路促进胃癌细胞增殖影响胃癌进展。总之,本研究结果表明,FJX1是一个新的胃癌预后生物标志物,并有潜力成为胃癌的治疗靶点。
1. 资料和方法
1.1. 生物信息学分析
通过Timer在线数据库[14] (https://cistrome.shinyapps.io/timer/)分析了FJX1在人类常见恶性肿瘤中的表达数据。通过UCSC Xena数据库获取癌症基因组图谱(TCGA)数据库的胃癌(STAD)队列的Counts数据及临床病理资料,其中Counts数据被转换为TPM格式并进一步经过log2(TPM + 1)处理。在Gene Expression Omnibus(GEO)数据库中获取胃癌数据集(GSE66229,GSE84437)的基因芯片数据以及临床病理资料,芯片数据均接受了RMA法标准化。生物信息学分析采用R 4.2.0软件,可视化由R“ggplot2”包实现。受试者工作特征(ROC)分析由R“pROC”包实现。采用R“survminer”包计算FJX1最优截断值进行Kaplan-Meier生存分析。基因本体(GO)和京都基因与基因组百科全书(KEGG)分析通过R“clusterProfliter”包[15]实现,以校准P < 0.01作为FJX1相关基因的筛选标准。
1.2. 临床资料及样本
本研究纳入了2017年1月~11月在蚌埠医学院第一附属医院胃肠外科接受手术的87例胃癌患者,包括63例男性和24例女性,年龄在50~75岁,中位年龄为63岁。所有入组患者均成功施行了R0胃癌根治术,并且在术前均未接受任何肿瘤相关治疗(化疗、放疗、免疫治疗和中医药治疗)。从电子病历系统中获取患者的临床病理信息,包括性别、年龄、肿瘤临床分期、手术病理诊断、术前肿瘤标志物等。患者对应的胃癌癌组织和癌旁正常组织的蜡块从病理科取回。入组患者随访信息经由电话随访获得,末次随访时间为2022年6月9日。本研究获得了蚌埠医学院伦理委员会的批准(伦科批字[2022]第183号)。
1.3. 免疫组化检测
免疫组织检测胃癌和癌旁组织中FJX1和Ki67的表达,根据既往文献报道[16, 17],简述如下:将胃癌及癌旁组织的蜡块切成厚度4 μm的切片,经过脱蜡、脱水、抗原修复和封闭。将切片与一抗(anti-FJX1,1∶200,17417-1-AP,武汉三鹰;anti-Ki67,1∶200,ab16667,Abcam)在4 ℃条件下孵育过夜,次日取出后继续二抗室温孵育,DAB染色并使用苏木素复染后脱水封片。采用半定量的评分方法来比较免疫组化的染色强度[18],简述如下:从每个组织切片中随机选择5个区域对蛋白表达进行评分。染色分数分为:1分(≤10%的阳性细胞着色)、2分(< 10%和≤30%的阳性细胞着色)、3分(< 30和≤50%的阳性细胞着色)、4分(> 50%的阳性细胞着色)。染色强度分数分为:0分(阴性)、1分(弱)、2分(中等)、3分(强)。IHC评分的计算方法为:单个样本染色分数×染色强度。每张切片均由两位病理医师观察后进行独立评分,若结果不同则由第3位病理医师进行额外评判并得出最终评分。
1.4. 细胞培养和慢病毒转染
人胃癌细胞系MGC803和SGC7901(中科院上海细胞库)予以RPMI 1640(gibco)培养基,辅以10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素,在37 ℃和5% CO2浓度的环境下培养。
将MGC803和SGC7901细胞按照105/孔的比例铺至无菌6孔板中,使用制备的空白对照、过表达FJX1、沉默FJX1的慢病毒浓缩液(2 μL,1×105)处理细胞,经过12 h后更换正常培养基,继续常规培养3 d。在第4天在培养加入2 μg/mL的嘌呤霉素。7 d后挑选单克隆细胞集落转移至无菌24孔板中,并培养基中加入为1 μg/mL浓度的嘌呤霉素,待细胞长满后进行筛选。消化细胞后稀释至100 mL,取1 μL加入预先放入99 μL 10%DMEM培养基的96孔板中继续培养,继续加入1 μg/mL嘌呤霉素浓度,传代时转入无菌6孔板进行扩大培养,在转染细胞通过建立稳定生长后收集对照组(Vector)组、FJX1过表达组(OE-FJX1)和FJX1沉默组(sh-FJX1)的胃癌细胞进行相关检测。
1.5. Western blot检测
Western blot检测参考既往报道并简述如下[17]:首先提取胃癌细胞中的全部蛋白,随后使用BCA方法对蛋白进行定量,采用SDS-PAGE凝胶电泳方法分离组织匀浆中的蛋白质,然后转移到PVDF膜上,采用5%脱脂牛奶和1× TBST室温封闭,封闭结束后漂洗3次加一抗4 ℃孵育过夜,次日取出后洗膜3次加二抗室温孵育,洗膜后ECL化学法显色拍照。使用的一抗商品及浓度信息为anti-FJX1(1:200, 17417-1-AP, 武汉三鹰)、anti-Ki67(1:200, ab16667, Abcam)、anti-PCNA(1:1000, 10205-2-AP, 武汉三鹰)、anti-PI3K(1:500, ab191606, Abcam)、anti-pPI3K(1:500, ab182651, Abcam)、anti-AKT(1:500, ab32505, Abcam)、anti-p-AKT(1:500, ab38449, Abcam)、anti-β-actin (1:200, ab179467, Abcam)。使用ImageJ 1.53q软件通过光密度法对目的蛋白条带进行量化,并以β-actin条带值为标准进行归一化处理。每组实验均进行了3次重复。
1.6. CCK-8实验
使用Cell Counting Kit-8(CCK-8)检测细胞增殖,将Vector组,OE-FJX1组和sh-FJX1组的胃癌细胞(8× 103/孔)种于96孔板中培养过夜。在培养24、48、72和96 h后,向每孔加入总共10 μL的CCK-8试剂,在37 ℃下进一步培养细胞2 h,使用全波长酶标仪检测每个孔的吸光度值A450 nm。每组实验均进行了3次重复。
1.7. 裸鼠成瘤实验
雄性BALB/c裸鼠(4~6周龄,n=9)(江苏集萃药康生物),饲养在SPF环境中,50%~70%湿度和24 ℃条件下,12/12 h的光/暗循环,自由获得水食。将裸鼠随机分为对照组(Vector)、FJX1过表达组(OE-FJX1)和FJX1沉默组(sh-FJX1),每组各3只。分别将FJX1-Vector组、OE-FJX1组和sh-FJX1组胃癌细胞(MGC-803,6× 106/mL)重悬于PBS溶液中,选取100 μL重悬液注入裸鼠左侧腋下皮下组织。实验共持续28 d,在实验结束后给予麻醉后完整剥离肿瘤,称取移植瘤质量、测量肿瘤体积并拍照。本研究动物实验经过蚌埠医学院动物伦理委员会批准。
1.8. 统计分析
采用R 4.2.0软件和GraphPad Prism 9.0.0软件进行统计分析。测序数据及芯片数据两组之间的比较采用Wilcoxon秩和检验,配对样本采用配对Wilcoxon检验。非测序数据的两组间比较采用Student's t检验,配对样本采用配对t检验,多组间比较采用方差分析并进行Tukey事后检验。计数资料的比较采用卡方检验,当理论频数小于5时则采用Fisher精确检验。相关性检验采用Spearman相关性分析。生存分析采用Log-rank χ2检验。数据以均数±标准差形式进行展示,当P < 0.05时差异被认为具有统计学意义。
2. 结果
2.1. FJX1在胃癌中的表达情况
FJX1基因在大多数肿瘤组织中的表达水平高于正常组织(图 1A)。FJX1在TCGA队列胃癌组织中明显高于正常组织,差异有统计学意义(P < 0.001,图 1B)。此外,在同一患者配对样本中进行差异分析的结果也显示FJX1在胃癌组织中的表达水平明显高于正常组织(P < 0.001,图 1C)。ROC分析结果表明FJX1可以区分胃癌和正常样本(AUC=0.84,图 1D)。在GEO数据库的胃癌队列(GSE66229)中的分析结果也证实了FJX1在胃癌组织中表达异常增高并可以区分胃癌和正常样本(P < 0.001,AUC=0.90,图 1E~G)。
图 1.
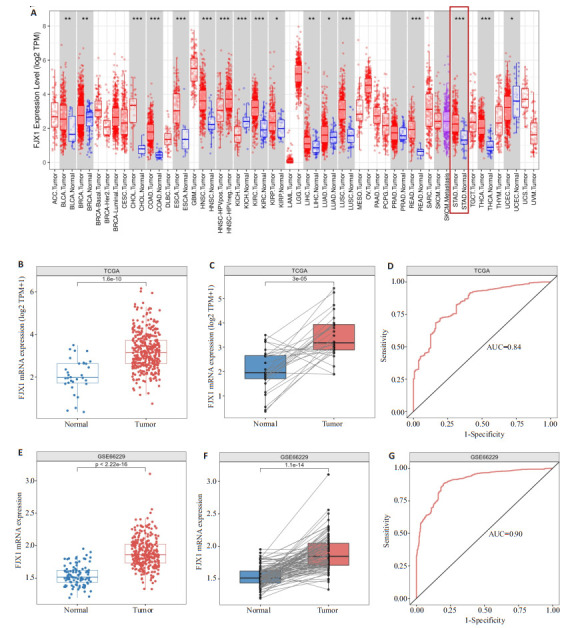
FJX1在胃癌中的表达情况
Expression of FJX1 in GC tissues. A: Expression of FJX1 in pan-cancer tissues and normal tissues. B: Expression of FJX1 in GC samples of TCGA cohort. C: FJX1 expression in paired GC samples of TCGA cohort. D: ROC analysis of FJX1 in GC samples of TCGA cohort. E: Expression of FJX1 in GC samples of GSE66229 cohort. F: FJX1 expression in paired GC samples of GSE66229 cohort. G: ROC analysis of FJX1 in GC samples of GSE66229 cohort.
2.2. FJX1表达与胃癌患者的不良预后相关
TCGA队列中的Kaplan-Meier生存分析结果表明,FJX1高表达组中胃癌患者的生存期显著低于FJX1低表达组,差异有统计学差异(Log-rank P=0.0097,图 2A)。多因素COX分析结果表明FJX1是影响胃癌患者预后的独立危险因素(HR=1.95,P=0.0217,图 2B)。通过GEO的胃癌队列(GSE84437)验证了FJX1与胃癌患者预后的关系,Kaplan-Meier生存分析结果证实FJX1高表达组患者的生存期显著低于FJX1低表达组患者(Log-rank P=0.00081,图 2C)。多因素COX分析结果也证实FJX1是影响胃癌患者预后的独立危险因素(HR=1.64,P=0.0065,图 2D)。
图 2.
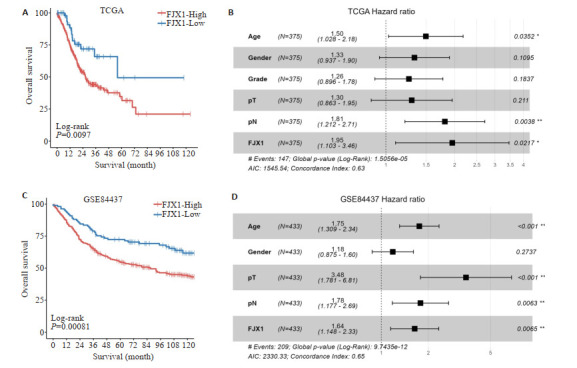
FJX1在胃癌中的预后价值分析
Analysis of the prognostic value of FJX1 in GC. A: Analysis of FJX1 expression and prognosis of GC patients in the TCGA cohort. B: Multifactorial COX analysis of risk factors affecting the prognosis of GC patients in the TCGA cohort. C: Analysis of FJX1 expression and prognosis of GC patients in the GSE84437 cohort. D: Multifactorial COX analysis of risk factors affecting the prognosis of GC patients in the GSE84437 cohort. *P < 0.05, **P < 0.01.
2.3. FJX1蛋白表达与胃癌患者临床病理参数和不良预后相关
在纳入87例胃癌患者的BBMC队列中通过免疫组化检测FJX1的蛋白表达水平,结果表明FJX1在胃癌组织中的蛋白表达水平明显高于癌旁正常组织,差异有统计学意义(P < 0.01,图 3A、B)。此外,免疫组化结果还显示FJX1与Ki67在胃癌组织中的蛋白表达呈正相关(R=0.34,P=0.0014,图 3C、D),这也表明FJX1高表达可能与胃癌的活跃增殖有关。Logistics回归分析结果显示FJX1高表达组与FJX1低表达组在性别、年龄、体质量指数(BMI)、CEA等指标方面无差异(P > 0.05,表 1)。但在CA199、T分期、N分期其他3项指标中,FJX1高表达组与FJX1低表达组的差异有统计学意义(P=0.017,P=0.017,P=0.03,表 1)。生存分析结果表明,与FJX1低表达患者相比,FJX1高表达患者的预后更差,差异有统计学意义(Log-rank P=0.0017,图 3D)。多因素COX回归分析结果也表明FJX1是胃癌不良预后的独立危险因素(HR=1.921,P=0.0388,图 3E)。
图 3.
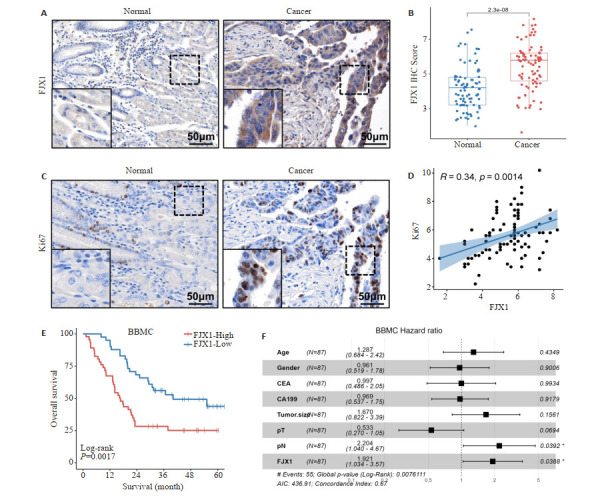
FJX1在胃癌中的蛋白表达以及预后价值
Protein expression of FJX1 in GC and its prognosis value. A: Immunohistochemical detection of FJX1 and Ki67 expression in GC and normal tissues. B: Differential analysis of FJX1 protein expression in GC and normal tissues. C: Correlation analysis of protein expression levels of FJX1 and KI67 in GC tissues. D: Survival analysis of FJX1 in the BBMC cohort. E: Multifactorial COX analysis of FJX1 in the BBMC cohort. *P < 0.05.
表 1.
BBMC队列中FJX1蛋白表达与胃癌患者临床病理参数的相关性分析
Analysis of the correlation between FJX1 protein expression and clinicopathological parameters of GC patients in the BBMC cohort
| Factors | n | FJX1 Expression (n, %) | χ2 | P | |
| High (n=43) | Low (n=44) | ||||
| FJX1: Four-joint box kinase 1; BMI: Body Mass Index; CEA: carcinoembryonic anti-gen; CA199: Carbohydrate antigen199. | |||||
| Gender | |||||
| Male | 63 | 31 (49.2%) | 32 (50.8%) | 0.149 | 0.700 |
| Female | 24 | 12 (50%) | 12 (50%) | ||
| Age (year) | |||||
| ≥60 | 53 | 28 (56%) | 25 (44%) | 0 | 0.992 |
| < 60 | 34 | 15 (44.1%) | 19 (55.9%) | ||
| BMI | |||||
| ≥24 | 35 | 17 (48.6%) | 18 (51.4%) | 0.184 | 0.668 |
| < 24 | 52 | 26 (50%) | 26 (50%) | ||
| CEA (μg/L) | |||||
| ≥10 | 20 | 13 (65%) | 7 (35%) | 1.623 | 0.209 |
| < 10 | 67 | 30 (44.8%) | 37 (55.2%) | ||
| CA199 (kU/L) | |||||
| ≥35 | 31 | 21 (66.7%) | 10 (32.3%) | 6.232 | 0.017 |
| < 35 | 56 | 22 (39.3%) | 34 (60.7%) | ||
| pT | |||||
| T1/T2 | 27 | 6 (22.2%) | 21 (77.8%) | 5.342 | 0.017 |
| T3/T4 | 60 | 37 (61.7%) | 23 (38.3%) | ||
| pN | |||||
| N0 | 46 | 15 (32.6%) | 31 (67.4%) | 4.977 | 0.03 |
| N1-N3 | 41 | 28 (68.3%) | 13 (31.7%) | ||
2.4. FJX1与胃癌中功能富集分析
GO分析结果提示FJX1参与了调节细胞黏附、细胞因子产生等生物学过程(图 4A)。FJX1主要发挥细胞外基质构成、生长因子结合等分子功能(图 4A)。而FJX1基因产物主要表达于细胞外基质、细胞膜外表面等细胞组分(图 4A)。KEGG分析结果提示FJX1可能通过调节磷脂酰肌醇3-激酶(PI3K-AKT)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路等癌症相关信号通路影响胃癌进展,其中PI3K-AKT途径是与FJX1表达最相关的信号通路(图 4B)。GSEA分析结果显示胃癌中的FJX1表达升高与激活的PI3K-Akt信号通路有关(图 4C)。此外,通过相关性分析发现FJX1表达与PI3K/Akt信号通路中的关键基因PIK3CA、AKT1、AKT2和AKT3的表达呈现正相关性(P < 0.05,图 4D)。
图 4.
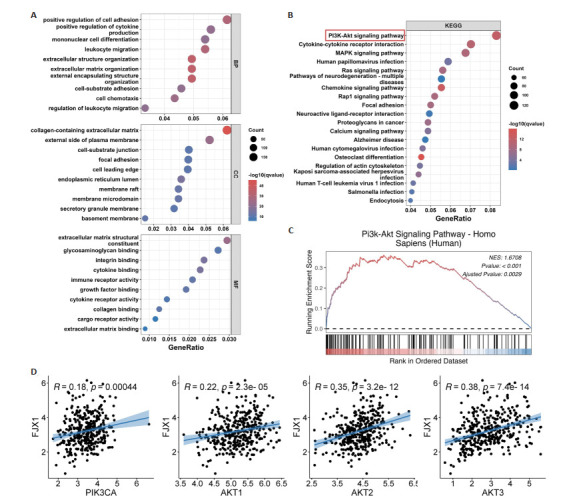
FJX1在胃癌中的功能富集分析
Functional enrichment analysis of FJX1 in GC. A: GO analysis of FJX1 in GC. B: KEGG analysis of FJX1 in GC. C: GSEA analysis of FJX1 expression and PI3K-Akt signaling pathway. D: Correlation analysis of FJX1 with key genes of PI3K/AKT signaling pathway in gastric cancer.
2.5. FJX1调控胃癌细胞增殖
Western blot结果证实FJX1过表达和FJX1沉默的稳转细胞株构建成功(图 5A、B)。Western blot结果显示与FJX1-Vector组相比,过表达FJX1促进了增殖相关蛋白Ki67和PCNA的表达,而沉默FJX1则抑制了Ki67和PCNA的表达(P < 0.05,图 5C、E)。CCK8检测结果表明过表达FJX1促进胃癌细胞的增殖(P < 0.05),沉默FJX1则抑制了胃癌细胞的增殖(图 5D、F)。
图 5.
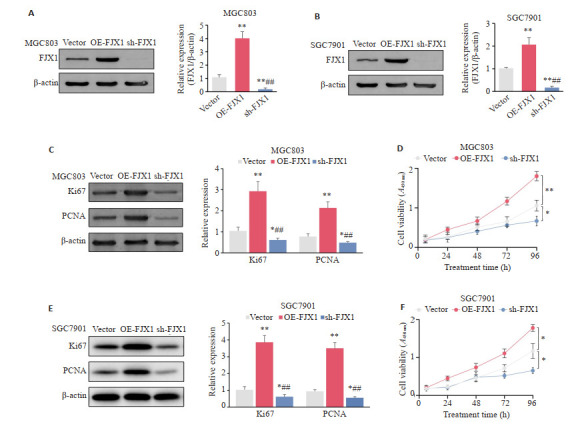
FJX1调控胃癌细胞增殖
FJX1 regulates gastric cancer cell proliferation. A: Validation of FJX1 overexpression and FJX1 silencing in MGC803 cells. B: Validation of FJX1 overexpression and FJX1 silencing in SGC7901 cells. C: FJX1 regulates the expression of proliferation-associated proteins Ki67 and PCNA in MGC803 cells. D: Cell proliferation was determined by CCK8 assay in MGC803 cells. E: FJX1 regulates the expression of proliferation-associated proteins Ki67 and PCNA in SGC7901 cells. F: Cell proliferation was determined by CCK8 assay in SGC7901 cells. *P < 0.05, **P < 0.01 vs Vector group, ##P < 0.01 vs OE-FJX1 group.
2.6. FJX1调控胃癌细胞中的PI3K/AKT信号通路
Western blot结果显示与FJX1-Vector组相比,过表达FJX1提高了该通路关键蛋白PI3K及AKT的磷酸化蛋白表达水平,而沉默FJX1则抑制了磷酸化PI3K及磷酸化AKT的表达(P < 0.05,图 6)。
图 6.
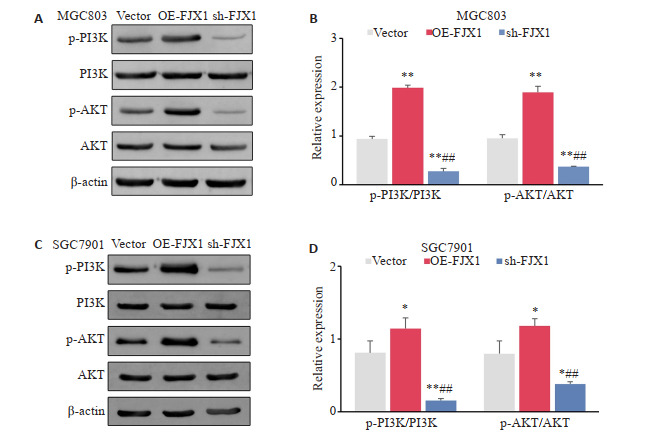
FJX1调控胃癌细胞中的PI3K/AKT信号通路
FJX1 regulates the PI3K/AKT signaling pathway in gastric cancer cells. A: Detection of PI3K, AKT protein and phosphorylated protein expression in FJX1 differentially expressed MGC803 cells by WB. B: Differential analysis of IOD values of phosphorylated PI3K and phosphorylated AKT protein expression in MGC803 cells. C: Detection of PI3K, AKT protein and phosphorylated protein expression in FJX1 differentially expressed SGC7901 cells by WB. D: Differential analysis of IOD values of phosphorylated PI3K and phosphorylated AKT protein expression in SGC7901 cells. *P < 0.05, **P < 0.01 vs Vector group, ##P < 0.01 vs OE-FJX1 group.
2.7. FJX1在裸鼠成瘤模型中促进胃癌增殖
过表达FJX1促进了肿瘤的生长(图 7A)。与FJX1-Vector组,过表达FJX1处理后移植瘤的肿瘤显著增加(P < 0.05,图 7B)。并且过表达FJX1组移植瘤的体积也明显增加,差异有统计学意义(P < 0.05,图 7C)。相反,沉默FJX1则抑制了移植瘤的生长。
图 7.
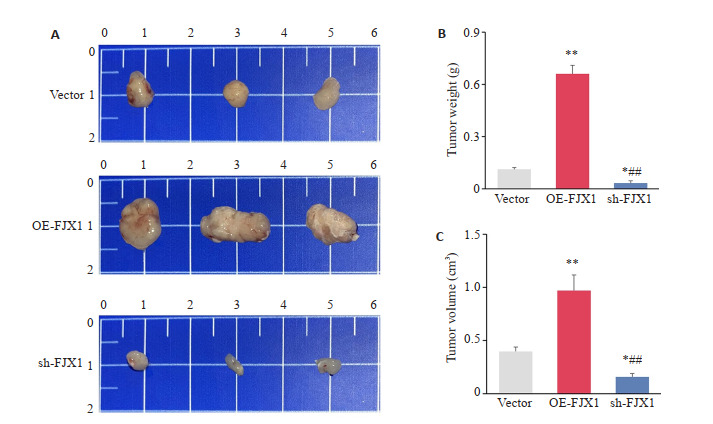
FJX1在移植瘤模型中促进肿瘤生长
FJX1 promotes tumor growth in an implantation tumor model. A: Implantation tumor growth of MGC803 cells in Vector group, OE-FJX1 group and sh-FJX1 group. B: Comparison of tumor weight in Vector group, OE-FJX1 group and sh-FJX1 group. C: Comparison of tumor volume in Vector group, OE-FJX1 group and sh-FJX1 group. *P < 0.05, **P < 0.01 vs Vector group, ##P < 0.01 vs OE-FJX1 group.
3. 讨论
本研究首次探讨了FJX1在胃癌的致癌作用及其相关作用机制,主要发现如下:(1)FJX1在胃癌组织中表达异常增高并与胃癌患者的不良预后相关;(2)FJX1促进胃癌细胞增殖和肿瘤生长;(3)FJX1激活PI3K/AKT信号通路促进胃癌细胞增殖。综上,我们的结果表明FJX1是胃癌的一个预后生物标志物,并通过激活PI3K/AKT信号通路促进胃癌进展。
虽然FJX1在人体内的确切功能仍不明确,但最近的报道认为其在癌症中发挥了致癌基因的作用[19, 20]。有研究提出FJX1是Hippo信号通路中YAP和TAZ致癌基因的直接目标[12]。亦有研究表明抑制FJX1表达可以减少结肠腺癌细胞的增殖和迁移[21]。这些结果都支持FJX1是一个潜在的致癌基因,并有可能在胃癌中发挥致癌作用。我们通过生物信息学分析和免疫组化发现,与癌旁正常组织相比,FJX1在胃癌组织中的mRNA和蛋白水平异常升高。此外,我们发现FJX1高表达患者的生存率要明显低于FJX1低表达患者,多因素COX回归分析也显示FJX1是影响胃癌患者不良预后的独立危险因素之一。这些结果提示FJX1在胃癌发生发展过程中扮演了致癌基因的角色,并有潜力成为胃癌的预后生物标志物。
肿瘤细胞的异常增殖是恶性肿瘤的主要异质性表现,而致癌基因的改变则是异常增殖的主要驱动过程[22-24]。Ki67是一种位于细胞核内的蛋白质,与细胞增殖密切相关,是肿瘤内异质性的一个潜在指标[25, 26]。增殖细胞核抗原(PCNA)作为DNA复制和修复的重要因素参与细胞分裂过程,其表达水平也被认为是细胞增殖活性的评价指标[27]。而我们的结果表明在胃癌组织中FJX1和Ki67的蛋白表达呈显著正相关。WB检测的结果也显示FJX1能够促进胃癌细胞中Ki67和PCNA的表达。此外,我们还发现FJX1过表达的胃癌细胞增殖活性显著增高,并且FJX1过表达细胞的移植瘤生长也明显更快。相反,FJX1沉默细胞的增殖活性显著降低。这些结果均表明FJX1可能通过促进胃癌细胞增殖从而加速胃癌进展。
PI3K/AKT信号通路被认为是癌症密切相关的分子途径,在肿瘤的发生和发展中发挥重要作用[28, 29]。而在胃癌病理过程中PI3K/AKT信号通路被激活,通过促进胃癌细胞增殖从而影响肿瘤进展[30-32]。通过生物信息学分析发现PI3K/AKT信号通路与FJX1的异常表达相关,提示了FJX1可能通过PI3K/AKT途径发挥致癌作用。WB结果显示过表达FJX1后,胃癌细胞中PI3K以及AKT的磷酸化水平显著提高,证实PI3K/AKT信号通路被显著激活。而沉默FJX1后磷酸化PI3K以及磷酸化AKT的蛋白水平均显著降低。这些结果表明了FJX1通过激活PI3K/AKT信号通路促进细胞增殖,从而加速胃癌进展。
虽然本研究在多个角度上探讨了FJX1在胃癌的角色及作用机制,但仍存在几个局限性不足:(1)本研究为一项单中心研究,临床样本量小,未来可能需要更大的临床样本量或者多中心数据来进一步验证我们的结果;(2)本研究探讨了FJX1与PI3K/AKT信号通路之间的相互作用,但这并不能排除FJX1可以通过其他途径影响胃癌进展;(3)本研究仅通过了裸鼠移植瘤实验评估了FJX1在体对胃癌细胞增殖的影响,但FJX1在体的确切作用途径可能需要更深层次的研究进行探讨。
综上,本研究揭示了FJX1是胃癌的致癌基因,并且是胃癌患者不良预后的独立危险因素。此外,FJX1通过激活PI3K/AKT信号途径促进胃癌细胞增殖加速胃癌进展。本研究为探索FJX1在胃癌进展中的作用及分子机制提供了研究基础,并为临床提供了关于胃癌的预后标志物和潜在治疗靶点。
Biography
张浩,硕士研究生,E-mail: drhz90s@163.com
Funding Statement
国家自然科学基金(82070561);蚌埠医学院省级重点科研平台开放课题(KFDX202202);蚌埠医学院研究生科研创新计划项目(Byycx21073);安徽省卫生健康科研项目(AHWJ2022a019,AHWJ2022b088)
Supported by National Natural Science Foundation of China (82070561)
Contributor Information
张 浩 (Hao ZHANG), Email: drhz90s@163.com.
左 芦根 (Lugen ZUO), Email: zuolugen@bbmc.edu.cn.
References
- 1.Smyth EC, Nilsson M, Grabsch HI, et al. Gastric cancer. Lancet. 2020;396(10251):635–48. doi: 10.1016/S0140-6736(20)31288-5. [DOI] [PubMed] [Google Scholar]
- 2.Strong VE. Progress in gastric cancer. Updates Surg. 2018;70(2):157–59. doi: 10.1007/s13304-018-0543-3. [DOI] [PubMed] [Google Scholar]
- 3.Cui L, Wang X, Zhang D. TLRs as a promise target along with immune checkpoint against gastric cancer. Front Cell Dev Biol. 2020;8:611444. doi: 10.3389/fcell.2020.611444. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chen S, Wu H, Zhu L, et al. miR-199b-5p promotes gastric cancer progression by regulating HHIP expression. Front Oncol. 2021;11:728393. doi: 10.3389/fonc.2021.728393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Wu D, Zhang P, Ma J, et al. Serum biomarker panels for the diagnosis of gastric cancer. Cancer Med. 2019;8(4):1576–83. doi: 10.1002/cam4.2055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Cui XJ, Shan T, Qiao LN. Collagen type IV alpha 1 (COL4A1) silence hampers the invasion, migration and epithelial-mesenchymal transition (EMT) of gastric cancer cells through blocking Hedgehog signaling pathway. Bioengineered. 2022;13(4):8972–81. doi: 10.1080/21655979.2022.2053799. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Wang L, Li B, Zhang L, et al. miR-664a-3p functions as an oncogene by targeting Hippo pathway in the development of gastric cancer. Cell Prolif. 2019;52(3):e12567. doi: 10.1111/cpr.12567. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 8.Hu F, Liu J, Liu H, et al. Role of Exosomal Non-coding RNAs in Gastric Cancer: Biological Functions and Potential Clinical Applications. Front Oncol. 2021;11:700168. doi: 10.3389/fonc.2021.700168. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ashery-Padan R, Alvarez-Bolado G, Klamt B, et al. Fjx1, the murine homologue of the Drosophila four-jointed gene, codes for a putative secreted protein expressed in restricted domains of the developing and adult brain. Mech Dev. 1999;80(2):213–7. doi: 10.1016/S0925-4773(98)00218-4. [DOI] [PubMed] [Google Scholar]
- 10.Rock R, Heinrich AC, Schumacher N, et al. Fjx1: a Notch-inducible secreted ligand with specific binding sites in developing mouse embryos and adult brain. Dev Dyn. 2005;234(3):602–12. doi: 10.1002/dvdy.20553. [DOI] [PubMed] [Google Scholar]
- 11.Chai SJ, Yap YY, Foo YC, et al. Identification of four-jointed box 1 (FJX1)-specific peptides for immunotherapy of nasopharyngeal carcinoma. PLoS One. 2015;10(11):e0130464. doi: 10.1371/journal.pone.0130464. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Chai SJ, Ahmad Zabidi MM, Gan SP, et al. An oncogenic role for four-jointed box 1 (FJX1) in nasopharyngeal carcinoma. Dis Markers. 2019;2019:3857853. doi: 10.1155/2019/3857853. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Al-Greene NT, Means AL, Lu P, et al. Four jointed box 1 promotes angiogenesis and is associated with poor patient survival in colorectal carcinoma. PLoS One. 2013;8(7):e69660. doi: 10.1371/journal.pone.0069660. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Li T, Fan J, Wang B, et al. TIMER: a web server for comprehensive analysis of tumor-infiltrating immune cells. Cancer Res. 2017;77(21):e108–10. doi: 10.1158/0008-5472.CAN-17-0307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Wu T, Hu E, Xu S, et al. clusterProfiler 4.0: a universal enrichment tool for interpreting omics data. Innovation: Camb. 2021;2(3):100141. doi: 10.1016/j.xinn.2021.100141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Zuo LG, Li J, Ge ST, et al. Bryostatin‐1 ameliorated experimental colitis in Il‐10-/- Mice by protecting the intestinal barrier and limiting immune dysfunction. J Cell Mol Med. 2019;23(8):5588–99. doi: 10.1111/jcmm.14457. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Zuo LG, Li J, Zhang XF, et al. Aberrant mesenteric adipose extracellular matrix remodelling is involved in adipocyte dysfunction in crohn's disease: the role of TLR-4-mediated macrophages. J Crohns Colitis. 2022;16(11):1762–76. doi: 10.1093/ecco-jcc/jjac087. [DOI] [PubMed] [Google Scholar]
- 18.Peng C, Chen H, Li Y, et al. LRIG3 suppresses angiogenesis by regulating the PI3K/AKT/VEGFA signaling pathway in glioma. Front Oncol. 2021;11:621154. doi: 10.3389/fonc.2021.621154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Wan N, Yang W, Cheng H, et al. FOXD3-AS1 contributes to the progression of melanoma via miR-127-3p/FJX1 axis. Cancer Biother Radiopharm. 2020;35(8):596–604. doi: 10.1089/cbr.2019.3093. [DOI] [PubMed] [Google Scholar]
- 20.Chang HJ, Yoo JY, Kim TH, et al. Overexpression of four joint box-1 protein (FJX1) in eutopic endometrium from women with endometriosis. Reprod Sci. 2018;25(2):207–13. doi: 10.1177/1933719117716780. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Dang W, Zhu Z. microRNA-1249 targets four-jointed box kinase 1 and reduces cell proliferation, migration and invasion of colon adenocarcinoma. J Gene Med. 2020;22(7):e3183. doi: 10.1002/jgm.3183. [DOI] [PubMed] [Google Scholar]
- 22.Ding Y, Li Y, Duan Y, et al. LncRNA MBNL1-AS1 represses proliferation and cancer stem- like properties of breast cancer through MBNL1-AS1/ZFP36/CENPA axis. J Oncol. 2022;2022:9999343. doi: 10.1155/2022/9999343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Kumar AR, Shanmugasundaram KB, Li JR, et al. Ultrasensitive melanoma biomarker detection using a microchip SERS immunoassay with anisotropic Au-Ag alloy nanoboxes. RSC Adv. 2020;10(48):28778–85. doi: 10.1039/D0RA05032F. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Wang G, Zhang ZJ, Jian WG, et al. Novel long noncoding RNA OTUD6B-AS1 indicates poor prognosis and inhibits clear cell renal cell carcinoma proliferation via the Wnt/β-catenin signaling pathway. Mol Cancer. 2019;18(1):15. doi: 10.1186/s12943-019-0942-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Wang K, Pan S, Zhao P, et al. PTBP1 knockdown promotes neural differentiation of glioblastoma cells through UNC5B receptor. Theranostics. 2022;12(8):3847–61. doi: 10.7150/thno.71100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pajtler KW, Wei Y, Okonechnikov K, et al. YAP1 subgroup supratentorial ependymoma requires TEAD and nuclear factor Imediated transcriptional programmes for tumorigenesis. Nat Commun. 2019;10(1):3914. doi: 10.1038/s41467-019-11884-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zhang S, Zhou T, Wang Z, et al. Post-translational modifications of PCNA in control of DNA synthesis and DNA damage tolerance-the implications in carcinogenesis. Int J Biol Sci. 2021;17(14):4047–59. doi: 10.7150/ijbs.64628. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Liu Q, Zeng H, Yuan Y, et al. Osteopontin inhibits osteoarthritis progression via the OPN/CD44/PI3K signal axis. Genes Dis. 2022;9(1):128–39. doi: 10.1016/j.gendis.2020.06.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Yan G, Pu C, Lan S, et al. Discovery of 4-phenyl-2H-benzo[b][1, 4] oxazin-3(4H)-one derivatives as potent and orally active PI3K/mTOR dual inhibitors. Eur J Med Chem. 2019;178:667–86. doi: 10.1016/j.ejmech.2019.06.021. [DOI] [PubMed] [Google Scholar]
- 30.Fan M, Xiong X, Han L, et al. SERPINA5 promotes tumour cell proliferation by modulating the PI3K/AKT/mTOR signalling pathway in gastric cancer. J Cell Mol Med. 2022;26(18):4837–46. doi: 10.1111/jcmm.17514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Li J, Ye D, Shen P, et al. miR-20a-5p induced WTX deficiency promotes gastric cancer progressions through regulating PI3K/AKT signaling pathway. J Exp Clin Cancer Res. 2020;39(1):212. doi: 10.1186/s13046-020-01718-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Huang T, Song C, Zheng L, et al. The roles of extracellular vesicles in gastric cancer development, microenvironment, anti-cancer drug resistance, and therapy. Mol Cancer. 2019;18(1):62. doi: 10.1186/s12943-019-0967-5. [DOI] [PMC free article] [PubMed] [Google Scholar]


