Abstract
目的
通过对宫颈癌外照射放射治疗计划的量化评估,探究放疗计划中存在的问题以指导临床,降低出错几率,提高放疗计划质量,完善放疗流程。
方法
选取2019年5月~2022年1月在中山大学肿瘤防治中心进行放射治疗的227例宫颈癌患者,将经临床批准且实施的放疗计划通过计划系统至Plan IQTM工作站。根据ICRU83号报告、GEC-ESTRO工作组的推荐指南及本中心临床要求制定评估指标,经高资历临床医生批准后对计划进行量化评估。总结记录放疗计划中存在的问题,同时,对评分较低的计划重新再计划,分析再计划前后的差异性。
结果
通过对277例宫颈癌放疗计划分析得出:(1)靶区得分不及格主要是大体肿瘤GTV、计划靶区PGTV(CI、V66Gy),分别为10.6%、65.2%、1%。得分0的有:计划靶区PGTV(CI)、大体肿瘤GTV、计划靶区PCTV(D98%、HI),分别为0.4%、10.1%、0.4%、0.4%。OARs中不及格的主要是肠道(直肠、小肠、结肠),比例≥20.7%。且直肠、小肠、结肠、肾、股骨头存在得分为0的情况;(2)资深剂量师在PGTV(V60 Gy、D98%)、PCTV(CI)、CTV(D98%)上优于初级剂量师(P≤0.046),且在脊髓和小肠的保护方面一致性优于初级剂量师(P≤0.034);(3)俯卧位组计划在满足靶区要求的情况下,肠道的剂量明显低于仰卧位组计划(P < 0.05)。选择得分低的20例放疗计划进行再计划,结果再计划靶区的GTV(Dmin)、PTV(V45 Gy、D98%)高于原计划(P < 0.05)。在OARs中,小肠(V40 Gy和V30 Gy)、结肠(V40 Gy和V30 Gy)、膀胱(D35%)的剂量均明显低于原计划(P < 0.05)。
结论
放疗计划的量化评估在提高放疗计划质量的同时,可实现放疗计划质量及放疗流程的风险管理。
Keywords: 宫颈癌, 外照射, 计划质量, 定量评估, 再计划
Abstract
Objective
To identify the problems in clinical radiotherapy planning for cervical cancer through quantitative evaluation of the radiotherapy plans to improve the quality of the plans and the radiotherapy process.
Methods
We selected the clinically approved and administered radiotherapy plans for 227 cervical cancer patients undergoing external radiotherapy at Sun Yat-sen University Cancer Center from May, 2019 to January, 2022. These plans were transferred from the treatment planning system to the Plan IQTM workstation. The plan quality metrics were determined based on the guidelines of ICRU83 report, the GEC-ESTRO Working Group, and the clinical requirements of our center and were approved by a senior clinician. The problems in the radiotherapy plans were summarized and documented, and those with low scores were re-planned and the differences were analyzed.
Results
We identified several problems in the 277 plans by quantitative evaluation. Inappropriate target volume selection (with scores < 60) in terms of GTV, PGTV (CI) and PGTV (V66 Gy) was found in 10.6%, 65.2%, and 1% of the plans, respectively; and the PGTV (CI), GTV, and PCTV (D98%, HI) had a score of 0 in 0.4%, 10.1%, 0.4%, 0.4% of the plans, respectively. The problems in the organs at risk (OARs) involved mainly the intestines (the rectum, small intestine, and colon), found in 20.7% of the plans, and in occasional cases, the rectum, small intestine, colon, kidney, and the femoral head had a score of 0. Senior planners showed significantly better performance than junior planners in PGTV (V60 Gy, D98%), PCTV (CI), and CTV (D98%) (P≤0.046) especially in terms of spinal cord and small intestine protection (P≤0.034). The bowel (the rectum, small intestine and colon) dose was significantly lower in the prone plans than supine plans (P < 0.05), and targets coverage all met clinical requirements. Twenty radiotherapy plans with low scores were selected for re-planning. The re-planned plans had significantly higher GTV (Dmin) and PTV (V45 Gy, D98%) (P < 0.05) with significantly reduced doses of the small intestines (V40 Gy vs V30 Gy), the colon (V40 Gy vs V30 Gy), and the bladder (D35%) (P < 0.05).
Conclusion
Quantitative evaluation of the radiotherapy plans can not only improve the quality of radiotherapy plan, but also facilitate risk management of the radiotherapy process.
Keywords: cervical cancer, external beam radiotherapy, plan quality, quantitative evaluation, replanning
宫颈癌是全球女性最常见癌症之一[1]。在中国,宫颈癌的发病率和死亡率呈逐年上升趋势[2]。放射治疗是宫颈癌综合治疗手段之一,流程复杂且要求精准。放疗计划的制定作为放疗流程中关键环节之一,放疗计划质量的优劣与剂量分布、患者效益比密切相关,是放疗流程风险评估中的重要组成部分。
放疗计划质量受放疗技术、肿瘤大小、医生要求、计划者经验等影响[3-7]。放疗计划的质控是放疗流程风险管理和评估中的重要组成部分。研究者采用故障模式和效应分析(FMEA)和故障树分析(FTA)对放疗计划的设计流程进行评估,发现进行质量管理的计划和未进行质量管理控制的计划相比能够大幅度降低潜在故障和风险[8]。Kisling等[9]开发了全自动的治疗计划工具(RPA),使用FEMA评估RPA自动放疗计划的风险,发现自动计划流程中许多错误是人为所造成的。
Sun Nuclear公司研发的Plan IQTM软件具备剂量预测和放疗计划质量的量化评分,软件内置了计划质量测度(PQM)和剂量、结构重建的算法。通过计划质量评估准则的设定,可实现对放疗计划的量化评估。研究表明[10-12],运用Plan IQTM的计划和手工计划或自动计划比较,前者可在保证靶区满足要求的情况下,一致性降低正常器官的受量,提高计划质量。Sasaki等[13]人使用Plan IQTM对过去八年前列腺癌患者的放疗计划质量进行回顾性分析,发现放疗计划质量逐年增加,对部分剂量欠佳的计划进行再设计,得到的计划质量与之前相比有较大提升。虽然放疗计划的量化评估已有不少研究,但将量化评估对放疗计划进行质量控制,并运用于精准放疗流程风险管理的研究,暂未见到相关报道。
本研究在团队研究[8]基础上,以宫颈癌为例,结合国内外相关指南制定了量化评估准则,使用Plan IQTM回顾性分析过去几年内本中心227例宫颈癌外照射放疗计划,对放疗计划质量进行评估及管理,总结分析其中可能存在的问题并改进,以实现放疗计划质量评估与风险管理,完善整个放疗流程。
1. 资料和方法
1.1. 一般资料
选取2019年5月~2022年1月在中山大学肿瘤防治中心进行外照射放疗的227例宫颈癌患者,年龄段范围为28~89岁,中位年龄为57岁,所有入组患者均获得中山大学肿瘤防治中心伦理委员会批准(审批号:SB5010-2016-024)。
227例患者中仰卧位172例,俯卧位55例,仰卧位使用负压真空袋固定,俯卧位使用orfit架固定。所有患者均采用容积旋转调强放射治疗技术(VMAT)进行治疗。在定位前1 h排空肠道和膀胱,分次饮用500~ 800 mL水,使膀胱涨尿至200~400 mL。使用飞利浦64排大孔径CT模拟定位机对患者进行扫描,扫描层厚为5 mm,扫描范围从第10胸椎下缘至坐骨结节下缘4 cm,扫描电压140 kV。
所有患者靶区和正常器官勾画均在计划系统Monaco(版本5.11.03,Elekta)上完成。靶区由资深放疗科医生进行勾画,根据美国肿瘤放射治疗协作组织(RTOG)中宫颈癌靶区勾画共识, 肿瘤靶区(GTV)为影像可见的肿大淋巴结和区域淋巴结转移[14]。临床靶区(CTV)包括子宫、宫颈、宫旁和上1/2阴道,盆腔淋巴引流区如髂内、闭孔、髂外、髂总淋巴结。计划靶区(PCTV)在CTV所有方向上向外扩4~6 mm边界形成;PGTV(PGTV)则在GTV基础上外扩4~6 mm边界形成的。PGTV处方剂量为60 Gy/25次和PCTV处方剂量为45 Gy/25次,OARs包括直肠、膀胱、小肠、结肠、股骨头、肾和脊髓等。
1.2. 放疗计划评估标准的建立
根据国际辐射学单位委员会(ICRU)83号报告中靶区和OARs的剂量限值,参考GEC-ESTRO妇产科工作组推荐的剂量限值,结合本中心对宫颈癌的剂量限制,建立关于宫颈癌的放疗计划质量评估标准(表 1)[15-19]。其中靶区和OARs的权重分别为0.54和0.46,总权重和为1,靶区和OARs按得分权重依次得出。均匀性指数(HI)与适形性指数(CI)是放疗计划评估的常用指标。根据ICRU的83号报告及相关学者的研究,将其定义为公式1和2[20, 21]。
表 1.
各项计划质量评估指标及其相应得分
Metrics for plan quality assessment and the corresponding scores
| Structure | Parameters | Volume or Dose (Gy) | Scores |
| V60 Gy (%) refers to the percentage of the volume exposed to a dose of 60 Gy; Min dose (Gy) refers to the minimum dose; Max dose (Gy) refers to the maximum dose; D1cc (Gy) refers to the dose received by 1 cm3 of the structure; D98% (Gy) refers to the dose received by 98% of the volume of the structure; GTV: Gross tumor volume; CTV: Clinical tumor volume; PGTV: Planning gross tumor volume; PCTV: Planning clinical tumor volume. | |||
| PGTV | V66Gy(%) | ≥2, ≤1, 0≤ | 2/4.8/8 |
| V60Gy(%) | ≥90, ≥95, ≥97 | 1/5.4/9 | |
| D98% (Gy) | ≥54, ≥58.8, ≥60 | 1/3/5 | |
| CI | 0-1 | 0/2 | |
| HI | 0-1 | 0/2 | |
| GTV | Min dose (Gy) | < 60, ≥60 | 0/5 |
| PCTV | V45Gy(%) | ≥90, ≥95, ≥97 | 1/5.4/9 |
| D98% (Gy) | ≥40.5, ≥42.75, ≥45 | 1/3/5 | |
| CI | 0-1 | 0/2 | |
| HI | 0-1 | 0/2 | |
| CTV | D98% (Gy) | < 42.75, ≥42.75 | 0/5 |
| Bladder | D35% (Gy) | ≤50, ≤45 | 6/10 |
| Rectum | D60% (Gy) | > 50, ≤45, ≤40 | 0/6/10 |
| Kidney | V18Gy(%) | > 40, ≤32, ≤20 | 0/3/5 |
| Spinal cord | Max dose (Gy) | > 44, ≤40, < 35 | 0.5/1.8/2 |
| Femoral head | D15%(Gy) | > 45, ≤35, ≤30 | 0/1.8/2 |
| D1cc(Gy) | > 60, ≤50, ≤45 | 0/0.6/1 | |
| Small intestine | V40Gy (cm3) | > 500, ≤300, < 250 | 0/1.2/2 |
| V30Gy (cm3) | > 150, ≤100, < 80 | 0/1.2/2 | |
| Colon | V40Gy (cm3) | > ≥500, ≤300, < 250 | 0/1.2/2 |
| V30Gy (cm3) | > 150, ≤100, < 80 | 0/1.2/2 | |
 |
1 |
公式1中,VTref为处方剂量所覆盖的靶区体积(cm3);VT为靶区体积(cm3);Vref为处方剂量线所覆盖体积(cm3)。CI在0-1之间,值越大说明适形性越好。
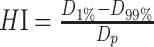 |
2 |
公式2中,D1%、D99%分别为靶区体积为1%和99%所受到的剂量照射,Dp为处方剂量。HI数值越小表示均匀性越好。
1.3. 统计学分析
本文中所有数据均采取均数±标准差标示。采用IBM SPSS 25.0软件对数据正态性检验,符合正态分布则使用独立t检验和配对t检验,不符合正态分布则使用Mann-Whitney U检验和Wilcoxon检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 放疗计划质量评估
2.1.1. 计划质量整体评估
经Plan IQTM计算后各单项得分归一化处理(将患者单项实际数值除该单项最大值)如图 1所示。图 1A中,PGTV(CI)、GTV、PCTV(D98%、HI)分值为0占比分别为0.4%、10.1%、0.4%、0.4%。GTV、PGTV(CI)、PGTV(V66 Gy)处于不及格,占比分别为10.6%、65.2%、1%。图 1B中,直肠(D60%)、左肾(V18 Gy)、右肾(V18 Gy)、左股骨头(D15%、D1cc)、右股骨头(D15%、D1cc)、小肠(V40 Gy、V30 Gy)、结肠(V40 Gy)0分占比分别为1.8%、2.2%、1.3%、1.3%、0.4%、1.3%、0.4%、13.7%、2.6%、9.3%。小肠(V30 Gy、V40 Gy)、直肠(D60%)、结肠(V40 Gy)、左股骨头(D15%)和右股骨头(D15%)得分 < 60,占比分别为24.7%、20.7%、52.9%、23.3%、11.9%和12.8%。
图 1.

患者计划中各单项指标分布情况
Distribution of indicators in plans (the dotted lines represent score 100 and 60, respectively). A: Normalized targets score. B: Normalized OARs scores. HI: Homogeneity index; CI: Conformity index.
靶区剂量适形性处于及格边缘,比较突出的是PGTV(CI),仅34.8%计划是及格的。靶区得分为0分主要是GTV(Dmin),不及格和得分为0的OARs主要是肠道器官。
2.1.2. 不同剂量师计划质量比较
资深剂量师指具有超过5年放疗计划设计经验的剂量师;初级剂量师指具有少于3年临床放疗计划设计经验的剂量师。资深剂量师在PGTV(V60 Gy、D98%)、PCTV(CI)、CTV(D98%)上的数值(99.67%%±0.56%、61.08±0.49 Gy、0.74±0.06、46.23±0.83 Gy)高于初级剂量师(99.50%±0.62%、60.88±0.47 Gy、0.72±0.06、46.05±0.87 Gy)(P≤0.046),且在靶区均匀性,脊髓和小肠的保护方面一致性优于初级剂量师(P≤0.034),即资深剂量师在靶区和对OARs的保护上均优于初级剂量师。
2.1.3. 不同体位下计划得分及肠道器官剂量的影响
俯卧位组患者总得分、靶区得分和OARs得分均高于仰卧位组患者(P < 0.05)。在满足靶区受照剂量的前提下,俯卧位组的计划2对肠道器官的保护优于仰卧位组(表 2),其中小肠、结肠差异尤其明显。
表 2.
不同体位下的肠道和膀胱的剂量学参数比较
Comparison of scores and dosimetric parameters of the bowel and bladder in different positions
| Structure | Parameter | Score (Supine) | Volume/Dose (Supine) | Score (Prone) | Volume/Dose (Prone) |
| "a" represents significantly difference (P < 0.05). | |||||
| Rectum | D60% (Gy) | 5.13±1.73 | 44.80±6.45 | 5.98±1.91a | 43.64±6.99a |
| Small intestine | V40Gy (cm3) | 1.29±0.79 | 98.01±62.88 | 1.70±0.60a | 66.65±58.43a |
| V30Gy (cm3) | 1.49±0.5 | 274.41±278.96 | 1.81±0.44a | 171.71±100.77a | |
| Colon | V40Gy (cm3) | 1.40±0.73 | 86.58±48.82 | 1.70±0.58a | 68.48±48.44a |
| V30Gy (cm3) | 1.95±0.21 | 133.79±74.74 | 1.96±0.19 | 100.49±65.94a | |
| Bladder | D35% (Gy) | 8.98±0.90 | 45.08±6.13 | 9.22±0.81a | 44.25±6.63a |
2.2. 再计划与原计划对比分析
按照得分由低到高选择得分低的20例患者放疗计划,同一资深剂量师进行再计划后利用PlanIQTM同一评价标准进行量化评估,结果显示,再计划后计划总分(P= 0.000)、靶区(P=0.000)和OARs的得分(P=0.000)均比原计划有所提高。
原计划与再计划的剂量学分析如表 3所示。靶区方面,再计划的GTV(Dmin)、PTV(V45 Gy、D98%)高于原计划(P < 0.05)。在OARs中,再计划的正常器官剂量比原计划有所降低,改善最为明显的是:小肠V40 Gy和V30 Gy的数值从125.39 ± 81.43 cm3、478.42 ± 748.43 cm3降至96.96±56.76 cm3、252.18±122.00 cm3,结肠V40 Gy和V30 Gy的数值从108.72±55.56 cm3、165.12±80.01 cm3降至94.75±44.51 cm3、151.68±68.89 cm3,膀胱D35%的数值从33.98±12.24 Gy降至28.22±8.85 Gy等,再计划后的靶区和正常器官的受照剂量均有所改善。
表 3.
原计划与再计划的剂量学参数比较
Comparison of scores and dosimetric parameters between the original plan (O-P) and the replans (Re-P)
| Item | Score of O-P | Dose of O-P | Score ofRe-P | Dose ofRe-P | |
| "a" represents significantly difference (P < 0.05); O-P: the original plan Re-P: the re-plans. | |||||
| PGTV | V60Gy(%) | 8.58±1.84 | 94.09±22.80 | 9.00±0 | 99.67±0.71 |
| V66Gy(%) | 7.68±0.85 | 0.10±0.27 | 7.35±1.53 | 0.24±0.62 | |
| D98% (Gy) | 4.78±0.76 | 60.65±1.36 | 4.89±0.47 | 61.14±0.77 | |
| CI | 0.91±0.35 | 0.46±0.18 | 0.99±0.28 | 0.49±0.14 | |
| HI | 1.86±0.04 | 0.07±0.02 | 1.85±0.04 | 0.07±0.02 | |
| GTV | Min dose (Gy) | 3.79±2.12 | 59.74±3.63 | 3.68±2.26 | 60.21±3.64a |
| PCTV | V45Gy(%) | 8.99±0.03 | 99.19±0.78 | 8.99±0.03 | 98.52±0.92a |
| D98% (Gy) | 4.97±0.12 | 46.03±1.56 | 4.88±0.22 | 45.64±1.54a | |
| CI | 1.44±0.21 | 0.72±0.10 | 1.46±0.18 | 0.73±0.09 | |
| HI | 1.22±0.09 | 0.39±0.05 | 1.18±0.09a | 0.41±0.04a | |
| CTV | D98% (Gy) | 5.00±0 | 46.79±1.64 | 5.00±0 | 46.76±1.73 |
| Spinal cord | Max dose (Gy) | 1.62±0.52 | 33.98±12.24 | 2.00±0a | 28.22±8.85a |
| Bladder | D35% (Gy) | 8.65±1.12 | 46.29±3.13 | 8.91±1.19a | 45.93±3.35a |
| Rectum | D60% (Gy) | 3.61±1.49 | 46.97±1.29 | 6.37±1.04a | 44.47±1.25a |
| Kidney | LV18Gy(%) | 4.68±1.15 | 10.79±17.10 | 4.92±0.34 | 7.47±8.54 |
| RV18Gy(%) | 4.65±1.15 | 8.99±11.98 | 4.91±0.36 | 8.48±9.06a | |
| Femoral head | LD15%(Gy) | 1.43±0.71 | 34.51±7.05 | 1.84±0.34a | 30.76±4.58a |
| LD1cc (Gy) | 0.95±0.12 | 41.93±4.33 | 0.96±0.11 | 42.36±3.44 | |
| RD15%(Gy) | 1.47±0.72 | 33.37±7.61 | 1.78±0.46a | 31.56±4.78 | |
| RD1cc (Gy) | 0.95±0.12 | 43.04±3.93 | 0.93±0.15 | 43.96±3.47 | |
| Small intestine | V40Gy (cm3) | 0.92±0.89 | 125.39±81.43 | 1.23±0.78a | 96.96±56.76a |
| V30Gy (cm3) | 1.22±0.75 | 478.42±748.43 | 1.52±0.67a | 252.18±122.00a | |
| Colon | V40Gy (cm3) | 1.00±0.81 | 108.72±55.56 | 1.27±0.67a | 94.75±44.51a |
| V30Gy (cm3) | 1.92±0.21 | 165.12±80.01 | 1.97±0.14 | 151.68±68.89a | |
3. 讨论
国内外的学者对放疗计划质量有很深入的研究,提出了各种评估指标和评估方法[22-26]。但这些的指标和方法需要在特定的条件下才能使用。本研究使用Plan IQTM对宫颈癌计划质量进行评估,能够减少人为主观因素和其他客观因素对计划质量的影响,且从单一评估计划优与差过渡到精细量化计划的各个指标,以数字的形式能够让我们更加清晰、直观地分析放疗计划的整体情况。回顾性分析近几年的计划质量,发现计划质量总体平稳,但从中也发现了不少问题。
靶区得分低主要表现在GTV覆盖和适形程度,如GTV(Dmin)、PGTV(CI)、PCTV(CI)、PCTV(HI)。PGTV(CI)主要分布在及格线下,说明PGTV的剂量适形性还有待改进。计划GTV(Dmin)得分为0占比10.1%,不及格占比10.6%,主要是GTV/GTVnd多孤立且体积小。同时,临床计划评估过程中关注更多的是PGTV的覆盖,对GTV关注较少。此外,在对放疗计划量化评估过程中,发现靶区命名千奇百怪,给自动量化评估造成困难。OARs呈现较明显的问题是出现一定比例的小肠结肠勾画不准确,主要原因是自动勾画后未进行人工审核,勾画的不准确必定造成剂量计算的不准确。其中得分不及格的主要是肠道器官,其中直肠占大多数。直肠的受照剂量偏大与患者的肠道准备、放疗医生对肠道剂量的要求不明确、计划者对肠道限制剂量不重视均有较大关系。
本研究结果得出,资深剂量师与初级剂量师的计划在靶区部分均满足处方要求,但资深剂量师在靶区覆盖和OARs保护上更有优势。Wang等[27]对比了不同经验的剂量师在乳腺癌调强计划,发现资深剂量师和初级剂量师及新手剂量师在靶区的剂量分布基本相等,但在OARs的剂量分布中,资深剂量师设计的计划和使用基于知识计划技术(KBP)所得计划剂量差异很小,无统计学差异,但初级剂量师和新手剂量师的剂量与KBP存在统计学差异。临床经验的丰富程度与计划的质量有一定的关系。因此,在计划设计过程中,新手剂量师要综合考虑的医生要求和对患者的保护等多方面的因素,可以参阅AAPM的TG-275报告等相关指南所提供的指导方法,对计划进行相对应核查并改进[28, 29]。
不同体位固定装置对肠道的受照剂量的分析中,俯卧位的患者计划总得分高于仰卧位组,且俯卧位的患者正常器官剂量一致性低于比仰卧位患者,尤其是小肠和结肠的受照剂量上的差异更为明显,即俯卧位对肠道的保护会优于仰卧位,这与严华梅等[30]研究结果所得到的结论相一致。因此推荐患者使用俯卧位进行体位固定和治疗能够对肠道等OARs有更好的保护。
针对上述问题,本研究选择得分较低的20例计划进行再计划。发现再计划相比于原计划,患者的靶区及正常组织的保护均有所提升。其中,小肠和结肠的受照剂量改善较为明显。如EMBRACE II期临床试验中针对放疗计划的飞行测试结果所示,放疗计划质量的好坏与评价标准的建立、相关培训及临床应用等有很大关系[31]。贺睿敏等[32]采用了一种计划质量评分系统对直肠癌放疗计划质量进行评估量化,既可保持计划质量的一致性,也提高计划的整体质量。吴秉志等[33]建立了直肠癌计划质量评估准则对15例直肠癌放疗计划进行初次打分,以预测剂量为优化目标,对放疗计划重新优化制定,并再次打分。发现优化后的计划相比于优化前,计划得分和计划质量有一定程度提升,所有OARs的Dmax均有不同程度地降低。
本研究通过对277例宫颈癌外照射放疗计划量化评估,结合TG100号报告中根因分析方法等,采取发现问题,记录并针对性进行再计划,计划质量取得了很大的进步,规范化了本中心宫颈癌放疗计划评估准则并运用于临床实践,实现放疗计划质量的风险管理。
综上所述,本文根据相关指南制定宫颈癌计划评价标准,并使用该标准对宫颈癌计划质量分析,根据分析结果进行针对性的改进,在靶区和正常器官均得到较大改善。该研究采用放疗计划的量化评估手段对放疗计划质量进行分析,指出放疗计划中存在的问题用以指导临床实践,降低出错几率,提高放疗计划质量,实现放疗计划质量及放疗流程的风险管理。
Biography
郭雨军,本科,E-mail: kwowyj@163.com
Funding Statement
国家自然科学基金(12075329);广东省基础与应用基础研究基金企业联合基金(2021A1515220140);中山大学肿瘤防治中心青年优创项目(QNYCPY32)
Supported by National Natural Science Foundation of China (12075329)
Contributor Information
郭 雨军 (Yujun GUO), Email: kwowyj@163.com.
黄 思娟 (Sijuan HUANG), Email: huangsj@sysucc.org.cn.
References
- 1.Lin SJ, Gao K, Gu SM, et al. Worldwide trends in cervical cancer incidence and mortality, with predictions for the next 15 years. Cancer. 2021;127(21):4030–9. doi: 10.1002/cncr.33795. [DOI] [PubMed] [Google Scholar]
- 2.李 想, 刘 灿, 周 维, et al. 2005-2015年中国宫颈癌发病与死亡趋势分析. 华中科技大学学报: 医学版. 2021;50(3):325-30, 346. [Google Scholar]
- 3.Batumalai V, Jameson MG, Forstner DF, et al. How important is dosimetrist experience for intensity modulated radiation therapy? A comparative analysis of a head and neck case. Pract Radiat Oncol. 2013;3(3):e99–106. doi: 10.1016/j.prro.2012.06.009. [DOI] [PubMed] [Google Scholar]
- 4.Collier DC. Assessment of consistency in contouring of normaltissue anatomic structures. JAppl Clin Med Phys. 2003;4(1):17. doi: 10.1120/jacmp.v4i1.2538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bell K, Heitfeld M, Licht N, et al. Influence of daily imaging on plan quality and normal tissue toxicity for prostate cancer radiotherapy. Radiat Oncol. 2017;12(1):1–11. doi: 10.1186/s13014-016-0740-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Piotrowski T, Ryczkowski A. Influence of the modulation factor on the treatment plan quality and execution time in Tomotherapy in head and neck cancer: In-phantom study. J Can Res Ther. 2013;9(4):618. doi: 10.4103/0973-1482.126458. [DOI] [PubMed] [Google Scholar]
- 7.Wang YY, Chen L, Zhu FY, et al. A study of minimum segment width parameter on VMAT plan quality, delivery accuracy, and efficiency for cervical cancer using Monaco TPS. J Appl Clin Med Phys. 2018;19(5):609–15. doi: 10.1002/acm2.12422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.丁 寿亮, 胡 江, 张 俊, et al. 故障模式和效应分析与故障树分析方法在调强放射治疗计划设计流程中的应用. 中华放射医学与防护杂志. 2019;39(9):673–9. [Google Scholar]
- 9.Kisling K, Johnson JL, Simonds H, et al. A risk assessment of automated treatment planning and recommendations for clinical deployment. Med Phys. 2019;46(6):2567–74. doi: 10.1002/mp.13552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.李 勇, 谭 庭强, 廖 雄飞, et al. PlanIQ软件在肺癌自动计划质量评价中的应用研究. 中国医疗设备. 2021;36(6):50–3. [Google Scholar]
- 11.Perumal B, Sundaresan HE, Ranganathan V, et al. Evaluation of plan quality improvements in PlanIQ-guided Autoplanning. Rep Pract Oncol Radiother. 2019;24(6):533–43. doi: 10.1016/j.rpor.2019.08.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Chen KZ, Zheng ZZ, Ding LJ, et al. Systematic quantitative evaluation of Plan-IQ for intensity-modulated radiation therapy after modified radical mastectomy. Sci Rep. 2021;11:21879. doi: 10.1038/s41598-021-01305-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Sasaki M, Nakaguuchi Y, Kamomae T, et al. Analysis of prostate intensity- and volumetric-modulated arc radiation therapy planning quality with PlanIQTM. J Appl Clin Med Phys. 2021;22(4):132–42. doi: 10.1002/acm2.13233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.William, Small, J r, et al. NRG oncology/RTOG consensus guidelines for delineation of clinical target volume for intensity modulated pelvic radiation therapy in postoperative treatment of endometrial and cervical cancer: an update. Int J Radiat Oncol. 2021;109(2):413–24. doi: 10.1016/j.ijrobp.2020.08.061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Indra J, D as, PhD F, et al. State of dose prescription and compliance to international standard (ICRU-83) in intensity modulated radiation therapy among academic institutions. Pract Radiat Oncol. 2017;7(2):e145–55. doi: 10.1016/j.prro.2016.11.003. [DOI] [PubMed] [Google Scholar]
- 16.Bratengeier K, Oechsner M, Gainey M, et al. Remarks on reporting and recording consistent with the ICRU reference dose. Radiat Oncol. 2009;4:44. doi: 10.1186/1748-717X-4-44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Shang HJ, Pu Y, Wang W, et al. Evaluation of plan quality and robustness of IMPT and helical IMRT for cervical cancer. Radiat Oncol. 2020;15(1):34. doi: 10.1186/s13014-020-1483-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Wang ML, Gu H, Hu J, et al. Evaluation of a highly refined prediction model in knowledge-based volumetric modulated arc therapy planning for cervical cancer. Radiat Oncol. 2021;16(1):58. doi: 10.1186/s13014-021-01783-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Richard, Pötter The embrace ii study: the outcome and prospect of two decades of evolution within the gec-estro gyn working group and the embrace studies. Clin Transl Radiat Oncol. 2018;9:48–60. doi: 10.1016/j.ctro.2018.01.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Hodapp N. Der ICRU-report 83: verordnung, dokumentation und kommunikation der fluenzmodulierten photonenstrahlentherapie (IMRT) Strahlenther Onkol. 2012;188(1):97–100. doi: 10.1007/s00066-011-0015-x. [DOI] [PubMed] [Google Scholar]
- 21.Richard D, Pezner Dosimetric comparison of helical tomotherapy treatment and step- and-shoot intensity-modulated radiotherapy of retroperitoneal sarcoma. Radiother Oncol. 2006;81(1):81–7. doi: 10.1016/j.radonc.2006.08.025. [DOI] [PubMed] [Google Scholar]
- 22.Park YK, Park S, Wu HG, et al. A new plan quality index for dose painting radiotherapy. JAppl Clin Med Phys. 2014;15(4):316–25. doi: 10.1120/jacmp.v15i4.4941. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Alexis D, Ian P. A novel index for assessing treatment plan quality in stereotactic radiosurgery. J Neurosurg. 2018;129(Suppl1):118–24. doi: 10.3171/2018.7.GKS18694. [DOI] [PubMed] [Google Scholar]
- 24.Akpati H, Kim C, Kim B, et al. Unified dosimetry index (UDI): a figure of merit for ranking treatment plans. J Appl Clin Med Phys. 2008;9(3):99–108. doi: 10.1120/jacmp.v9i3.2803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Covington EL, Chen XP, Younge KC, et al. Improving treatment plan evaluation with automation. J Appl Clin Med Phys. 2016;17(6):16–31. doi: 10.1120/jacmp.v17i6.6322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Wang JZ, Chen WZ, Studenski M, et al. A semi-automated tool for treatment plan-quality evaluation and clinical trial quality assurance. Phys Med Biol. 2013;58(13):N181–7. doi: 10.1088/0031-9155/58/13/N181. [DOI] [PubMed] [Google Scholar]
- 27.Wang JQ, Hu WG, Yang ZZ, et al. Is it possible for knowledge-based planning to improve intensity modulated radiation therapy plan quality for planners with different planning experiences in left-sided breast cancer patients? Radiat Oncol. 2017;12(1):1–8. doi: 10.1186/s13014-016-0740-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Ford E, Conroy L, Dong L, et al. Strategies for effective physics plan and chart review in radiation therapy: report of AAPM Task Group 275. Med Phys. 2020;47(6):e236–72. doi: 10.1002/mp.14030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Riegel AC, Polvorosa C, Sharma A, et al. Assessing initial plan check efficacy using TG 275 failure modes and incident reporting. J Appl Clin Med Phys. 2022;23(6):e13640. doi: 10.1002/acm2.13640. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.严 华梅, 李 政欢, 王 冬辉, et al. 不同体位对妇科肿瘤调强放射治疗剂量学和急性放射性肠炎的影响. 新医学. 2021;52(12):919–24. [Google Scholar]
- 31.Yvette, Seppenwoolde Importance of training in external beam treatment planning for locally advanced cervix cancer: report from the EMBRACE Ⅱ dummy Run. Radiother Oncol. 2019;133:149–55. doi: 10.1016/j.radonc.2019.01.012. [DOI] [PubMed] [Google Scholar]
- 32.贺 睿敏, 邱 小平, 杨 振, et al. 多重标准计划质量评价系统在直肠癌中的应用. 中国医学物理学杂志. 2018;35(9):1017–21. [Google Scholar]
- 33.吴 秉志, 彭 昭, 闫 永恒, et al. 基于剂量预测的个性化放射治疗计划质量的定量评价方法. 中华放射医学与防护杂志. 2022;42(3):188–93. [Google Scholar]


