Points clés
La vaccination hétérologue avec les vaccins anti-SRAS-CoV-2 BNT162b2 et mRNA-1273 pourrait être en lien avec des taux plus élevés de myopéricardite associée aux vaccins chez les hommes.
La myopéricardite associée aux vaccins anti-SRAS-CoV-2 à ARNm peut, quoique rarement, persister pendant des mois avec des taux élevés de troponine et des anomalies aux épreuves d’imagerie par résonance magnétique cardiaques.
Les traitements par anti-inflammatoires non stéroïdiens et colchicine sont efficaces pour le traitement des symptômes de myopéricardite associée aux vaccins anti-SRAS-CoV-2 à ARNm.
Un homme de 41 ans, par ailleurs en bonne santé et en vacances, a consulté le service des urgences d’un hôpital local pour une douleur persistante en coup de poignard au centre de la poitrine, aggravée à l’inspiration. Il n’a fait état d’aucune maladie récente, ni utilisation de médicaments ou drogues à usage récréatif. Ses seuls antécédents médicaux étaient un syndrome de Gilbert. Quatre mois auparavant, le patient avait reçu le vaccin anti-SRAS-CoV-2 BNT162b2, puis le vaccin mRNA-1273 il y a 2 semaines. L’examen clinique était sans particularités, mais sa troponine I de haute sensibilité (hs) était élevée (1200 ng/L [normale < 45]) et son électrocardiogramme montrait une élévation diffuse du segment ST. Un test PCR (réaction en chaîne par polymérase) de dépistage du SRAS-CoV-2 sur un frottis nasopharyngé était négatif. Compte tenu de la possibilité d’un infarctus aigu du myocarde, il a subi une coronarographie qui s’est révélée normale. L’échocardiogramme transthoracique a montré une fonction cardiaque préservée, sans épanchement péricardique. Le patient a reçu son congé après une hospitalisation de 3 jours avec un diagnostic de myopéricardite associée aux vaccins à ARNm, et un suivi en consultation externe de cardiologie a été planifié. Il n’avait plus de douleur au moment de son congé et aucun médicament ne lui a été prescrit pour la suite.
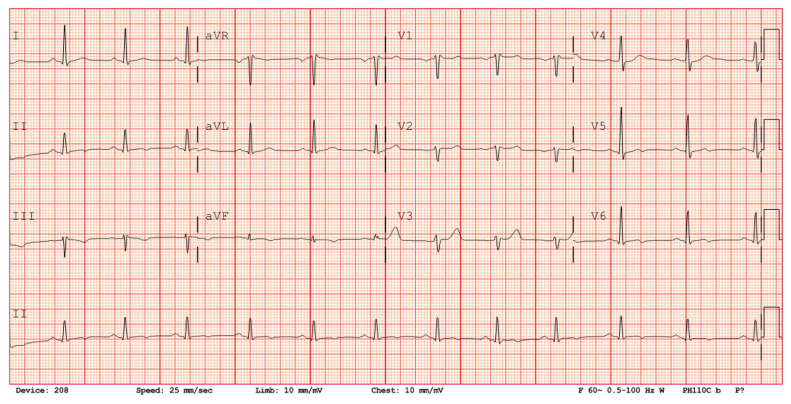
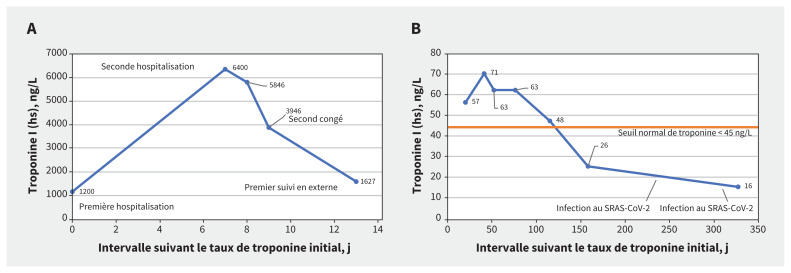
Quatre jours après son congé, de retour à domicile, les douleurs thoraciques se sont intensifiées et il a consulté le service des urgences de notre hôpital pour douleur grave, évaluée à 10 sur une échelle de 10; il la décrivait en coup de poignard du côté gauche, sans irradiation, aggravée à l’inspiration et inchangée au repos. Sa tension artérielle était à 121/83 mm Hg; sa fréquence cardiaque à 75 battements/min et régulière et l’examen cardiovasculaire était normal. Il ne présentait aucun râle à l’auscultation. La radiographie thoracique était normale. L’électrocardiogramme montrait un rythme sinusal, sans trouble de la conduction, et des modifications limites de l’onde T inférieure, sans déviation du segment ST (figure 1). Les analyses sanguines ont révélé une élévation de la troponine I de haute sensibilité (6400 ng/L; normale < 20 ng/L avec la trousse Beckman Coulter), un taux de peptide natriurétique de type B de 30 ng/L (normale < 100) et un taux de protéine C réactive de 3,7 mg/L (normale < 8,0) (figure 2A). Sa créatinine sérique était normale.
Figure 1:
Électrocardiogramme d’un homme de 41 ans à son arrivée à notre hôpital; on voit un rythme sinusal et des anomalies de l’onde T inféroapicales non spécifiques sans déviation du segment ST.
Figure 2:
Tendance temporelle des taux de troponine I de haute sensibilité (hs) aux semaines (A) 1 et 2 (congé au jour 13) et (B) 3–45 suivant la première hospitalisation.
Nous avons admis le patient au service de cardiologie avec un diagnostic de myopéricardite associée aux vaccins à ARNm. Le score à l’algorithme de Naranjo (probabilité de réaction médicamenteuse indésirable) était à 7, témoignant d’une probable réaction indésirable aux vaccins anti-SRAS-CoV-2. Nous avons envisagé d’autres causes de myopéricardite, mais les avons jugées improbables. Par exemple, étant donné l’absence de symptômes infectieux, nous ne l’avons pas cru atteint d’une myocardite virale et n’avons pas demandé d’analyses sérologiques en raison de leur piètre utilité. Nous avons estimé peu probable une cause auto-immune comme la sarcoïdose, car il ne présentait pas de graves tachyarythmies, de bloc cardiaque ou d’insuffisance cardiaque, et sa radiographie thoracique normale. En outre, le patient ne présentait aucun signe clinique de maladie systémique, et n’avait utilisé aucun médicament ni aucune drogue à usage récréatif associés à la myopéricardite.
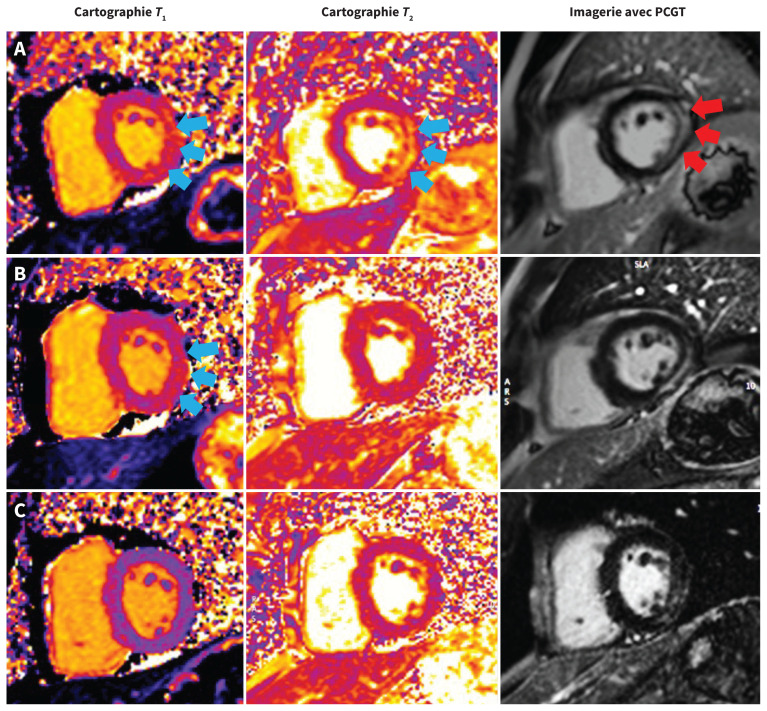
Nous l’avons traité au moyen d’acide acétylsalicylique (650 mg, 4 fois/j) et de colchicine (0,6 mg, 2 fois/j). L’imagerie par résonance magnétique (IRM) cardiaque au jour 3 de l’hospitalisation a montré une fonction cardiaque préservée, une fraction d’éjection ventriculaire gauche à 63 %, un œdème myocardique et une prise tardive du gadolinium non ischémique à la partie hémipariétale et sous-épicardique de la paroi inférolatérale concordant avec une myocardite aiguë (figure 3A). Nous lui avons donné son congé après cette épreuve d’imagerie; il ne présentait pas de douleur thoracique et son taux de troponine I de haute sensibilité était à 3946 ng/L.
Figure 3:
Imagerie par résonance magnétique cardiaque chez un homme de 41 ans atteint de myocardite. (A) Clichés de l’axe court oblique montrant un œdème de la paroi inférolatérale en T1 et T2 (flèches bleues) (T1 = 1083 ms [plage normale 950–1050 ms] et T2 = 71 ms [normale < 57 ms]) et à l’imagerie avec prise tardive de l’agent de contraste gadolinium (PCGT) (flèches rouges) durant l’hospitalisation. (B) Œdème myocardique persistant à la paroi inférolatérale en T1 (flèches bleues), mais non en T2 après 2 mois (T1 = 1080 ms; T2 = 48 ms). (C) Œdème myocardique résolu en T1 et en T2 après 6 mois (T1 = 1010 ms; T2 = 46 ms). Tous les clichés ont été acquis au moyen du même appareil d’IRM 1.5 T (Aera, Siemens Healthineers).
Après son congé, nous lui avons prescrit 3 mois de colchicine et une dose décroissante d’acide acétylsalicylique (réduction de 650 mg/j par semaine échelonnée sur 4 semaines). Malgré sa bonne observance thérapeutique, il a présenté d’occasionnelles douleurs thoraciques légères et ses taux de troponine sont demeurés élevés, quoique beaucoup moins qu’à l’admission (> 45 ng/L selon le dosage de Siemens) (figure 2B). Une IRM cardiaque 3 mois après son deuxième vaccin anti-SRAS-CoV-2 a montré une fonction ventriculaire gauche normale, une fraction d’éjection ventriculaire gauche de 63 % et une amélioration de l’œdème myocardique de la paroi inférolatérale, sans nouvelle prise tardive du gadolinium (figure 3B). Nous avons commencé un traitement de 6 semaines par naproxène (500 mg, 2 fois/j), et prolongé la colchicine 3 mois de plus. Au bout de 3 mois, ses symptômes de douleur thoracique avaient complètement disparu et son taux de troponine I de haute sensibilité était normal (figure 2B). Une IRM cardiaque de suivi a montré une fonction cardiaque préservée, avec résolution de l’œdème myocardique (figure 3C). Il a présenté 2 épisodes de maladie des voies respiratoires supérieures, 1 an, puis 14 mois après son premier vaccin anti-SRAS-CoV-2 et s’est révélé positif à l’égard du SRAS-CoV-2 lors de tests antigéniques rapides à domicile dans les 2 cas (présumés associés au variant Omicron). Il ne s’est toutefois plaint d’aucun symptôme cardiaque et la reprise du test de troponine I de haute sensibilité s’est révélée normale (figure 2B).
Un an après sa consultation initiale, il se sent bien et n’a reçu aucune autre dose de vaccin anti-SRAS-CoV-2.
Discussion
La myopéricardite, la myocardite et la péricardite sont de rares complications des vaccins anti-SRAS-CoV-2 à ARNm. Selon les Centres pour le contrôle et la prévention des maladies des États-Unis, 1226 cas probables ont été déclarés sur environ 300 millions de doses de vaccins anti-SRAS-CoV-2 à ARNm administrées en date du 11 juin 20211. Une revue systématique a révélé que la myocardite associée aux vaccins à ARNm survient en général dans la semaine suivant la vaccination et est plus courante après une deuxième dose2. Une étude de cohorte menée dans la population de la Colombie-Britannique a démontré que le risque est plus élevé chez les adolescents et les jeunes adultes de sexe masculin (de 12–29 ans) que chez les patients plus âgés et chez les femmes, et après l’administration du vaccin mRNA-1273 plutôt que BNT162b23. En outre, une récente étude de cohorte scandinave regroupant plus de 23 millions de participants a révélé qu’une vaccination hétérologue par BNT162b2 et mRNA-1273 était associée à 1,43 myocardite par 1000 années-personnes chez les hommes, ce qui est 2 fois plus élevé que lors d’une vaccination homologue par mRNA-1273 et 8 fois plus élevé que lors d’une vaccination homologue par BNT162b24. Notre patient a reçu le vaccin BNT162b2 suivi du vaccin mRNA-1273; la myopéricardite a été diagnostiquée 2 semaines après le deuxième vaccin. Il faut obtenir d’autres données au sujet du risque de la vaccination hétérologue, particulièrement chez les femmes.
Un aspect inhabituel de ce cas clinique est la persistance de la myocardite subaiguë, de la hausse des taux de troponine sérique et des anomalies à l’IRM cardiaque jusqu’à 4 mois après la vaccination. Chez les patients atteints de myocardite virale, l’inflammation myocardique est causée par une atteinte virale directe et est plus apparente à l’IRM cardiaque dans les 2 semaines qui suivent le déclenchement des symptômes5. Toutefois, on connaît mal l’évolution et la cause de la myocardite associée aux vaccins à ARNm. À notre connaissance, aucun cas d’élévation persistante de la troponine et d’œdème myocardique à l’imagerie n’avait encore été décrit. Une hypothèse qui sous-tend la myopéricardite associée aux vaccins est que la protéine S et ses dérivés sont potentiellement pro-inflammatoires6. En effet, les exomes circulants qui renferment la protéine S, et des anticorps dirigés contre la protéine S du SRAS-CoV-2 peuvent être détectés dans le plasma humain 4 mois après un vaccin à ARNm7. La myocardite persistante de notre patient peut avoir découlé d’une réaction auto-immune prolongée aux complexes formés avec la protéine S. L’absence de lésions myocardiques apparentes après ses infections subséquentes à SRAS-CoV-2 pourrait s’expliquer pas des variations de séquence du gène de la protéine S associées au variant Omicron du SRAS-CoV-28 ou par une élimination rapide des peptides viraux. Même s’il est impossible d’exclure la myopéricardite extrahospitalière, il s’agit d’une hypothèse peu probable en raison de l’absence de symptômes infectieux chez ce patient durant son épisode initial et du lien temporel avec sa deuxième dose de vaccin à ARNm. En outre, son score de 7 à l’algorithme de Naranjo concorde avec une probable réaction médicamenteuse indésirable.
Le traitement de la myocardite associée aux vaccins à ARNm repose habituellement sur des mesures de soutien; une consultation en cardiologie peut être envisagée. Les symptômes de péricardite sont traités au moyen d’anti-inflammatoires non stéroïdiens, de colchicine ou des deux. Il faut conseiller à la patientèle d’éviter toute activité physique exigeante et les sports compétitifs pendant 3–6 mois; les prestataires de soins de santé devraient par la suite documenter la résolution complète des symptômes et les anomalies diagnostiques avant un retour au jeu1,9.
Le Comité consultatif national de l’immunisation (CCNI) déconseille toute vaccination anti-SRAS-CoV-2 subséquente chez les personnes qui ont présenté une myocardite ou une myopéricardite associée aux vaccins10. Si, après une évaluation du risque, on décide d’en administrer une autre dose, le CCNI recommande d’attendre que l’épisode de myocardite soit entièrement résolu10.
Il faudra approfondir la recherche sur l’issue à long terme de la myocardite associée aux vaccins à ARNm, mais le pronostic à court terme chez les patients adolescents et adultes ayant souffert de myocardite associée aux vaccins à ARNm a été favorable11,12. Par exemple, chez 13 patients atteints de myocardite associée aux vaccins, la prise tardive du gadolinium myocardique à l’IRM cardiaque a diminué, la fraction d’éjection s’est normalisée et aucun événement cardiaque indésirable n’est survenu après un suivi médian de 159 jours12. Notre patient a aussi présenté une fonction cardiaque normale lors de l’épreuve d’imagerie cardiaque de suivi et n’a connu aucun incident cardiaque après la résolution de sa myopéricardite. Toutefois, il a eu besoin d’un traitement antiinflammatoire prolongé en raison de la persistance des symptômes et de la myocardite lors des tests en série.
Voir la version anglaise de l’article ici: www.cmaj.ca/lookup/doi/10.1503/cmaj.221510
Footnotes
Intérêts concurrents: Ian Paterson déclare avoir reçu des honoraires de conférencier des sociétés Pfizer Canada et AstraZeneca. Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Les auteurs ont obtenu le consentement du patient.
Collaborateurs: Tous les auteurs ont contribué à l’élaboration et à la conception du travail. Kai Wu et Ian Paterson ont rédigé l’ébauche du manuscrit. Tous les auteurs ont révisé de façon critique son contenu intellectuel important, ont donné leur approbation finale pour la version destinée à être publiée et assument l’entière responsabilité de tous les aspects du travail.
Références
- 1.Bozkurt B, Kamat I, Hotez PJ. Myocarditis with COVID-19 mRNA vaccines. Circulation 2021;144:471–84. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Pillay J, Gaudet L, Wingert A, et al. Incidence, risk factors, natural history, and hypothesised mechanisms of myocarditis and pericarditis following COVID-19 vaccination: living evidence syntheses and review. BMJ 2022;378:e069445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Naveed Z, Li J, Spencer M, et al. Observed versus expected rates of myocarditis after SARS-CoV-2 vaccination: a population-based cohort study. CMAJ 2022;194:E1529–36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Karlstad Ø, Hovi P, Husby A, et al. SARS-CoV-2 vaccination and myocarditis in a Nordic cohort study of 23 million residents. JAMA Cardiol 2022;7:600–12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lurz P, Luecke C, Eitel I, et al. Comprehensive cardiac magnetic resonance imaging in patients with suspected myocarditis: the MyoRacer-trial. J Am Coll Cardiol 2016;67:1800–11. [DOI] [PubMed] [Google Scholar]
- 6.Trougakos IP, Terpos E, Alexopoulos H, et al. Adverse effects of COVID-19 mRNA vaccines: the spike hypothesis. Trends Mol Med 2022;28:542–54. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Bansal S, Perincheri S, Fleming T, et al. Cutting edge: circulating exosomes with COVID spike protein are induced by BNT162b2 (Pfizer-BioNTech) vaccination prior to development of antibodies: a novel mechanism for immune activation by mRNA vaccines. J Immunol 2021;207:2405–10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ou J, Lan W, Wu X, et al. Tracking SARS-CoV-2 Omicron diverse spike gene mutations identifies multiple inter-variant recombination events. Signal Transduct Target Ther 2022;7:138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.McKinney J, Connelly KA, Dorian P, et al. COVID-19-myocarditis and return to play: reflections and recommendations from a Canadian working group. Can J Cardiol 2021;37:1165–74. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.COVID-19 vaccine: Canadian Immunization Guide. Ottawa: Public Health Agency of Canada; modifié le 2 févr. 2023. Accessible ici: https://www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-part-4-active-vaccines/page-26-covid-19-vaccine.html#a10.4 (consulté le 4 janv. 2023). [Google Scholar]
- 11.Schauer J, Buddhe S, Gulhane A, et al. Persistent cardiac magnetic resonance imaging findings in a cohort of adolescents with post-coronavirus disease 2019 mRNA vaccine myopericarditis. J Pediatr 2022;245:233–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Fronza M, Thavendiranathan P, Karur GR, et al. Cardiac MRI and clinical follow-up in COVID-19 vaccine-associated myocarditis. Radiology 2022;304:E48–9. [DOI] [PMC free article] [PubMed] [Google Scholar]