Abstract
Wir berichten über den Fall eines atypischen Therapieverlaufs bei amyopathischer MDA5-Antikörper-positiver Dermatomyositis mit Lungenbeteiligung. Aufgrund der schlechten Prognose erfolgte initial neben der Gabe von Prednisolon die frühzeitige Therapie mit Cyclophosphamid, gefolgt von Rituximab. Aufgrund des Therapieversagens erfolgte die Umstellung der Basistherapie auf Mycophenolat-Mofetil. Hierunter zeigte sich ein überraschend rascher positiver Verlauf bezüglich der Lungenveränderungen, der Hautveränderungen und der allgemeinen Krankheitsaktivität.
Schlüsselwörter: Interdisziplinär, Idiopathische inflammatorische Myopathie, Interstitielle Lungenveränderungen, Cyclophosphamid, Mycophenolat-Mofetil
Abstract
We report a case of an atypical course of therapy in amyopathic MDA5-antibody-positive dermatomyositis with interstitial lung disease. Due to the poor prognosis, early therapy with cyclophosphamide followed by rituximab was carried out initially in addition to the administration of prednisolone. Due to therapy failure, treatment was switched to mycophenolate mofetil. This showed a surprisingly rapid positive course in terms of interstitial lung disease, skin manifestation, and general disease activity.
Keywords: Interdisciplinary, Idiopathic inflammatory myopathy, Interstitial lung disease, Cyclophosphamide, Mycophenolate mofetil
Anamnese
Im November 2020 erfolgte die erstmalige Vorstellung einer 50-jährigen Patientin. Vorbekannt war ein effektiv therapierter Morbus Basedow und eine rezidivierende AV-Knoten-Reentry-Tachykardie (AVNRT) mit klinisch erfolgreicher Ablation. Die Patientin gab an, nie geraucht zu haben.
Befund
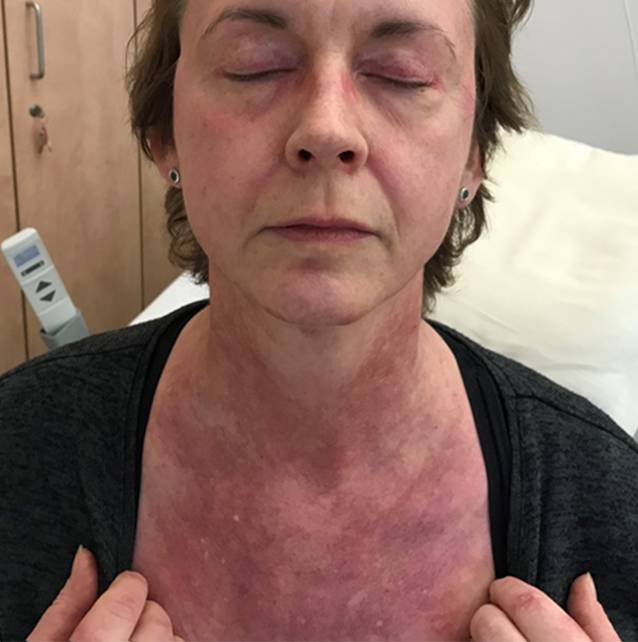
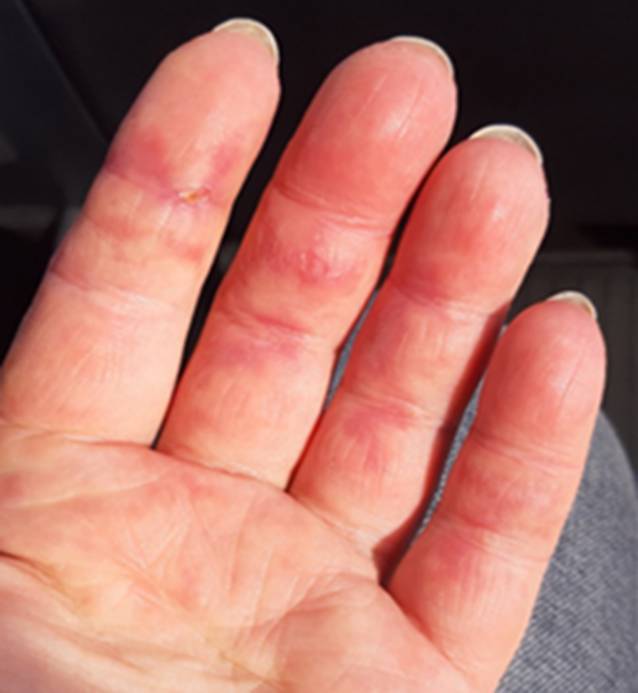
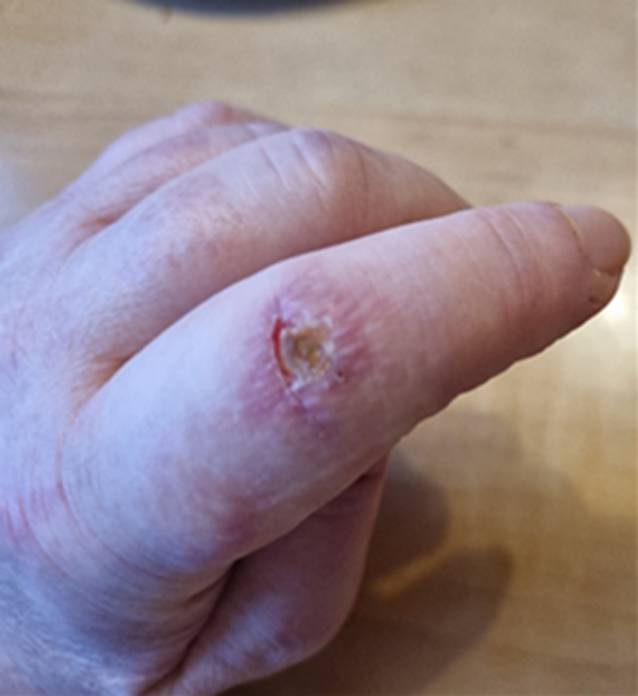
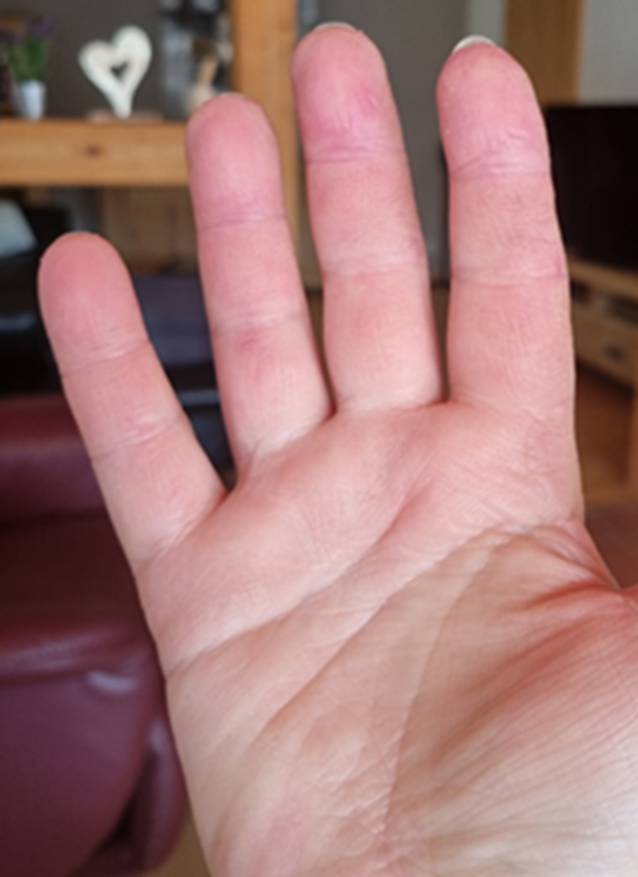
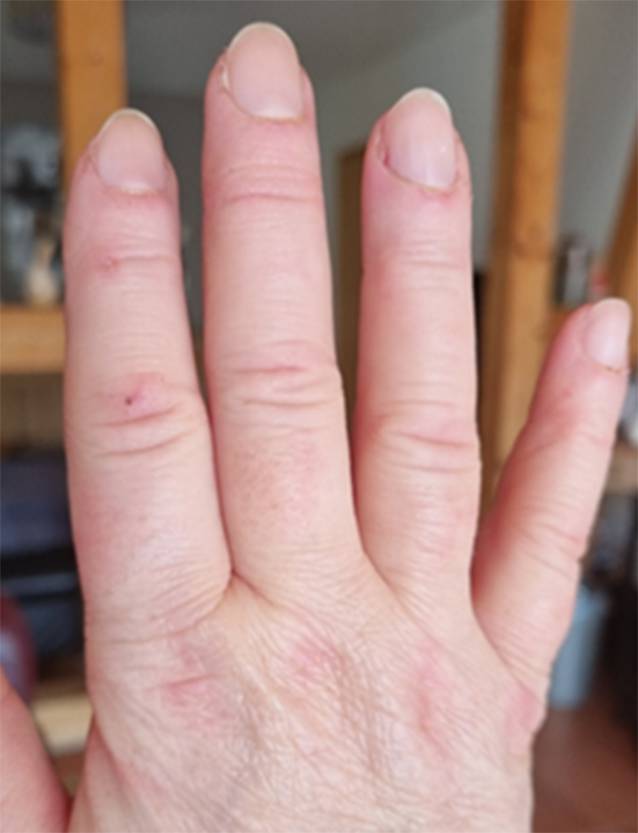
Seit 8 Wochen bestanden rasch progrediente Hautveränderungen im Sinne eines Erythems im Bereich des Dekolletés mit Juckreiz, rötlich-lividen Hautveränderungen im Bereich der Streck-/und Beugeseiten mehrerer Finger sowie papulösen Veränderungen der Handinnenflächen (Abb. 1, 2 und 3). Klinisch zeigten sich orale Aphthen, Arthralgien der Handgelenke beidseits, rezidivierendes Fieber bis 39 °C und ein ungewollter Gewichtsverlust von 5 kg in 6 Wochen sowie eine neu aufgetretene Belastungsdyspnoe.
Diagnose
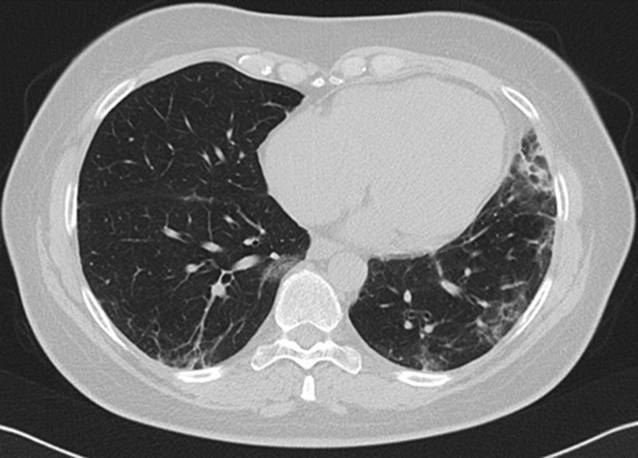
Laborchemisch bestanden keine relevant erhöhten Entzündungszeichen und normale Werte der Kreatinkinasen (CK). Es erfolgte eine umfangreiche Diagnostik ohne Hinweis auf eine infektiöse oder maligne Genese der Symptomatik. Initial zeigten sich in der Computertomographie (CT) des Thorax beginnende subpleural, peribronchial und basal betonte Konsolidierungen (Abb. 4). Lungenfunktionell zeigten sich eine restriktive Ventilationsstörung und eine Diffusionsstörung (Tab. 1). In der erweiterten Labordiagnostik ergaben sich der Nachweis von antinukleären Antikörpern (ANA) mit einem Titer von 1:100, positive Anti-Ro-52-Antikörper sowie gegen das Melanom-Differenzierungsantigen 5 gerichtete Antikörper (Anti-MDA5-Antikörper). Hinweise auf ein Sjögren-Syndrom wie eine Sicca-Symptomatik oder ein positiver Schirmer-Test bestanden zu diesem Zeitpunkt nicht. Wir stellten die Diagnose einer amyopathischen MDA5-positiven Dermatomyositis.

| FVCex | TLC | FEV1/FVC | FEV1 | TGV | RV | TLco | Kco | |
|---|---|---|---|---|---|---|---|---|
|
11/2020 (A) |
2,5 l (66 %) | 4,5 l (83 %) | 77 % (89 %) | – | – | 1,8 l (96 %) | – | – |
|
01/2022 (B) |
2,5 l (66 %) | 4,1 l (76 %) | 75 % (95 %) | 1,9 l (64 %) | 2,2 l (79 %) | 1,6 l (85 %) | 47 % | 76 % |
|
03/2022 (C) |
2,7l (72 %) | 4,1l (76 %) | 77 % (97 %) | 2,1 l (70 %) | 2,3 l (81 %) | 1,4 l (74 %) | 50 % | 73 % |
|
06/2022 (D) |
2,8 l (74 %) | 5,0 l (91 %) | 77 % (97 %) | 2,2 l (74 %) | 3,2 l (111 %) | 2,1 l (110 %) | 56 % | 77 % |
FVCex forcierte exspiratorische Vitalkapazität, TLC totale Lungenkapazität, FEV1 Einsekundenkapazität, TGV thorakales Gasvolumen, RV Residualvolumen, TLco Kohlenmonoxid-Transferfaktor, Diffusionskapazität Kco Transferkoeffizient
Therapie und Verlauf
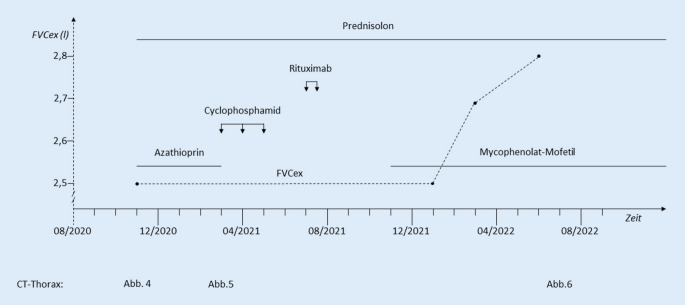
Es erfolgte eine Therapie mit Prednisolon (1 mg/kgKG) und Azathioprin (150 mg/Tag) über 4 Monate. Unter der Predisolon-Reduktion bis 20 mg/Tag zeigten sich rezidivierende Gottron-Papeln, ein erneutes heliotropes Exanthem sowie eine beginnende Muskelschwäche der proximalen Extremitäten. Bei klinisch deutlich progredienter Belastungsdyspnoe und auskultatorischem Knisterrasseln zeigten sich im CT-Thorax ebenfalls progrediente Konsolidierungen, sodass eine Therapie mit Cyclophosphamid (dreimalige Gabe von 1000 mg) erfolgte (Abb. 5). Die geplante Gabe von 6 Infusionen à 1000 mg Cyclophosphamid wurde aufgrund der rasch progredienten Verschlechterung der respiratorischen und kutanen Manifestationen somit zugunsten eines Wechsels der Therapiestrategie unterbrochen. Bei einem Therapieversagen von Cyclophosphamid und weiter progredienter Lungenbeteiligung in der CT nach 4 Monaten erfolgte eine zweimalige Gabe von 1000 mg Rituximab (im Abstand von 2 Wochen). Nach einem weiteren Intervall von 4 Monaten war keine Prednisolon-Reduktion unter eine Tagesdosis von 30 mg möglich. Es erfolgte bei weiter progredienter Belastungsdyspnoe eine Umstellung der Basistherapie auf Mycophenolat-Mofetil (MMF), 2 g/Tag.
Erstmalig war es nach 3 Monaten unter der Therapie mit MMF zu einer klinischen Besserung gekommen. Sowohl die Hautveränderungen als auch die Arthralgien/Myalgien und die Belastungsdyspnoe zeigten sich deutlich gebessert (Abb. 6 und 7). Zu Fieberschüben ist es nicht mehr gekommen. Nach 5 Monaten war eine Dosisreduktion der Prednisolon-Therapie auf 7,5 mg/Tag möglich.
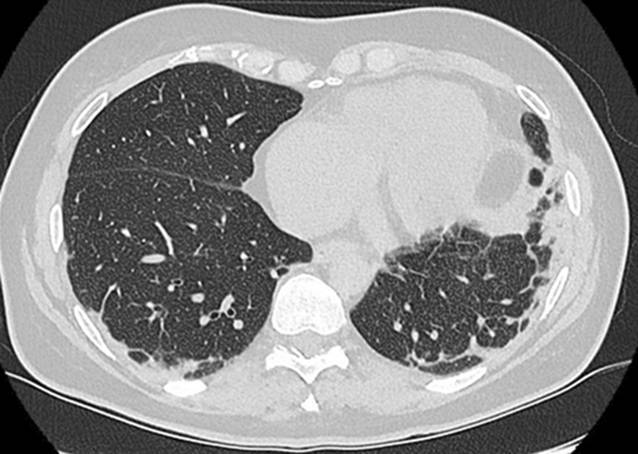
In der Computertomographie (CT) des Thorax zeigte sich nach 8 Monaten Therapie mit MMF eine Größenregredienz der subpleural, peribronchial und basal betonten Konsolidierungen (Abb. 8). Lungenfunktionell zeigte sich im Verlauf von 6 Monaten eine Besserung der restriktiven Ventilationsstörung sowie der Diffusionsstörung (Tab. 1). Somit konnte ein positiver Verlauf unter MMF bei therapierefraktärer MDA5-assoziierter Dermatomyositis mit rasch progredienter Lungenbeteiligung gezeigt werden (Abb. 9).
Diskussion
Die interstitiellen Lungenveränderungen bei amyopathischer MDA5-Antikörper-positiver Dermatomyositis bestimmen maßgeblich die Morbidität und die Mortalität dieser Patientengruppe [1]. Aufgrund der Seltenheit der Erkrankung ist die Evidenz zur Etablierung von Handlungsempfehlungen begrenzt. Die in der Literatur beschriebene 6‑Monats-Überlebensrate liegt bei 40 % [2]. Aufgrund der hohen Mortalität wird häufig auch eine aggressive Kombination von immunmodulierenden Therapien eingesetzt [1]. Die Therapie mit MMF in Kombination mit Prednisolon tritt somit bei den Therapieoptionen häufig in den Hintergrund. Einige Fallberichte beschreiben eine Verbesserung der interstitiellen Lungenveränderungen unter der Therapie mit Rituximab nach Versagen anderer immunsuppressiver Therapien wie Cyclophosphamid [3, 4]. Dieser Verlauf ließ sich in unserem Fall nicht bestätigen. Der positive Effekt der Therapie mit MMF konnte allerdings in anderen Fallberichten auch in der Erstlinientherapie bestätigt werden [5].
In der Literatur konnte ein positiver Nutzen eines kombinierten Therapieschemas aus hoch dosierten systemischen Glukokortikoiden und anderen Immunsuppressiva wie Calcineurin-Inhibitoren und/oder Cyclophosphamid gezeigt werden [6]. In dem von uns berichteten Fall wurde zum Zeitpunkt der Therapie mit Cyclophosphamid von einer Ergänzung der Therapie um einen Calcineurin-Inhibitor aufgrund der möglichen unerwünschten Nebenwirkung einer zeitgleichen Medikation und der bestehenden Therapiealternativen vorerst abgesehen.
In unserem Fall erfolgte eine sequenzielle Therapie. Dennoch wäre auch ein verzögertes Therapieansprechen auf Rituximab und somit eventuell auch eine synergistische Wirkung von Rituximab und MMF möglich. [7].
Auch wenn die Literatur weitere vielversprechende Therapieoption mit neuen Substanzen wie JAK-Inhibitoren (z. B. Tofacitinib) bietet [8], sollte MMF in die Entscheidung des individualisierten Therapieregimes von Patienten mit MDA5-positiver Dermatomyositis mit Lungenbeteiligung eingeschlossen werden.
Fazit für die Praxis
Mycophenolat-Mofetil stellt eine relevante Therapiealternative bei therapierefraktärer amyopathischer MDA5-positiver Dermatomyositis mit Lungenbeteiligung dar.
Funding
Open Access funding enabled and organized by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
F. Schumacher, M. Wollsching-Strobel, D. Kroppen, S.B. Schwarz, J. Strunk, W. Windisch und M. Berger geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien. Für Bildmaterial oder anderweitige Angaben innerhalb des Manuskripts, über die Patient/-innen zu identifizieren sind, liegt von ihnen und/oder ihren gesetzlichen Vertretern/Vertreterinnen eine schriftliche Einwilligung vor.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Lundberg IE, Fujimoto M, Vencovsky J, et al. Idiopathic inflammatory myopathies. Nat Rev Dis Primers. 2021;7(1):86. doi: 10.1038/s41572-021-00321-x. [DOI] [PubMed] [Google Scholar]
- 2.Ye S, Chen X, Lu X, et al. Adult clinically amyopathic dermatomyositis with rapid progressive interstitial lung disease: a retrospective cohort study. Clin Rheumatol. 2007;26(10):1647–1654. doi: 10.1007/s10067-007-0562-9. [DOI] [PubMed] [Google Scholar]
- 3.Koichi Y, Aya Y, Megumi U, et al. A case of anti-MDA5-positive rapidly progressive interstitial lung disease in a patient with clinically amyopathic dermatomyositis ameliorated by rituximab, in addition to standard immunosuppressive treatment. Mod Rheumatol. 2017;27(3):536–540. doi: 10.3109/14397595.2015.1014140. [DOI] [PubMed] [Google Scholar]
- 4.So H, Wong VTL, Lao VWN, Pang HT, Yip RML. Rituximab for refractory rapidly progressive interstitial lung disease related to anti-MDA5 antibody-positive amyopathic dermatomyositis. Clin Rheumatol. 2018;37(7):1983–1989. doi: 10.1007/s10067-018-4122-2. [DOI] [PubMed] [Google Scholar]
- 5.Parperis K, Kiyani A. Clinically amyopathic dermatomyositis associated with anti-MDA5 antibody. BMJ Case Rep. 2018 doi: 10.1136/bcr-2017-222060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.McPherson M, Economidou S, Liampas A, Zis P, Parperis K. Management of MDA-5 antibody positive clinically amyopathic dermatomyositis associated interstitial lung disease: a systematic review. Semin Arthritis Rheum. 2022;53:151959. doi: 10.1016/j.semarthrit.2022.151959. [DOI] [PubMed] [Google Scholar]
- 7.Hisanaga J, Kotani T, Fujiki Y, Yoshida S, Takeuchi T, Makino S. Successful multi-target therapy including rituximab and mycophenolate mofetil in anti-melanoma differentiation-associated gene 5 antibody-positive rapidly progressive interstitial lung disease with clinically amyopathic dermatomyositis. Int J Rheum Dis. 2017;20(12):2182–2185. doi: 10.1111/1756-185X.13136. [DOI] [PubMed] [Google Scholar]
- 8.Chen Z, Wang X, Ye S. Tofacitinib in amyopathic dermatomyositis-associated interstitial lung disease. N Engl J Med. 2019;381(3):291–293. doi: 10.1056/NEJMc1900045. [DOI] [PubMed] [Google Scholar]