Abstract
目的
探讨脑络欣通(NLXTD)含药血清对氧糖剥夺/再灌注(OGD/R)大鼠脑微血管内皮细胞(BMECs)焦亡及血管新生的影响和可能作用机制。
方法
BMECs体外培养,分别经OGD/R诱导、NLXTD含药血清处理及siRNA转染caspase-1,设置Control组:BMECs+10%空白血清;OGD/R组:BMECs+OGD/R+10%空白血清;NLXTD组:BMECs+OGD/R+10% NLXTD含药血清;siRNA-NC组:BMECs转染siRNA-NC+OGD/R+10%空白血清;si-caspase-1组:BMECs转染si-caspase-1+OGD/R+10%空白血清;si-caspase-1+NLXTD组:BMECs转染si-caspase-1+OGD/R+10%NLXTD含药血清。采用CCK-8法、Transwell小室实验、管腔形成实验分别检测细胞增殖、迁移、成管能力;试剂盒测定上清液中乳酸脱氢酶(LDH)活性;ELISA法检测培养液中炎性因子IL-1β、IL-18的含量;Western blot检测细胞焦亡相关蛋白pro-caspase-1、caspase-1、NLRP3、Gasdermin D及血管生成关键蛋白VEGF,VEGFR2的表达。
结果
BMECs经OGD/R诱导后出现明显的损伤;与OGD/R组比较,10%的NLXTD含药血清能显著提高OGD/R损伤BMECs的存活率、迁移能力及成管能力(P < 0.01),降低IL-1β、IL-18的含量以及LDH的释放(P < 0.01);Western blot实验结果显示,NLXTD含药血清可上调OGD/R损伤BMECs的VEGF和VEGFR2蛋白表达(P < 0.01),并降低pro-caspase-1、caspase-1、NLRP3、Gasdermin D的蛋白表达(P < 0.01),加入caspase-1 siRNA后,能进一步促进VEGFR2蛋白表达(P < 0.01)。
结论
NLXTD可以提高OGD/R损伤后的BMECs增殖、迁移、成管能力,促进血管新生,其机制可能与抑制细胞焦亡caspase-1/Gasdermin D通路,减轻BMECs损伤,上调VEGF、VEGFR2水平有关。
Keywords: 脑络欣通, 脑微血管内皮细胞, 氧糖剥夺/再灌注, 血管新生, 细胞焦亡, 血管内皮生长因子
Abstract
Objective
To investigate the effects of Naoluo Xintong Decoction (NLXTD) on pyroptosis and angiogenesis of brain microvascular endothelial cells (BMECs) and explore the possible mechanisms in rats with oxygen-glucose deprivation/ reperfusion (OGD/R).
Methods
Rat BMECs with or without caspase-1 siRNA transfection were cultured in the presence of 10% medicated serum from NLXTD-treated rats (or blank serum) and exposed to OGD/R. CCK-8 assay, Transwell chamber assay, and tube formation assay were used to assess proliferation, migration, and tube-forming abilities of the cells. The activity of lactate dehydrogenase (LDH) in the culture supernatant was determined using a commercial assay kit, and the levels of inflammatory factors IL-1β and IL-18 were detected with ELISA. The cellular expressions of pro-caspase-1, caspase-1, NLRP3, Gasdermin D, and angiogenesis-related proteins VEGF and VEGFR2 were detected using Western blotting.
Results
The BMECs showed obvious injuries after OGD/R exposure. Compared with the blank serum, the medicated serum significantly improved the cell viability, migration ability, and lumen-forming ability (P < 0.01) and lowered the levels of IL-1β and IL-18 and the LDH release (P < 0.01) of the cells with OGD/R exposure. Western blotting showed that in the BMECs exposed to OGD/R, the medicated serum strongly upregulated the expression of VEGF and VEGFR2 proteins (P < 0.01) and reduced the protein expressions of pro-caspase-1, caspase-1, NLRP3, and Gasdermin D (P < 0.01), and transfection of the cells with caspase-1 siRNA further promoted the expressions of VEGFR2 protein in the cells (P < 0.01).
Conclusion
NLXTD can improve the proliferation, migration, and tube- forming ability and promote angiogenesis of BMECs with OGD/R injury probably by inhibiting the caspase-1/Gasdermin D pathway in pyroptosis, alleviating cell injury, and upregulating the expressions of VEGF and VEGFR2.
Keywords: Naoluo Xintong Decoction, brain microvascular endothelial cells, oxygen-glucose deprivation/reperfusion, angiogenesis, pyroptosis, vascular endothelial growth factor
《中国卒中报告2020》[1]指出:我国卒中(Stroke)的粗死亡率呈持续上升趋势,且上升速度高于全球其他国家,严重危害到民众的身心健康,其中缺血性脑卒中(IS)发生率远高于出血性脑卒中,约占82.6%。目前,IS的首选治疗策略是通过手术取栓或药物溶栓尽快恢复缺血组织的血液循环和营养支持,但再灌注会带来脑组织的二次损伤,即脑缺血再灌注损伤(CIRI)[2]。CIRI的发生涉及多种病理机制,包括氧化应激、炎症反应、钙超载、神经元自噬、凋亡等,以及神经元、血管内皮细胞、胶质细胞等多种细胞的参与[3]。研究发现,再灌注引起血管内皮细胞结构损伤和功能异常,包括旁分泌功能紊乱、炎症因子激活、黏附分子增多、血脑屏障破坏等,导致内皮细胞死亡、血管形成障碍,贯穿于IS继发性损伤的全过程[4, 5]。因此,血管内皮细胞成为干预CIRI的重要靶点。
细胞焦亡是近年来发现的一种依赖于胱天蛋白酶介导的促炎性细胞死亡方式[6]。研究表明,CIRI可通过caspase-1/Gasdermin D信号通路诱导脑微血管内皮细胞(BMECs)发生焦亡,释放炎症因子白细胞介素-1β(IL- 1β),导致细胞活力降低、造成缺血损伤[7]。另外在缺血性疾病中发现,抑制内皮细胞发生焦亡,可以促进内皮细胞存活、血管新生,改善缺血预后[8]。因此,通过干预BMECs焦亡信号通路,促进血管内皮细胞存活和血管生成,可能成为治疗脑缺血的新方向。课题组前期研究发现[9, 10],脑络欣通(NLXTD)能减轻CIRI引起的炎症反应、细胞凋亡,并能上调脑梗死大鼠缺血半暗带CD34和BrdU阳性细胞率以及血管内皮生长因子(VEGF)表达,增加微血管密度,促进血管新生,但其具体机制尚不清晰。本研究旨在观察NLXTD含药血清对氧糖剥夺/ 再灌注(OGD/R)损伤后BMECs焦亡发生及其对血管新生的影响,并探讨其可能作用机制。
1. 材料和方法
1.1. 材料
1.1.1. 细胞株和动物
大鼠BMECs购自赛百慷(上海)生物技术股份有限公司。20只雄性SD大鼠,SPF级,3~ 4月龄,体质量250~280 g,购于辽宁长生生物技术股份有限公司,许可证号:SCXK (辽) 2020-0001,饲养在安徽中医药大学新安医学教育部重点实验室动物中心,室内温度22±1℃、相对湿度(45±5)%,明暗循环12 h/12 h。大鼠分笼喂养,自由摄食饮水。本实验经安徽中医药大学动物管理与伦理委员会批准(编号:AHUCM-rats-2022028)。
1.1.2. 药物
NLXTD由黄芪30 g、川芎10 g、三七6 g、天麻10 g、蜈蚣2条、红花10 g、当归10 g组成,药材均购自安徽中医药大学第一附属医院。药物常规煎煮两次,合并两次过滤药液,浓缩至含生药量0.5 g/mL,于4 ℃冰箱保存备用。
1.1.3. 试剂
内皮细胞完全培养基(赛百慷(上海)生物技术股份有限公司),DMEM高糖培养基(HyClone),Opti-MEM、CCK-8试剂盒(北京博奥森生物),胎牛血清(FBS)(Invitrogen),青霉素-链霉素溶液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),Matrigel基质胶(BD)、LipofectamineTM2000转染试剂、Trizol试剂(赛默飞公司),乳酸脱氢酶(LDH)测定试剂盒(南京建成生物工程研究所),IL-1β、IL-18酶联免疫吸附测定试剂盒(武汉基因美科技有限公司)、半胱氨酸天冬氨酸特异蛋白酶-1(caspase-1)抗体、pro-caspase-1抗体、NOD样受体热蛋白结构域相关蛋白3(NLRP3)抗体、血管内皮生长因子受体2(VEGFR2)抗体(Abcam),VEGF抗体(北京博奥森生物),消皮素D(Gasdermin D)抗体(Affinity)、β-actin抗体、山羊抗小鼠IgG辣根酶标记二抗、山羊抗兔IgG辣根酶标记二抗(北京中杉金桥生物技术有限公司),Transwell小室(Corning)、小干扰RNA(siRNA)和阴性对照siRNA(siRNA-NC)序列由上海吉玛生物公司有限公司合成。
1.1.4. 实验仪器
BB150型CO2细胞培养箱、ALLEGR64R高速立式冷冻离心机(赛默飞);CHSQ- 50-Ⅲ型三气培养箱(上海川宏实验仪器有限公司);MW-GZT-SZD1000C101型无菌洁净工作台(东莞美维);CK2型倒置显微镜(Olympus);SpectraMax iD3型酶标仪(Molecular Device);GelView 6000Plus型化学发光成像系统(广州博鹭腾生物科技有限公司)。
1.2. 方法
1.2.1. 细胞培养
BMECs培养于含10%胎牛血清和1% 青霉素-链霉素的内皮细胞完全培养基中,放置在37 ℃、5% CO2、饱和湿度的细胞培养箱,待融合度达到80%~ 90%进行传代,选取对数生长期、生长状态良好的细胞进行后续实验研究。
1.2.2. NLXTD含药血清制备
SD大鼠按随机数表法分为空白血清组和药物血清组,10只/组。参照《药理实验学》[11]中成人与动物体表面积折算系数计算等效剂量,中药组按每日8.4 g/kg的剂量灌胃,对照血清组按大鼠体质量予以等体积生理盐水灌胃,2次/d,持续7 d。末次给药2 h后,大鼠腹腔注射1%戊巴比妥钠(40 mg/kg)行深度麻醉,无菌条件下进行腹主动脉取血,室温静置2 h,3000 r/min离心15 min,收集上清,于56 ℃水中灭活30 min,经0.22 μm微孔滤膜滤过除菌,分装于-80℃冻存备用。
1.2.3. NLXTD含药血清对OGD/R损伤BMECs存活率的影响
取对数生长期的BMECs常规消化,调整细胞浓度以1×104个/孔的密度接种于96孔板中,每孔加入100 μL细胞悬液,待细胞贴壁融合至80%~90%,设置正常对照组(Normal)、模型组(Model)和给药组(NLXTD)。正常对照组于正常条件下培养;模型组将培养基更换为DMEM无糖培养基,并将细胞置于三气培养箱(37 ℃,95% N2、5% CO2、1% O2)中培养6 h,随后更换完全培养基于普通培养箱中复氧24 h进行模型诱导[12];给药组将培养基更换为DMEM无糖培养基,缺氧培养6 h后,分别加入2.5%、5%、10%、20%的NLXTD含药血清,置于普通培养箱中培养12、24、48 h。随后更换新鲜培养基,每孔加入10 μL CCK-8溶液,置于37 ℃普通培养箱中孵育2 h。用酶标仪测定波长在450 nm处的吸光度(A),按照公式计算细胞存活率(%)=[(A实验-A空白)/(A对照-A空白)]×100%。
1.2.4. BMECs的caspase-1 siRNA转染及筛选
将BMECs按5×105/孔的密度接种于6孔板中,待细胞融合度达到80%后进行转染。操作步骤如下:将100 pmol siRNA加入250 μL Opti-MEM中,用枪头轻轻吹打混匀,室温放置5 min;吸取5 μL Lipofectamin 2000试剂加入250 μL Opti-MEM中,摇匀后室温孵育5 min;将稀释好的siRNA和稀释好的Lipofectamin 2000充分混合室温放置30 min,形成转染复合物。将500 μL siRNA/ Lipofectamin复合物加到含有细胞和培养基的孔板中,转染6 h后更换新鲜培养基。24 h后提取细胞总RNA,进行逆转录后通过qRT-PCR反应检测caspase-1 mRNA相对表达量,引物序列:F:AGCTTCAGTCAGGT CCATCAGC;R:GGCAAAACTTGAGGGAACCAC。
1.2.5. 分组和给药
设置Control组、OGD/R组、NLXTD组、siRNA-NC组、si-caspase-1组、si-caspase-1 + NLXTD组。Control组给予空白血清培养基,置于正常条件培养;OGD/R组按照“1.2.3”项下方法进行氧糖剥夺6 h后,给予空白血清培养基复氧24 h;NLXTD组按OGD/R组方法进行氧糖剥夺诱导后,加入10%含药血清培养基,于普通培养箱中复氧24 h;siRNA-NC组和si-caspase-1组在OGD/R组基础进行siRNA-NC、caspase-1 siRNA转染;si-caspase-1 + NLXTD组在NLXTD组基础上进行caspase-1 siRNA转染。
1.2.6. Transwell小室实验检测细胞迁移能力
将BMECs以1×104个/孔接种到Transwell上腔室,按“1.2.5”项下方法进行分组及给药,分别于上、下室添加含血清的DMEM无糖培养基,缺氧处理6 h后,将下室培养基替换为600 μL含10% FBS的DMEM高糖培养基。普通培养箱中孵育24 h后,取出小室,用4%多聚甲醛中室温固定30 min,0.1%结晶紫中室温染色20 min,用湿润的棉签轻柔拭去上室底部未迁移的细胞,在倒置显微镜下随机选取不同区域的3个视野进行拍照、计数。
1.2.7. 管腔形成实验检测血管生成能力
于96孔板中均匀铺满预冷的Matrigel基质胶(200 μL),在37 ℃下凝固30 min。取对数生长期的BMECs,分别用10%空白血清和含药血清的DMEM无糖培养基重悬细胞,按1× 104/孔的细胞密度均匀接种至预先铺胶的96孔板中,缺氧培养6 h后置于显微镜下观察BMECs管腔形成情况,每孔选取3个视野进行拍照并使用Image J软件进行图像分析。
1.2.8. LDH试剂盒检测细胞毒性
选取生长状况良好的BMECs,以1×105/mL接种于6孔板中,细胞分组及干预方法同“1.2.5”。收集各组细胞上清液,按照LDH试剂盒说明书进行操作,测定各组细胞LDH的释放量。
1.2.9. 酶联免疫吸附测定法(ELISA)检测IL-1β和IL-18含量
各组细胞经“1.2.5”项造模/药物处理后,收集上清液作为待测样品。参照IL-1β、IL-18 ELISA试剂盒说明书进行操作,用酶标仪测定每孔在450 nm处的A450 nm值,根据标准曲线计算样本待测因子浓度。
1.2.10. Western blotting检测细胞中pro-caspase-1、caspase-1、NLRP3、Gasdermin D、VEGF、VEGFR2蛋白表达
根据实验目的按“1.2.5”项进行细胞造模和药物处理后,提取总蛋白,采用BCA法测定蛋白浓度。制备SDS-PAGE胶,每组取等量蛋白上样,经电泳分离后转移至PVDF膜。5%脱脂奶粉室温封闭2 h后,一抗procaspase-1(1∶1000)、caspase-1(1∶1000)、NLRP3(1∶ 1000)、Gasdermin D(1∶2000)、VEGF(1∶1000)、VEGFR2(1∶1000)和β- actin(1∶1000)4 ℃孵育过夜;TBST洗膜后加入对应的二抗(1∶20 000)室温孵育2 h。采用ECL发光试剂盒显影,化学发光凝胶系统成像,Image J软件统计分析蛋白条带灰度值。
1.3. 统计学分析
计量资料用均数±标准差表示,用GraphPad Prism 9.0软件进行统计学分析。符合正态分布、方差齐时,两组间比较采用独立样本t检验,多组间比较采用单因素方差(One-way ANOVA)分析;方差不齐使用Tamhane's T2分析;不符合正态分布,采用Kruskal-Wallis秩和检验。P < 0.05表示差异具有统计学意义。
2. 结果
2.1. NLXTD含药血清提高OGD/R损伤BMECs的存活率
CCK-8实验结果见图 1。与正常对照组比较,OGD/R损伤后,模型组3个时间段的BMECs存活率均显著降低(P < 0.01);与模型组比较,不同浓度的NLXTD含药血清在3个时间段细胞活力均显著提高(P < 0.01)。10%的含药血清浓度干预24 h或48 h时细胞存活率最高,二者差异无统计学意义(P > 0.05),因此选用10%的含药血清浓度作用24 h作为后续实验条件。
图 1.
不同浓度脑络欣通(NLXTD)含药血清对OGD/R损伤BMECs存活率的影响
Effect of different concentrations of medicated serum from Naoluo Xintong Decoction (NLXTD)-treated rats on viability of the cells with OGD/R injury (n=6). **P < 0.01 vs the normal group; ##P < 0.01 vs model group.
2.2. Caspase-1 siRNA分子转染筛选
如图 2所示,与对照组比较,siRNA-NC组转染caspase-1 mRNA表达无显著变化(P > 0.05);与siRNANC组比较,转染caspase-1-siRNA-1、siRNA-2、siRNA- 3均显著降低BMECs的caspase-1 mRNA的表达水平(P < 0.01),其中siRNA-2的干扰效果最为明显(P < 0.01),因此选择siRNA-2进行后续实验干预。
图 2.

BMECs caspase-1基因转染序列的筛选
Screening of caspase-1 siRNA sequences for BMEC transfection (n=3). **P < 0.01 vs control group.
2.3. NLXTD含药血清提高OGD/R损伤BMECs的迁移能力
与Control组比较,OGD/R组BMECs迁移数显著减少(P < 0.01);与OGD/R组比较,NLXTD组细胞迁移数目显著增加(P < 0.01),si-caspase-1组细胞迁移数也显著增多(P < 0.01);与si-caspase-1组比较,合用NLXTD进一步促进细胞迁移数(P < 0.01,图 3)。
图 3.
NLXTD含药血清对OGD/R损伤BMECs迁移能力的影响
Effect of NLXTD-mediated serum on migration of BMEC with OGD/R injury (Original magnification: ×100, n=6). **P < 0.01 vs control group; ##P < 0.01 vs OGD/R group; ▲▲P < 0.01 vs NLXTD group; && P < 0.01 vs si-caspase-1 group.
2.4. NLXTD含药血清提高OGD/R损伤BMECs的管腔形成能力
管腔形成是评价血管新生能力的一项重要指标。图 4结果显示,与Control组比较,OGD/R组BMECs形成管腔数目显著减少(P < 0.01);与OGD/R组比较,NLXTD组管腔形成数目显著增加(P < 0.01),sicaspase-1组形成管腔数目也显著增加(P < 0.01);与sicaspase-1组比较,合用NLXTD进一步增加管腔形成数(P < 0.05)。
图 4.
NLXTD含药血清对OGD/R损伤BMECs成管能力的影响
Effect of NLXTD-mediated serum on the lumen forming ability of BMECs induced by OGD/R injury (×200, n=3). **P < 0.01 vs control group; ##P < 0.01 vs OGD/R group; ▲▲P < 0.01 vs NLXTD group; & P < 0.05 vs si-caspase-1 group.
2.5. NLXTD含药血清抑制OGD/R损伤BMECs的LDH释放
由图 5可知,与Control组比较,OGD/R组BMECs上清液中LDH的释放量显著增加(P < 0.01);与OGD/R组比较,NLXTD组和si-caspase-1组LDH含量显著减少(P < 0.01);与NLXTD组比较,敲低caspase-1进一步减轻LDH含量(P < 0.01)。
图 5.

NLXTD含药血清对OGD/R损伤BMECs上清液中LDH含量的影响
Effect of NLXTD-mediated serum on LDH content in the supernatant of BMECs with OGD/R injury (n=3). **P < 0.01 vs control group; ##P < 0.01 vs OGD/R group; ▲▲P < 0.01 vs NLXTD group; && P < 0.01 vs si-caspase-1 group.
2.6. NLXTD含药血清降低OGD/R损伤BMECs的IL- 1β、IL-18含量
利用ELISA法检测NLXTD对OGD/R损伤BMECs炎症因子水平的影响(图 6)。与Control组比较,OGD/R组IL-1β、IL-18含量显著增加(P < 0.01),提示OGD/R损伤增加BMECs炎症因子表达;与OGD/R组比较,si-caspase-1组IL-1β、IL-18含量显著降低(P < 0.01);NLXTD组IL-1β、IL-18含量降低(P < 0.01),敲低caspase-1后,IL-18含量进一步降低(P < 0.01),表明NLXTD降低OGD/R诱导BMECs损伤后的炎症因子表达,敲低caspase-1后,该作用进一步促进。
图 6.
NLXTD含药血清对OGD/R损伤BMECs炎症因子含量的影响
Effect of NLXTD-mediated serum on IL-1β (A) and IL-18 (B) levels in BMECs with OGD/R injury (n=3). **P<0.01 vs control group; ##P<0.01 vs OGD/R group; ▲▲P<0.01 vs NLXTD group; &&P<0.01 vs si-caspase-1 group.
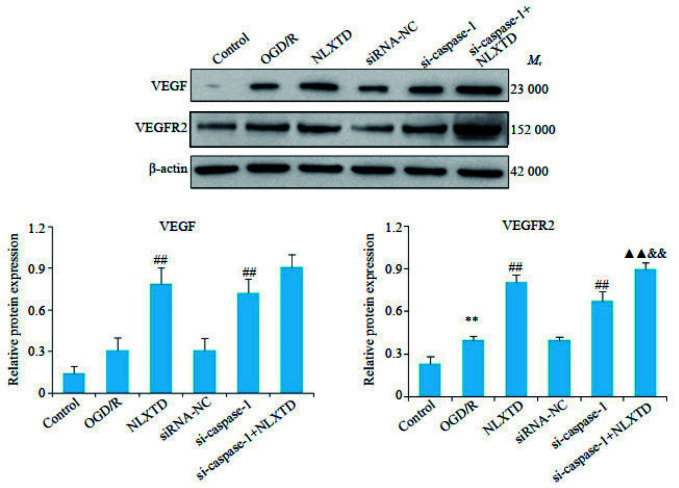
2.7. NLXTD含药血清对OGD/R损伤BMECs焦亡及血管新生关键蛋白表达的影响
Western blot检测结果见图 7、8。与Control组比较,OGD/R组pro-caspase-1、caspase-1、NLRP3、Gasdermin D和VEGFR2蛋白表达水平均显著升高(P < 0.01);与OGD/R组比较,给予NLXTD含药血清干预后,procaspase-1、caspase-1、NLRP3、Gasdermin D蛋白表达水平显著降低(P < 0.01),而VEGF和VEGFR2蛋白表达水平显著升高(P < 0.01);敲低caspase-1后,pro-caspase-1、caspase-1、NLRP3、Gasdermin D蛋白表达水平显著降低(P < 0.01),VEGF和VEGFR2蛋白表达水平显著升高(P < 0.01);与si-caspase-1组比较,合用NLXTD进一步降低pro-caspase-1、caspase-1、NLRP3、Gasdermin D蛋白表达水平(P < 0.01),VEGFR2蛋白表达水平进一步增加(P < 0.01)。
图 7.
各组细胞焦亡关键蛋白pro-caspase-1、caspase-1、NLRP3、Gasdermin D表达水平
Expression levels of pro-caspase-1, caspase-1, NLRP3, and Gasdermin D in each group (n=4). **P < 0.01 vs control group; ##P < 0.01 vs OGD/R group; ▲▲P < 0.01 vs NLXTD group; && P < 0.01 vs si-caspase-1 group.
图 8.
各组血管新生关键蛋白VEGF、VEGFR2表达水平
Expression levels of VEGF and VEGFR2 proteins in each group (n=4). **P < 0.01 vs control group, ##P < 0.01 vs OGD/R group; ▲▲P < 0.01 vs NLXTD group; && P < 0.01 vs si-caspase-1 group.
3. 讨论
血管新生存在于脑梗死三级侧支循环的建立中,是指在缺血周边原毛细血管和微静脉的基础上,由内皮细胞增殖、迁移、成熟并形成新的血管的过程[13]。血管新生的过程接受一系列促血管生长因子和抑制因子的调节,其中VEGF及其受体VEGFR2参与到血管新生的各个阶段,在脑缺血后血管新生调控中发挥关键作用[14]。体内外研究结果表明,通过启动缺血区血管新生,增加微血管密度和局部脑血流量,能为损伤神经元修复、突触重建和神经发生提供良好的微环境[15, 16]。临床资料也显示,脑卒中患者的生存时间长短和预后与新生微血管数量呈正相关[17]。BMECs是血管新生中重要的物质基础,其增殖、迁移和管腔形成也是血管新生过程的关键步骤。研究发现,缺血再灌注可以引起内皮细胞结构损伤和功能异常,导致促血管生成能力减弱[4, 18, 19]。因此,通过药物保护BMECs,促进血管新生,建立侧支循环实现“药物搭桥”是应对CIRI后神经系统内源性修复的关键保护策略。
CIRI属于中医“中风”范畴,其基本病机为气血亏虚、络脉瘀阻、脑脉受损,属本虚标实之证[20]。益气活血方脑络欣通(NLXTD)是新安医家王乐匋先生临床辨治中风的有效方剂,现已为院内制剂。该方君药黄芪气薄味厚,功专补气而无耗血之弊;臣药川芎、三七辛香温窜、活血和营,当归、红花活血通经,并寓有养血之意;针对久病瘀阻之证,佐虫药蜈蚣搜络剔邪,天麻熄风通络;全方以气血为本,合以辛温通络、辛润通络、虫蚁通络等法,共奏“益气活血、熄风通络”之功。既往研究发现[21-23],NLXTD可促进VEGF、血管紧张素Ⅱ(Ang Ⅱ)表达,下调C反应蛋白(CRP)、Toll样受体(TLR4)、肿瘤坏死因子α(TNF-α)、caspase-3等水平,减轻脑梗死急性期炎症反应、细胞凋亡,促进血管新生,改善脑梗死患者神经功能缺损情况。本实验研究结果显示,OGD/R刺激导致BMECs损伤,细胞膜通透性增加,LDH释放量增多,细胞增殖和迁移数量明显减少,管腔形成受到明显抑制,而应用NLXTD含药血清干预后能够显著减少BMECs损伤,LDH释放量减少,细胞增殖和迁移数显著增加,管腔形成数也明显增多。以上结果表明,NLXTD能显著增加BMECs OGD/R损伤后的细胞增殖、迁移和成管能力,同时能减轻氧糖剥夺的细胞毒性,进而提高BMECs的血管新生能力。
细胞焦亡又称细胞炎性坏死,是一种依赖于炎性半胱天冬酶(caspase-1/4/5/11)介导的程序性细胞死亡,其中caspase-1介导的经典途径是焦亡发生的主要途径[24]。在经典途径中,机体受到各种病原体刺激后组装炎症小体大分子多蛋白复合物NLRP3,使caspase-1前体活化形成caspase-1,随后切割Gasdermin D使其N端部分在细胞膜寡聚形成孔洞,引起细胞肿胀、质膜快速破裂、细胞死亡,同时导致炎症因子IL-1β、IL-18大量释放到胞外,募集更多的炎症细胞,扩大炎症反应[25]。近年来多项研究结果表明[26-29],细胞焦亡是参与CIRI发生发展的重要病理机制之一,不同类型的脑细胞如神经元、小胶质细胞、巨噬细胞经历焦亡参与脑损伤的形成,并且干预焦亡信号通路在治疗神经系统疾病中表现出良好的应用前景。此外,Guo等[7]研究发现,OGD/R诱导BMECs损伤后焦亡相关蛋白NLRP3、caspase-1、Gasdermin D及炎性因子IL-1β水平显著增加,导致细胞活力和增殖能力降低,表明氧糖剥夺后BMECs存活与细胞焦亡相关。Lopez-Pastrana等[8]研究表明,在caspase-1-/-后肢缺血小鼠模型中,VEGFR2表达增加,缺血组织的血管新生和血液供应得到改善;而抑制人主动脉内皮细胞中的caspase-1表达,可以减轻细胞焦亡,促进血管生成;该结果提示在缺血状态下,抑制内皮细胞焦亡,减轻内皮细胞损伤,可以增强血管新生的能力。因此,细胞焦亡影响着CIRI的发生、发展,其关键分子在保护内皮细胞、促血管新生中可能发挥着不利的作用。
本实验研究结果中发现,OGD/R损伤BMECs后,焦亡相关分子pro-caspase-1、caspase-1、NLRP3、Gasdermin D的蛋白表达水平显著升高,炎症因子IL-1β、IL-18含量也明显增加,表明细胞焦亡参与到BMECs氧糖剥夺复灌后损伤的病理过程;进一步应用siRNA干扰技术敲低BMECs中caspase-1基因水平,发现OGD/R诱导BMECs的焦亡损伤情况得到改善,同时血管新生关键因子VEGF和VEGFR2的蛋白水平升高,伴随着细胞迁移和管腔形成能力的增加,该结果提示在OGD/R状态下,抑制内皮细胞焦亡,减轻BMECs损伤,可以促促进血管新生,发挥保护作用,与上述研究结果保持一致。同时,NLXTD含药血清呈现了有效且显著的作用,Western blot及ELISA结果显示,NLXTD能显著抑制细胞焦亡经典途径中pro-caspase-1、caspase-1、NLRP3、Gasdermin D蛋白的表达,减轻IL- 1β、IL-18的含量,并上调VEGF和VEGFR2的蛋白表达水平,促进内皮细胞增殖、迁移和管腔形成,发挥对内皮细胞保护的作用,在敲低caspase-1基因后,该保护作用得到进一步促进。
细胞焦亡的发生除造成细胞死亡外,还会通过分泌促炎细胞因子IL-1β、IL-18引发炎症级联反应。BMECs是血管内壁与血液中有害物质和代谢产物之间的第一道防线,缺血再灌注期间,细胞间黏附分子表达增多,促进中性粒细胞、淋巴细胞、单核细胞和嗜酸性粒细胞与内皮细胞之间强烈的黏附和激活,导致内皮细胞受损[30]。同时,在炎症激活的状态下,内皮细胞表面表达的Toll样受体会启动核因子κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)信号通路,加快释放IL-1β、IL-6和TNF-α等炎性因子,造成内皮细胞功能障碍[31]。在本研究中,我们发现OGD/R诱导BMECs损伤后细胞上清液中IL-1β、IL-18含量增多,出现炎症损伤;而给予NLXTD和si-caspase-1干预后,IL-1β、IL-18含量显著降低,结合细胞焦亡关键蛋白表达的变化,推测NLXTD可能通过抑制caspase-1/Gasdermin D焦亡途径,进而抑制炎症反应过度激活,减轻BMECs炎症损伤,发挥保护作用。
综上所述,本研究结果表明OGD/R诱导BMECs发生焦亡损伤,导致血管新生能力减弱,益气活血方NLXTD可以提高OGD/R损伤的BMECs增殖、迁移和成管能力,促进血管新生,其机制可能与抑制细胞焦亡caspase-1/Gasdermin D通路,减轻缺血后BMECs损伤,上调血管新生关键蛋白VEGF、VEGFR2水平有关。本实验研究结果为中药复方NLXTD防治CIRI提供了一些实验依据,接下来可从脑卒中动物模型开展BMECs焦亡损伤对血管新生影响的相关研究。
Biography
李佩佩,助教,E-mail: PeipeiLitcm@126.com
Funding Statement
安徽省第十三批115产业创新团队(皖人才办【2020】4号);安徽省自然科学基金(2208085MH265);国家中医药管理局学术流派传承工作室第二轮建设项目(国中医药办人教函[2019]62号);安徽中医药大学2021年度科技创新基金重点项目(2021ZD02)
Contributor Information
李 佩佩 (Peipei LI), Email: PeipeiLitcm@126.com.
胡 建鹏 (Jianpeng HU), Email: hujianpeng351@126.com.
References
- 1.王 拥军, 李 子孝, 谷 鸿秋, et al. 中国卒中报告2020(中文版)(1) 中国卒中杂志. 2022;17(5):433–47. [Google Scholar]
- 2.Shen LA, Gan QY, Yang YC, et al. Mitophagy in cerebral ischemia and ischemia/reperfusion injury. Front Aging Neurosci. 2021;13:687246. doi: 10.3389/fnagi.2021.687246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wu PF, Zhang Z, Wang F, et al. Natural compounds from traditional medicinal herbs in the treatment of cerebral ischemia/reperfusion injury. Acta Pharmacol Sin. 2010;31(12):1523–31. doi: 10.1038/aps.2010.186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Krüger-Genge A, Blocki A, Franke RP, et al. Vascular endothelial cell biology: an update. Int J Mol Sci. 2019;20(18):4411. doi: 10.3390/ijms20184411. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.龙 送开, 王 白云, 周 麒儿, et al. 右美托咪定抗血管内皮细胞缺血再灌注损伤研究进展. 检验医学与临床. 2022;19(17):2425–9. doi: 10.3969/j.issn.1672-9455.2022.17.033. [DOI] [Google Scholar]
- 6.Cookson BT, Brennan MA. Pro-inflammatory programmed cell death. Trends Microbiol. 2001;9(3):113–4. doi: 10.1016/s0966-842x(00)01936-3. [DOI] [PubMed] [Google Scholar]
- 7.GUO Y, YANG J H, HE Y, et al. Protocatechuic aldehyde prevents ischemic injury by attenuating brain microvascular endothelial cell pyroptosis via lncRNAXist. Phytomedicine. 2022;94:153849. doi: 10.1016/j.phymed.2021.153849. [DOI] [PubMed] [Google Scholar]
- 8.Lopez-Pastrana J, Ferrer LM, Li YF, et al. Inhibition of caspase-1 activation in endothelial cells improves angiogenesis: a novel therapeutic potential for ischemia. J Biol Chem. 2015;290(28):17485–94. doi: 10.1074/jbc.M115.641191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Li PP, He L, Zhang LM, et al. Naoluo Xintong Decoction ameliorates cerebral ischemia-reperfusion injury by promoting angiogenesis through activating the HIF-1 α/VEGF signaling pathway in rats. Evid Based ComplementAlternat Med. 2022;2022:9341466. doi: 10.1155/2022/9341466. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.王 丽娜, 曹 健, 朱 国旗, et al. 脑络欣通降低局灶性脑缺血再灌注大鼠额顶叶皮质TLR4及TRAF6和TNF-α蛋白的表达. 细胞与分子免疫学杂志. 2018;34(8):702–7. doi: 10.13423/j.cnki.cjcmi.008633. [DOI] [PubMed] [Google Scholar]
- 11.徐 叔云. 药理实验方法学. 北京: 人民卫生出版社; 2002. [Google Scholar]
- 12.Liu CD, Liu NN, Zhang S, et al. Salvianolic acid A prevented cerebrovascular endothelial injury caused by acute ischemic stroke through inhibiting the Src signaling pathway. Acta Pharmacol Sin. 2021;42(3):370–81. doi: 10.1038/s41401-020-00568-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kanazawa M, Takahashi T, Ishikawa M, et al. Angiogenesis in the ischemic core: a potential treatment target? J Cereb Blood Flow Metab. 2019;39(5):753–69. doi: 10.1177/0271678X19834158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Melincovici CS, Boşca AB, Şuşman S, et al. Vascular endothelial growth factor (VEGF) -key factor in normal and pathological angiogenesis. Rom J Morphol Embryol. 2018;59(2):455–67. [PubMed] [Google Scholar]
- 15.Ergul A, Alhusban A, Fagan SC. Angiogenesis: a harmonized target for recovery after stroke. Stroke. 2012;43(8):2270–4. doi: 10.1161/STROKEAHA.111.642710. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hoffmann CJ, Harms U, Rex A, et al. Vascular signal transducer and activator of transcription-3 promotes angiogenesis and neuroplasticity long-term after stroke. Circulation. 2015;131(20):1772–82. doi: 10.1161/CIRCULATIONAHA.114.013003. [DOI] [PubMed] [Google Scholar]
- 17.Krupinski J, Kaluza J, Kumar P, et al. Role of angiogenesis in patients with cerebral ischemic stroke. Stroke. 1994;25(9):1794–8. doi: 10.1161/01.STR.25.9.1794. [DOI] [PubMed] [Google Scholar]
- 18.毛 庆菊, 陈 邦国. 电针对局灶性脑缺血再灌注大鼠大脑皮层微血管超微结构及血管内皮生长因子表达的影响. 针刺研究. 2012;37(6):476–81. [PubMed] [Google Scholar]
- 19.Yu QJ, Tao H, Wang X, et al. Targeting brain microvascular endothelial cells: a therapeutic approach to neuroprotection against stroke. Neural Regen Res. 2015;10(11):1882–91. doi: 10.4103/1673-5374.170324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.王 永炎, 张 伯礼. 中医脑病学. 北京: 人民卫生出版社; 2007. [Google Scholar]
- 21.胡 建鹏, 王 键, 吴 玲, et al. 脑络欣通对脑缺血再灌注气虚血瘀证大鼠皮质、海马CA1区FADD和Caspase-3蛋白表达的影响. 中国中医药科技. 2006;13(1):11–3. [Google Scholar]
- 22.李 旦, 梁 赟, 章 颖. 脑络欣通对脑梗死急性期气虚血瘀证患者神经功能、血液流变学及氧化应激的保护作用. 中国老年学杂志. 2020;40(16):3395–7. doi: 10.3969/j.issn.1005-9202.2020.16.012. [DOI] [Google Scholar]
- 23.谭 辉, 尹 婷婷, 邓 勇, et al. 益气活血中药脑络欣通促进脑缺血气虚血瘀证大鼠脑血管再生及机制. 细胞与分子免疫学杂志. 2020;36(8):712–8. [PubMed] [Google Scholar]
- 24.Bergsbaken T, Fink SL, Cookson BT. Pyroptosis: host cell death and inflammation. Nat Rev Microbiol. 2009;7(2):99–109. doi: 10.1038/nrmicro2070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Li T, Zheng GJ, Li B, et al. Pyroptosis: a promising therapeutic target for noninfectious diseases. Cell Prolif. 2021;54(11):e13137. doi: 10.1111/cpr.13137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Li J, Hao JH, Yao D, et al. Caspase-1 inhibition prevents neuronal death by targeting the canonical inflammasome pathway of pyroptosis in a murine model of cerebral ischemia. CNS Neurosci Ther. 2020;26(9):925–39. doi: 10.1111/cns.13384. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Yan WT, Yang YD, Hu XM, et al. Do pyroptosis, apoptosis, and necroptosis (PANoptosis) exist in cerebral ischemia? Evidence from cell and rodent studies. Neural Regen Res. 2022;17(8):1761–8. doi: 10.4103/1673-5374.331539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zhao B, Fei YX, Zhu JP, et al. PAF receptor inhibition attenuates neuronal pyroptosis in cerebral ischemia/reperfusion injury. Mol Neurobiol. 2021;58(12):6520–39. doi: 10.1007/s12035-021-02537-0. [DOI] [PubMed] [Google Scholar]
- 29.蒋 希成, 陈 阳燕, 李 晓莹, et al. 细胞焦亡在缺血性脑卒中的作用机制研究进展. 辽宁中医杂志 [Google Scholar]
- 30.Zhang HY, Park JH, Maharjan S, et al. Sac-1004, a vascular leakage blocker, reduces cerebral ischemia-reperfusion injury by suppressing blood-brain barrier disruption and inflammation. J Neuroinflammation. 2017;14(1):1–15. doi: 10.1186/s12974-017-0897-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Khakpour S, Wilhelmsen K, Hellman J. Vascular endothelial cell Toll-like receptor pathways in sepsis. Innate Immun. 2015;21(8):827–46. doi: 10.1177/1753425915606525. [DOI] [PubMed] [Google Scholar]