Abstract
La enfermedad pulmonar obstructiva crónica (EPOC) se relaciona con el tabaquismo como principal agente etiológico, si bien existen otros factores de riesgo que pueden interactuar influyendo en el desarrollo de la enfermedad. La definición de EPOC se asienta en tres puntos: la presencia de síntomas respiratorios persistentes, la exposición a agentes etiológicos y un cociente espirométrico obstructivo no reversible. La espirometría forzada con prueba broncodilatadora es la prueba de elección para confirmar el diagnóstico de EPOC, no obstante, se están intentando desarrollar métodos alternativos para el cribado de la enfermedad, dado el importante infradiagnóstico actual de esta patología.
Con el fin de avanzar en una medicina más personalizada, en el paciente se han adoptado herramientas de clasificación como son los fenotipos clínicos y los rasgos tratables, permitiendo adecuar los tratamientos en función de las características de los pacientes. El tratamiento no farmacológico, como la deshabituación tabáquica, la vacunación, el ejercicio físico… es fundamental en el manejo de la enfermedad, así como el tratamiento farmacológico basado en los fenotipos clínicos. Los eosinófilos se han convertido en un marcador clave a la hora de instaurar el tratamiento con glucocorticoides inhalados.
En el seguimiento de la enfermedad, es de especial relevancia evaluar el grado de control de esta, siendo un elemento fundamental para establecer un adecuado control la ausencia de agudizaciones. Estas conllevan importantes implicaciones en la mortalidad, morbilidad y calidad de vida de los pacientes, siendo necesarios más estudios para definir mejor los fenotipos de las agudizaciones y sus biomarcadores.
Palabras clave: EPOC, Etiología, Diagnóstico, Tratamiento
Abstract
Chronic Obstructive Pulmonary Disease (COPD) is related to smoking as the main etiological agent although there are other risk factors that can interact influencing the development of the disease. The definition of COPD is based on three points: the presence of persistent respiratory symptoms, exposure to risk agents, and a non-reversible obstructive spirometric ratio. Forced spirometry with a bronchodilator test is necessary to confirm the diagnosis of COPD, however, attempts are being made to develop alternative methods for screening given the current significant underdiagnosis of this pathology.
In order to advance in a more personalized medicine for the patient, classification tools have been adopted such as clinical phenotypes and treatable traits, allowing treatments to be adapted according to the characteristics of the patients. Non-pharmacological treatment (smoking cessation, vaccination, physical exercise...) are essential for the management of the disease, as well as pharmacological treatment based on clinical phenotypes. Eosinophils have become a key marker when establishing treatment with inhaled glucocorticoids.
In the follow-up of the disease, it is very relevant to evaluate the degree of control being a fundamental element the absence of exacerbations given their implications in mortality, morbidity and quality of life of patients. More studies are needed to better define the phenotypes of exacerbations and their biomarkers.
Keywords: COPD, Etiology, Diagnosis, Treatment
¿Qué factores condicionan el desarrollo de la enfermedad pulmonar obstructiva crónica
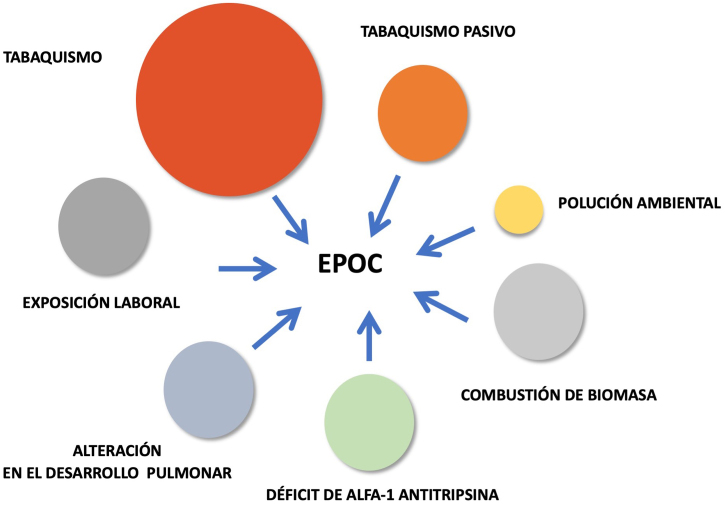
El consumo de tabaco es el principal factor de riesgo relacionado con el desarrollo de la enfermedad pulmonar obstructiva crónica (EPOC). Su relación causal ha sido ampliamente demostrada en numerosos estudios, siendo el riesgo de desarrollar la enfermedad proporcional al consumo acumulado de tabaco, de tal manera que los pacientes fumadores presentan un mayor riesgo de descenso del volumen espiratorio forzado en el primer segundo (FEV1) respecto a los no fumadores. Es bien sabido que no solamente el tabaquismo activo, sino también el tabaquismo pasivo, puede conllevar un aumento del riesgo en desarrollar la enfermedad1, 2. No obstante, solo el 15% de los fumadores desarrolla la enfermedad, lo que sugiere que otros factores de riesgo también están implicados en la patogenia de la enfermedad3.
En zonas rurales y países en vías de desarrollo, la utilización de combustibles de biomasa es uno de los factores más relacionados con la enfermedad. La utilización de estos combustibles ya sea para calentar hogares o en la cocina contribuye a incrementar la polución dentro de las viviendas, sobre todo en aquellas con mala ventilación, asociándose a una mayor limitación al flujo aéreo en aquellas personas expuestas a los mismos4.
El ambiente laboral también es muy importante dado que la exposición a productos químicos, vapores y polvos orgánicos e inorgánicos también puede conducir al desarrollo de EPOC. Entre los estudios que han demostrado este hecho destaca el de Marchetti et al.5, que asoció la exposición a polvos y vapores tóxicos en el medio laboral a una mayor limitación al flujo aéreo y sintomatología, pero también a una mayor presencia de enfisema y atrapamiento aéreo valorado mediante tomografía computarizada. Por otro lado, el efecto de la polución ambiental como causa etiológica de la EPOC no está del todo establecido, siendo su influencia mucho menor si lo comparamos con el efecto que produce el tabaquismo. No obstante, sí parece desempeñar un papel relevante como desencadenante de las agudizaciones6.
Las trayectorias de función pulmonar clásicas descritas por Peto y Fletcher7, han demostrado que la madurez del desarrollo pulmonar se alcanza a los 25 años con un declinar funcional progresivo a partir de esta edad, pero Lange et al.8, en tres cohortes independientes, objetivaron que un 50% de los pacientes no llegaban a alcanzar esta función pulmonar normal, de tal manera que entre un 4% a un 12% de la población no alcanza un desarrollo pulmonar completo. La afectación de la función pulmonar en los primeros 6 años de vida, las infecciones respiratorias en la infancia, la inhalación pasiva de tabaco en la niñez, la prematuridad, el bajo peso al nacer o el tabaquismo materno durante el embarazo, son entre otros, factores que pueden influir en esta falta de desarrollo pulmonar9.
En cuanto a los factores genéticos, se han relacionado varias alteraciones genéticas en la patogenia de la enfermedad como el déficit de alfa-1 antitripsina o polimorfismos génicos de varias enzimas implicadas en los procesos de oxidación-reducción y de inflamación. El déficit de alfa 1 antitripsina es la alteración congénita más estudiada y conocida, pero a pesar de ello sigue estando infradiagnosticada siendo muy importante su detección, por la pérdida acelerada de parénquima pulmonar que conlleva su déficit10.
Como conclusión, la EPOC es una enfermedad compleja con un componente epigenético significativo y en el que existen múltiples factores de riesgo ambientales (incluido el tabaquismo y muchos otros) que interactúan a lo largo de la vida, influyendo en el desarrollo de la enfermedad (fig. 1).
Figura 1.
Factores de riesgo asociados al desarrollo de la EPOC.
¿Cuál es la diferencia entre los fenotipos clínicos y los rasgos tratables?
El abordaje de la EPOC se ha modificado en las últimas décadas gracias a los avances realizados en el diagnóstico y tratamiento de la enfermedad. Con el fin de conseguir una estrategia de medicina de precisión, además de los fenotipos, en las últimas guías publicadas se han incorporado los rasgos tratables con el objetivo de mejorar la atención individual de los pacientes y dirigir el tratamiento de forma más precisa2, 11, 12.
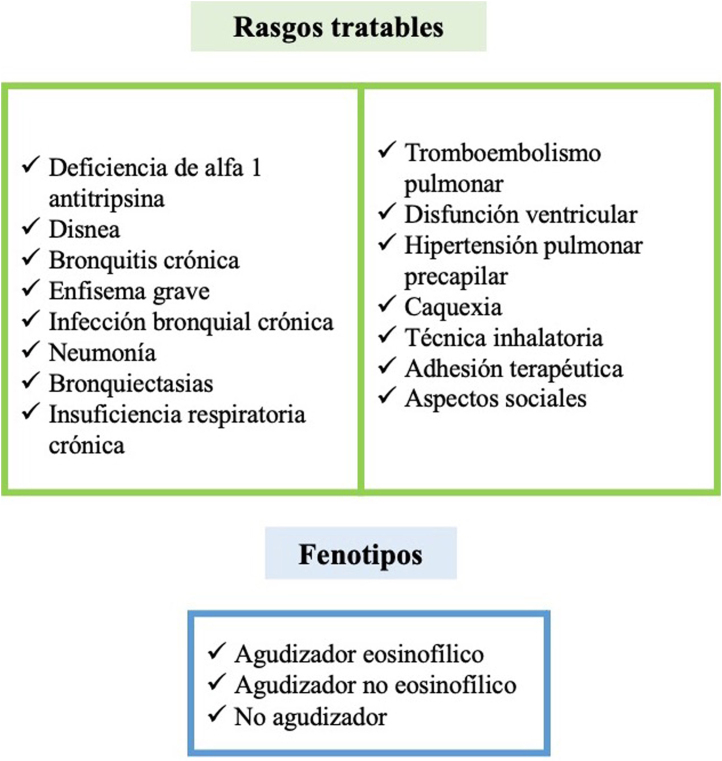
El fenotipo clínico engloba a aquellos atributos de la enfermedad que solos o combinados permiten clasificar a los individuos con EPOC en relación con parámetros que tienen significado clínico (síntomas, agudizaciones, respuesta al tratamiento, velocidad de progresión de la enfermedad o muerte). Se asocian con factores pronósticos y sobre todo con una distinta respuesta a los tratamientos disponibles13.
Las primeras alusiones a los fenotipos se remontan a 1955 con las definiciones de los clásicos «blue bloater» (bronquítico cianótico abotargado) y «pink puffer» (enfisema sonrosado soplador)14. Desde entonces hasta la actualidad, han sido distintos los fenotipos que se han adoptado en la práctica clínica. Uno de ellos ha sido el denominado fenotipo asthma-COPD overlap (ACO), aplicado a pacientes con EPOC con criterios diagnósticos de asma, o que presentaban rasgos considerados asmáticos, como una prueba broncodilatadora muy positiva y/o una eosinofilia en sangre periférica superior a las 300 cél/mm. En la actualidad, no se considera fenotipo dado que la prueba broncodilatadora positiva raramente se encuentra de forma aislada y por su escaso valor diagnóstico. Es por ello que la denominación ACO en la actualidad se reserva para el diagnóstico de asma como comorbilidad en la EPOC15.
En las anteriores guías de práctica clínica se incluían los fenotipos agudizadores bronquítico crónico y enfisematoso16. En la actualidad, también se han eliminado como fenotipos y se han incluido estas características clínicas como rasgos tratables, debido a que el tratamiento farmacológico inhalado es muy similar en ambos tipos de pacientes pero con expresión de biomarcadores propios que permiten adoptar tratamientos no farmacológicos específicos.
En base por tanto al abordaje farmacológico, en la última actualización de la Guía Española de la EPOC (GesEPOC)2 se reconocen en los pacientes de alto riesgo tres fenotipos: el agudizador no eosinofílico, el agudizador eosinofílico y el no agudizador. El paciente no agudizador se caracteriza por presentar una agudización en el año previo sin requerir atención hospitalaria y por un tratamiento inicial basado, en los pacientes de alto riesgo, en la doble broncodilatación. El fenotipo agudizador eosinofílico se define en aquel paciente con más de 300 eosinófilos/mm y un historial de agudizaciones de repetición (dos o más agudizaciones ambulatorias, o una o más agudizaciones graves, que precisen atención hospitalaria). En estos pacientes el tratamiento de elección son los corticoides inhalados en base a la reducción de las agudizaciones demostrada en diferentes estudios. El fenotipo agudizador no eosinofílico se caracteriza por los mismos criterios del fenotipo agudizador, pero con menos de 300 eosinófilos/mm en sangre periférica. En estos pacientes los corticoides inhalados son menos eficaces aunque no se excluye su uso, sobre todo cuando el recuento de eosinófilos sea mayor de 100 células/mm.
A diferencia de los fenotipos, los rasgos tratables se definen como una característica (clínica, fisiológica o biológica) que se puede identificar mediante pruebas diagnósticas o biomarcadores, y que tienen un tratamiento específico asociado a cada rasgo identificado. Incluyen factores pulmonares y extrapulmonares, factores de riesgo y factores conductuales que pueden coexistir en un mismo paciente y evolucionar a lo largo del tiempo (espontáneamente o como resultado del tratamiento).
Tanto los fenotipos clínicos como los rasgos tratables han supuesto un avance en la medicina de precisión en el manejo de la EPOC, siendo herramientas que nos permiten adoptar los tratamientos más apropiados en cada paciente y nos acercan a una visión más global de la enfermedad (fig. 2).
Figura 2.
Rasgos tratables y fenotipos clínicos según GesEPOC 2021. Adaptado de Miravitlles et al2.
¿Es suficiente la espirometría para diagnosticar la EPOC?
La sospecha diagnóstica en un paciente con EPOC se basa en la exposición a factores de riesgo, habitualmente el humo del tabaco, los síntomas persistentes como la disnea de esfuerzo, la tos, expectoración y/o infecciones respiratorias bajas frecuentes y un cociente obstructivo no reversible en la espirometría. Tanto las guías de estrategia global para el manejo de la EPOC (GOLD)1, como GesEPOC2, continúan recomendando la espirometría forzada con prueba broncodilatadora como la prueba de elección para confirmar el diagnóstico de EPOC. Esta siempre se debe realizar en fase estable de la enfermedad y debe ser siempre interpretada dentro del contexto clínico adecuado. Dado que por definición en la EPOC la obstrucción al flujo aéreo no es completamente reversible, la persistencia de un patrón obstructivo (cociente FEV1/ capacidad vital forzada [FVC] < 0,7) tras la realización de prueba broncodilatadora, confirmaría el diagnóstico de EPOC17, 18.
A pesar de que la espirometría es una prueba sencilla, económica y reproducible, para que sea considerada de calidad, requiere de requisitos técnicos apropiados, de una adecuada formación y una experiencia del personal técnico que dificulta su implementación en determinados ámbitos asistenciales, como la Atención Primaria. A pesar de los esfuerzos realizados para implementar espirometrías de calidad en los centros de salud, la EPOC continúa siendo una enfermedad infradiagnosticada con cifras cercanas al 75%. Es por ello que se han propuesto otras herramientas más sencillas para el cribado de la EPOC. Una de ellas, es la medición del FEV6 (volumen espiratorio forzado a los 6 segundos), usando el cociente FEV1/FEV6 como parámetro de obstrucción al flujo aéreo dada su buena correlación con el FEV1/FVC, mostrando ser útil para el cribado y con un alto valor predictivo negativo19.
Hay que tener en cuenta que el criterio del cociente fijo FEV1/FVC < 0,7 pierde especificidad a medida que aumenta la edad, pudiendo sobrediagnosticar la enfermedad en pacientes de edad avanzada dada la disminución fisiológica de este cociente con los años. Se ha visto que el 15% de la población sana mayor de 70 años tiene un FEV1/FVC < 0,7 y esta proporción asciende hasta el 50% en mayores de 80 años20, 21. Es por esto que se ha propuesto utilizar el uso del límite inferior de la normalidad (LIN) que corresponde al percentil 5 de la relación FEV1/FVC de la población sana de referencia. Sin embargo, el valor del LIN depende la ecuación utilizada para definir este valor de referencia sobre la población sana, y hasta la fecha no existen estudios longitudinales de validación de este.
Por otra parte, el cociente fijo FEV1/FVC < 0,7 puede ser poco sensible e infradiagnosticar la enfermedad en adultos jóvenes. Algunos pacientes fumadores sintomáticos pueden tener una espirometría normal y presentar daños estructurales en el parénquima pulmonar identificados en la TAC de tórax, o en alteraciones funcionales como la disminución en la capacidad de difusión del monóxido de carbono (DLco) o el atrapamiento aéreo en los volúmenes pulmonares, reflejando enfisema y/o enfermedad de la pequeña vía aérea. Es por ello, que la dependencia exclusiva de la espirometría puede resultar en la subestimación de un deterioro fisiológico que podría ser clínicamente relevante para el paciente quedando excluido de recibir un tratamiento específico. Recientemente algunos autores han propuesto la clasificación GOLD0-DLCOI como una forma temprana de abordaje de la enfermedad, siendo todavía necesarios más estudios clínicos prospectivos que evalúen la evolución e implicaciones clínicas en estos pacientes22.
Otras pruebas complementarias que permiten una mejor caracterización de la enfermedad se resumen en la tabla 1.
Tabla 1.
Pruebas complementarias en la EPOC
| Pruebas | Indicación |
|---|---|
| Analítica de sangre | Valoración de los niveles de eosinófilos y de alfa 1 antitripsina |
|
Radiografía de tórax posteroanterior y lateral |
Signos de atrapamiento aéreo e hiperinsuflación |
| Tomografía computarizada de tórax | Cuantificación y distribución del enfisema, diagnóstico de bronquiectasias |
| Volúmenes pulmonares estáticos y prueba de difusión de monóxido de carbono (DLco) | Cuantifica el grado de atrapamiento aéreo e hiperinsuflación pulmonar así como el impacto funcional del enfisema |
| Test de la marcha de 6 minutos | Evalúa la capacidad de ejercicio y la desaturación con el esfuerzo |
| Gasometría arterial | Indicada ante la sospecha de insuficiencia respiratoria y/o sospecha de hipercapnia |
| Cultivo de esputo | En pacientes agudizadores frecuentes con criterios de bronquitis crónica para descartar infección bronquial |
| Ecocardiograma transtorácico | Si existe sospecha de hipertensión arterial pulmonar y para el estudio de comorbilidad cardiaca |
| Estudio de sueño | En caso de sospecha de apnea obstructiva del sueño o pacientes con hipertensión pulmonar desproporcionada para el grado de obstrucción pulmonar |
¿Cómo se debe realizar el seguimiento de un paciente con EPOC?
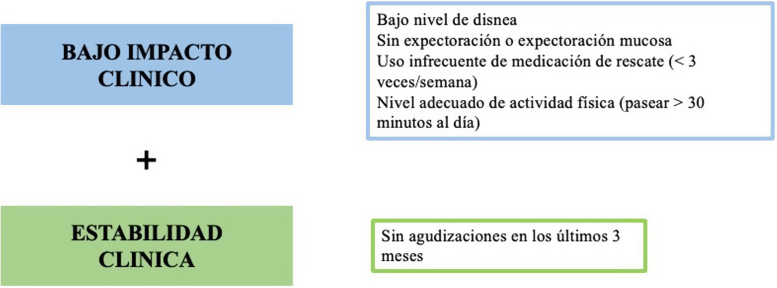
El seguimiento del paciente con EPOC va a depender del grado de control de la enfermedad. Aunque la EPOC es una de las enfermedades crónicas más prevalentes a nivel mundial, la definición de este concepto es complicada dado que la sintomatología y la alteración funcional pulmonar irreversible propias de la enfermedad van a estar presentes por definición. Sin embargo, en el 2014 se definió por primera vez el concepto de control de la enfermedad como una situación de bajo impacto clínico mantenida a lo largo del tiempo23. Esta definición incluye la combinación de dos ejes: uno transversal, el impacto clínico, evaluado en el momento actual y que debe ser siempre el menor posible variando en función de la gravedad de la enfermedad, y otro longitudinal, la estabilidad, entendida como la ausencia de agudizaciones o de empeoramiento clínico a lo largo del tiempo.
En los últimos años, han sido diversos los trabajos publicados con el fin de validar este concepto con la utilización de diferentes variables y umbrales ajustados a la gravedad de la enfermedad24, 25, 26. En los diferentes estudios publicados, se ha podido comprobar la aplicabilidad de este concepto en la práctica clínica diaria, alcanzando el objetivo de control en un 30-60% en las diferentes series publicadas. Asimismo, se ha objetivado la correlación entre el buen control de la enfermedad con una mejor calidad de vida, con un menor número de eventos clínicos adversos como las exacerbaciones a corto y largo plazo, así como con una mejor supervivencia27, 28, 29, 30.
Es por ello, que recientemente, se ha publicado en la última actualización de GesEPOC2, una escala diseñada y validada para facilitar al clínico la evaluación del control del paciente basado en una serie de variables muy sencillas y fáciles de obtener en cada visita médica. El impacto de la enfermedad se evalúa con cuatro preguntas basadas en la coloración del esputo, la necesidad del uso de broncodilatadores de corta duración, la actividad física realizada y el grado de disnea según la escala modificada del Medical Research Council (mMRC) ajustada a la función pulmonar. La estabilidad del paciente se evalúa a través de dos sencillas preguntas acerca de la situación clínica del paciente en relación con la anterior visita y el número de exacerbaciones en los últimos tres meses. Cuando el paciente presenta un bajo impacto clínico y una estabilidad en el tiempo se encuentra bien controlado (fig. 3). La aplicación de esta herramienta de control puede ayudar a adecuar el tratamiento terapéutico con el fin de alcanzar los objetivos terapéuticos establecidos por las diferentes guías. Asimismo, en la última actualización de la guía GOLD, se ha incluido un check list para facilitar al clínico el seguimiento de los pacientes en las consultas.
Figura 3.
Control de la EPOC. Adaptado de Soler-Cataluña et al23.
Para conseguir una mejor atención y el más adecuado seguimiento de los pacientes con EPOC es fundamental la coordinación entre los diferentes niveles asistenciales que asisten a estos pacientes.
En un primer nivel asistencial se atiende a aquellos pacientes estables de bajo riesgo y con buena evolución. En las visitas de seguimiento de estos pacientes se debe identificar el nivel de riesgo y el grado de control. Se debe realizar una espirometría anual en caso de estabilidad o antes si existe un empeoramiento de la sintomatología o si se realiza un cambio de tratamiento. Se realizará una radiografía de tórax para descartar complicaciones, especialmente en los pacientes fumadores y se debe evaluar la calidad de vida percibida por el paciente a través del COPD Assessment Test (CAT). Este cuestionario es muy útil, ya que permite identificar aspectos de la enfermedad que pueden pasar desapercibidos en el interrogatorio habitual, detectando cambios clínicamente importantes cuando existe un cambio de 2 unidades entre diferentes visitas. Un mal control de la enfermedad y una puntuación del CAT elevada, aun en presencia de una función pulmonar conservada o un bajo nivel de síntomas, debe poner al clínico en alerta, siendo preciso un análisis detallado de las posibles causas de esta falta de control: necesidad de incremento de la intensidad del tratamiento, hábito tabáquico, pérdida de acondicionamiento físico, mala técnica inhalatoria, comorbilidades asociadas a la enfermedad, etc.
Los pacientes de alto riesgo se deben seguir en las consultas de neumología donde se podrá realizar una evaluación más completa del paciente.
¿Existen diferentes fenotipos en las agudizaciones de la EPOC?
Las agudizaciones de la EPOC contribuyen de forma negativa al curso y control de la enfermedad, siendo causa de un gran deterioro en la calidad de vida de estos pacientes e incremento del consumo de recursos sanitarios. La guía GOLD1 define la exacerbación de EPOC como un empeoramiento agudo de los síntomas respiratorios, diferente a las variaciones normales diarias y que requiere un tratamiento adicional. La GesEPOC, acuña el nuevo termino «síndrome de agudización de EPOC» (SAE) y lo define como un episodio de inestabilidad clínica que se produce en un paciente con EPOC como consecuencia del agravamiento de la limitación espiratoria al flujo aéreo o del proceso inflamatorio subyacente, y se caracteriza por un empeoramiento agudo de los síntomas respiratorios respecto de la situación basal del paciente31. Tanto la EPOC como sus agudizaciones, se caracterizan por ser complejas y heterogéneas, por lo que es de gran utilidad identificar los factores implicados en su aparición. Aproximadamente el 70% de los SAE son causados por infecciones respiratorias y el 20-30% restante se debe a inflamación eosinofílica, contaminación ambiental, humo de tabaco, mala adherencia al tratamiento o sin causa conocida.
En 2011, un estudio de Bafhadel et al.32 en busca de índices de inflamación e infección, identificó cuatro posibles fenotipos de agudizaciones: bacteriano (55%), vírico (28%), eosinofílico (28%) y paucinflamatorio (14%). Se identificaron diferentes biomarcadores: la interleuquina 1β (IL-1β) en esputo en las agudizaciones bacterianas, la CXCL10 en sangre en las agudizaciones víricas y los eosinófilos en sangre en las agudizaciones eosinofílicas.
El SAE de fenotipo bacteriano es predominantemente neutrofílico, objetivándose en el esputo con mayor frecuencia Haemophilus influenzae, Streptococcus pneumoniae y Moraxella catarrhalis. Se asocia a una mayor estancia hospitalaria y es un predictor independiente de ingreso en unidades de cuidados intensivos. Los virus son detectados en más de un 50% de las SAE, siendo el más frecuente el rinovirus y asociándose en un 25% a coinfección bateriana. El SAE eosinofílico se relaciona con una reducción significativa de la función pulmonar pero con una menor estancia hospitalaria y mejor respuesta al tratamiento con corticoides orales que los no eosinofílicos33. En cuanto al SAE paucinflamatorio, hasta 1/3 de todas las agudizaciones pueden no tener causa conocida, predominando en este grupo el componente mecánico pulmonar. Es importante recordar que ante todo SAE es fundamental realizar un buen diagnóstico diferencial con otras patologías como el tromboembolismo pulmonar, neumotórax, derrame pleural, traumatismo torácico, insuficiencia cardiaca, arritmias cardiacas, cardiopatía isquémica, ansiedad y obstrucción de la vía aérea superior entre otras34.
En conclusión, existen diferentes fenotipos en los SAE con implicaciones en la mortalidad, morbilidad y calidad de vida de los pacientes, siendo necesarios más estudios para definir mejor los fenotipos y sus biomarcadores.
¿Cuál es el pilar del tratamiento farmacológico de la EPOC?
La EPOC es una enfermedad respiratoria prevenible y tratable. Los objetivos generales del tratamiento de la EPOC son reducir los síntomas y el riesgo de exacerbaciones, así como mejorar el control de la enfermedad y su pronóstico a medio y largo plazo. El pilar fundamental del tratamiento farmacológico de la EPOC en fase estable es la terapia inhalada, que debe individualizarse según las características, el nivel de síntomas y el riesgo de exacerbaciones del paciente.
GesEPOC2 propone un esquema terapéutico inicial basado en la utilización de broncodilatadores de larga duración (beta 2-adrenérgicos [LABA] y anticolinérgicos [LAMA]) en monoterapia o en combinación en función del nivel de riesgo del paciente (grado de disnea, historial de exacerbaciones en el año previo y función pulmonar). Según esta recomendación, en los pacientes de riesgo bajo, el tratamiento farmacológico estará guiado por los síntomas, mientras que en aquellos de riesgo alto vendrá determinado por el fenotipo clínico.
La incorporación de la eosinofilia periférica como un biomarcador distintivo en los pacientes agudizadores viene determinada por nueva evidencia disponible que avala su papel predictor en la respuesta clínica al tratamiento con corticosteroides inhalados. Los pacientes con fenotipo clínico agudizador se subdividirán en eosinofílicos y no eosinofílicos según presenten o no una concentración superior a 300 eosinófilos/mm3, de forma que esta característica será la que marque un tratamiento diferencial, con o sin la adición del corticosteroide inhalado35.
La GOLD1 a diferencia de GesEPOC clasifica a los pacientes según el nivel de síntomas que presentan y el historial de exacerbaciones, sin tener en cuenta la función pulmonar y, en base a ello, establece un esquema de tratamiento. Si bien el método de clasificación que proponen estos documentos es diferente, la mayor parte de las recomendaciones que establecen son superponibles36.
En cuanto al tratamiento de mantenimiento, ambas guías apuestan por realizar una evaluación y ajuste dinámico del mismo a lo largo del seguimiento. Estas estrategias conllevan una intensificación o reducción (escalado/desescalado) de tratamiento y deben ir siempre precedidas de la comprobación de una correcta técnica inhalatoria y una adherencia adecuada a la medicación pautada37.
La detección de las comorbilidades asociadas a la enfermedad como son la patología cardiovascular, la ansiedad y depresión o la osteoporosis, entre otras, deben ser identificadas y tratadas conjuntamente con la enfermedad pulmonar.
Por último, no debemos olvidar la importancia del tratamiento no farmacológico en el paciente con EPOC. Es fundamental la deshabituación tabáquica en los pacientes fumadores, el incentivar la actividad física y la rehabilitación respiratoria y el abordaje nutricional. A nivel preventivo es muy relevante el papel de las vacunas, especialmente por el problema de inmunosenescencia que presentan los pacientes de más edad. Es por ello que no solo se contempla la vacunación frente a la gripe, el neumococo o la COVID-19, sino que también se están realizando estudios sobre la relevancia de la vacunación frente a la tosferina, el herpes zóster o el virus respiratorio sincitial.
Autoría/colaboradores
Todos los autores han contribuido en la elaboración y redacción del manuscrito.
Financiación
Los autores declaran que el presente manuscrito no cuenta con financiación por ninguna entidad pública ni privada.
Conflicto de intereses
Elena García Castillo ha recibido honorarios por impartir conferencias de AstraZeneca y GlaxoSmithKline. Gianna Vargas ha recibido honorarios por impartir conferencias de AstraZeneca. José Alfonso García Guerra ha recibido honorarios por impartir conferencias de GlaxoSmithKline y Boehringer Ingelhein. Tamara Alonso Pérez ha recibido horonarios por impartir conferencias de AstraZenecea y GlaxoSmithKline.
Alejandra López declara no tener ningún conflicto de intereses.
Bibliografía
- 1.Global strategy for prevention, diagnosis and management of COPD. GOLD; 2022 [consultado 27 Nov 2021]. Disponible en https://goldcopd.org.
- 2.Miravitlles M., Calle M., Molina J., Almagro P., Gómez J.T., Trigueros J.A., et al. Spanish COPD Guidelines (GesEPOC) 2021: Updated Pharmacological treatment of stable COPD. Arch Bronconeumol. 2022;58(1):69–81. doi: 10.1016/j.arbres.2021.03.005. [DOI] [PubMed] [Google Scholar]
- 3.Kohansal R., Martinez-Camblor P., Agusti A., Buist A.S., Mannino D.M., Soriano J.B. The natural history of chronic airflow obstruction revisited: an analysis of the Framingham off spring cohort. Am J Respir Crit Care Med. 2009;180:3–10. doi: 10.1164/rccm.200901-0047OC. [DOI] [PubMed] [Google Scholar]
- 4.Salvi S.S., Barnes P.J. Chronic obstructive pulmonary disease in non-smokers. Lancet. 2009;374(9691):733–743. doi: 10.1016/S0140-6736(09)61303-9. [DOI] [PubMed] [Google Scholar]
- 5.Marchetti N., Garshic E., Kinney G.L., McKenzie A., Stinson D., Lutz S.M., et al. Association between occupational exposure and lung function, respiratory symptoms and high-resolution computed tomography imaging in COPDGene. Am J Respir Crit Care Med. 2014;190(7):56–62. doi: 10.1164/rccm.201403-0493OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Doiron D., Hoogh K., Probst-Hensch N., Fortier I., Cai Y., de Matteis S. et al. Air pollution, lung function and COPD: results from the population-based UK Biobank study. Eur Respir J. 2019;54:1802140. doi: 10.1183/13993003.02140-2018. [DOI] [PubMed] [Google Scholar]
- 7.Fletcher C., Peto R. The natural history of chronic airflow obstruction. Br Med J. 1977;1:1645. doi: 10.1136/bmj.1.6077.1645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Lange P., Celli B., Agustí A., Boje Jensen G., Divo M., Faner R., et al. Lung-function trajectories leading to chronic obstructive pulmonary disease. N Engl J Med. 2015;373:111–122. doi: 10.1056/NEJMoa1411532. [DOI] [PubMed] [Google Scholar]
- 9.Toledo-Pons N., Cosío B.J., del Valle Velasco, Casanova C. Enfermedad pulmonar obstructiva crónica de origen no tabáquico. Arch Bronconeumol. 2017;53(2):45–46. doi: 10.1016/j.arbres.2016.07.013. [DOI] [PubMed] [Google Scholar]
- 10.Antón Díaz, Ruiz López D., Ancochea Bermúdez J. Herencia y ambiente en la EPOC. Arch Bronconeumol. 2007;43(Supl1):10–17. doi: 10.1016/S0210-5705(09)71003-9. [DOI] [Google Scholar]
- 11.McDonald V., Fingleton J., Agusti A., Hiles S.A., Clark V.L., Holland A.E., et al. Treatable traits: a new paradigm for 21st century management of chronic airway diseases: Treatable Traits Down Under International Workshop report. Eur Respir J. 2019;9(535) doi: 10.1183/13993003.02058-2018. 1802058. [DOI] [PubMed] [Google Scholar]
- 12.Agustí A. The path to personalised medicine in COPD. Thorax. 2014;69:857–864. doi: 10.1136/thoraxjnl-2014-205507. [DOI] [PubMed] [Google Scholar]
- 13.Han M.K., Agusti A., Calverley P.M., Celli B.R., Criner G., Curtis J.L., et al. Chronic obstructive pulmonary disease phenotypes: the future of COPD. Am J Respir Crit Care Med. 2010 Sep 1;182(5):598–604. doi: 10.1164/rccm.200912-1843CC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Dornhorst A.C. Respiratory insufficiency. Lancet. 1955;268(6876):1185. doi: 10.1016/S0140-6736(55)90689-9. [DOI] [PubMed] [Google Scholar]
- 15.Plaza V., Álvarez F., Calle M., Casanova C., Cosío B.G., López-Viña A., et al. Consenso sobre el solapamiento de asma y EPOC (ACO) entre la Guía española de la EPOC (GesEPOC) y la Guía Española para el Manejo del Asma (GEMA) Arch Bronconeumol. 2017;53(8):443–449. doi: 10.1016/j.arbres.2017.04.002. [DOI] [PubMed] [Google Scholar]
- 16.Miravitlles M., Soler-Cataluña J.J., Calle M., Molina J., Almagro P., Quintano J.A., et al. Spanish COPD guidelines (GesEPOC) Pharmacological treatment of stable COPD. Arch Bronconeumol. 2012;48:247–257. doi: 10.1016/j.arbres.2012.04.001. [DOI] [PubMed] [Google Scholar]
- 17.Pellegrino R., Viegi G., Brusasco V., Crapo R.O., Burgos F., Casaburi R., et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26:948–968. doi: 10.1183/09031936.05.00035205. [DOI] [PubMed] [Google Scholar]
- 18.Miller M.R., Hankinson J., Brusasco V., Burgos F., Casaburi R., Coates A., et al. Standardisation of spirometry. Eur Respir J. 2005;26:319–338. doi: 10.1183/09031936.05.00034805. [DOI] [PubMed] [Google Scholar]
- 19.Represas Represas C., Botana Rial M., Leiro Fernández V., González Silva A.I., del Campo Pérez V., Fernández-Villar A. Validación del dispositivo portátil COPD-6 para la detección de patologías obstructivas de la vía aérea. Arch Bronconeumol. 2010;46(8):426–432. doi: 10.1016/j.arbres.2010.04.008. [DOI] [PubMed] [Google Scholar]
- 20.Hardie J.A., Buist A.S., Vollmer W.M., Ellingsen I., Bakke P.S., Mørkve O. Risk of over-diagnosis of COPD in asymptomatic elderly never-smokers. Eur Respir J. 2002;20:1117–1122. doi: 10.1183/09031936.02.00023202. [DOI] [PubMed] [Google Scholar]
- 21.Soriano J.B., Alfageme I., Miravitlles M., de Lucas P., Soler-Cataluña J.J., García-Río F., et al. Prevalence and Determinants of COPD in Spain: EPISCAN II. Arch Bronconeumol. 2021;57(1):61–69. doi: 10.1016/j.arbres.2020.07.024. [DOI] [PubMed] [Google Scholar]
- 22.Harvey B.G., Strulovici-Barel Y., Kaner R.J., Sanders A., Vincent T.L., Mezey J.G., et al. Risk of COPD with obstruction in active smokers with normal spirometry and reduced diffusion capacity. Eur Respir J. 2015;46:1589–1597. doi: 10.1183/13993003.02377-2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Soler-Cataluña J.J., Alcazar B., Miravitlles M. The concept of control of COPD in clinical practice. Int J Chron Obst Pulm Dis. 2014;9:1397–1405. doi: 10.2147/COPD.S71370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Nibber A., Chrisholm A., Soler-Cataluña J.J., Alcázar B., Price D., Miravitlles M. Validating the concept of COPD control: A real-wold cohort study from the United Kingdom. COPD. 2017;14:504–512. doi: 10.1080/15412555.2017.1350154. 7. [DOI] [PubMed] [Google Scholar]
- 25.Miravitlles M., Sliwinski P., Rhee C.K., Costello R.W., Carter V., Tan J., et al. Evaluation criteria for clinical control in a prospective, international, multicenter study of patients with COPD. Respir Med. 2018;136:8–14. doi: 10.1016/j.rmed.2018.01.019. [DOI] [PubMed] [Google Scholar]
- 26.Soler-Cataluña J.J., Marzo M., Catalán P., Miralles C., Alcazar B., Miravitlles M. Validation of clinical control in COPD as a new tool for optimizing treatment. Int J Chron Obstruct Pulmon Dis. 2018;13:3719–3731. doi: 10.2147/COPD.S178149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Soler-Cataluña J.J., Alcázar B., Marzo M., Pérez J., Miravitlles M. Evaluation of changes in control status in COPD: an opportunity for early intervention. Chest. 2020;157:1138–1146. doi: 10.1016/j.chest.2019.11.004. [DOI] [PubMed] [Google Scholar]
- 28.Barrecheguren M., Kostikas K., Mezzi K., Shen S., Alcazar B., Soler-Cataluña J.J., et al. COPD clinical control as a predictor of future exacerbations: concept validation in the SPARK study population. Thorax. 2020;75:351–353. doi: 10.1136/thoraxjnl-2018-212752. [DOI] [PubMed] [Google Scholar]
- 29.Miravitlles M, Sliwinski P, Rhee CK, Costello RW, Carter V, Tan JHY, et al. Predictive value of control of COPD for risk of exacerbations: an international, prospective study. Respirology. 2020b;25(11):1136-43. https://doi.org/10.1111/resp.13811. [DOI] [PubMed]
- 30.Calle M., Rodríguez Hermosa J.L., P de Torres J., Marín J.M., Martínez González C., Fúster A., et al. COPD Clinical Control: predictors and long term follow up of the CHAIN cohort. Respir Res. 2021;22(36) doi: 10.1186/s12931-021-01633-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Soler-Cataluña JJ, Pinera P, Trigueros JA, Calle M, Casanova C, Cosío BG, et al. Actualización 2021 de la guía española de la EPOC (GesEPOC). Diagnóstico y tratamiento del síndrome de agudización de la EPOC, Archivos de Bronconeumología, https://doi.org/10.1016/j.arbres.2021.05.011. [DOI] [PubMed]
- 32.Bafadhel M., McKenna S., Terry S., Mistry V., Reid C., Haldar P., et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med. 2011;184:662–671. doi: 10.1164/rccm.201104-0597OC. [DOI] [PubMed] [Google Scholar]
- 33.Bafadhel M., McKenna S., Terry S., Mistry V., Pancholi M., Venge P., et al. Blood analysis to direct corticosteroid treatment of exacerbations of chronic obstructive pulmonary disease: a randomized placebo-controlled trial. Am J Respir Crit Care Med. 2012;186:48–55. doi: 10.1164/rccm.201108-1553OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sapey E., Bafadhel M., Bolton C.E., Wilkinson T., Hurst J.R., Quint J.K. Building toolkits for COPD exacerbations: lessons from the past and present. Thorax. 2019;74:898–905. doi: 10.1136/thoraxjnl-2018-213035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Golpe R., Dacal D., Sanjuán-López P., Martín-Robles I., Pérez de Llano L.A. Recuento de eosinófilos en sangre y eventos centrados en el paciente con enfermedad pulmonar obstructiva crónica en práctica asistencial real. Arch Bronconeumol. 2020;56(2):129–130. doi: 10.1016/j.arbres.2019.09.015. [DOI] [PubMed] [Google Scholar]
- 36.Miravitlles M. GesEPOC 2021 y GOLD 2021. ¿Más cerca o más lejos?. [published online ahead of print, 2021 Apr 20] Arch Bronconeumol (Engl Ed). 2021 doi: 10.1016/j.arbres.2021.04.009. S0300-2896(21)00130-7. doi:10.1016/j.arbres.2021.04.009 DOI: 10.1016/j.arbres.2021.04.009. [DOI] [PubMed] [Google Scholar]
- 37.Alonso-Pérez T., García-Castillo E., López Campos J.L. Escalando y desescalando el tratamiento en la enfermedad pulmonar obstrucitva crónica. ¿El inhalador importa? Arch Bronconeumol. 2021;57:604–605. doi: 10.1016/j.arbres.2021.01.018. [DOI] [PubMed] [Google Scholar]