Abstract
La apnea obstructiva de sueño (AOS) se define como la presencia de un índice de apneas-hiponeas (IAH)>15/h, predominantemente obstructivas o IAH mayor de 5 con síntomas, los síntomas clásicos son apneas observadas, somnolencia diurna y roncopatía, no obstante, hay muchos otros síntomas asociados. Para valorar la gravedad de AOS clásicamente se atendía únicamente al valor de IAH pero cada vez hay mayor evidencia en implicar otros factores. La predisposición para desarrollar AOS viene determinado por rasgos anatómicos y funcionales. Padecer AOS aumenta el riesgo de accidentes, hipertensión arterial (HTA) y se asociado con riesgo cardiovascular, diabetes mellitus (DM), arrítmica cardiaca y neoplasias. Para valorar la probabilidad de AOS se han desarrollado cuestionarios y escalas para valorar síntomas, el diagnóstico de certeza se obtiene mediante polisomnografía (PSG) que es la prueba gold standard, o bien la poligrafía que es una prueba diagnóstica más simple y accesible para el diagnóstico validada, la utilización de una u otra dependerá de la sospecha y las comorbilidades asociadas. Los tratamientos para la apnea del sueño cada vez tienden a ser más individualizado en función de las características del paciente y todos son complementarios. Las medidas higiénico-dietéticas debe aplicarse en todos los pacientes, la presión positiva continua en la vía respiratoria (CPAP) es el tratamiento más efectivo y con mayor evidencia, pero también se dispone de otros tratamientos como los dispositivos de avance mandibular (DAM), la terapia postural y opciones quirúrgicas entre otros. La telemedicina está avanzando en el seguimiento de los pacientes con AOS, tanto desde las consultas no presenciales como el control de los equipos mediante wifi para valorar la adherencia, eficacia y correcto control de la terapia.
Palabras clave: Apnea obstructiva sueño (AOS), Diagnóstico, Consecuencias, Tratamiento, Telemedicina
Abstract
Obstructive sleep apnea (OSA) is defined as the presence of an apnea-hyponea index (AHI)>15/h, predominantly obstructive or AHI greater than 5 with symptoms, the classic symptoms are observed apneas, daytime sleepiness and snoring, however, there are many other associated symptoms. To assess the severity of OSA, classically, only the AHI value was considered, but there is increasing evidence to implicate other factors. The predisposition to develop OSA is determined by anatomical and functional features. Having OSA increases the risk of accidents, high blood pressure (HBP) and is associated with cardiovascular risk, diabetes mellitus (DM), cardiac arrhythmia and neoplasms. To assess the probability of OSA, questionnaires and scales have been developed to assess symptoms, the certain diagnosis is obtained by polysomnography (PSG), which is the gold standard test, or polygraphy, which is a simpler and more accessible diagnostic test for diagnosis validated, the use of one or the other will depend on the suspicion and the associated comorbidities. Treatments for sleep apnea increasingly tend to be more individualized based on the characteristics of the patient and all are complementary. Hygienic-dietary measures should be applied in all patients, continuous positive airway pressure (CPAP) is the most effective treatment and with the most evidence, but other treatments are also available such as mandibular advancement devices (MAD), postural therapy and surgical options among others. Telemedicine is advancing in the follow-up of patients with OSA, both from non-face-to-face consultations and control of equipment via Wi-Fi to assess adherence, efficacy and correct control of therapy.
Keywords: Obstructive sleep apnea (OSA), Diagnosis, Consequences, Treatment, Telemedicine
¿Cuál es la definición actual de la apnea del sueño?
Desde el año 1976 en el que Guilleminault et al.1 definieron el término de síndrome de apnea del sueño para describir sujetos con apneas obstructivas y somnolencia diurna durante el día, tanto la definición como la nomenclatura de dicha enfermedad, se ha ido modificando a lo largo de los años. Así, en el documento de consenso nacional de 2005, se utilizó el concepto de síndrome de apneas-hipopneas del sueño (SAHS), igualando la importancia de las apneas e hipopneas producidas en esta enfermedad2. El documento internacional de consenso (DIC) sobre apnea obstructiva del sueño publicado en 20223 se decide simplificar la nomenclatura y eliminar la palabra «hipopnea», así como la palabra «síndrome», que es una terminología anticuada que se aleja de la realidad actual de la enfermedad. Por tanto, se recomienda usar la denominación de «apnea obstructiva del sueño» y sus siglas «AOS». En relación con la definición, el DIC considera la AOS cuando se cumplen los puntos 1 o 2:
-
1.
La presencia de un índice de apneas-hipopneas (IAH) ≥ 15 h, predominantemente obstructivas.
-
2.
La presencia de un IAH ≥ 5 h acompañado de uno o más de los siguientes factores: excesiva somnolencia durante el día, sueño no reparador, cansancio excesivo y/o deterioro de la calidad de vida relacionada con el sueño, no justificables por otras causas.
Que un paciente sea roncador, ¿implica que tenga apnea del sueño? ¿Está la somnolencia diurna siempre presente en los pacientes con AOS no tratados?
Aunque la tríada clásica de la AOS se caracteriza por la presencia de ronquidos, la excesiva somnolencia diurna (ESD) y las apneas observadas, no todos los sujetos roncadores presentan una AOS (muchos varones a partir de los 40 años y mujeres posmenopáusicas roncan sin padecer AOS), ni todos los pacientes con AOS presentan ESD. La presentación clínica difiere mucho de unos pacientes a otros, e incluso se ha descrito que hay algunos grupos concretos, como las mujeres y los ancianos, cuyas manifestaciones y consecuencias clínicas difieren de lo habitual3.
Además de la tríada clásica, en la apnea del sueño aparecen otra serie de síntomas tanto diurnos (sueño no reparador, cansancio, cefalea matutina, irritabilidad, apatía, dificultad para la concentración, pérdida de memoria, disminución de la líbido, impotencia) como nocturnos (episodios asfícticos, diaforesis, despertares frecuentes, nicturia, sueño agitado, insomnio y reflujo gastroesofágico)3.
¿Cómo se determina la gravedad de la apnea obstructiva del sueño?
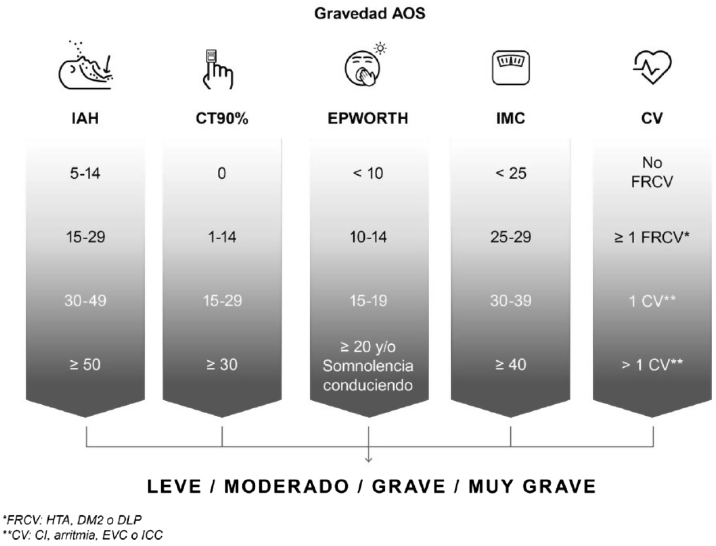
Clásicamente se ha definido la gravedad de la AOS según el valor de índice de apnea hipopnea (IAH), indicando un IAH ≥ 30 una AOS grave, un IAH 15-30 moderado y un IAH < 15 leve. Sin embargo, en los últimos años este ha sido un tema muy debatido, puesto que muchas de las consecuencias sistémicas de la AOS se producen debido a otros factores no reflejados en el IAH, como es la hipoxia intermitente. En el DIC, se propone una valoración de la gravedad de la AOS mucho más completa, que tiene en cuenta, no solo el IAH, sino la sintomatología, es decir, la somnolencia que presente el paciente, las comorbilidades, el índice de masa corporal, así como la gravedad de la hipoxia3 (fig. 1). No obstante, no hay evidencia científica para establecer unos límites en gravedad en las diferentes variables, por lo que se precisan investigaciones en el futuro en este ámbito.
Figura 1.
Valoración de la gravedad de la apnea obstructiva del sueño: Se establecen diferentes variables que influyen en la gravedad como es el índice de apnea del sueño (IAH), la insuficiencia respiratoria nocturna (CT90%), la somnolencia diurna (medido mediante test de Epworth, el índice de masa corporal [IMC] y las comorbilidades cardiovasculares). Extraída del DIC [3].
¿Todos los pacientes con AOS son obesos? ¿Cuáles son los fenotipos fisiopatológicos descritos hasta ahora en la AOS?
A pesar de la que la obesidad es la causa fundamental de la AOS en el adulto, una proporción sustancial de pacientes con AOS no son obesos. Estudios previos estiman que los pacientes no obesos constituyen al menos el 20% de la población adulta con AOS4. Similar a la heterogeneidad clínica, la patogénesis de la AOS también es multifactorial. Han sido muchos los avances en la última década en relación con los factores implicados en la aparición de eventos respiratorios5, 6. Gracias a estos avances, a día de hoy, podemos hablar de la existencia de los denominados fenotipos fisiopatológicos, que pueden variar sustancialmente entre los pacientes o en un mismo paciente, y que contribuyen al desarrollo de la AOS, pudiendo tener implicaciones futuras en el manejo como dianas terapéuticas dirigidas hacia el tratamiento personalizado5.
Se han descrito al menos 4 fenotipos fisiopatológicos, dentro de estos se diferencian a su vez entre factores anatómicos y no anatómicos (fig. 2).
Figura 2.
Factores anatómicos y no anatómicos implicados en la fisiopatología de la AOS. Estos factores pueden variar sustancialmente entre los pacientes o en un mismo paciente.
Factor anatómico
-
1)
El factor clave implicado en la AOS es el aumento de la colapsabilidad de la vía aérea superior (VAS)
Factor no anatómico o funcional
-
2)
Ineficacia de la contracción muscular durante el sueño
-
3)
Umbral bajo del despertar
-
4)
Inestabilidad del control respiratorio7.
¿Qué factores anatómicos y no anatómicos pueden aumentar la colapsabilidad de la vía aérea superior en la AOS?
El depósito de tejido graso alrededor de la VAS como consecuencia de la obesidad, es el principal factor de riesgo anatómico para el aumento de la colapsabilidad de la vía respiratoria8. Estos depósitos grasos estrechan el espacio faríngeo, depositándose en muchas ocasiones en la lengua o en las propias fibras musculares de la VAS. Además de la obesidad existen otros factores que pueden alterar la anatomía de la VAS. Entre estos destacan a nivel de la rinofaringe la obstrucción nasal y a nivel de la orofaringe la hipertrofia amigdalar, la hipertrofia de úvula, y malformaciones a nivel del paladar entre otras. Las anomalías craneofaciales, como la micrognatia y la retrognatia, así como las alteraciones dentofaciales graves pueden tener también una implicación importante en la patogénesis de los pacientes con AOS.
Dentro de los factores no anatómicos implicados en la patogénesis de la AOS destaca el factor muscular, un bajo umbral de despertar y la inestabilidad del control respiratorio.
Para comprender el factor muscular implicado en la patogénesis de la AOS, debemos hablar de los músculos dilatadores de la VAS, principales músculos responsables de mantener la permeabilidad de la VAS durante el sueño. El geniogloso (GG) es el principal de estos músculos. Al inicio del sueño, la actividad de GG cae más rápidamente en pacientes con AOS que en sujetos sanos, disminuyendo la eficacia muscular, y sufriendo un descenso del tono muscular, estrechando la luz faríngea, y consecuentemente incrementando la resistencia y obstrucción de la VAS9.
Algunos pacientes con AOS pueden presentar un bajo umbral de despertar (nivel de arousabilidad bajo), favoreciendo la inestabilidad ventilatoria, y una menor activación de la musculatura de la VAS, facilitando así la aparición de eventos respiratorios obstructivos10.
La inestabilidad del control respiratorio favorecida por una hipersensibilidad de los quimiorreceptores, con el aumento de la ventilación como respuesta excesiva a la hipoxia y la hipercapnia (Loop Gain elevado) está presente frecuentemente en los pacientes con AOS moderado-grave3.
¿A día de hoy se ha demostrado alguna implicación directa de estos fenotipos fisiopatológicos en el manejo de los pacientes con AOS?
Además del papel que juegan los fenotípicos fisiopatológicos en la contribución a la patogénesis de la AOS, estos son importantes para implementar nuevas estrategias terapéuticas11. Los pacientes en los que predomina el factor anatómico pueden beneficiarse del tratamiento con CPAP, de la pérdida de peso y/o cirugía. En pacientes con ineficacia de la contracción muscular durante el sueño, tratamientos centrados en favorecer la activación muscular del geniogloso como son la terapia miofuncional y la estimulación del nervio hipogloso podrían tener una mayor indicación9. Se ha postulado, que un umbral de excitación bajo puede ser un factor fisiológico que contribuye a una mala adherencia y un bajo cumplimiento de la CPAP12, pudiendo beneficiarse de otros tratamientos farmacológicos que aumenten el umbral de excitación. Así mismo, la terapia con oxígeno13, así como los inhibidores de la anhidrasa carbónica podrían estar indicados en el tratamiento de pacientes con AOS y Loop Gain elevado14.
¿La excesiva somnolencia diurna y el resto de síntomas son el único motivo por el que tratamos la apnea del sueño?
No. Sabemos que la fragmentación de sueño es la causa fundamental de los síntomas de los pacientes, los accidentes de tráfico y laborales y la disminución de su calidad de vida15. Sin embargo, también tratamos pacientes con apnea estando asintomáticos, debido a su asociación demostrada con enfermedades sobre todo de índole cardiovascular.
Los episodios repetidos de desaturaciones de oxígeno en sangre durante el sueño, los cambios de presión intratorácica que producen alteraciones hemodinámicas y la activación simpática secundaria a la hipoxemia, son los principales mecanismos responsables de estas consecuencias16.
¿Aumenta entonces el riesgo de muerte durante el sueño si se padece una AOS?
Esta relación no está demostrada. Sin embargo, sí existe una asociación entre la AOS y el riego de desarrollar hipertensión arterial (HTA), fallo cardiaco y arritmias en estos pacientes.
Se sabe que la presencia de apneas impide la bajada fisiológica de cifras de tensión arterial durante el sueño (patrón non-dipping nocturno), lo que aumenta el riesgo de padecer HTA diurna y que esta sea refractaria al tratamiento17.
Además, la AOS se asocia con la presencia de arritmias cardiacas nocturnas, secundarias a la hipoxemia y activación del sistema nervioso simpático18, siendo las más frecuentes las extrasístoles ventriculares. La fibrilación auricular es la arritmia más estudiada por sus consecuencias clínicas, se ha relacionado con la presencia de apnea del sueño, siendo más frecuente a mayor gravedad y aumentando el riesgo de recurrencias a pesar de tratamiento con ablación o cardioversión eléctrica19.
Así mismo, 2 grandes estudios (cohorte de Wisconsin con 1.131 sujetos seguidos durante 24 años y la cohorte de Sleep Heart Health Study con 4.422 sujetos seguidos durante 8 años) demostraron que la AOS grave no tratada aumenta el doble el riesgo de desarrollar insuficiencia cardiaca20, 21. Sin embargo, las investigaciones sugieren cada vez con más evidencia que la apnea tipo central y en concreto la respiración de Cheyne-Stokes parece tener un papel protector en la supervivencia de estos pacientes, por lo que su tratamiento es controvertido en la actualidad22.
Por otro lado, la prevalencia de la AOS en pacientes con cardiopatía isquémica es elevada por mecanismos similares a los anteriores. Sin embargo, 2 estudios recientes (ISAAC y SAVE) no pudieron demostrar que el tratamiento de la AOS reduzca el riesgo de padecer nuevos eventos cardiovasculares isquémicos y de mortalidad en estos pacientes23, 24.
¿Existe riesgo de padecer otras enfermedades no cardiológicas en relación con la AOS?
Sí. La presencia de apnea del sueño aumenta hasta 2-3 veces el riesgo de padecer un ictus o accidente cerebrovascular, sobre todo en varones por mecanismo similares a los cardiovasculares, y las evidencias cada vez son más claras en relación con el aumento de la recurrencia de los mismos si no se trata25.
Con respecto a consecuencias metabólicas, la presencia de la AOS aumenta la actividad simpática y el estrés oxidativo, demostrándose que es un factor de riesgo independiente para desarrollar diabetes mellitus tipo 2. Además, se ha demostrado que la prevalencia de síndrome metabólico (obesidad abdominal, HTA, dislipemia y resistencia a la insulina) es de 6 a 9 veces más frecuente en pacientes con AOS que en la población general. En esta línea, también se ha demostrado que padecer AOS aumenta el riesgo de desarrollo de nefropatía26.
Desde hace unos años se encuentra en auge la investigación en torno a la relación que existe entre la AOS y el cáncer. La fragmentación de sueño, la hipoxia intermitente, el estrés oxidativo y la inflamación sistémica podrían ser los mecanismos que explicaran el aumento de la velocidad de crecimiento y la diseminación tumoral, siendo el melanoma y el cáncer de pulmón los más estudiados27.
Por último, se ha relacionado también el padecimiento de la AOS con efectos a nivel neurocognitivo. La fragmentación de sueño, la hipoxia e hipoperfusión cerebral y la neuroinflamación se ha relacionado con el desarrollo de deterioro cognitivo y enfermedades como la demencia tipo Alzheimer28. Por mecanismos similares, se ha demostrado que padecer la AOS aumenta hasta 2 veces el riesgo de desarrollar un trastorno de ánimo tipo depresivo, sobre todo en las mujeres.
¿Cómo se diagnostica la apnea obstructiva del sueño y cuál es el principal método diagnóstico?
La sospecha de apnea del sueño se establece en base a la clínica y la exploración del paciente, aunque ningún síntoma, signo o conjunto de estos, ha demostrado la suficiente rentabilidad para el diagnóstico. Disponemos de cuestionarios que nos ayudan a determinar la probabilidad de presentar apnea del sueño (Berlin, NoSAS, STOP-Bang) o valorar ciertos aspectos clínicos como la somnolencia (Epworth)3. Para establecer el diagnóstico de confirmación, existen diferentes métodos diagnósticos que identifican la presencia de eventos respiratorios durante el sueño. Le elección de uno u otro debe estar determinada por un profesional experto en medicina del sueño en base a la clínica del paciente, sus características, comorbilidades y el resultado de los cuestionarios.
La polisomnografía (PSG) es una técnica en la que se registran, analizan e interpretan diversas variables fisiológicas de forma simultánea durante el sueño y se considera la prueba gold standard para el diagnóstico de los trastornos del sueño. Se trata de un método complejo que incluye parámetros cardiorrespiratorios (esfuerzo respiratorio, flujo aéreo y saturación de O2) y neurofisiológicos (EEG, EOG y EMG). Se realiza generalmente en el ámbito hospitalario bajo supervisión, y precisa de personal formado para su interpretación. Por todo ello, es una prueba poco eficiente para el diagnóstico de una enfermedad tan prevalente como la apnea del sueño29. Ante este hecho, se han desarrollado métodos menos complejos y costosos y más accesibles. La poligrafía respiratoria (PR) es un sistema más sencillo, y más cómodo para el paciente que no requiere la presencia de un técnico y donde se registra la respiración, el esfuerzo toraco-abdominal y la pulsioximetría (4-7 canales). En la práctica clínica, la PSG y la PR son los métodos más utilizados en la mayoría de las unidades de sueño. Ambos sistemas han presentado un enorme desarrollo tecnológico existiendo en la actualidad una gran variedad de equipos comercializados, incluso algunos permiten la realización de PSG domiciliaria30, 31.
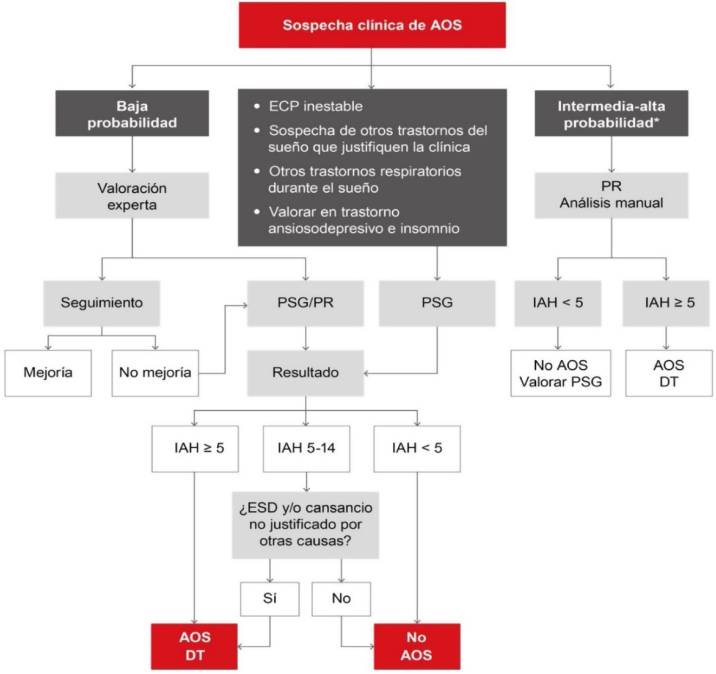
Según la sospecha clínica y/o las comorbilidades asociadas o factores de riesgo, está indicado realizar un tipo de prueba u otra, como así está indicado en el DIC (fig. 3).
Figura 3.
Algoritmo diagnóstico en la AOS. Según la sospecha clínica o comorbilidades está indicado realizar o no una prueba diagnóstica. La poligrafía respiratoria confirma si es positiva en caso de intermedia o alta sospecha clínica. La polisomnografía es la prueba gold standard para el diagnóstico de la AOS, y la indicada si existe comorbilidades (*ver algoritmo) o sospecha de otros trastornos respiratorios de sueño. Extraída del DIC [3].
¿Cuál es el futuro en el diagnóstico de la apnea del sueño?
La tendencia actual de las nuevas tecnologías es crear dispositivos diagnósticos que interfieran en menor medida con el sueño del paciente. Se han utilizado colchones o sensores colocados bajo el colchón, que detectan los movimientos respiratorios y cardiacos del paciente32, 33. Otro método en el que se está trabajando en la actualidad es la tonometría arterial periférica que mide la amplitud y la variabilidad del tono arterial periférico mediante un sencillo dispositivo colocado en el dedo34. El ECG también ha sido ampliamente estudiado para la identificación de pacientes con apnea del sueño, basándose en la variación que sufre el mismo durante el ciclo respiratorio. Por último, en el intento de minimizar la interferencia con el sueño del paciente, incluso se ha empleado la grabación de señales de audio (que identifican ronquidos y pausas respiratorias) o de vídeo (registro de movimientos torácicos). A pesar de todos estos avances, ninguna de estas novedosas técnicas ha demostrado suficiente evidencia frente a los métodos diagnósticos convencionales.
¿Cuál es el objetivo del tratamiento y las primeras medidas a adoptar en la AOS?
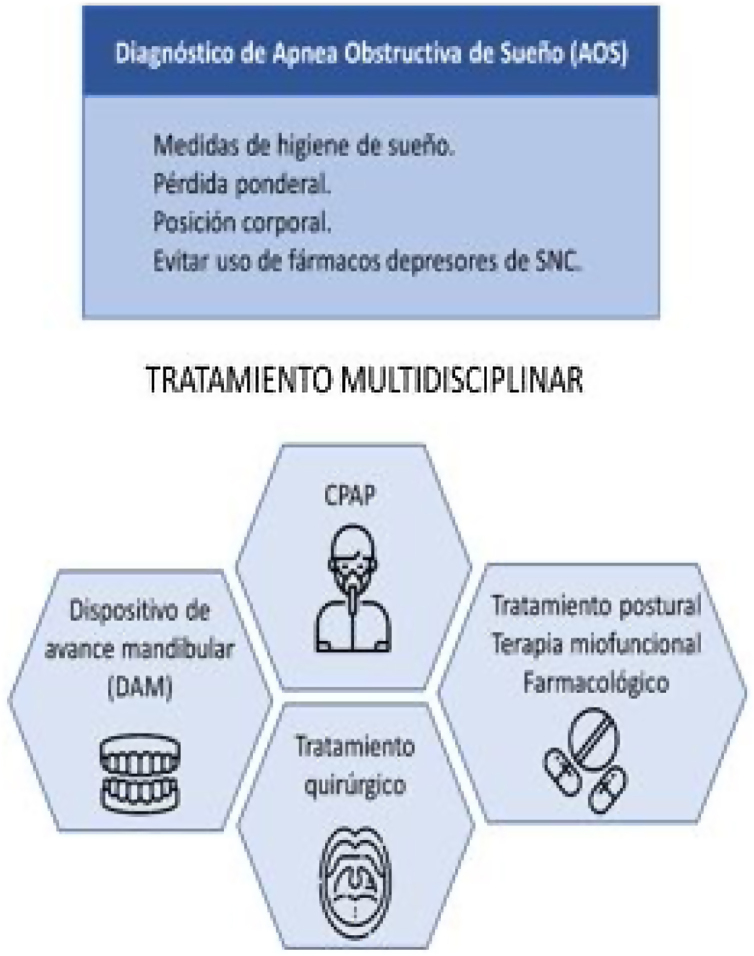
El tratamiento de la AOS tiene como objetivo evitar el colapso de la vía aérea superior (VAS) durante el período nocturno, con la consiguiente reducción del IAH y la recuperación de la saturación de oxígeno. Estos cambios deben conducir a una mejoría en la sintomatología del paciente, en la calidad de sueño y a una menor morbilidad. Para optimizar el resultado del tratamiento, se requiere un abordaje multidisciplinar con diferentes opciones terapéuticas complementarias3 (fig. 4).
Figura 4.
Tratamiento multidisciplinar de la AOS y complementario.
Es recomendable hacer partícipe al paciente en su enfermedad e incorporar las siguientes medidas generales a cualquier plan de tratamiento:
-
-
Higiene de sueño, se entregan las recomendaciones3 recogidas en la tabla 1.
-
-
Pérdida ponderal en pacientes con sobrepeso u obesidad, por su asociación con un descenso del IAH29. Considerar cirugía bariátrica en aquellos pacientes con AOS e IMC > 353.
-
-
Posición corporal, se recomienda dormir en posición decúbito lateral, ya que los eventos se ven influidos por la posición supino en más del 50% de los pacientes con AOS35.
-
-
Evitar el uso de fármacos depresores del sistema nervioso central, como benzodiazepinas, opioides o alcohol. Estos fármacos pueden afectar a la VAS reduciendo el tono muscular y favoreciendo su colapso3.
Tabla 1.
Medidas higiénico-dietéticas recomendables en pacientes con AOS
| 1. Fijar la hora de dormir y despertarse, e intentar que sea todos los días a la misma hora |
| 2. No dormir durante el día; en caso de hacerlo, no debe exceder los 45 min |
| 3. Asegurar un ambiente adecuado. Dormir en una cama cómoda, con temperatura confortable, buena ventilación, sin ruidos molestos o luces innecesarias |
| 4. Evitar trabajar o recrearse en la cama con televisión, móvil, hablar por teléfono, discutir, etc. |
| 5. No prolongar excesivamente el tiempo en la cama |
| 6. Evitar el consumo de alcochol en cantidades excesivas 4-6 h antes de acostarse |
| 7. No fumar |
| 8. No tomar cafeína 6 h antes de acostarse (café, té, bebidas refrescantes, chocolate) |
| 9. Cenar ligero. No ingerir comidas copiosas, picantes o dulces 4 h antes de acostarse |
| 10. Hacer deporte de forma regular, pero no inmediatamente antes de acostarse |
AOS: apnea obstructiva de sueño.
¿Existe un tratamiento de elección en la AOS?
En la mayoría de los casos la presión positiva continua en la vía respiratoria (CPAP) se considera el tratamiento de elección, ya que está demostrado que se consigue la normalización del IAH en el 90% de los pacientes. Su aplicación consigue mantener una presión constante en la vía aérea gracias a un flujo de aire generado por una turbina, que se administra al paciente a través de una mascarilla nasal u oronasal. De esta forma se estabiliza la VAS, incrementa su área y evita su colapso35.
Según el consenso internacional de sueño publicado en 20213, el tratamiento con CPAP está recomendado en pacientes con AOS moderado o grave (IAH > 15) y que presenten: a) somnolencia diurna excesiva (Epworth > 10), b) alteraciones de la calidad de vida relacionada con el sueño (ronquido intenso, episodios de asfixia nocturna, insomnio, cefalea matutina, nicturia, deterioro del rendimiento laboral o académico, repercusión social y/o cansancio durante el día), y c) y/o HTA (especialmente si es resistente).
La presión de inicio en la CPAP debe establecerse de forma individualizada. El procedimiento de referencia es la titulación mediante polisomnografía, sin embargo, dado su coste y disponibilidad, se reserva para pacientes complejos con apneas centrales del sueño, enfermedad cardiopulmonar significativa, sospecha del síndrome de obesidad hipoventilación y/u otros trastornos del sueño asociado. Como alternativa, se utiliza la autoCPAP o una presión empírica basada en una estimación matemática, con la posterior comprobación del IAH residual a través de un estudio de sueño o mediante la tarjeta de memoria incorporada en el equipo3, 36.
Resaltar el papel de la empresa suministradora de terapias respiratorias y de la enfermería en la enseñanza del paciente, en la búsqueda de una mascarilla que minimice las fugas no intencionadas y en la vigilancia de los efectos secundarios más frecuentes como rinitis, sequedad oral o molestias en el puente nasal3, 37. Con el objetivo de un cumplimiento mínimo de 4 h por noche durante el 70% de las noches3.
¿Existen otros tratamientos? ¿Hay alternativas en la intolerancia a la CPAP?
Sí, actualmente los tratamientos para la AOS han aumentado, y disponemos de varias alternativas tanto médicas como quirúrgicas.
No obstante, si existe una causa reversible de AOS este será el tratamiento de elección, los tratamientos no son excluyentes, sino complementarios y hay pacientes que pueden requerir la aplicación de varios tratamientos a la vez3:
-
-
Dispositivo de avance mandibular (DAM), el cual se recomienda en pacientes con AOS e indicación de CPAP con intolerancia a la misma, y en pacientes con AOS leve o moderado, si existe sintomatología menor o ronquido3. El DAM consiste en un dispositivo intraoral que, mediante el avance mandibular, modifica la posición de la lengua, el paladar blando y el hueso hioides, produciendo un aumento en el diámetro de la VAS y consiguiendo una mayor estabilización y menor colapsabilidad29.
-
-
Se aboga por dispositivos realizados a medida y graduables, ya que consiguen una mejor respuesta respecto al control de los eventos y comodidad para el paciente. En un reciente metaanálisis se demuestra que el DAM reduce de forma significativa el IAH, no obstante, los estudios disponibles carecen de homogeneidad en los criterios de inclusión y objetivos37. Entre los efectos adversos destacan molestias en la zona temporomandibular y cambios oclusales debido al movimiento de las arcadas dentales29.
-
-
Terapia postural, se puede indicar en:
-
•
Pacientes con AOS posicional (eventos en supino e IAH < 15 h en otras posiciones), donde se recomienda un estudio de sueño de control.
-
•
Pacientes a tratamiento con CPAP y predominio de eventos en supino, con el objetivo de disminuir la presión del equipo.
-
•
Pacientes con predominio de eventos en supino que rechazan las terapias de primera línea de tratamiento3.
-
-
Existen diferentes métodos para el tratamiento postural, desde procedimientos domésticos como colocar una pelota de tenis en un bolsillo cosido al pijama, hasta dispositivos más sofisticados. En la actualidad existen modelos tipo banda torácica o collar, que vibran cuando el paciente se coloca en decúbito supino y fomentan su colocación en decúbito lateral34, 38.
-
-
Tratamientos alternativos como la terapia miofuncional, la EPAP nasal y la terapia de presión oral3.
¿Cuándo está indicado el tratamiento quirúrgico? ¿Existe un tratamiento farmacológico?
Para la identificación inicial de los pacientes candidatos se requiere una exploración orofaríngea en la consulta de sueño, siendo las 2 valoraciones más utilizadas: la escala de Mallampati y la de Friedman39. Dado que la obstrucción de la VAS suele ocurrir a varios niveles, el drug induced sleep endoscopy (DISE) proporciona un examen más exhaustivo y localiza las zonas de mayor colapso40, 41.
A nivel de ORL, la intervención más extendidas es la amigdalectomía en pacientes con hipertrofia amigdalar grado 3-43.
A nivel de cirugía maxilofacial, se contempla el avance bimaxilar en AOS grave con IAH > 65 que presenten colapso concéntrico en el DISE y/o alteraciones dentofaciales grave3.
Actualmente no existe un tratamiento farmacológico para la AOS, pero es un área en desarrollo, con varios ensayos clínicos en curso. Destacar los estudios combinando la atomoxetina y la oxibutinina41, así como los trabajos con los inhibidores de la anhidrasa carbónica42.
¿Qué tipo de telemedicina es utilizado en el seguimiento de pacientes con apnea obstructiva de sueño?
Hay diferentes formas de realizar el seguimiento de los pacientes, a diferencia de la forma clásica de visita presencial que es frecuente y prevalece en la práctica clínica habitual, cada vez hay más métodos que nos acompañan y fortalecen a la misma para el seguimiento de los pacientes con apnea obstructiva del sueño.
Por un lado, la existencia de un buzón de voz43 en las unidades de sueños, asistido por personal de enfermería o administrativo para emergencias o dudas en el seguimiento, ha permitido una mayor relación con las unidades de sueños y respuesta temprana a los problemas que pudieran surgir a los pacientes.
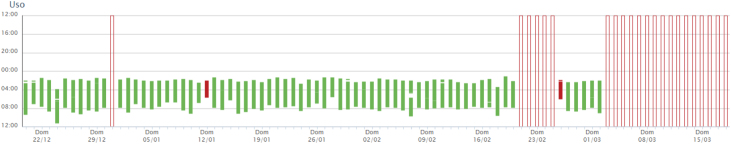
Además, el seguimiento en consulta mediante llamada o videollamada, que ha experimentado un gran auge debido a la pandemia covid, ha demostrado ser no inferior en las visitas de seguimiento frente a la visita presenciales en pacientes con AOS en tratamiento con CPAP, permitiendo monitorizar el uso correcto del dispositivo de CPAP (fig. 5) y corregir la mayoría de efectos secundarios44, 45, 46, 47, 48, y reducir las listas de espera en las primeras visitas de estos pacientes.
Figura 5.
Gráfica de adherencia obtenida mediante telemonitorización. En ella se puede valorar el rango de horas que se ha utilizado por día. El color verde significa su uso más de 4 h y rojo si lo usa menos de 4 h. Las barras vacías cuando no se conecta ese día, si la barra es discontinua es porque se ha desconectado el tratamiento en ese intervalo de tiempo.
Por otro lado, no solo se ha desarrollado la telemedicina para el seguimiento y comunicación con los pacientes, sino que el gran auge se establece en el manejo y control de los equipos ventilatorios.
¿En qué consiste la telemonitorización y qué parámetros obtenemos? ¿Qué evidencia existe con la telemonitorización?
La telemonitorización consiste en que los nuevos equipos de CPAP y posiblemente en un futuro la totalidad de ellos, disponen de un sistema de envío de información mediante wifi y plataforma online. De tal modo, que desde un centro hospitalario se puede valorar, controlar y modificar los equipos domiciliarios a distancia y a tiempo real.
Mediante telemonitorización podemos valorar los parámetros establecidos en el CPAP de presión y el resultado de la terapia en el paciente: IAH residual, horas de uso cada día y fuga (fig. 6). Además, cabe destacar de manera remota que también podemos modificarle los parámetros, permitiendo corregir al instante los problemas o terapia insuficiente detectada, de forma progresiva, evitando desplazamientos del paciente.
Figura 6.
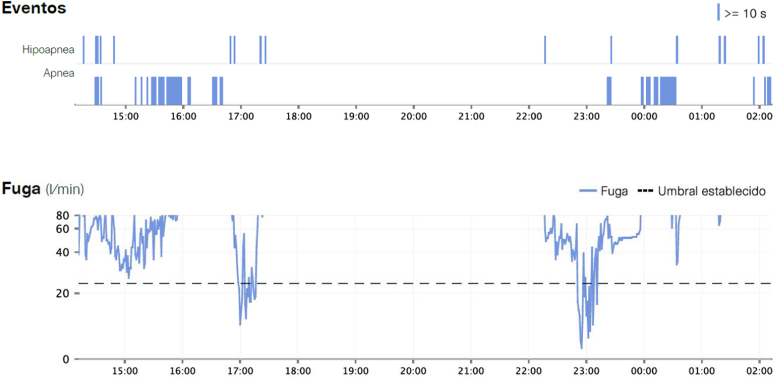
Gráfica de eventos y fuga obtenida mediante telemonitorización. En la gráfica superior se observa mediante línea azul cada uno de los eventos (hipopnea o apnea) que persisten con tratamiento y la hora en la que ocurre.
Los estudios de telemedicina están creciendo en los últimos años, especialmente en sueño, anteriormente estaba más desarrollando en la cardiología. No obstante, no hay evidencia fuertes en la misma debido a la heterogeneidad en los datos que se analizan en cada estudio, el tiempo de seguimiento, si es solo telemedicina o combinado con presencial, sanitario que lo realice…
La mayor evidencia está establecida en el aumento de la adherencia cuando se utiliza telemonitorización respecto a visitas presenciales, especialmente si se utiliza al inicio del tratamiento, y esto repercute a su vez en el seguimiento y adherencia a largo plazo49, 50, 51. Además, también es preferido por el paciente, aunque presenta el aspecto legal de requerir una autorización por el paciente debido a la información proporcionada a tiempo real52.
Detecta problemas de forma precoz y permite un mayor ajuste de parámetros, reduciendo las visitas del paciente al hospital, y a la inversa a su domicilio. Por lo que la mayoría de estudios al respecto, avalan que es coste-efectiva53.
¿Cuándo telemonitorizar a un paciente? ¿Qué utilidades puede tener la telemonitorización?
Las recomendaciones más importantes incluidas en el documento de posicionamiento sobre la telemonitorización son que la telemedicina se destina, básicamente, a sujetos con problemas de desplazamiento o con domicilio lejano y a aquellos que no cumplen de forma adecuada el tratamiento con CPAP. No obstante, un elemento clave es la individualización de los pacientes54.
Hay diferentes opciones, por un lado, se puede plantear telemonitorizar al inicio de terapia exclusivamente (3 primeros meses), en este caso hay videncia de aumento de la adherencia, se consigue detectar problemas pronto, iniciar con bajas presiones para mejorar tolerancia, titulación y subida progresiva de la presión, pero se pierden posteriores incidencias, seguimiento de pacientes complejos, y en ocasiones es insuficiente para ajuste de presión óptimo. Por otro lado, se puede realizar una telemonitorización indefinido o semi-indefinido (>3 meses), en este caso se puede intervenir en la adherencia, detectar fugas, incidencias a lo largo del tiempo, es muy importante para pacientes complejos, somnolencia no explicada y para realizar un ajuste de presión progresivo e ir regulando con los cambios de peso, por ejemplo, no obstante, este caso es más complejo para el mantenimiento de equipos y recursos sanitarios para el control de los mismos55, 56, 57.
Por tanto, la decisión de telemonitorizar o no a un paciente, puede ser por un lado con la simple intención de correcta adaptación y conseguir buena adherencia, que sería al inicio del tratamiento, o posteriormente en aquellos pacientes en los que hay dudas en la correcta corrección de eventos, adherencia, sintomatología o pecualiaridades.
Además de todo lo anteriormente comentado, la telemonitorización puede ser de utilidad e incluso llegar a sustituir en un futuro a la titulación, no obstante, hasta el momento no hay estudios que avalen esto.
La prueba gold standard para titulación de presión en CPAP es la PSG titulación, no obstante, hay estudios que indican que la titulación automática con autoCPAP puede sustituir a la misma y está indicado en el DIC para su manejo habitual3. Es entendible, que si el autoCPAP cambia su presión de forma automática según la presencia de eventos de flujo para corregirlos, si se hace mediante telemonitorización con el mismo equipo de forma manual progresivamente hasta que se obtiene un IAH residual no significativo pudiera ser también extrapolable (fig. 7).
Figura 7.
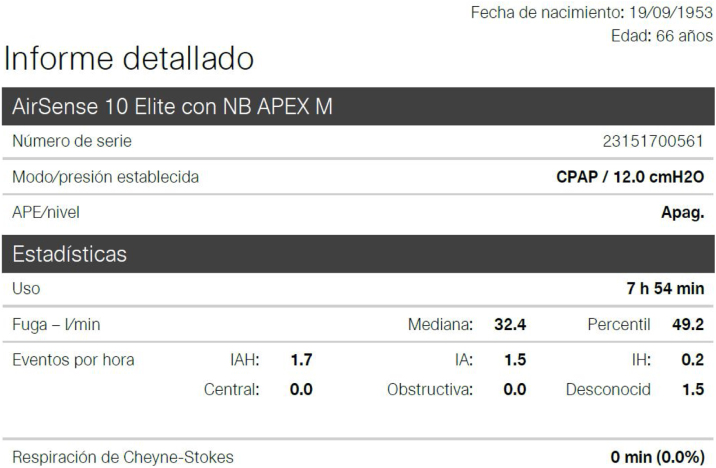
Informe detallado obtenido mediante telemonitorización. En ella se puede observar la presión a la que está prescrito el CPAP, las horas medias de uso y valores estadísticos de fuga y eventos residuales.
Financiación
Los autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Contribuciones de los autores
Todos los autores han contribuido intelectualmente a la obra, cumplen las condiciones de autoría y han aprobado la versión final.
Bibliografía
- 1.Guilleminault C., Tilkian A., Dement W.C. The sleep apnea syndromes. Annu Rev Med. 1976;27:465–485. doi: 10.1146/annurev.me.27.020176.002341. [DOI] [PubMed] [Google Scholar]
- 2.Puertas Cuesta F.J., Pin Arboledas G., Santa María Cano J., Durán-Cantolla J., y el Grupo Español de Sueño (GES) Consenso Nacional sobre el síndrome de las apneas-hipopneas del sueño. Arch Bronconeumol. 2005;41:1–110. doi: 10.1016/S0210-5705(09)71003-9. [DOI] [Google Scholar]
- 3.Mediano O., González Mangado N., Montserrat J.M., Alonso-Álvarez M.L., Almendros I., Alonso-Fernández A., et al. International Consensus Document on Obstructive Sleep Apnea. Arch Bronconeumol. 2022;58:52–68. doi: 10.1016/j.arbres.2021.03.017. [DOI] [PubMed] [Google Scholar]
- 4.Heinzer R., Vat S., Marques-Vidal P., Marti-Soler H., Andries D., Tobback N., et al. Prevalence of sleep-disordered breathing in the general population: The HypnoLaus study. Lancet Respir Med. 2015;3:310–318. doi: 10.1016/S2213-2600(15)00043-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Eckert D.J. Phenotypic approaches to obstructive sleep apnoea - New pathways for targeted therapy. Sleep Med Rev. 2018;37:45–59. doi: 10.1016/j.smrv.2016.12.003. [DOI] [PubMed] [Google Scholar]
- 6.Edwards B.A., Eckert D.J., Jordan A.S. Obstructive sleep apnoea pathogenesis from mild to severe: Is it all the same? Respirology. 2017;22:33–42. doi: 10.1111/resp.12913. [DOI] [PubMed] [Google Scholar]
- 7.Young T., Skatrud J., Peppard P.E. Risk factors for obstructive sleep apnea in adults. JAMA. 2004;291:2013–2016. doi: 10.1001/jama.291.16.2013. [DOI] [PubMed] [Google Scholar]
- 8.Mediano O., Romero- Peralta S., Resano P., Cano-Pumarega I., Sánchez de la Torre M., Castillo-García M., et al. Obstructive Sleep Apnea: Emerging Treatments Targeting the Genioglossus Muscle J. Clin Med. 2019;8:1754. doi: 10.3390/jcm8101754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Eckert D.J., Younes M.K. Arousal from sleep: Implications for obstructive sleep apnea pathogenesis and treatment. J Appl Physiol (1985) 2014;116:302–313. doi: 10.1152/japplphysiol.00649.2013. [DOI] [PubMed] [Google Scholar]
- 10.Bosi M., De Vito A., Eckert D.J., Steier J., Kotecha B., Vicini C., et al. Qualitative Phenotyping of Obstructive Sleep Apnea and Its Clinical Usefulness for the Sleep Specialist. J Environ Res Public Health. 2020;17:2058. doi: 10.3390/ijerph17062058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Carberry J.C., Amatoury J., Eckert D.J. Personalized Management Approach for OSA. Chest. 2018;153:744–755. doi: 10.1016/j.chest.2017.06.011. [DOI] [PubMed] [Google Scholar]
- 12.Gray E.L., McKenzie D.K., Eckert D.J., Steier J., Kotecha B., Vicini C., et al. Obstructive sleep apnea without obesity is common and difficult to treat: Evidence for a distinct pathophysiological phenotype. J Clin Sleep Med. 2017;13:81–88. doi: 10.3390/ijerph17062058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wellman A., Malhotra A., Jordan A.S., Stevenson K.E., Gautam S., White D.P. Effect of oxygen in obstructive sleep apnea: Role of loop gain. Respir Physiol Neurobiol. 2008;162:144–151. doi: 10.1016/j.resp.2008.05.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Edwards B.A., Sands S.A., Eckert D.J., White D.P., Butler J.P., Owens R.L., et al. Acetazolamide improves loop gain but not the other physiological traits causing obstructive sleep apnoea. J Physiol. 2012;590:1199–1211. doi: 10.1113/jphysiol.2011.223925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Garbarino S., Guglielmi O., Sanna A., Mancardi G.L., Magnavita N. Risk of Occupational Accidents in Workers with Obstructive Sleep Apnea: Systematic Review and Meta-analysis. SLEEP. 2016;39:1211–1218. doi: 10.5665/sleep.5834. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Bonsignore M.R., Baiamonte P., Mazzuca E., Castrogiovanni A., Marrone O. Obstructive sleep apnea and comorbidities: A dangerous liaison. Multidiscip Respir Med. 2019;14:8. doi: 10.1186/s40248-019-0172-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Jenner R., Fatureto-Borges F., Costa-Hong V., Lopes H.F., Teixeira S.H., Marum E., et al. Association of obstructive sleep apnea with arterial stiffness and nondipping blood pressure in patients with hypertension. J Clin Hypertens (Greenwich) 2017;19:910–918. doi: 10.1111/jch.13008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Marinheiro R., Parreira L., Amador P., Mesquita D., Farinha J., Fonseca M., et al. Ventricular Arrhythmias in Patients with Obstructive Sleep Apnea. Curr Cardiol Rev. 2019;15:64–74. doi: 10.2174/1573403X14666181012153252. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Zhao E., Chen S., Du Y., Zhang Y. Association between Sleep Apnea Hypopnea Syndrome and the Risk of Atrial Fibrillation: A Meta-Analysis of Cohort Study. Biomed Res Int. 2018;2018:5215868. doi: 10.1155/2018/5215868. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Young T., Finn L., Peppard P.E., Szklo-Coxe M., Austin D., Nieto F.J., et al. Sleep disordered breathing and mortality: Eighteen-year follow-up of the Wisconsin sleep cohort. Sleep. 2008;31:1071–1078. [PMC free article] [PubMed] [Google Scholar]
- 21.Gottlieb D.J., Yenokyan G., Newman A.B., O’Connor G.T., Punjabi N.M., Quan S.F., et al. Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure: The sleep heart health study. Circulation. 2010;122:352–360. doi: 10.1161/CIRCULATIONAHA.109.901801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Cowie M.R., Woehrle H., Wegscheider K., Angermann C., d’Ortho M.P., Erdmann E., et al. Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med. 2015;373:1095–1105. doi: 10.1056/NEJMoa1506459. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Sánchez-de-la-Torre M., Sánchez-de-la-Torre A., Bertran S., Abad J., Duran-Cantolla J., Cabriada V., et al. Spanish Sleep Network. Effect of obstructive sleep apnoea and its treatment with continuous positive airway pressure on the prevalence of cardiovascular events in patients with acute coronary syndrome (ISAACC study): A randomised controlled trial. Lancet Respir Med. 2020;8:359–367. doi: 10.1016/S2213-2600(19)30271-1. [DOI] [PubMed] [Google Scholar]
- 24.McEvoy R.D., Antic N.A., Heeley E., Luo Y., Ou Q., Zhang X., et al. SAVE Investigators and Coordinators. CPAP for Prevention of Cardiovascular Events in Obstructive Sleep Apnea. N Engl J Med. 2016;375:919–931. doi: 10.1056/NEJMoa1606599. [DOI] [PubMed] [Google Scholar]
- 25.Boulos M.I., Dharmakulaseelan L., Brown D.L., Swartz R.H. Trials in Sleep Apnea and Stroke: Learning From the Past to Direct Future Approaches. Stroke. 2021;52:366–372. doi: 10.1161/STROKEAHA.120.031709. [DOI] [PubMed] [Google Scholar]
- 26.Anothaisintawee T., Reutrakul S., Van Cauter E., Thakkinstian A. Sleep disturbances compared to traditional risk factors for diabetes development: Systematic review and meta-analysis. Sleep Med Rev. 2016;30:11–24. doi: 10.1016/j.smrv.2015.10.002. [DOI] [PubMed] [Google Scholar]
- 27.Seijo L.M., Pérez-Warnisher M.T., Giraldo-Cadavid L.F., Oliveros H., Cabezas E., Troncoso M.F., et al. Obstructive sleep apnea and nocturnal hypoxemia are associated with an increased risk of lung cancer. Sleep Med. 2019;63:41–45. doi: 10.1016/j.sleep.2019.05.011. [DOI] [PubMed] [Google Scholar]
- 28.Baril A.A., Carrier J., Lafrenière A., Warby S., Poirier J., Osorio R.S., et al. Canadian Sleep and Circadian Network. Biomarkers of dementia in obstructive sleep apnea. Sleep Med Rev. 2018;42:139–148. doi: 10.1016/j.smrv.2018.08.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Gottlieb D.J., Punjabi N.M. Diagnosis and Management of Obstructive Sleep Apnea: A Review. JAMA. 2020;323:1389–1400. doi: 10.1001/jama.2020.3514. [DOI] [PubMed] [Google Scholar]
- 30.Masa J.F., Corral J., Pereira R., Duran-Cantolla J., Cabello M., Hernández-Blasco L., et al. Effectiveness of home respiratory polygraphy for the diagnosis of sleep apnoea and hypopnoea syndrome. Thorax. 2011;66:567–573. doi: 10.1136/thx.2010.152272. [DOI] [PubMed] [Google Scholar]
- 31.Masa J.F., Duran-Cantolla J., Capote F., Cabello M., Abad J., Garcia-Rio F., et al. Effectiveness of home single-channel nasal pressure for sleep apnea diagnosis. Sleep. 2014;37:1953–1961. doi: 10.5665/sleep.4248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Norman M.B., Middleton S., Erskine O., Middleton P.G., Wheatley J.R., Sullivan C.E. Validation of the Sonomat: A contactless monitoring system used for the diagnosis of sleep disordered breathing. Sleep. 2014;37:1477–1487. doi: 10.5665/sleep.3996. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Nakayama C., Fujiwara K., Sumi Y., Matsuo M., Kano M., Kadotani H. Obstructive sleep apnea screening by heart rate variability-based apnea/normal respiration discriminant model. Physiol Meas. 2019;40:125001. doi: 10.1088/1361-6579/ab57be. [DOI] [PubMed] [Google Scholar]
- 34.Omobomi O., Quan S.F. Positional therapy in the management of positional obstructive sleep apnea-a review of the current literature. Sleep Breath. 2018;22:297–304. doi: 10.1007/s11325-017-1561-y. [DOI] [PubMed] [Google Scholar]
- 35.Patil S.P., Ayappa I.A., Caples S.M., John Kimoff R., Patel S.R., Harrod C.G. Treatment of adult obstructive sleep apnea with positive airway pressure: An American academy of sleep medicine systematic review, meta-analysis, and GRADE assessment. J Clin Sleep Med. 2019;15:301–334. doi: 10.5664/jcsm.7638. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.González Mangado N., Egea-Santaolalla C.J., Chiner Vives E., Mediano O. Sleep Obstructive Apnea. Open Respir Arch. 2020;2:46–66. doi: 10.1016/j.opresp.2020.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Ramar K., Dort L.C., Katz S.G., Lettieri C.J., Harrod C.G., Thomas S.M., et al. Clinical Practice Guideline for the Treatment of Obstructive Sleep Apnea and Snoring with Oral Appliance Therapy: An Update for 2015. J Clin Sleep Med. 2015;11:773–827. doi: 10.5664/jcsm.4858. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.de Vries G.E., Hoekema A., Doff M.H., Kerstjens H.A., Meijer P.M., van der Hoeven J.H., et al. Usage of positional therapy in adults with obstructive sleep apnea. J Clin Sleep Med. 2015;11:131–137. doi: 10.5664/jcsm.4458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Esteller E., Carrasco M., Díaz-Herrera MÁ, Vila J., Sampol G., Juvanteny J., et al. Clinical Practice Guideline recommendations on examination of the upper airway for adults with suspected obstructive sleep apnoea-hypopnoea syndrome [Article in English, Spanish] Acta Otorrinolaringol Esp (Engl Ed) 2019;70:364–372. doi: 10.1016/j.otorri.2018.06.008. [DOI] [PubMed] [Google Scholar]
- 40.Carrasco Llatas M., Martínez Ruiz de Apodaca P., Baptista Jardín P., O’Connor Reina C., Plaza Mayor G., Méndez-Benegassi Silva I., et al. Drug-induced sleep endoscopy [Article in English, Spanish] Acta Otorrinolaringol Esp (Engl Ed) 2020;71:316–320. doi: 10.1016/j.otorri.2019.02.007. [DOI] [PubMed] [Google Scholar]
- 41.Taranto-Montemurro L., Messineo L., Sands S.A., Azarbarzin A., Marques M. Edwards et al. The Combination of Atomoxetine and Oxybutynin Greatly Reduces Obstructive Sleep Apnea Severity. A Randomized, Placebo-controlled, Double-Blind Crossover Trial. Am J Respir Crit Care Med. 2019;199:1267–1276. doi: 10.1164/rccm.201808-1493OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Eskandari D., Zou D., Grote L., Hoff E., Hedner J. Acetazolamide reduces blood pressure and sleep-disordered breathing in patients with hypertension and obstructive sleep apnea: A randomized controlled trial. J Clin Sleep Med. 2018;14:309–317. doi: 10.5664/jcsm.6968. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.COVID-19: FAQs for Sleep Medicine Clinicians and Sleep Facilities. AASM. American Academy of Sleep Medicine. Association for Sleep Clinicians and Re-searchers. [actualizado 8 Abr 2020] Disponible en: https://aasm.org/clinical-resources/covid-19-faq/COVID-19. Mitigation Strategies for Sleep Clinics and Labs
- 44.Lugo V.M., Garmendia O., Suarez-Girón M., Torres M., Vázquez-Polo F.J., Negrín M.A., et al. Comprehensive management of obstructive sleep apnea by telemedicine: Clinical improvement and cost-effectiveness of a Virtual Sleep Unit. A randomized controlled trial. PLoS One. 2019;14:e0224069. doi: 10.1371/journal.pone.0224069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Isetta V., Negrín M.A., Monasterio C., Masa J.F., Feu N., Álvarez A., et al. SPANISH SLEEP NETWORK A Bayesian cost-effectiveness analysis of a telemedicine-based strategy for the management of sleep apnoea: A multicentre randomised controlled trial. Thorax. 2015;70:1054–1061. doi: 10.1136/thoraxjnl-2015-207032. [DOI] [PubMed] [Google Scholar]
- 46.Isetta V., León C., Torres M., Embid C., Roca J., Navajas D., et al. Telemedicine-based approach for obstructive sleep apnea management: Building evidence. Interact J Med Res. 2014;3:e6. doi: 10.2196/ijmr.3060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Salord N, Montserrat JM, Roncero A, Puertas FJ, Cano I, Mediano O. Capitulo 6: Unidades de sueño y consultas de ventilación mecánica no invasiva. Documento SEPAR y SES de desescalada tras COVID en la ventilación mecánica no invasiva. Consenso entre la sociedad española de neumología y cirugía torácica (SEPAR) y la sociedad española de sueño (SES).
- 48.Chen C., Wang J., Pang L., Wang Y., Ma G., Liao W. Telemonitor care helps CPAP compliance in patients with obstructive sleep apnea: A systemic review and meta-analysis of randomized controlled trials. Ther Adv Chronic Dis. 2020;11 doi: 10.1177/2040622320901625. 2040622320901625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Hwang D., Chang J.W., Benjafield A.V., Crocker M.E., Kelly C., Becker K.A., et al. Effect of Telemedicine Education and Telemonitoring on Continuous Positive Airway Pressure Adherence The Tele-OSA Randomized Trial. Am J Respir Crit Care Med. 2018;197:117–126. doi: 10.1164/rccm.201703-0582OC. [DOI] [PubMed] [Google Scholar]
- 50.Contal O., Poncin W., Vaudan S., De Lys A., Takahashi H., Bochet S., et al. One-Year Adherence to Continuous Positive Airway Pressure With Telemonitoring in Sleep Apnea Hypopnea Syndrome: A Randomized Controlled Trial. Front Med (Lausanne) 2021;8:626361. doi: 10.3389/fmed.2021.626361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Bros J.S., Poulet C., Arnol N., Deschaux C., Gandit M., Charavel M. Acceptance of Telemonitoring Among Patients with Obstructive Sleep Apnea Syndrome: How is the Perceived Interest by and for Patients? Telemed J E Health. 2018;24:351–359. doi: 10.1089/tmj.2017.0134. [DOI] [PubMed] [Google Scholar]
- 52.Chang J., Liang J., Becker K., Kim J., Woodrum R., Vega D., et al. 1048 Impact of Automated CPAP Tele-monitoring on CPAP Adherence At 2 Years: Follow-up From The Tele-OSA Randomized Clinical Trial. Sleep. 2018;41(Suppl_1):A390. doi: 10.1093/sleep/zsy061.1047. [DOI] [Google Scholar]
- 53.Hwang D., Chang J.W., Benjafield A.V., Crocker M.E., Kelly C., Becker K.A., et al. Effect of Telemedicine Education and Telemonitoring on Continuous Positive Airway Pressure Adherence. The Tele-OSA Randomized Trial. Am J Respir Crit Care Med. 2018;197:117–126. doi: 10.1164/rccm.201703-0582OC. [DOI] [PubMed] [Google Scholar]
- 54.Montserrat Canal J.M., Suárez-Girón M., Egea C., Embid C., Matute-Villacís M., de Manuel Martínez L., et al. Spanish Society of Pulmonology and Thoracic Surgery positioning on the use of telemedine in sleep-disordered breathing and mechanical ventilation [Article in English, Spanish] Arch Bronconeumol (Engl Ed) 2021;57:281–290. doi: 10.1016/j.arbres.2020.05.032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Marques S., Bento A., Gralho A., Duarte M., Mayoralas S., Caneiras C. The implementation of telemedicine monitoring in a digital era: The impact in adherence in positive airway pressure in obstructive sleep apnea patients. Port J Public Health. 2018;36(Suppl 1):22. [Google Scholar]
- 56.Ekroos H., Karvonen T., Hahl J. Telemonitoring versus usual care in continuous positive airway pressure users: Cost analysis. Eur Respir J. 2017;50(Suppl 61) [Google Scholar]
- 57.Turino C., de Batlle J., Woehrle H., Mayoral A., Castro-Grattoni A.L., Gómez S., et al. Management of continuous positive airway pressure treatment compliance using telemonitoring in obstructive sleep apnoea. Eur Respir J. 2017;49 doi: 10.1183/13993003.01128-2016. 1601128. [DOI] [PubMed] [Google Scholar]