Abstract
目的
探索牙龈卟啉单胞菌感染的非酒精性脂肪肝局部巨噬细胞功能变化及潜在调控靶点。
方法
利用单细胞测序技术分析合并牙龈卟啉单胞菌感染的非酒精性脂肪性肝炎(NASH)小鼠肝脏中的各类细胞表型及其功能变化。进一步利用实时荧光定量聚合酶链反应、酶联免疫吸附和免疫荧光染色观察肝脏组织中的炎症程度及巨噬细胞抗原呈递功能标志物表达水平,利用油红染色观察NASH肝脏局部脂肪组织堆积情况。体外利用牙龈卟啉单胞菌来源的脂多糖干预小鼠腹腔巨噬细胞,通过实时荧光定量聚合酶链反应和转录组测序验证体内试验结果。
结果
与健康肝脏中的巨噬细胞相比,牙龈卟啉单胞菌感染的NASH小鼠肝脏巨噬细胞表现出了显著的异质性,其高表达包括C1qb、C1qc、Mafb、Apoe和Cd14在内的多个炎症基因,但与抗原提呈功能相关的基因Cd209a、H2-Aa、H2-Ab1和H2-DMb1等的表达相对较低。进一步的体内外研究表明,这些巨噬细胞的活化和浸润可能是由于局部牙龈卟啉单胞菌来源的脂多糖的积累和诱导造成的。
结论
牙龈卟啉单胞菌来源的脂多糖诱导非酒精性脂肪肝的局部巨噬细胞免疫耐受表型,可能是牙周炎致病菌感染促进NASH炎症和发病的关键机制。本研究结果进一步阐明巨噬细胞在NASH相关疾病发病过程中的功能障碍和调节机制,并为其临床治疗提供了几个潜在的调控靶点。
Keywords: 牙龈卟啉单胞菌, 非酒精性脂肪性肝炎, 巨噬细胞, 抗原呈递, 单细胞测序
Abstract
Objective
This study aimed to explore the functions and potential regulatory targets of local macrophages in nonalcoholic fatty liver combined with Porphyromonas gingivalis (P. gingivalis) infection.
Methods
Single-cell RNA sequencing was used to analyze the phenotypes and functional changes in various cells in the liver tissue of nonalcoholic steatohepatitis (NASH) mice fed with P. gingivalis. Real-time polymerase chain reaction (RT-PCR), enzyme-linked immunosorbent assay, and immunofluorescence staining were applied to observe the inflammation and expression levels of macrophage antigen presenting functional markers in the NASH liver. Oil red staining was performed to observe the accumulation of local adipose tissue in the NASH liver. Results were verified through RT-PCRand RNA sequencing using P. gingivalis-lipopolysaccharide treated mouse peritoneal macrophages.
Results
In comparison with healthy livers with Kupffer cells, the NASH liver combined with P. gingivalis infection-related macrophages showed significant heterogeneity. C1qb, C1qc, Mafb, Apoe, and Cd14 were highly expressed, but Cd209a, H2-Aa, H2-Ab1, and H2-DMb1, which are related to the antigen presentation function, were weakly expressed. Further in vivo and in vitro investigations indicated that the activation and infiltration of these macrophages may be due to local P. gingivalis-lipopolysaccharide accumulation.
Conclusion
P. gingivalis-lipopolysaccharide induces a local macrophage immunotolerance phenotype in nonalcoholic fatty liver, which may be the key mechanism of periodontitis pathogen infection that promotes NASH inflammation and pathogenesis. This study further clarifies the dysfunction and regulatory mechanisms of macrophages in the pathogenesis of P. gingivalis-infected NASH, thereby providing potential therapeutic targets for its clinical treatment.
Keywords: Porphyromonas gingivalis, nonalcoholic steatohepatitis, macrophage, antigen presentation, single-cell RNA sequencing
非酒精性脂肪性肝病/非酒精性脂肪性肝炎(nonalcoholic fatty liver disease/nonalcoholic steatohepatitis,NAFLD/NASH)是世界上最常见的慢性肝病之一,导致患者肝脏组织脂肪变性,并影响了全球约四分之一的人口,因此是全球范围内的一大公共卫生挑战[1]。NASH是一种NAFLD发病过程中的代表性阶段,以肝脏组织的炎症浸润和进行性纤维化为主要表现,若不加以有效控制,最终将发展为肝硬化和肝癌[2]。虽然有多篇研究关注到了NASH发病过程中的肠道菌群异位影响等因素会造成肝脏组织的炎症和脂肪堆积[3],并且牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)的感染也与NASH局部的炎症和组织破坏息息相关[4],但这一过程中NASH进展的分子机制依旧复杂且尚未完全阐明。目前NAFLD/NASH的治疗手段十分局限,尚无有效的临床治疗药物[5],因此针对NASH的发病机制和治疗靶点的探索一直是相关领域的研究热点。
巨噬细胞在不同组织来源或不同疾病微环境因素的影响下表现出不同的表型和功能[6]。尽管肝巨噬细胞被报道是局部主要的免疫调节和解毒角色,但在肥胖相关疾病(如NAFLD[7])中,其表型和功能存在显著的异质性。NAFLD疾病中肝巨噬细胞的激活是由炎症细胞因子、异位细菌和脂多糖等多种因素介导的,它们的释放可能是由于肠道通透性增加以及肠道微生物及其代谢产物的迁移造成的[8]。在这些因素的影响下,局部巨噬细胞被显著激活,其中M1表型表现出了明显的吞噬活性并分泌多种炎症细胞因子[9]–[13]。在急性炎症期间,这些M1巨噬细胞诱导细胞外基质降解(纤维蛋白溶解),从而介导疾病组织的改建和转归[11],[14]。相反,巨噬细胞的另一种抗炎表型M2表型的激活也可能通过免疫抑制效果和纤维化促进效果参与NASH的病变过程,其机制可能是由于M2巨噬细胞高表达白细胞介素(interleukin,IL)-13和转化生长因子(transforming growth factor,TGF)-β1造成的[15]。然而,巨噬细胞在NASH肝脏中的表型分化和功能相对更加复杂。到目前为止,NASH肝脏中有3种类型的促炎表型和4种类型的抗炎表型巨噬细胞被报道[16]–[17],但每种类型的巨噬细胞具体的功能变化和调控效果尚不清楚。本研究拟采取单细胞测序技术探索合并了P. gingivalis肠道感染的NASH小鼠模型中的肝巨噬细胞的表型特点及功能变化,以阐明NASH肝脏巨噬细胞的分群特点、P. gingivalis对NASH小鼠肝脏免疫微环境的影响和潜在治疗靶点。
1. 材料和方法
1.1. 主要试剂及仪器
DMEM培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、双抗(链霉素、青霉素)及谷氨酰胺(Invitrogen公司,美国),优质胎牛血清(fetal bovine serum,FBS)(GIBCO公司,美国),巨噬细胞分选试剂盒(Miltenyi Biotec公司,德国),TRIzol(Invitrogen公司,美国),RNA逆转录试剂盒(Takara公司,日本),Power SYBR® Green 聚合酶链反应(polymerase chain reaction,PCR)试剂盒(Life Technologies公司,英国),RIPA裂解液、TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),CD11b抗体(CST#17800,Cell Signaling Technology公司,美国),兔抗488荧光二抗(ab150077,Abcam公司,美国),PE-MHC-Ⅱ抗体(CST#67762,Cell Signaling Technology公司,美国),4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole dihydrochloride,DAPI)(Vector公司,美国),10%山羊血清(北京中杉金桥生物技术有限公司),P. gingivalis来源的LPS(Pg-LPS)(Invitrogen公司,美国),酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒(北京索莱宝科技有限公司)。所有引物均购自上海生工生物工程有限公司。
Nikon光学显微镜(Nikon公司,日本),紫外分光光度计(Eppendorf公司,德国),倒置显微镜及照相系统(OLYMPUS公司,日本),SW-CJ-IF超净工作台(苏州净化设备有限公司),PCR扩增仪、PCR定量仪器(BIO-RAD公司,美国),细胞培养板及细胞刮匙(Corning公司,美国)。
1.2. NASH动物模型的建立
使用6周龄雄性C57BL/6小鼠建立NASH模型,小鼠购于北京维通利华实验动物技术有限公司。实验动物被饲养于SPF级标准化实验动物室,饲养条件为25 °C的室温、12 h光照/12 h黑暗。本研究所开展的所有动物研究均遵循首都医科大学附属北京口腔医院动物伦理委员会制定的标准(伦理审查号KQYY-202206-007),并符合ARRIVE指南。
NASH组的动物连续15周喂食D12492研究型饮食(北京斯贝福生物技术有限公司)诱导小鼠NASH模型,而对照组的动物则喂食正常饮食(1130SH12090494D,北京斯贝福生物技术有限公司)。在NASH建模的最后4周时,隔天灌喂P. gingivalis 1×108 CFU,直至建模结束。对照组不进行任何的额外操作,正常饮食直至建模结束。
建模结束后处死2组老鼠,取血清送首都医科大学附属北京口腔医院检验科进行血生化检测,取动物肝脏进行肉眼观察及称重,4%多聚甲醛固定24 h后脱水包埋。
1.3. 组织学评价
2组老鼠的肝脏组织标本脱水包埋后,进行组织切片(切片厚度为5 µm),之后进行苏木精-伊红(hematoxylin-eosin,HE)染色,并在显微镜下观察切片。
1.4. TUNEL染色
使用TUNEL细胞凋亡检测试剂盒来分析肝脏组织的局部细胞凋亡。利用DAPI对细胞核进行染色并用甘油封片。镜下计数,计算TUNEL阳性的细胞比例。
1.5. 免疫荧光分析
组织切片首先用10%山羊血清在37 °C下封闭1 h,之后将组织切片与CD11b和MHC-Ⅱ抗体(50 µg/mL)在4 °C下孵育过夜,将切片与兔抗488荧光二抗(1 µg/mL)孵育,并用DAPI复染后封片。镜下观察切片,将CD11b阳性(CD11b+)的细胞定义为巨噬细胞,观察CD11b+巨噬细胞群体中MHC-Ⅱ的表达水平。
1.6. 油红O染色
使用油红O染色试剂盒进行油红O染色以及脂滴的检测。检测方法为显微镜下观察至少5个随机区域。
1.7. 单细胞测序及分析
采用SeekOneMM高通量单细胞转录组试剂盒(编号K00104-04,北京寻因生物科技有限公司)对肝脏组织进行单细胞测序分析。更多信息详见参考文献[18]。
1.8. 小鼠腹膜巨噬细胞的分离培养
小鼠腹膜巨噬细胞的分离方法详见参考文献[19]。使用巨噬细胞分选试剂盒分选巨噬细胞。随后在DMEM培养基中培养,该培养基含有10%的胎牛血清、5%的青霉素/链霉素和5%的谷氨酰胺,细胞培养条件为37 °C和5%CO2。
1.9. 实时荧光定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)
将分选后的巨噬细胞分别在PBS(Control组)或P. gingivalis来源的LPS(LPS组)条件下进行诱导,使用TRIzol提取总RNA,Power SYBR® Green PCR试剂盒和特定引物(表1)进行RT-PCR检测。
表 1. 本研究使用的引物序列.
Tab 1 Primers used in this study
| 基因名称 | 序列(5’-3’) |
| Gapdh | F:GAGAGGCCCTATCCCAACTC |
| R:TCAAGAGAGTAGGGAGGGCT | |
| Tnfa | F:CCACCACGCTCTTCTGTCTA |
| R:TGGTTTGTGAGTGTGAGGGT | |
| Nos2 | F:CGGAGATCAATGTGGCTGTG |
| R:GAAGGACTCTGAGGCTGTGT | |
| Cd209a | F:CTGGGAGAGGAAGACTGTGC |
| R:CTTGCTAGGGCAGGAAGTTG | |
| H2-Aa | F:TTCTTCAAGTGACCCCCAAC |
| R:AATTCCAAGGGTGTGTGAGC | |
| H2-Eb1 | F:CTGGAACACCACAACCTCCT |
| R:TTCCGGAACCATCTGACTTC | |
| H2-Ab1 | F:TCTGCTCCGAATTCCTGACT |
| R:TCACAAGAGCTGAGGTGGTG | |
| H2-DMb1 | F:AACAAGGAGAAGACGGCTCA |
| R:GTGTAGACGTCCCCGTAGGA | |
| Cd14 | F:TCTCAGATCCGAAGCCAGAT |
| R:CGTGTCCACACGCTTTAGAA |
1.10. ELISA测定
利用ELISA测定肿瘤坏死因子(tumor necrosis factor,TNF)-α、IL-1β等炎症细胞因子在体内的表达水平。使用RIPA裂解液提取组织总蛋白,利用各组的蛋白质样品(100 µg)进行ELISA检测。
1.11. 体外转录组测序(RNA sequencing,RNA-seq)分析
将分选后的巨噬细胞分别在PBS(Control组)或P. gingivalis来源的LPS(LPS组)条件下进行诱导,之后将其储存于液氮。用TRIzol试剂提取RNA,并评估其纯度和浓度。合格的RNA样本由广州基迪奥生物科技有限公司进行测序,并使用在线工具(http://www.omicshare.com/tools)进行后续的生物信息学分析,包括基因集富集分析(gene set enrichment analysis,GSEA)。
1.12. 统计学分析
采用SPSS 22.0软件进行统计分析。所有的实验至少重复3次。数据用均数±标准差表示。符合正态分布的数据使用t检验进行分析,多组变量比较使用单因素方差分析(ANOVA)进行比较。
2. 结果
2.1. 小鼠NASH模型中肝脂肪变性、肝功能障碍和局部细胞损伤凋亡
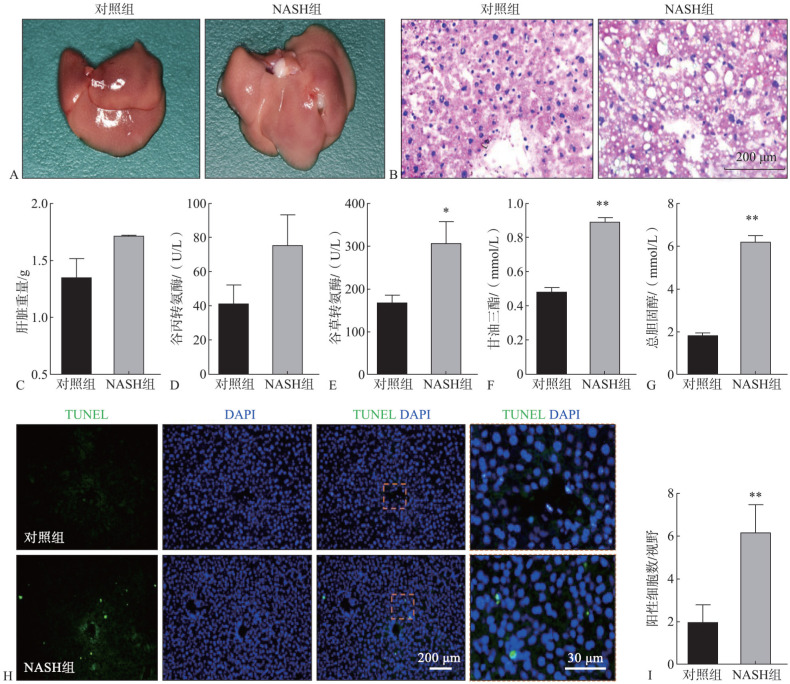
本研究通过高脂肪饮食诱导15周建立了小鼠NASH模型,同时在诱导最后4周时给予小鼠P. gingivalis的灌喂。肉眼观察及组织学染色观察评估建模小鼠肝脏的变化,结果显示,NASH组小鼠的肝脏明显较大,颜色较浅,边缘圆钝,呈现出典型的NASH样肝脏病变(图1A)。HE染色结果显示,NASH组的肝组织出现脂肪堆积造成的气球样病变(图1B),这与NASH肝的典型病理特征一致。除了肝脏的组织学变化及重量变化(图1C)外,血生化检测结果也显示,与对照组相比,NASH组的肝功能指标均呈上调趋势,表明其存在肝组织损伤和肝功异常(图1D~G)。TUNEL染色结果显示,NASH组肝组织中凋亡细胞的数量显著增加(图1H、I)。以上结果均表明,高脂饮食+P. gingivalis灌喂诱导的NASH小鼠模型中肝脂肪变性、肝功能障碍和局部细胞损伤凋亡,证明本研究体内模型建模成功。
图 1. NASH小鼠表现出典型的非酒精性脂肪肝症状.
Fig 1 NASH mice showed typical pathological symptoms
A:与对照组相比,NASH组的肝脏明显变大、颜色变浅、边缘圆钝;B:HE染色显示,NASH组肝组织出现脂肪堆积造成的气球样病变;C:与对照相相比,NASH组肝脏的重量增加;D~G:血液生化测试显示,与对照组相比,NASH组小鼠的肝功能指标均呈上调趋势;H、I:TUNEL染色表明,与对照组相比,NASH组局部肝组织中凋亡细胞数量显著增加。*P<0.05,**P<0.01。
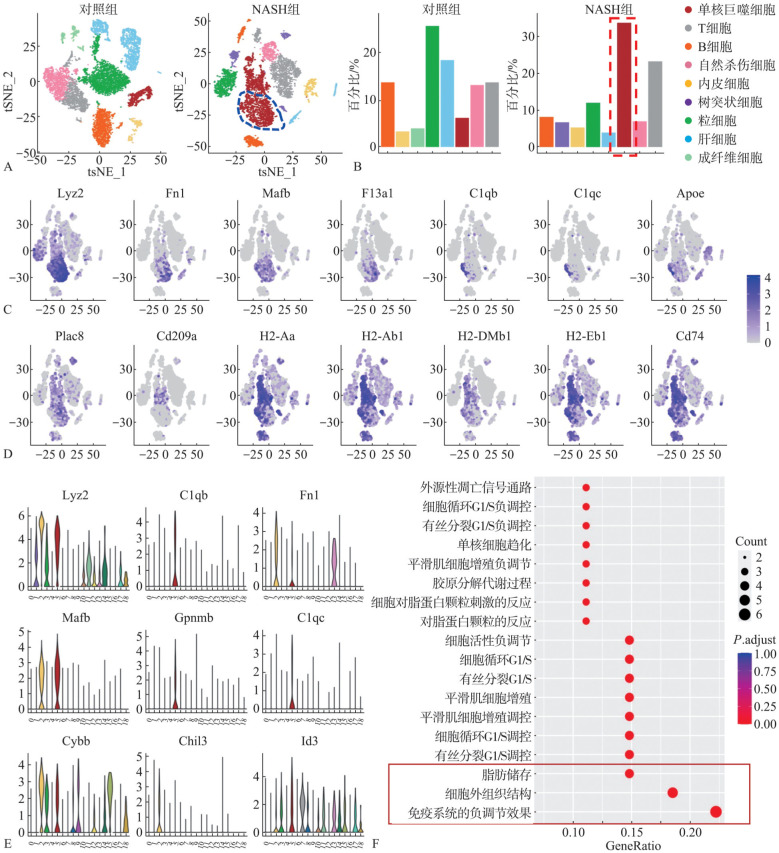
2.2. NASH肝脏中巨噬细胞发挥关键调节作用,具有异质性和亚群变化
单细胞测序技术分析2组肝组织中各种细胞的变化,结果显示NASH组肝脏中单核巨噬细胞的数量显著增加(从对照组的6.28%增加到NASH组的33.69%)(图2A、B),成为NASH肝脏中最大的细胞集群,表明巨噬细胞可能在NASH的进展中发挥关键作用。对这群巨噬细胞簇中的高表达基因进一步分析,发现对照组的巨噬细胞高表达包括抗原呈递相关基因H2-Aa、Cd209a。但NASH组的巨噬细胞明显出现了一群不同的分群(图2A中蓝色虚线标记的细胞群),其高表达补体基因包括C1qb和C1qc,但H2-Aa、Cd209a相对表达降低。这群巨噬细胞与对照组肝组织中的正常巨噬细胞存在显著的差异(NASH组巨噬细胞的相关基因表达分布如图2C、D所示)。
图 2. 单细胞测序结果表明NASH肝脏中巨噬细胞出现明显的异质性和亚群变化.
Fig 2 Single-cell RNA sequencing results indicated the heterogeneity and subgroup changes in NASH-related macrophages
A:2组肝脏组织单细胞测序的tSNE结果;B:NASH组肝组织中单核巨噬细胞的数量显著增加(从对照组的6.28%增加到NASH组的33.69%);C:NASH组的巨噬细胞表现出明显的异质性,其中A图蓝色虚线标记的亚群与对照组的巨噬细胞特征显著不同,其高表达补体基因C1qb、C1qc和脂质代谢相关基因Apoe;D:NASH组巨噬细胞的抗原呈递相关基因H2-Aa、Cd209a表达水平较低;E:对测序结果中的细胞2群和5群进一步分析,其表达M1和M2巨噬细胞标志物,表明这群巨噬细胞是高度活化的;F:KEGG分析发现,这群巨噬细胞对宿主免疫功能表现出负调控作用效果,并参与了脂质储存过程。
对这一特殊的巨噬细胞亚群(测序结果中的细胞2群和5群)进一步分析其基因表达情况,结果提示其高度表达Gpnmb、Chil3等基因(图2E),表明这些簇同时含有促炎和抗炎表型。KEGG分析显示,这些细胞对宿主免疫功能表现出抑制效果,并参与了脂质储存过程(图2F)。研究结果表明,NASH肝脏中的巨噬细胞高度活化,但其抗原呈递功能相对受到抑制,这可能不利于宿主的免疫防御和凋亡细胞或脂肪组织的清除。
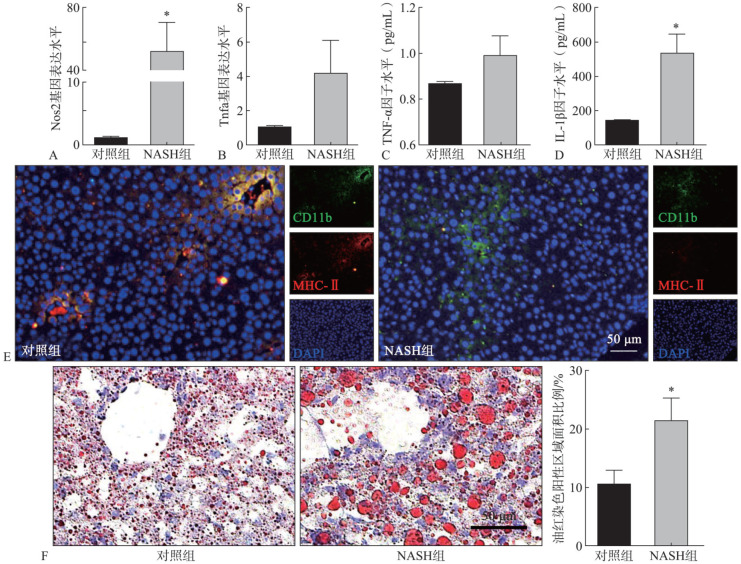
2.3. NASH肝脏中的巨噬细胞高度活化,但其抗原呈递功能出现障碍
为了验证单细胞测序的结果,采用PCR检测评估2组小鼠肝脏组织中的炎症基因表达水平。结果显示,M1巨噬细胞的标志物Nos2和Tnfa在NASH肝脏中呈增加趋势(图3A、B)。ELISA检测评估肝组织中炎症因子的表达水平,结果证实了NASH肝脏中TNF-α和IL-1β的上调(图3C、D)。这些结果表明,NASH肝脏存在明显的炎症和显著的M1巨噬细胞活化。此外,CD11b和MHC-Ⅱ荧光双染进一步观察NASH肝脏中巨噬细胞的抗原呈递功能,与单细胞测序结果一致,NASH肝脏中CD11b+巨噬细胞中MHC-Ⅱ的表达显著下调(图3E),这表明巨噬细胞抗原呈递功能受到抑制。油红染色显示NASH组肝脏中局部大量脂滴积聚,证实了这种抗原呈递功能障碍导致了NASH肝脏中的脂质组织无法有效去除,局部大量脂滴积聚(图3F)。
图 3. 体内研究证实NASH局部巨噬细胞的抗原呈递功能障碍.
Fig 3 In vivo studies confirmed the antigen presentation dysfunction of NASH-related macrophages
A、B:RT-PCR结果显示,NASH组Nos2和Tnfa基因表达增加;C、D:ELISA结果显示,NASH组TNF-α和IL-1β表达上调;E:CD11b和MHC-Ⅱ荧光双染结果显示,NASH肝脏中巨噬细胞抗原呈递功能受到抑制;F:油红染色显示,NASH组大量脂滴积聚。*P<0.05。
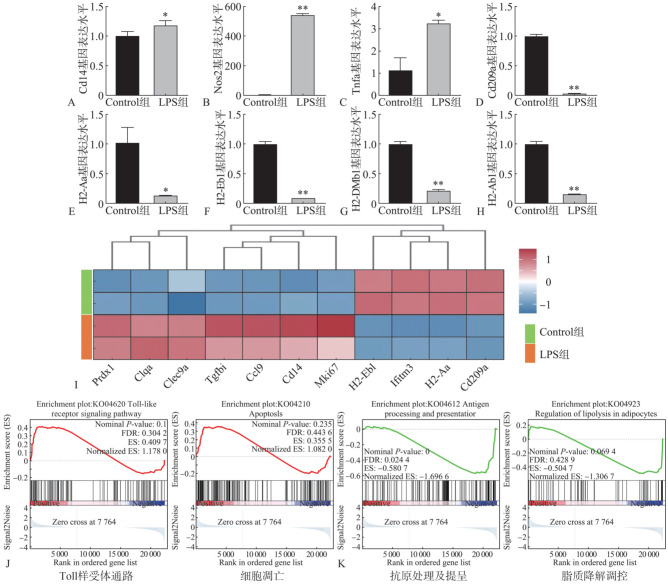
2.4. 体外研究证明P. gingivalis来源的LPS抑制小鼠腹腔巨噬细胞抗原呈递功能相关基因的表达
小鼠腹腔巨噬细胞在PBS(Control组)或P. gingivalis来源的LPS(LPS组)条件下进行诱导后,RT-PCR结果显示,LPS组Cd14、Nos2和Tnfa表达水平增加(图4A~C),Cd209a、H2-Aa、H2-Eb1、H2-DMb1和H2-Ab1表达水平降低(图4D~H)。Pg-LPS的诱导增加了巨噬细胞炎症因子的表达水平,这与体内研究结果一致。RNA-seq进一步分析巨噬细胞中更多的基因表达水平,结果显示,Pg-LPS诱导后的巨噬细胞高表达包括Cd14和Ccl9在内的炎症基因,但Cd209a和包括H2-Aa、H2-Eb1在内的抗原呈递相关基因相对受到抑制(图4I)。此外,GSEA显示,LPS组Toll样受体途径(经典的M1巨噬细胞活化途径)相对上调(图4J),抗原处理及提呈通路、脂肪降解通路相对下调(图4K)。这些体外研究结果支持体内实验的结论,即P. gingivalis感染的NASH肝脏中局部巨噬细胞抗原呈递功能和相关基因表达的变化可能是NASH发病的病理机制和潜在的治疗靶点。
图 4. 体外研究表明Pg-LPS下调小鼠腹腔巨噬细胞的抗原呈递功能基因表达.
Fig 4 In vitro studies showed that the antigen-presenting function genes of mouse peritoneal macrophages was down-regulated under Pg-LPS induction
A~C:Real-time PCR结果显示,LPS组巨噬细胞炎症因子Cd14、Nos2和Tnfa的表达水平增加;D~H:LPS组Cd209a、H2-Aa、H2-Eb1、H2-DMb1、H2-Ab1的表达水平受到抑制;I:RNA-seq分析热图显示LPS组与Control组之间的差异基因水平变化;J、K:GSEA分析显示,LPS组巨噬细胞的Toll样受体通路和细胞凋亡通路上调,但其抗原处理及提呈通路和脂肪降解通路被抑制。*P<0.05,**P<0.01。
3. 讨论
脂质堆积、肝脏脂肪变性、炎症细胞浸润、细菌感染、氧化应激[20]等全身代谢紊乱表现是NAFLD/NASH的主要病理表现。近年来,越来越多的证据[21]–[23]表明,固有免疫细胞在NASH的进展中起着关键作用。然而,巨噬细胞在NASH中的调节机制尚不明确。肝脏巨噬细胞包括组织中常驻的枯否细胞(Kupffer细胞)和从腹腔/骨髓趋化而来的巨噬细胞,它们通过产生不同的细胞因子、趋化因子、补体因子参与各种肝脏疾病的发生和发展。同时巨噬细胞作为抗原呈递细胞参与调节T细胞和B细胞的功能,对识别和清除微生物及细胞碎片至关重要,是维持肝组织稳态及降低肝组织炎症不可或缺的功能之一[24]。巨噬细胞的抗原呈递功能是否在NASH组织中发生变化以及这种变化对疾病发展的调控意义尚不明确,需要体内外研究证据证明。
P. gingivalis作为牙周炎的主要致病菌之一,被证明与全身健康和多种系统性疾病息息相关。近年来,研究发现P. gingivalis通过调控体内巨噬细胞功能参与了多种全身脂代谢相关疾病的发病和进展。有学者[25]发现,高脂血症兔肺泡巨噬细胞膜表面清道夫受体-A的基因表达在Pg-LPS作用下显著增加,导致动脉粥样硬化的发病风险提高。而对肝脏微环境而言,P. gingivalis可引起肝脏巨噬细胞浸润增加,导致基质金属蛋白酶(matrix metalloproteinase,MMP)-9、IL-1β、单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)- 1表达上调,同时伴有脂代谢平衡受损以及血清脂多糖水平提高[26]。然而,这是否意味着P. gingivalis参与并促进了NASH的发病尚不明确,P. gingivalis在NASH发病过程中对巨噬细胞功能及分化的调控机制和靶点还需要进一步深入的研究。
本研究利用单细胞测序技术深入地探讨了合并P. gingivalis感染的NASH肝脏中各种细胞表型及其功能变化。与健康肝脏中高表达Cd209a和MHC-Ⅱ类基因的Kupffer细胞不同,NASH相关巨噬细胞表现出明显的异质性,包括高表达C1qb和C1qc(补体功能相关基因[27])、Mafb和Apoe(脂质代谢相关基因[28]–[29]),以及Cd14和Ccl9(炎症相关基因[30]–[31]),低表达Cd209a、H2-Aa、H2-Ab1和H2-DMb1。这些细胞高表达M1和M2表型的标记基因,表明其被高度激活,但抗原呈递相关基因被明显抑制,这一结果提示其适应性免疫诱导功能可能受损。
通过进一步的体内验证和体外研究,结果发现小鼠腹腔巨噬细胞的MHC-Ⅱ类基因在P. gingivalis来源的LPS诱导下受到抑制,这不利于免疫反应的调节和对凋亡细胞或细菌的清除,从而加重了NASH的炎症和病理现象。本研究的结论与以前的研究[32]一致,即NASH相关的巨噬细胞表现出明显的免疫耐受表型。本研究进一步展示了这类细胞的多个标志物和潜在调控靶点,这将有助于未来NASH的机制探索和临床治疗策略的开发。
本研究尚存在一些不足之处,如体内分组的设计是基于探讨合并P. gingivalis感染的NASH小鼠肝脏局部微环境变化特点,因此只设立了健康对照组及P. gingivalis感染的NASH模型组。在本研究NASH肝脏中发现的免疫耐受表型的巨噬细胞是否普遍存在于NAFLD的局部组织中并发挥关键作用,需要未来更加详细和严谨的探索及验证。
综上,P. gingivalis感染的NASH肝脏中存在一类与脂质代谢有关的巨噬细胞亚型。这些细胞高表达C1qb、C1qc、Mafb、Apoe和Cd14,但低表达Cd209a、H2-Aa、H2-Ab1和H2-DMb1等多个抗原呈递功能相关基因。这些巨噬细胞的活化和浸润可能是由于局部P. gingivalis来源的脂多糖的积累。本研究结果进一步阐明了P. gingivalis感染促进NASH发病的相关分子机制,并为其临床治疗提供了几个潜在的治疗靶点。
Funding Statement
[基金项目] 国家重点研发计划(2022YFC2504200);国家自然科学基金(81600891,82201053,81991504,81974149);首都医科大学附属北京口腔医院创新团队建设项目(CXTD202202);首都医科大学附属北京口腔医院创新基金(21-09-18);首都医科大学附属北京口腔医院青年科技创新人才培育计划(YSP202105);中华口腔医学会青年临床科研基金(CSA-SIS2022-11);北京市医管局青年人才培养计划“青苗”计划(QML20181501;QML20231506);北京市医院管理局临床医学发展专项—“扬帆计划”(ZYLX202121);北京市医院管理局“登峰”人才培养计划(DFL20181501);北京市属医院科研培育计划(PX2023054)
Supported by: National Key R&D Program of China (2022YFC2504200); National Nature Science Foundation of China (81600891, 82201053, 81991504, 81974149); Innovation Research Team Project of Beijing Stomatological Hospital, Capital Medical University (CXTD202202); Innovation Foundation of Beijing Stomatological Hospital, Capital Medical University (21-09-18); Young Scientist Program of Beijing Stomatological Hospital, Capital Medical University (YSP202105); Young Clinical Research Fund of Chinese Stomatological Association (CSA-SIS2022-11); Beijing Municipal Administration of Hospitals’ Youth Programme (QML20181501; QML20231506); Beijing Municipal Administration of Hospitals Clinical Medicine Development of Special Funding Support (ZYLX202121); Beijing Municipal Administration of Hospitals’ Ascent Plan (DFL20181501); Beijing Municipal Administration of Hospitals Incubating Program (PX2023054).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Xu X, Poulsen KL, Wu L, et al. Targeted therapeutics and novel signaling pathways in non-alcohol-associated fatty liver/steatohepatitis (NAFL/NASH)[J] Signal Transduct Target Ther. 2022;7(1):287. doi: 10.1038/s41392-022-01119-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Zhang C, Yang M. Current options and future directions for NAFLD and NASH treatment[J] Int J Mol Sci. 2021;22(14):7571. doi: 10.3390/ijms22147571. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Jayakumar S, Loomba R. Review article: emerging role of the gut microbiome in the progression of nonalcoholic fatty liver disease and potential therapeutic implications[J] Aliment Pharmacol Ther. 2019;50(2):144–158. doi: 10.1111/apt.15314. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Nagasaki A, Sakamoto S, Arai T, et al. Elimination of Porphyromonas gingivalis inhibits liver fibrosis and inflammation in NASH[J] J Clin Periodontol. 2021;48(10):1367–1378. doi: 10.1111/jcpe.13523. [DOI] [PubMed] [Google Scholar]
- 5.Sumida Y, Yoneda M. Current and future pharmacological therapies for NAFLD/NASH[J] J Gastroenterol. 2018;53(3):362–376. doi: 10.1007/s00535-017-1415-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Diskin C, Pålsson-McDermott EM. Metabolic modulation in macrophage effector function[J] Front Immunol. 2018;9:270. doi: 10.3389/fimmu.2018.00270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Barreby E, Chen P, Aouadi M. Macrophage functional diversity in NAFLD-more than inflammation[J] Nat Rev Endocrinol. 2022;18(8):461–472. doi: 10.1038/s41574-022-00675-6. [DOI] [PubMed] [Google Scholar]
- 8.Kazankov K, Jørgensen SMD, Thomsen KL, et al. The role of macrophages in nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J] Nat Rev Gastroenterol Hepatol. 2019;16(3):145–159. doi: 10.1038/s41575-018-0082-x. [DOI] [PubMed] [Google Scholar]
- 9.Mehal WZ, Schuppan D. Antifibrotic therapies in the liver[J] Semin Liver Dis. 2015;35(2):184–198. doi: 10.1055/s-0035-1550055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Pellicoro A, Ramachandran P, Iredale JP, et al. Liver fibrosis and repair: immune regulation of wound healing in a solid organ[J] Nat Rev Immunol. 2014;14(3):181–194. doi: 10.1038/nri3623. [DOI] [PubMed] [Google Scholar]
- 11.Ramachandran P, Pellicoro A, Vernon MA, et al. Differential Ly-6C expression identifies the recruited macrophage phenotype, which orchestrates the regression of murine liver fibrosis[J] PNAS. 2012;109(46):E3186–E3195. doi: 10.1073/pnas.1119964109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Tacke F, Zimmermann HW. Macrophage heterogeneity in liver injury and fibrosis[J] J Hepatol. 2014;60(5):1090–1096. doi: 10.1016/j.jhep.2013.12.025. [DOI] [PubMed] [Google Scholar]
- 13.Karlmark KR, Weiskirchen R, Zimmermann HW, et al. Hepatic recruitment of the inflammatory Gr1+ monocyte subset upon liver injury promotes hepatic fibrosis[J] Hepatology. 2009;50(1):261–274. doi: 10.1002/hep.22950. [DOI] [PubMed] [Google Scholar]
- 14.Duffield JS, Forbes SJ, Constandinou CM, et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair[J] J Clin Invest. 2005;115(1):56–65. doi: 10.1172/JCI22675. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Schuppan D, Surabattula R, Wang XY. Determinants of fibrosis progression and regression in NASH[J] J Hepatol. 2018;68(2):238–250. doi: 10.1016/j.jhep.2017.11.012. [DOI] [PubMed] [Google Scholar]
- 16.Eming SA, Wynn TA, Martin P. Inflammation and metabolism in tissue repair and regeneration[J] Science. 2017;356(6342):1026–1030. doi: 10.1126/science.aam7928. [DOI] [PubMed] [Google Scholar]
- 17.Murray PJ, Allen JE, Biswas SK, et al. Macrophage activation and polarization: nomenclature and experimental guidelines[J] Immunity. 2014;41(1):14–20. doi: 10.1016/j.immuni.2014.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hou R, Huang R, Zhou Y, et al. Single-cell profiling of the microenvironment in decidual tissue from women with missed abortions[J] Fertil Steril. 2023;119(3):492–503. doi: 10.1016/j.fertnstert.2022.12.016. [DOI] [PubMed] [Google Scholar]
- 19.Xia H, Liu Y, Xia G, et al. Novel isoquinoline alkaloid litcubanine A—A potential anti-inflammatory candidate[J] Front Immunol. 2021;12:685556. doi: 10.3389/fimmu.2021.685556. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Caligiuri A, Gentilini A, Marra F. Molecular pathogenesis of NASH[J] Int J Mol Sci. 2016;17(9):E1575. doi: 10.3390/ijms17091575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Poynard T, Munteanu M, Charlotte F, et al. Impact of steatosis and inflammation definitions on the performance of NASH tests[J] Eur J Gastroenterol Hepatol. 2018;30(4):384–391. doi: 10.1097/MEG.0000000000001033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Arrese M, Cabrera D, Kalergis AM, et al. Innate immunity and inflammation in NAFLD/NASH[J] Dig Dis Sci. 2016;61(5):1294–1303. doi: 10.1007/s10620-016-4049-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Schuster S, Cabrera D, Arrese M, et al. Triggering and resolution of inflammation in NASH[J] Nat Rev Gastroenterol Hepatol. 2018;15(6):349–364. doi: 10.1038/s41575-018-0009-6. [DOI] [PubMed] [Google Scholar]
- 24.Guilliams M, Scott CL. Liver macrophages in health and disease[J] Immunity. 2022;55(9):1515–1529. doi: 10.1016/j.immuni.2022.08.002. [DOI] [PubMed] [Google Scholar]
- 25.刘 崇武, 吴 春芳, 骆 凯, et al. 牙龈卟啉单胞菌脂多糖和白细胞介素-10对高脂血症兔肺巨噬细胞SR-A表达的影响[J] 福建医科大学学报. 2014;48(4):213–216. [Google Scholar]; Liu CW, Wu CF, Luo K, et al. The impact of Porphyromonas gingivalis lipopolysaccharide and IL-10 on the expression of SR-A in hyperlipidemic rabbit alveolar macrophages[J] J Fujian Med Univ. 2014;48(4):213–216. [Google Scholar]
- 26.申 道南, 吴 亚菲, 赵 蕾. 牙周致病菌在动脉粥样硬化发生发展中的作用研究[J] 中华口腔医学杂志. 2021;56(6):584–590. doi: 10.3760/cma.j.cn112144-20210222-00085. [DOI] [PubMed] [Google Scholar]; Shen DN, Wu YF, Zhao L. Roles of periodontal pathogens in the pathogenesis of atherosclerosis[J] Chin J Stomatol. 2021;56(6):584–590. doi: 10.3760/cma.j.cn112144-20210222-00085. [DOI] [PubMed] [Google Scholar]
- 27.Willems E, Alkema W, Keizer-Garritsen J, et al. Biosynthetic homeostasis and resilience of the complement system in health and infectious disease[J] EBioMedicine. 2019;45:303–313. doi: 10.1016/j.ebiom.2019.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Civeira-Marín M, Cenarro A, Marco-Benedí V, et al. APOE genotypes modulate inflammation independently of their effect on lipid metabolism[J] Int J Mol Sci. 2022;23(21):12947. doi: 10.3390/ijms232112947. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Tran MTN, Hamada M, Jeon H, et al. MafB is a critical regulator of complement component C1q[J] Nat Commun. 2017;8(1):1700. doi: 10.1038/s41467-017-01711-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Wu Z, Zhang Z, Lei Z, et al. CD14: biology and role in the pathogenesis of disease[J] Cytokine Growth Factor Rev. 2019;48:24–31. doi: 10.1016/j.cytogfr.2019.06.003. [DOI] [PubMed] [Google Scholar]
- 31.Maurer M, von Stebut E. Macrophage inflammatory protein-1[J] Int J Biochem Cell Biol. 2004;36(10):1882–1886. doi: 10.1016/j.biocel.2003.10.019. [DOI] [PubMed] [Google Scholar]
- 32.Orci LA, Kreutzfeldt M, Goossens N, et al. Tolerogenic properties of liver macrophages in non-alcoholic steatohepatitis[J] Liver Int. 2020;40(3):609–621. doi: 10.1111/liv.14336. [DOI] [PubMed] [Google Scholar]