Abstract
目的
探讨雷帕霉素在大鼠局灶性脑缺血再灌注后24 h给药对脑损伤的保护作用。
方法
104只Sprague Dawley大鼠随机分为手术对照组、模型对照组、建模后6 h雷帕霉素给药组(6 h给药组)和建模后24 h雷帕霉素给药组(24 h给药组)。采用Longa法建立大鼠大脑中动脉缺血再灌注模型。采用神经功能损伤程度评分(NSS)对大鼠进行神经功能评分;氯化三苯基四氮唑(TTC)染色法检测各组大鼠脑梗死体积;Fluoro-Jade B(FJB)染色法检测大鼠脑组织神经元凋亡;蛋白质印迹法检测各组大鼠mTOR信号通路磷酸化S6蛋白表达。
结果
与手术对照组比较,模型对照组大鼠NSS升高,脑梗死体积增加,FJB阳性细胞增多,半暗带磷酸化S6蛋白表达量增加(均 P < 0.01);与模型对照组比较,6 h和24 h给药组大鼠NSS均降低,脑梗死体积缩小,FJB阳性细胞减少,半暗带磷酸化S6蛋白表达量减少(均 P < 0.05或 P < 0.01),且24 h给药组各项指标变化与6 h给药组差异均无统计学意义(均 P > 0.05)。
结论
缺血再灌注后24 h给予雷帕霉素对大鼠局灶性脑缺血再灌注所致脑损伤仍有保护作用。
Abstract
Objective
To investigate whether rapamycin treatment starting at 24 h after cerebral ischemia/reperfusion(I/R) has protective effect on brain injury in rats.
Methods
The rat I/R model was established by middle cerebral artery occlusion according to Longa's method. A total of 104 Sprague Dawley rats were randomly divided into sham group, model group, and rapamycin-treated groups (6 h or 24 h after modeling). Neurological function was assessed with neurological severity score (NSS). Triphenyl tetrazolium chloride (TTC) staining and Fluoro-Jade B (FJB) staining were used to examine the infarct volume and neuronal apoptosis, respectively. The expression of p-S6 protein in mTOR signaling pathway was detected by Western blot analysis.
Results
Compared with sham group, NSS of the model group was significantly increased and TTC staining indicated obvious infarct area (all P < 0.01). Furthermore, significantly increased number of FJB-positive cells and p-S6 expression in the penumbra area were shown in the model group (all P < 0.01). Compared with the model group, both rapamycin-treated groups demonstrated decreased NSS, infarction volume and FJB positive cells as well as p-S6 expression in the penumbra area ( P < 0.05 or P < 0.01). There was no significant difference between the groups of rapamycin administrated 6 h and 24 h after modeling (all P > 0.05).
Conclusion
Rapamycin treatment starting at 24 h after I/R exhibits protective effect on brain injury in rats.
Keywords: Brain ischemia/drug therapy, Reperfusion injury/drug therapy, Neurons, Apoptosis, Protein kinases/physiology, Sirolimus/pharmacology, Signal transduction
缺血性脑卒中是一种因急性或慢性血供障碍引起的脑损伤疾病,在全球已成为致残和致死的主要原因之一 [ 1- 2] 。在中国,每年有150万人死于缺血性脑卒中,仅次于心脏病和恶性肿瘤 [ 2] 。尽早恢复血液灌注是处理缺血性脑卒中的主要原则,但血流恢复后由于氧自由基生成、钙超载等因素亦可导致脑组织损伤和功能障碍进一步加重,因此缺血再灌注损伤在临床上极为常见。目前,缺血性脑卒中的治疗方法很少,组织型纤溶酶原激活剂是美国食品药品监督管理局(FDA)唯一批准的治疗药物 [ 3] 。然而,由于其治疗时间窗狭窄,一般缺血后90 min内效果最佳 [ 4] ,因此仅适用于极少数患者。若能找到延长治疗窗的药物,会有更多患者受益。
缺血性脑卒中再灌注损伤涉及多个分子生物学机制 [ 5- 7] 。其中,Akt/mTOR信号通路颇受关注,但其对缺血性脑卒中再灌注损伤的作用尚无一致结论。研究显示,上调mTOR激酶活性可降低缺血性脑卒中损害,改善神经功能 [ 8- 9] ;mTOR抑制剂可促进神经元和小胶质细胞凋亡,从而降低细胞存活率 [ 2, 10] 。但是,研究者使用人脐静脉内皮细胞进行原代细胞氧糖剥夺模拟缺血条件的实验时发现,mTOR抑制剂通过诱导保护性自噬可以增加神经元存活率 [ 11] 。因此,不同原因和条件导致缺血性脑卒中时mTOR信号的微妙平衡对细胞存活至关重要。
我们前期研究表明,在小鼠慢性缺血性脑卒中模型中,mTOR抑制剂雷帕霉素可以改善慢性缺血性脑卒中所致学习记忆能力下降,其机制可能与抑制半暗带神经元凋亡和增加自噬有关 [ 12] 。在大鼠大脑中动脉梗死模型中,雷帕霉素预防性给药和建模后6 h给药均显著抑制半暗带mTOR信号通路的异常激活,并降低脑梗死体积 [ 13] 。为了进一步明确建模后24 h给予雷帕霉素是否仍然有效,本实验采用大脑中动脉阻塞法建立大鼠缺血再灌注模型,对比雷帕霉素在建模后6 h和24 h给药对缺血再灌注大鼠的保护作用。
雷帕霉素为大连美仑生物科技有限公司产品。兔抗磷酸化S6抗体、兔抗S6抗体为美国Cell Signaling公司产品;兔二抗、BCA蛋白浓度测定试剂盒为南京碧云天生物技术有限公司产品;荧光二抗为美国LI-COR公司产品;Fluoro-Jade B(FJB)粉末为美国Millipore Chemicon公司产品。激光多普勒血流仪为英国Moor公司产品;冰冻切片机为德国Microm公司产品;激光共聚焦显微镜为日本Olymbus公司产品。
104只体质量为230~270 g的清洁级雄性Sprague Dawley大鼠购自上海斯莱克实验动物有限公司,实验动物许可证号为SYXK(沪)2012-0002。动物使用及相关处理严格参照浙江大学实验动物管理办法执行。实验动物的饲养条件为温度(24±1)℃,湿度为50 % ~60 %,每日光照时间固定为12 h,自由进食和饮水。适应性饲养一周后随机分为手术对照组、模型对照组、建模后6 h雷帕霉素给药组(6 h给药组)和建模后24 h雷帕霉素给药组(24 h给药组),每组26只。雷帕霉素给药剂量为3 mg/kg,1次/d,连续腹腔注射3 d;手术对照组和模型对照组给予腹腔注射等量溶剂。
大鼠术前24 h禁食不禁水,腹腔注射10%水合氯醛溶液(30 mg/kg)麻醉。将麻醉后的大鼠仰卧位固定,颈部常规备皮、消毒,取右侧旁正中切口,暴露右侧颈总动脉、颈内动脉和颈外动脉。参照Longa法 [ 14] 建立右侧阻塞的大鼠大脑中动脉缺血模型。手术组大鼠夹闭颈总动脉、颈内动脉,结扎颈外动脉远心端,斜剪切口,将线栓插入,经颈外进入颈内,沿颈内推送,至有压力感为止(从颈总动脉分叉处算起约插入20~22 mm)。同时利用激光多普勒脑血流仪对梗死脑区血流进行监测,当血流量稳定下降至30 %时开始计时,缺血1 h后将线栓轻轻退出,以此时间记为再灌注开始。手术对照组仅分离相应动脉,不插入线栓。大鼠术后置于温度适宜、清洁通风的环境中分笼饲养。建模成功的标志:右眼霍纳综合征、行走时向左侧倾倒或转圈,提尾时左前肢屈曲内收。排除以下情况者:①蛛网膜下腔出血;②未到观察时间点提前死亡;③组织切片染色结果无病理学改变。
缺血性脑卒中再灌注后1、3、7、10、14 d,采用双盲方式依据神经功能损伤程度评分(neurological severity score,NSS) [ 15] 对各组大鼠进行评分。NSS包括运动功能测试、感觉测试、横杆平衡木测试、反射和异常动作测试四部分( 表 1)。分值为0~18分,其中1~6分提示轻度损害,7~12分提示中度损害,13~18分提示严重损害。评分越高,神经损伤越严重。
|
测试项目 |
评分 |
|
运动功能测试 |
|
|
从尾部提起大鼠 |
|
|
前肢屈曲 |
1 |
|
后肢屈曲 |
1 |
|
头部在30 s内上仰超过10° |
1 |
|
将大鼠放于平台上(正常0分,最多3分) |
|
|
正常爬行 |
0 |
|
无法笔直爬行 |
1 |
|
围绕偏瘫侧打转 |
2 |
|
向偏瘫侧跌倒 |
3 |
|
感觉测试 |
|
|
浅感觉测试(视觉和触觉测试) |
1 |
|
本体感觉测试(深感觉,将患肢置于桌子边缘,动物无肢体收缩反应) |
1 |
|
横杆平衡木测试(正常0分,最多6分) |
|
|
平衡 |
0 |
|
抓住横杆一侧 |
1 |
|
抱住横杆,一肢体掉下 |
2 |
|
抱住横杆,二肢体掉下或抱横杆旋转>60 s |
3 |
|
尽力平衡,但失败掉下(>40 s) |
4 |
|
尽力平衡,但失败掉下(>20 s) |
5 |
|
掉下(< 20 s) |
6 |
|
反射和异常动作测试 |
|
|
耳廓反射(刺激耳道后摇头) |
1 |
|
角膜反射(棉花刺激角膜后眨眼) |
1 |
|
惊吓反射(听到突然声响后运动反射或尖叫) |
1 |
|
抽搐、肌阵挛、肌张力异常 |
1 |
大鼠于建模后第4天断头取脑,将脑组织自前向后连续切成厚约2 mm的冠状切片5片,置于含2 % TTC的PBS 37 ℃避光孵育30 min,每10 min翻动一次切片,再用PBS溶液洗去TTC,将切片浸入4 %多聚甲醛溶液固定30 min并摄片。正常脑组织为均匀红色,梗死组织为白色。采用Image Pro Plus 6.0软件测量各层面脑组织的面积、梗死侧梗死面积、正常侧面积 [ 16] 。梗死总体积=梗死总面积×2(mm,切片厚度);相对脑梗死体积(%)=[梗死总体积-(梗死侧半球体积-正常侧半球体积)] /正常侧半球体积×100 % [ 17] 。
大鼠建模后第7天采用水合氯醛溶液麻醉,利用灌注泵经左心室升主动脉灌流取脑组织(压力为0.2 mPa,流速低于200 mL/min)。先用预冷的等渗氯化钠溶液快速灌流250 mL,再用4 %多聚甲醛灌流250 mL,先快后慢共灌注约1 h,灌流结束后取全脑。脑组织用4 %多聚甲醛4 ℃固定过夜,然后依次放入15 %蔗糖溶液、30 %蔗糖溶液直至沉底。常规制作冰冻切片吹干后用PBS冲洗,1 %氢氧化钠/80 %乙醇溶液处理5 min,然后依次浸入70 %乙醇溶液和蒸馏水各2 min。在0.06 %高锰酸钾溶液中振荡染色10 min,切片经水洗后置入0.1 %醋酸/0.001 % FJB溶液中浸染20 min。封片后激光共聚焦显微镜下观察计数。选定半暗带区域,每只小鼠选取不同断面的2张切片,每个切片随机选取2个目标视野(×200倍,0.4 mm 2范围)计数,计算选定区域内FJB阳性细胞的数量。
建模14 d时,各组大鼠断头取正常区和半暗带脑组织,半暗带取材参考文献[ 18- 19]。经超声后匀浆离心取上清液,BCA法蛋白定量后进行SDS-PAGE,转膜后硝酸纤维膜经5 %脱脂奶粉封闭,加入S6、磷酸化S6抗体(1: 1000)4 ℃孵育过夜,洗膜后加入由HRP标记的抗兔IgG(1: 5000),室温孵育1 h后采用电化学发光剂获取蛋白表达的信号。采用ImageJ软件计算磷酸化S6/总S6比值。
使用SPSS 16.0软件进行统计分析。计量数据以均值±标准差( x ± s)表示,多组间比较采用方差分析,组间两两比较采用LSD- t检验, P < 0.05为差异有统计学意义。
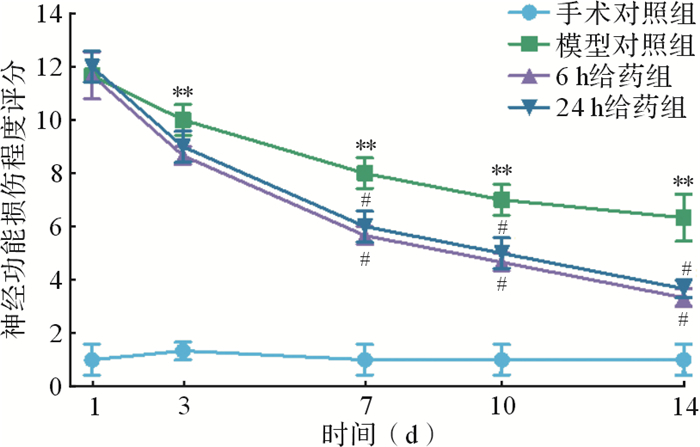
各组大鼠在缺血性脑卒中再灌注后1、3、7、10、14 d的NSS如 图 1所示。与手术对照组比较,模型对照组大鼠NSS增加( P < 0.01),提示建模成功;与模型对照组比较,雷帕霉素给药组在术后第7天起NSS降低(均 P < 0.05),且24 h给药组与6 h给药组之间差异无统计学意义(均 P > 0.05),提示缺血再灌注后6 h或24 h给予雷帕霉素治疗可改善大鼠受损神经功能。
手术对照组大鼠脑组织均染成红色,未见明显梗死部位;模型对照组有大面积梗死灶出现(相对梗死体积为26.50 % ±2.69 %),6 h给药组及24 h给药组亦有梗死灶(相对梗死体积分别为16.25 % ±2.19 %和18.50 %±2.41 %),但与模型对照组比较梗死灶明显缩小(均 P < 0.01),见 图 2。6 h给药组脑梗死体积与24 h给药组差异无统计学意义( P > 0.05)。结果提示,缺血再灌注后6 h或者24 h给予雷帕霉素治疗均可缩小脑梗死体积。

各组大鼠神经元凋亡结果如 图 3所示。手术对照组、模型对照组、6 h给药组和24 h给药组在0.4 mm 2范围内FJB阳性细胞数量分别为15±4、150±17、76±12和83±13。与手术对照组比较,模型对照组和雷帕霉素给药组FJB阳性细胞数量均明显增多(均 P < 0.01)。与模型对照组比较,给药组FJB阳性细胞减少(均 P < 0.01),6 h给药组与24 h给药组差异无统计学意义( P>0.05)。结果提示,缺血再灌注后6 h或24 h给予雷帕霉素治疗均能保护缺血性脑卒中再灌注损伤的神经元。

与手术对照组比较,模型对照组半暗带磷酸化S6蛋白表达量增加( P < 0.01);与模型对照组比较,6 h和24 h给药组半暗带磷酸化S6蛋白表达量降低(均 P < 0.01);6 h给药组半暗带磷酸化S6蛋白表达量与24 h给药组差异无统计学意义( P > 0.05),见 图 4。结果提示,缺血再灌注后6 h或24 h给予雷帕霉素治疗均可逆转缺血所致mTOR信号通路异常激活。

近年来,mTOR信号通路与缺血性脑卒中已成为研究热点,如何有效治疗缺血性脑卒中再灌注损伤是亟待解决的问题。本实验采用Longa线栓法制备大鼠缺血再灌注模型,以缺血性脑卒中1 h作为缺血时间点,与目前临床静脉溶栓时间点基本一致。实验鼠体质量、麻醉剂量、阻塞脑血管血流量等多种因素会影响缺血性脑卒中再灌注模型的成功率和稳定性 [ 20] ,其中影响最大的是脑血流量的改变。因此,实时监测脑血流量值在很大程度上可以提高动物模型的成功率和可靠性。本研究采用多普勒血流仪来监测建模过程中大鼠脑部血流量、体温和血气的变化,当脑血流量值下降到建模前的30 %时判定发生脑部缺血。本实验TTC染色结果显示模型对照组脑组织有大面积梗死灶出现,结合NSS,我们认为建模大鼠神经功能受损严重,证实本次实验建模成功。
研究发现,PI3K/Akt/mTOR信号通路参与了缺血性脑卒中再灌注损伤的病理过程,PI3K可激活下游靶蛋白Akt,Akt磷酸化后启动下游的级联反应,通过多种途径促进细胞存活,发挥抗细胞凋亡作用 [ 21- 23] 。mTOR是PI3K信号通路下游的重要分子,扮演着枢纽作用,但mTOR激活对于神经细胞的作用尚无定论。研究显示,抑制PTEN(mTOR通路的上游抑制分子)进而激活mTOR可降低缺血性脑卒中损伤,改善神经功能 [ 8- 9] 。Koh等 [ 24] 研究表明,雌激素可以减轻大脑中动脉阻塞模型大鼠局灶性脑梗死体积,其作用机制与激活mTOR、P70S6K和Akt密切相关。然而,亦有研究结果显示激活mTOR信号并非均表现为神经保护作用。如有学者发现雷帕霉素通过抑制mTOR信号通路激活自噬活性,或改变大脑中的丙二醛、谷胱甘肽、一氧化氮和髓过氧化物酶的水平进而发挥神经保护作用 [ 13, 25] 。缺血性脑卒中研究中,动物品系、建模方法、缺血和再灌注时间差异、观察和检测部位的不同均可能影响实验结果,如我们前期研究显示mTOR信号通路在缺血再灌注后的半暗带区被激活,而在梗死核心区mTOR通路则被抑制。半暗带是缺血性脑卒中核心区周边的组织,存在大量处于休眠状态或半休眠状态的神经细胞,具有可逆性即潜在修复能力。本实验选取半暗带作为研究对象,发现缺血再灌注大鼠模型给予雷帕霉素治疗后半暗带S6磷酸化水平和NSS降低,提示雷帕霉素可以通过逆转缺血性脑卒中所致的半暗带mTOR异常激活发挥神经保护作用,改善受损神经功能。
雷帕霉素通过多种途径保护缺血后脑组织,如通过增强自噬和抑制凋亡信号通路发挥作用;抑制大量一氧化氮释放及调节细胞膜代谢、钙离子稳态等效应;抑制小胶质细胞活化和星形胶质细胞增殖以减轻炎症反应等 [ 26- 28] 。缺血性脑卒中后神经元调亡是后续神经功能障碍和认知功能障碍的病理基础。本研究表明雷帕霉素能显著减轻模型大鼠的神经功能损伤,缩小梗死体积,减少神经细胞凋亡。本研究中6 h给药组各项指标变化均比24 h给药组明显,但两者并无显著差异,提示24 h给药对受损脑组织仍有保护作用,为已过溶栓时间窗的患者提供了另一种可能的替代治疗方式。
综上所述,mTOR抑制剂雷帕霉素对缺血再灌注大鼠脑组织有明显的保护作用,且缺血后24 h给药仍有效果,提示缺血性脑卒中发生后相对较长的时间窗内给予mTOR激酶抑制剂治疗的可以改善脑功能。
Funding Statement
杭州市科技发展计划重大科技创新专项(20152013A02);浙江省公益技术应用研究(实验动物)(2017C37122)
References
- 1.GAO H J, LIU P F, LI P W, et al. Ligustrazine monomer against cerebral ischemia/reperfusion injury. Neural Regen Res. 2015;10(5):832–840. doi: 10.4103/1673-5374.156991. [GAO H J, LIU P F, LI P W, et al. Ligustrazine monomer against cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2015, 10(5):832-840.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.PAN Y, CAI X, HUO X, et al. Cost-effectiveness of mechanical thrombectomy within 6 hours of acute ischaemic stroke in China[J/OL]. BMJ Open, 2018, 8(2): e018951. https://www.ncbi.nlm.nih.gov/pubmed/29472264. . [DOI] [PMC free article] [PubMed]
- 3.CHONG Z Z, YAO Q Q, LI H H. The rationale of targeting mammalian target of rapamycin for ischemic stroke. Cell Signal. 2013;25(7):1598–1607. doi: 10.1016/j.cellsig.2013.03.017. [CHONG Z Z, YAO Q Q, LI H H. The rationale of targeting mammalian target of rapamycin for ischemic stroke[J]. Cell Signal, 2013, 25(7):1598-1607.] [DOI] [PubMed] [Google Scholar]
- 4.HACKE W, DONNAN G, FIESCHI C, et al. Association of outcome with early stroke treatment:pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet. 2004;363(9411):768–774. doi: 10.1016/S0140-6736(04)15692-4. [HACKE W, DONNAN G, FIESCHI C, et al. Association of outcome with early stroke treatment:pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials[J]. Lancet, 2004, 363(9411):768-774.] [DOI] [PubMed] [Google Scholar]
- 5.CHOI J H, PILE-SPELLMAN J. Reperfusion changes after stroke and practical approaches for neuroprotection. Neuroimaging Clin N Am. 2018;28(4):663–682. doi: 10.1016/j.nic.2018.06.008. [CHOI J H, PILE-SPELLMAN J. Reperfusion changes after stroke and practical approaches for neuroprotection[J]. Neuroimaging Clin N Am, 2018, 28(4):663-682.] [DOI] [PubMed] [Google Scholar]
- 6.NARNE P, PANDEY V, PHANITHI P B. Role of nitric oxide and hydrogen sulfide in ischemic stroke and the emergent epigenetic underpinnings. https://link.springer.com/article/10.1007/s12035-018-1141-6. Mol Neurobiol. 2018 doi: 10.1007/s12035-018-1141-6. [NARNE P, PANDEY V, PHANITHI P B. Role of nitric oxide and hydrogen sulfide in ischemic stroke and the emergent epigenetic underpinnings[J]. Mol Neurobiol, 2018.] [DOI] [PubMed] [Google Scholar]
- 7.HOU Y, WANG K, WAN W, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats. Genes Dis. 2018;5(3):245–255. doi: 10.1016/j.gendis.2018.06.001. [HOU Y, WANG K, WAN W, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats[J]. Genes Dis, 2018, 5(3):245-255.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.SHI G D, OUYANG Y P, SHI J G, et al. PTEN deletion prevents ischemic brain injury by activating the mTOR signaling pathway. Biochem Biophys Res Commun. 2011;404(4):941–945. doi: 10.1016/j.bbrc.2010.12.085. [SHI G D, OUYANG Y P, SHI J G, et al. PTEN deletion prevents ischemic brain injury by activating the mTOR signaling pathway[J]. Biochem Biophys Res Commun, 2011, 404(4):941-945.] [DOI] [PubMed] [Google Scholar]
- 9.MAIESE K. Cutting through the complexities of mTOR for the treatment of stroke. Curr Neurovasc Res. 2014;11(2):177–186. doi: 10.2174/1567202611666140408104831. [MAIESE K. Cutting through the complexities of mTOR for the treatment of stroke[J]. Curr Neurovasc Res, 2014, 11(2):177-186.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.FLETCHER L, EVANS T M, WATTS L T, et al. Rapamycin treatment improves neuron viability in an in vitro model of stroke[J/OL]. PLoS One, 2013, 8(7): e68281. https://www.ncbi.nlm.nih.gov/pubmed/23861877. . [DOI] [PMC free article] [PubMed]
- 11.URBANEK T, KUCZMIK W, BASTA-KAIM A, et al. Rapamycin induces of protective autophagy in vascular endothelial cells exposed to oxygen-glucose deprivation. Brain Res. 2014;1553:1–11. doi: 10.1016/j.brainres.2014.01.017. [URBANEK T, KUCZMIK W, BASTA-KAIM A, et al. Rapamycin induces of protective autophagy in vascular endothelial cells exposed to oxygen-glucose deprivation[J]. Brain Res, 2014, 1553:1-11.] [DOI] [PubMed] [Google Scholar]
- 12.张 斌斌, 吴 美玲, 刘 露娜, et al. 抑制哺乳动物雷帕霉素靶蛋白信号通路对慢性脑缺血小鼠认知功能的改善和机制. http://www.zjujournals.com/med/CN/10.3785/j.issn.1008-9292.2017.08.10. 浙江大学学报(医学版) 2017;46(4):405–411. [张斌斌, 吴美玲, 刘露娜, 等.抑制哺乳动物雷帕霉素靶蛋白信号通路对慢性脑缺血小鼠认知功能的改善和机制[J].浙江大学学报(医学版), 2017, 46(4):405-411.] [Google Scholar]
- 13.WU M, ZHANG H, KAI J, et al. Rapamycin prevents cerebral stroke by modulating apoptosis and autophagy in penumbra in rats. https://api.wiley.com/onlinelibrary/tdm/v1/articles/10.1002%2Facn3.507. Ann Clin Transl Neurol. 2018;5(2):138–146. doi: 10.1002/acn3.507. [WU M, ZHANG H, KAI J, et al. Rapamycin prevents cerebral stroke by modulating apoptosis and autophagy in penumbra in rats[J]. Ann Clin Transl Neurol, 2018, 5(2):138-146.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989;20(1):84–91. doi: 10.1161/01.STR.20.1.84. [LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.] [DOI] [PubMed] [Google Scholar]
- 15.CHEN J, SANBERG P R, LI Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats. Stroke. 2001;32(11):2682–2688. doi: 10.1161/hs1101.098367. [CHEN J, SANBERG P R, LI Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11):2682-2688.] [DOI] [PubMed] [Google Scholar]
- 16.WANG T, LI Y, WANG Y, et al. Lycium barbarum polysaccharide prevents focal cerebral ischemic injury by inhibiting neuronal apoptosis in mice[J/OL]. PLoS One, 2014, 9(3): e90780. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM24595452. . [DOI] [PMC free article] [PubMed]
- 17.冯 春燕, 樊 小农, 张 春红, et al. 氯化三苯四氮唑染色后梗死灶定量分析方法. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK200902125592. 生物工程学杂志. 2009;26(6):1363–1366. [冯春燕, 樊小农, 张春红, 等.氯化三苯四氮唑染色后梗死灶定量分析方法[J].生物工程学杂志, 2009, 26(6):1363-1366.] [PubMed] [Google Scholar]
- 18.ASHWAL S, TONE B, TIAN H R, et al. Core and penumbral nitric oxide synthase activity during cerebral ischemia and reperfusion. Stroke. 1998;29(5):1037–1046. doi: 10.1161/01.STR.29.5.1037. [ASHWAL S, TONE B, TIAN H R, et al. Core and penumbral nitric oxide synthase activity during cerebral ischemia and reperfusion[J]. Stroke, 1998, 29(5):1037-1046;discussion 1047.] [DOI] [PubMed] [Google Scholar]
- 19.孙 明, 赵 育梅, 徐 超. 局灶性脑缺血再灌注损伤核心区及半暗带的组织学定位. 中华神经外科杂志. 2003;19(4):259–262. doi: 10.3760/j.issn:1001-2346.2003.04.005. [孙明, 赵育梅, 徐超.局灶性脑缺血再灌注损伤核心区及半暗带的组织学定位[J].中华神经外科杂志, 2003, 19(4):259-262.] [DOI] [Google Scholar]
- 20.刘 震乾, 张 清秀, 魏 秀娥, et al. 小鼠脑缺血再灌注模型的优化及其效果评价. 东南大学学报(医学版) 2017;36(3):328–332. doi: 10.3969/j.issn.1671-6264.2017.03.004. [刘震乾, 张清秀, 魏秀娥, 等.小鼠脑缺血再灌注模型的优化及其效果评价[J].东南大学学报(医学版), 2017, 36(3):328-332.] [DOI] [Google Scholar]
- 21.WALKER C L, WALKER M J, LIU N K, et al. Systemic bisperoxovanadium activates Akt/mTOR, reduces autophagy, and enhances recovery following cervical spinal cord injury[J/OL]. PLoS One, 2012, 7(1): e30012. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM22253859. . [DOI] [PMC free article] [PubMed]
- 22.KOH S H, LO E H. The role of the PI3K pathway in the regeneration of the damaged brain by neural stem cells after cerebral infarction. J Clin Neurol. 2015;11(4):297–304. doi: 10.3988/jcn.2015.11.4.297. [KOH S H, LO E H. The role of the PI3K pathway in the regeneration of the damaged brain by neural stem cells after cerebral infarction[J]. J Clin Neurol, 2015, 11(4):297-304.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.KOROTCHKINA L G, LEONTIEVA O V, BUKREEVA E I, et al. The choice between p53-induced senescence and quiescence is determined in part by the mTOR pathway. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_2919254. Aging(Albany NY) 2010;2(6):344–352. doi: 10.18632/aging.100160. [KOROTCHKINA L G, LEONTIEVA O V, BUKREEVA E I, et al. The choice between p53-induced senescence and quiescence is determined in part by the mTOR pathway[J]. Aging(Albany NY), 2010, 2(6):344-352.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.KOH P O, CHO J H, WON C K, et al. Estradiol attenuates the focal cerebral ischemic injury through mTOR/p70S6 kinase signaling pathway. Neurosci Lett. 2008;436(1):62–66. doi: 10.1016/j.neulet.2008.02.061. [KOH P O, CHO J H, WON C K, et al. Estradiol attenuates the focal cerebral ischemic injury through mTOR/p70S6 kinase signaling pathway[J]. Neurosci Lett, 2008, 436(1):62-66.] [DOI] [PubMed] [Google Scholar]
- 25.HARA A, NIWA M, YOSHIMI N, et al. Apoptotic cell death in vulnerable subpopulation of cerebellar granule cells. Acta Neuropathol. 1997;94(5):517–518. doi: 10.1007/s004010050744. [HARA A, NIWA M, YOSHIMI N, et al. Apoptotic cell death in vulnerable subpopulation of cerebellar granule cells[J]. Acta Neuropathol, 1997, 94(5):517-518.] [DOI] [PubMed] [Google Scholar]
- 26.YIN L, YE S, CHEN Z, et al. Rapamycin preconditioning attenuates transient focal cerebral ischemia/reperfusion injury in mice. Int J Neurosci. 2012;122(12):748–756. doi: 10.3109/00207454.2012.721827. [YIN L, YE S, CHEN Z, et al. Rapamycin preconditioning attenuates transient focal cerebral ischemia/reperfusion injury in mice[J]. Int J Neurosci, 2012, 122(12):748-756.] [DOI] [PubMed] [Google Scholar]
- 27.CHAUHAN A, SHARMA U, JAGANNATHAN N R, et al. Rapamycin ameliorates brain metabolites alterations after transient focal ischemia in rats. Eur J Pharmacol. 2015;757:28–33. doi: 10.1016/j.ejphar.2015.03.006. [CHAUHAN A, SHARMA U, JAGANNATHAN N R, et al. Rapamycin ameliorates brain metabolites alterations after transient focal ischemia in rats[J]. Eur J Pharmacol, 2015, 757:28-33.] [DOI] [PubMed] [Google Scholar]
- 28.DING S. Dynamic reactive astrocytes after focal ischemia. Neural Regen Res. 2014;9(23):2048–2052. doi: 10.4103/1673-5374.147929. [DING S. Dynamic reactive astrocytes after focal ischemia[J]. Neural Regen Res, 2014, 9(23):2048-2052.] [DOI] [PMC free article] [PubMed] [Google Scholar]


