Abstract
目的
筛选脓毒性急性肾损伤(SAKI)中参与线粒体DNA(mtDNA)损伤修复的相关基因。
方法
40只清洁级雄性C57BL/6J小鼠随机分为SAKI组(28只)和对照组(12只)。采用盲肠结扎穿刺术建立SAKI小鼠模型。分别于术后8、24、48 h采集两组的血液和肾脏标本,干式生化仪检测血清肌酐和尿素氮,ELISA法检测血清炎症因子表达水平;HE染色观察肾脏组织病理学变化。RNA测序和生物信息学分析筛选mtDNA损伤修复相关基因;实时定量RT-PCR法和免疫组织化学法检测相关基因的mRNA和蛋白表达水平。
结果
SAKI组小鼠术后均出现脓毒症症状,死亡16只;血清炎症因子(TNF-α和IL-6)、肌酐和尿素氮水平均高于对照组( P < 0.05或 P < 0.01);肾小管上皮细胞肿胀,炎症细胞浸润,并可见大量细胞空泡形成,提示建模成功。生物信息学分析筛选出 Gadd45α、 Bcl2l1、 Cdkn1a、 Jun、 Rela、 Nfkbia和 Nfkb1等线粒体DNA损伤修复相关基因,实时定量RT-PCR检测以上基因表达量结果与RNA测序趋势一致。SAKI组Gadd45α主要在肾小管上皮细胞核中表达,其阳性表达率高于对照组( P < 0.05)。
结论
Gadd45α、 Bcl2l1、 Cdkn1a、 Jun、 Rela、 Nfkbia和 Nfkb1基因参与了SAKI中mtDNA损伤修复,可以作为SAKI防治的新靶点。
Abstract
Objective
To screen genes involved in mitochondrial DNA (mtDNA) damage repair in rats with septic acute kidney injury (SAKI).
Methods
Forty male C57BL/6J mice were randomly divided into SAKI group ( n=28) and sham operation group ( n=12). The SAKI mouse model was established by cecal ligation and puncture. Blood and kidney samples were collected at 8, 24, and 48 h after surgery. Serum creatinine and urea nitrogen were measured by a dry biochemical analyzer. Serum inflammatory cytokines were detected by ELISA. Histopathological changes were observed with HE staining. The mtDNA damage repair related genes were screened by RNA sequencing and bioinformatics analysis; the mRNA and protein expression levels of related genes were detected by real-time quantitative RT-PCR and immunohistochemisry, respectively.
Results
Symptoms of sepsis were observed in SAKI group, and 16 out of 28 mice were died in the SAKI group; serum TNF-α, IL-6, creatinine and urea nitrogen levels were higher than those in the sham group ( P < 0.05 or P < 0.01). Histopathological examination in SAKI group showed that renal tubular epithelial cells were swollen, inflammatory cells infiltrated, and a large number of cell vacuoles were seen, suggesting successful modeling. Mitochondrial DNA damage repair related genes Gadd45α, Bcl2l1, Cdkn1a, Jun, Rela, Nfkbia and Nfkb1 were screened out. The expression of these genes was detected by real-time RT-PCR, and the results were consistent with RNA sequencing trends. Immunohistochemical staining showed that Gadd45α was mainly expressed in the nucleus of renal tubular epithelial cells, and the positive rate of Gadd45α in SAKI group was higher than that in the sham operation group ( P < 0.05).
Conclusion
Gadd45α, Bcl2l1, Cdkn1a, Jun, Rela, Nfkbia and Nfkb1 genes are involved in mtDNA damage repair in rats with SAKI, indicating that these genes may be used as new targets for prevention and treatment of SAKI.
Keywords: Sepsis; DNA damage; Genes, tumor suppressor; Mitochondria; Kidney/injuries; Kidney/pathology; Renal insufficiency, acute; Disease models, animal
急性肾损伤是脓毒症常见的高危并发症之一 [ 1] 。脓毒性急性肾损伤(septic acute kidney injury,SAKI)临床上主要表现为脓毒症发生后的数小时至数天内患者肾脏滤过功能和排泄体内代谢产物的能力急剧下降 [ 2] 。研究表明,脓毒症和脓毒性休克是急性肾损伤发生的主要原因,超过50%的脓毒症和脓毒性休克患者会发生急性肾损伤,病死率极高 [ 3] 。
根据内共生学说,线粒体起源于古细菌,即细菌被真核生物吞噬后,在长期的共生过程中演变形成线粒体 [ 4] 。线粒体DNA(mitochondrial DNA, mtDNA)的完整性对于维持线粒体的功能和组织,以及细胞的生存起着至关重要的作用 [ 5] 。与核基因组相比,线粒体基因组不被蛋白质压缩,缺少组蛋白的修饰和保护作用。急性肾损伤发生时,近端小管细胞中线粒体肿胀、破碎,导致线粒体嵴紊乱、活性氧自由基增加以及mtDNA释放 [ 6] 。mtDNA释放和活性氧产生的主要部位较近,且mtDNA在结构上缺乏组蛋白的修饰和保护作用,因此mtDNA极易受到损伤。
越来越多的研究表明,mtDNA损伤和功能障碍可能参与SAKI的发生和发展过程 [ 7- 8] 。因此我们推测,通过控制mtDNA损伤,增强mtDNA损伤修复的能力和稳定性有望成为防治SAKI的新策略。然而目前报道的SAKI中mtDNA损伤修复相关基因仍然较少。本研究旨在通过RNA测序技术,筛选出参与SAKI中mtDNA损伤修复的相关基因,寻找有望作为SAKI防治的新靶点。
40只8~10周龄体质量为20~25 g的清洁级雄性C57BL/6J小鼠购自上海斯莱克实验动物责任有限公司,并经浙江大学实验动物中心检疫合格。Oligo(dT)磁珠为美国Thermo Fisher公司产品;TRIzol试剂为美国Invitrogen公司产品;逆转录试剂盒为日本TaKaRa公司产品;柠檬酸钠缓冲液为北京中杉金桥生物技术有限公司产品;Gadd45α抗体为英国Abcam公司产品;ELISA试剂盒为欣博盛生物科技有限公司产品;GTVision TMⅢ抗鼠/兔通用型免疫组织化学检测试剂盒为基因科技(上海)股份有限公司产品;其余生化试剂均为国产分析纯试剂。干式生化仪为日本富士公司产品;荧光定量PCR仪为美国Bio-Rad公司产品;荧光正置显微镜为德国Leica公司产品;酶标仪为瑞士Tecan公司产品。
小鼠于(22±2)℃分笼饲养,标准饲料喂养,可自由饮水。所有小鼠随机分为SAKI组(28只)和对照组(12只)。SAKI组小鼠适应性喂养一周,术前8 h禁水、禁食,0.1%戊巴比妥钠60 mg/kg腹腔麻醉后固定,备皮消毒后沿腹部正中线作长约1.0 cm切口,游离肠系膜和盲肠,距盲肠盲端1 cm处结扎,以27G针头垂直盲肠肠管贯通穿刺,挤出少许肠内容物,将盲肠回纳入腹腔,逐层关腹。对照组打开腹腔后,仅把盲肠拉出腹腔,然后回纳,不进行结扎穿刺和其他处理。术后各组小鼠均皮下注射预热的等渗氯化钠溶液1 mL,置于热垫直至苏醒。SAKI小鼠建模成功的标准:术后小鼠出现精神萎靡、寒战、竖毛、活动减少、行动迟缓、眼眶分泌物等脓毒症症状;血清炎症因子水平升高;小鼠死亡率增加;小鼠肾功能损害标志物血清肌酐和尿素氮水平升高 [ 9] 。建模后8、24、48 h,两组各取4只小鼠,腹腔注射0.1%戊巴比妥钠,处死小鼠,留取血液和肾脏标本。所得血液样本13 800× g离心10 min后取血清于-80 ℃冻存。肾脏组织标本行常规脱水、石蜡包埋。
本研究中动物使用符合浙江大学实验动物中心相关管理条例。
取各时间点采集的小鼠血液样本,采用干式生化仪检测血清肌酐和尿素氮表达水平。
取出试验所需板条,空白孔加标本通用稀释液(100 μL/孔),反应孔加各血清样本或不同浓度标准品100 μL/孔,用封板胶纸封住反应孔,37 ℃孵育90 min;洗板五次;空白孔加生物素化抗体稀释液(100 μL/孔),反应孔加入生物素化抗体工作液100 μL/孔,用新封板胶纸封住反应孔,37 ℃孵育60 min;洗板五次;空白孔加酶结合物稀释液(100 μL/孔),反应孔加入酶结合物工作液100 μL/孔,用新封板胶纸封住反应孔,37 ℃避光孵育30 min;洗板五次;加入显色底物3, 3′, 5, 5′-四甲基联苯胺(TMB)100 μL/孔,37 ℃避光孵育15 min;加入终止液100 μL/孔混匀,使用酶标仪即刻测量吸光度值,计算TNF-α、IL-6等炎症因子的表达量。
肾脏组织标本经包埋、切片、常规脱水后,苏木素室温染核6 min,快速自来水冲洗蓝化30~60 s。若核染色较深,则用1%盐酸乙醇分化数秒,自来水冲洗1 min后伊红室温染色15 min,自来水冲洗5 min。经梯度乙醇和二甲苯脱水透明,中性树胶封片,于400倍荧光显微镜下观察。
提取肾脏组织RNA后,用Oligo(dT)磁珠富集mRNA,并使其片段化。以片段化的mRNA为模板,用六碱基随机引物合成cDNA第一链,并加入缓冲液、脱氧核糖核苷酸(dNTP)、核糖核酸酶H(RNaseH)和DNA聚合酶Ⅰ合成cDNA第二链,洗脱纯化后的双链cDNA再进行末端修复、加碱基A、加测序接头处理,然后经琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增,从而完成整个文库制备工作。构建好的文库用Illumina HiSeq 2500测序。文库的构建和RNA测序由北京安诺优达基因科技有限公司完成。
测序获得原始数据之后,经过测序错误率检查,胞嘧啶、胸腺嘧啶分布检查和原始数据的过滤,获得后续分析可使用的读段数。采用TopHat2(2.0.12版)对过滤后的测序数据进行参考基因组的比对分析。
采用基于负二项分布模型DEGseq(1.18.0版),以|log 2Ratio|≥1和 P < 0.05为标准,筛选对照组和SAKI组差异表达的基因。
采用GSEA软件对DEGseq分析所得的差异表达基因进行分析,即使用预定义的基因集(通常来自功能注释或先前实验的结果),将基因按照在两类样本中的差异表达程度排序,然后检验预先设定的基因集合是否在这个排序表的顶端或者底端富集。
将DEGseq分析所得的差异表达基因通过与MitoCarta数据库中的蛋白匹配,筛选出与线粒体相关的差异表达基因。
采用STRING数据库对GSEA分析所得信号通路的差异表达基因与MitoCarta数据库匹配出的线粒体氧化应激和DNA损伤修复相关基因进行蛋白质相互作用分析。
利用TRIzol试剂提取小鼠肾脏组织总RNA。实时定量RT-PCR反应体系为25 μL,其中SYBR Green超混合液12.5 μL,cDNA 2 μL,上下游引物各1 μL,无菌去离子水补足至25 μL。实时定量RT-PCR引物由杭州擎科梓熙生物技术有限公司设计并合成,引物序列见 表 1。循环条件:95 ℃变性30 s;95 ℃ 5 s,55 ℃ 30 s,40个循环。所有样品重复三次。以 Gapdh作为内参,采用2 -ΔΔCt计算SAKI组目的基因相较于对照组的倍数变化。
表1 实时定量RT-PCR引物序列
Table 1 Primer sequences for real-time RT-PCR
|
引物名称 |
引物序列(5′→3′) |
|
Gadd45α |
正向:CTGCAGAGCAGAAGACCGAA |
|
反向:GGGTCTACGTTGAGCAGCTT |
|
|
Bcl2l1 |
正向:GGAGAGCGTTCAGTGATC |
|
反向:AGGTGGTCATTCAGATAGGT |
|
|
Jun |
正向:ACGACCTTCTACGACGAT |
|
反向:CATTGCTGGACTGGATGAT |
|
|
Cdkn1a |
正向:GTGATGTCCGACCTGTTC |
|
反向:TCAAAGTTCCACCGTTCTC |
|
|
Rela |
正向:GGCATCTGTGGACAACTC |
|
反向:CGCAATGGAGGAGAAGTC |
|
|
Nfkbia |
正向:GCCAGTGTAGCAGTCTTG |
|
反向:CAGGTAGCCGTGGATAGA |
|
|
Nfkb1 |
正向:CAAGAGTGATGACGAGGAG |
|
反向:GTGGATGATGGCTAAGTGTA |
|
|
Gapdh |
正向:CATGGCCTTCCGTGTTCCTA |
|
反向:CCTGCTTCACCACCTTCTTGAT |
将石蜡包埋的小鼠肾脏组织切片脱蜡,再水化,并在亚沸点温度下用酸碱度为6.0的柠檬酸钠进行10 min的抗原暴露;在0.3%过氧化氢中孵育10 min以阻断内源性过氧化物酶活性;用5%牛血清白蛋白(BSA)在室温下封闭30 min;弃BSA,滴加1:1000 Gadd45α多克隆抗体4 ℃孵育过夜,再滴加与HRP偶联的二抗室温孵育30 min;二氨基联苯胺(DAB)显色,苏木素复染,升梯度乙醇脱水,二甲苯透明,中性树胶封片。每次染色均设以缓冲液代替一抗的阴性对照。
采用GraphPad Prism 5软件进行数据分析。计量数据呈正态分布,以均数±标准差( x ± s)表示,两组间比较采用 t检验,多组间比较采用单因素方差分析;计数数据以百分率表示,两组间比较采用 χ 2检验。 P < 0.05为差异有统计学意义。
SAKI组小鼠术后出现精神萎靡、寒战、竖毛、活动减少、行动迟缓、眼眶分泌物等脓毒症症状,术后死亡16只;对照组无上述症状出现, 所有小鼠均存活。SAKI组血清炎症因子TNF-α、IL-6水平均高于对照组( P<0.05或 P<0.01);血清肌酐和尿素氮水平亦均高于对照组( P<0.05或 P<0.01),见 图 1。

小鼠肾脏组织病理学检查结果显示,对照组小鼠肾脏组织结构正常,无炎症细胞浸润;SAKI组小鼠肾脏组织可见肾小管上皮细胞高度肿胀,肾间质大量炎症细胞浸润,视野中可见大量细胞空泡形成( 图 2)。

以上结果提示,小鼠SAKI模型建立成功。
与对照组比较,SAKI组8 h时的下调基因1776个,上调基因1406个;24 h时的下调基因2840个,上调基因2760个;48 h时的下调基因861个,上调基因500个( 图 3)。

两组差异表达基因主要涉及细胞周期、细胞免疫、凋亡和DNA损伤修复等103条相关通路。前20条与SAKI相关的信号通路见 表 2,其中毛细血管扩张共济失调突变(ataxia-telangiectasia mutated, ATM)信号通路与DNA损伤修复相关,该通路中富集的基因见 表 3。
表2 两组差异表达基因功能富集分析所得前20条相关信号通路
Table 2 Top20 signaling pathways in gene set enrichment analysis of differentially expressed genes
|
序号 |
信号通路名称 |
基因数 |
富集得分 |
|
1 |
BIOCARTA_RELA_PATHWAY |
16 |
0.731 220 |
|
2 |
BIOCARTA_AMI_PATHWAY |
15 |
0.759 689 |
|
3 |
BIOCARTA_AKT_PATHWAY |
17 |
0.652 274 |
|
4 |
BIOCARTA_ALK_PATHWAY |
29 |
0.180 719 |
|
5 |
BIOCARTA_AT1R_PATHWAY |
30 |
0.463 202 |
|
6 |
BIOCARTA_CHEMICAL_PATHWAY |
20 |
0.338 688 |
|
7 |
BIOCARTA_SPPA_PATHWAY |
19 |
0.295 740 |
|
8 |
BIOCARTA_ATM_PATHWAY |
18 |
0.574 498 |
|
9 |
BIOCARTA_BCR_PATHWAY |
33 |
0.370 569 |
|
10 |
BIOCARTA_BIOPEPTIDES_PATHWAY |
38 |
0.264 800 |
|
11 |
BIOCARTA_CASPASE_PATHWAY |
21 |
0.712 487 |
|
12 |
BIOCARTA_CCR3_PATHWAY |
20 |
0.310 291 |
|
13 |
BIOCARTA_CD40_PATHWAY |
15 |
0.626 474 |
|
14 |
BIOCARTA_G1_PATHWAY |
24 |
0.302 741 |
|
15 |
BIOCARTA_G2_PATHWAY |
21 |
0.404 999 |
|
16 |
BIOCARTA_CERAMIDE_PATHWAY |
21 |
0.531 168 |
|
17 |
BIOCARTA_TID_PATHWAY |
17 |
0.576 491 |
|
18 |
BIOCARTA_GCR_PATHWAY |
17 |
0.583 920 |
|
19 |
BIOCARTA_CTCF_PATHWAY |
20 |
0.472 224 |
|
20 |
BIOCARTA_CELLCYCLE_PATHWAY |
20 |
0.348 596 |
均 P < 0.05.
表3 ATM信号通路相关差异表达基因
Table 3 Differentially expressed genes associated with ataxia-telangiectasia mutated(ATM) signaling pathway
|
基因 |
排名得分 |
富集得分 |
核心富集 |
|
Cdkn1a |
3.694 151 |
0.169 178 |
是 |
|
Nfkbia |
2.551 620 |
0.279 946 |
是 |
|
Gadd45α |
2.287 872 |
0.388 357 |
是 |
|
Jun |
1.479 635 |
0.421 320 |
是 |
|
Rela |
1.376 330 |
0.483 236 |
是 |
|
Nfkb1 |
1.167 506 |
0.523 231 |
是 |
|
Rad51 |
0.947 872 |
0.533 983 |
是 |
|
Brca1 |
0.877 482 |
0.563 427 |
是 |
|
Rad50 |
0.682 282 |
0.546 523 |
是 |
|
Mre11a |
0.619 685 |
0.558 859 |
是 |
|
Mdm2 |
0.579 492 |
0.574 498 |
是 |
ATM:毛细血管扩张共济失调突变.
将DEGseq筛选出的差异表达基因与小鼠MitoCarta数据库进行匹配,得到223个差异表达基因,包括69个上调基因和154个下调基因,进一步筛选出与线粒体氧化应激和DNA损伤修复相关基因16个( 表 4)。
表4 线粒体氧化应激和DNA损伤修复相关基因筛选结果
Table 4 Screening results of mitochondrial oxidative stress and DNA damage repair related genes
|
基因 |
术后8 h |
术后24 h |
术后48 h |
|||
|
log 2(倍数变化) |
P值 |
log 2(倍数变化) |
P值 |
log 2(倍数变化) |
P值 |
|
|
Ucp2 |
1.545 837 765 |
0.000 0 |
2.421 564 |
0.000 0 |
-0.232 888 755 |
0.000 1 |
|
Ucp3 |
2.005 799 517 |
0.019 1 |
1.877 483 |
0.023 9 |
-0.022 749 298 |
0.655 0 |
|
Bcl2l1 |
0.966 255 449 |
0.000 0 |
1.418 362 |
0.000 0 |
0.136 584 293 |
0.032 7 |
|
Txnrd1 |
0.633 360 128 |
0.000 0 |
1.394 716 |
0.000 0 |
0.226 891 292 |
0.000 0 |
|
Ung |
0.420 837 016 |
0.164 8 |
1.362 909 |
0.000 0 |
0.392 288 202 |
0.283 3 |
|
Cry1 |
2.212 250 395 |
0.000 0 |
1.230 154 |
0.000 0 |
0.939 775 997 |
0.002 5 |
|
Ephx2 |
0.076 290 019 |
0.049 5 |
1.202 637 |
0.000 0 |
0.113 014 758 |
0.009 4 |
|
Trmt11 |
-0.232 064 313 |
0.178 3 |
1.038 919 |
0.000 0 |
0.676 802 335 |
0.000 1 |
|
Aifm3 |
-1.001 395 984 |
0.000 0 |
-1.084 27 |
0.000 0 |
-0.150 239 033 |
0.336 5 |
|
Cpt1c |
-2.203 653 849 |
0.000 0 |
-1.162 05 |
0.005 0 |
-0.910 274 568 |
0.043 5 |
|
Msrb2 |
-1.083 997 153 |
0.000 0 |
-1.186 08 |
0.000 0 |
-0.258 678 473 |
0.022 5 |
|
Alas2 |
1.274 288 353 |
0.000 0 |
-1.274 52 |
0.000 0 |
1.325 174 006 |
0.000 0 |
|
Sept4 |
-1.297 047 836 |
0.000 0 |
-1.365 54 |
0.000 0 |
-0.110 745 779 |
0.346 6 |
|
Gstk1 |
-0.254 009 677 |
0.000 3 |
-1.671 25 |
0.000 0 |
-0.197 267 995 |
0.009 8 |
|
Mpv17l |
0.076 453 114 |
0.000 0 |
-2.021 58 |
0.000 0 |
-1.680 361 986 |
0.000 0 |
|
Idh1 |
-1.407 372 317 |
0.000 0 |
-2.546 52 |
0.000 0 |
0.104 786 086 |
0.000 0 |
将ATM信号通路上的差异表达基因与MitoCarta数据库匹配出的线粒体氧化应激和DNA损伤修复相关基因共同作蛋白相互作用分析,结果提示ATM信号通路与线粒体相关基因的相互作用主要集中在绿色模块( 图 4)。因此,后续实验选择绿色模块的基因进行mRNA水平的验证,这些基因经RNA测序所得到的表达量倍数变化见 表 5。

表5 两组蛋白质相互作用相关基因RNA测序结果
Table 5 Sequencing results of protein interaction-related genes
|
基因 |
术后8 h |
术后24 h |
术后48 h |
|||
|
log 2倍数变化 |
P值 |
log 2倍数变化 |
P值 |
log 2倍数变化 |
P值 |
|
|
Gadd45α |
1.825 227 |
0.000 0 |
2.287 872 |
0.000 0 |
-0.033 4 |
0.590 9 |
|
Bcl2l1 |
0.966 255 |
0.000 0 |
1.418 362 |
0.000 0 |
0.136 584 |
0.032 7 |
|
Cdkn1a |
3.114 603 |
0.000 0 |
3.694 151 |
0.000 0 |
1.681 139 |
0.000 0 |
|
Jun |
0.861 052 |
0.000 0 |
1.479 635 |
0.000 0 |
-0.805 31 |
0.000 0 |
|
Rela |
0.823 518 |
0.000 0 |
1.376 33 |
0.000 0 |
0.093 765 |
0.000 0 |
|
Nfkbia |
1.904 727 |
0.000 0 |
2.551 62 |
0.000 0 |
0.712 892 |
0.000 0 |
|
Nfkb1 |
0.149 964 |
0.000 0 |
1.167 506 |
0.000 0 |
-0.188 24 |
0.000 0 |
实时定量RT-PCR检测结果显示,盲肠结扎穿刺术后8 h,SAKI组 Gadd45α、 Bcl2l1、 Cdkn1a、 Jun、 Rela和 Nfkbia的表达量均高于对照组(均 P < 0.05),而 Nfkb1的表达量与对照组差异无统计学意义( P>0.05);术后24 h,SAKI组 Gadd45α、 Bcl2l1、 Cdkn1a、 Jun、 Rela、 Nfkbia和 Nfkb1的表达量均高于对照组(均 P < 0.05);术后48 h,SAKI组 Gadd45α、 Cdkn1a、 Rela和 Nfkb1的表达量均高于对照组(均 P < 0.05),其余基因表达量与对照组差异均无统计学意义(均 P>0.05),见 图 5。结果提示,SAKI小鼠肾组织mtDNA损伤修复相关基因的表达水平与RNA测序检测结果趋势一致。

选取Gadd45α蛋白进一步验证。结果发现,Gadd45α主要在肾小管上皮细胞的细胞核中表达,表现为棕黄色颗粒状物质沉积( 图 6)。术后8、24、48 h,SAKI组肾小管上皮细胞Gadd45α表达率分别为18.53%、31.03%、29.74%,均高于对照组(4.68%、5.23%、4.18%,均 P<0.05)。结果提示,Gadd45α蛋白在SAKI组小鼠肾脏组织中表达明显增多。
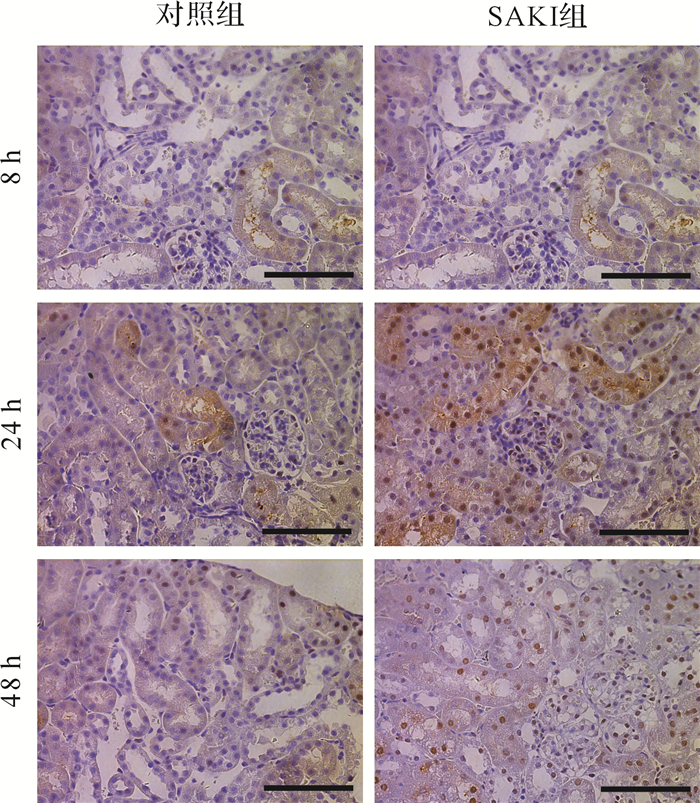
SAKI是急性肾损伤的重要类型,约占所有急性肾损伤的50%。目前,临床尚缺乏防治SAKI特异有效的手段。因此,研究SAKI发生和发展的机制,探索新的治疗靶点,可为解决这一临床难题提供思路和线索。
本研究的目的是利用RNA测序技术,筛选出SAKI中参与mtDNA损伤修复的相关基因,并对其定性、定量表达进行验证分析。研究结果显示,RNA测序后,通过对两组差异表达基因进行功能富集分析,筛选出一条DNA损伤修复相关通路——ATM信号通路;将差异表达基因与MitoCarta数据库进行匹配,筛选出与线粒体氧化应激和DNA损伤修复相关的差异表达基因共16个。将16个线粒体相关基因与ATM信号通路相关基因进行STRING蛋白质相互作用分析,结果发现ATM信号通路上基因与线粒体相关基因的相互作用主要集中在 Gadd45α、 Bcl2l1、 Cdkn1a、 Jun、 Rela、 Nfkbia和 Nfkb1基因。
ATM信号通路主要参与DNA损伤后修复信号传导通路和细胞周期关卡通路的激活,使受损的DNA停滞于细胞周期关卡并对其进行损伤修复 [ 10] 。细胞周期素依赖蛋白激酶抑制剂1a( Cdkn1a)是调控细胞周期检查站的一个重要因子,可与多种Cyclin/CDK复合物结合,抑制底物磷酸化作用,参与细胞周期调节、DNA损伤修复和细胞凋亡等过程 [ 11] ; Jun基因可编码c-jun蛋白,是细胞周期G1期进展的重要分子 [ 12] ;作为细胞核因子Nf-κB的亚基, Rela、 Nfkb1普遍存在于机体的各类细胞之中,而 Nfkbia基因编码含317个氨基酸的IκBα蛋白,是Nf-κB的抑制剂IκB家族的主要成员 [ 13] 。
ATM信号通路中的另一重要基因—— Gadd45α属于生长抑制和DNA损伤诱导基因(growth arrest and DNA damage-inducible genes, Gadd基因)。 Gadd基因最初从紫外线照射的细胞中分离得到,包括 Gadd34、 Gadd45、 Gadd153等。其中Gadd45家族包含三个结构相似的酸性蛋白Gadd45α、Gadd45β、Gadd45γ,其主要定位于细胞核,并且在不同种属间具有高度同源性(相同氨基酸达55%~57%) [ 14] 。Gadd45α作为ATM信号通路的下游分子,在多种生长抑制和损伤因素作用下,通过与多种蛋白相互作用,在细胞周期监测、DNA损伤修复、细胞凋亡和信号转导等方面发挥重要的调控作用 [ 15] 。尿液Gadd45γ的表达水平与肾脏疾病的进展具有相关性 [ 16- 17] 。有研究表明,Gadd45α参与丝裂原活化蛋白激酶(MAPK)信号通路的调控,介导p38的活化 [ 18] ,而p38是MAPK家族重要的成员之一,它可因生理性刺激、脂多糖、渗透性应激和紫外线照射而激活,参与细胞凋亡和细胞周期的调控。p38激活可使IκBα磷酸化并发生降解,从而活化Nf-κB,活化的Nf-κB进入细胞核内与双链DNA结合,可调控 Bcl2l1的表达 [ 19- 21] 。Bcl2l1蛋白位于线粒体外膜上,属于Bcl2蛋白家族,可形成同源或异源二聚体,参与细胞凋亡的过程 [ 22] ;同时可调节线粒体外膜通道的开放,进而调节线粒体膜电位,从而影响活性氧自由基的产生和细胞色素c的释放 [ 23- 24] 。有研究发现,Bcl2蛋白家族在氧化应激的刺激下可有效抑制线粒体脱嘌呤嘧啶核酸内切酶1(aprimidinic/apurinic endonuclease 1,mtAPE1)的核酸内切酶活性 [ 25] 。mtAPE1核酸内切酶介导的碱基切除修复途径是线粒体中DNA修复的主要途径,因此抑制mtAPE1介导的mtDNA修复可明显抑制线粒体DNA修复及增强线粒体DNA突变率 [ 26] 。
本文资料显示,SAKI小鼠肾脏组织中 Gadd45α、 Rela、 Nfkb1、 Nfkbia和 Bcl2l1的表达水平升高。我们推测,在SAKI中 Gadd45α作为应激刺激的感受器最先被激活,并进一步通过Nf-κB通路激活下游 Bcl2l1表达,从而抑制mtDNA的修复,加重SAKI的损伤程度。然而 Gadd45α是否通过 Bcl2l1调控线粒体的作用,进而参与SAKI的具体机制仍有待进一步研究。
Funding Statement
国家自然科学基金(81670621);浙江省自然科学基金(LY16H050001)
References
- 1.LAFRANCE J P, MILLERD R. Acute kidney injury associates with increased long-term mortality. J Am Soc Nephrol. 2010;21(2):345–352. doi: 10.1681/ASN.2009060636. [LAFRANCE J P, MILLERD R. Acute kidney injury associates with increased long-term mortality[J]. J Am Soc Nephrol, 2010, 21(2):345-352.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.HOSTE E A, LAMEIRE N H, VANHOLDER R C, et al. Acute renal failure in patients with sepsis in a surgical ICU:predictive factors, incidence, comorbidity, and outcome. J Am Soc Nephrol. 2003;14(4):1022–1030. doi: 10.1097/01.ASN.0000059863.48590.E9. [HOSTE E A, LAMEIRE N H, VANHOLDER R C, et al. Acute renal failure in patients with sepsis in a surgical ICU:predictive factors, incidence, comorbidity, and outcome[J]. J Am Soc Nephrol, 2003, 14(4):1022-1030.] [DOI] [PubMed] [Google Scholar]
- 3.MAIDEN M J, OTTO S, BREALEY J K, et al. Structure and function of the kidney in septic shock. A prospective controlled experimental study. Am J Respir Crit Care Med. 2016;194(6):692–700. doi: 10.1164/rccm.201511-2285OC. [MAIDEN M J, OTTO S, BREALEY J K, et al. Structure and function of the kidney in septic shock. A prospective controlled experimental study[J]. Am J Respir Crit Care Med, 2016, 194(6):692-700.] [DOI] [PubMed] [Google Scholar]
- 4.GRAY M W, BURGER G, LANGB F. Mitochondrial evolution. Science. 1999;283(5407):1476–1481. doi: 10.1126/science.283.5407.1476. [GRAY M W, BURGER G, LANGB F. Mitochondrial evolution[J]. Science, 1999, 283(5407):1476-1481.] [DOI] [PubMed] [Google Scholar]
- 5.DÖLLE C, FLØNES I, NIDO G S, et al. Defective mitochondrial DNA homeostasis in the substantia nigra in Parkinson disease. Nat Commun. 2016;7:13548. doi: 10.1038/ncomms13548. [DÖLLE C, FLØNES I, NIDO G S, et al. Defective mitochondrial DNA homeostasis in the substantia nigra in Parkinson disease[J/OL]. Nat Commun, 2016, 7:13548.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.EMMA F, MONTINI G, PARIKH S M, et al. Mitochondrial dysfunction in inherited renal disease and acute kidney injury. Nat Rev Nephrol. 2016;12(5):267–280. doi: 10.1038/nrneph.2015.214. [EMMA F, MONTINI G, PARIKH S M, et al. Mitochondrial dysfunction in inherited renal disease and acute kidney injury[J]. Nat Rev Nephrol, 2016, 12(5):267-280.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.PARIKH S M, YANG Y, HE L, et al. Mitochondrial function and disturbances in the septic kidney. Semin Nephrol. 2015;35(1):108–119. doi: 10.1016/j.semnephrol.2015.01.011. [PARIKH S M, YANG Y, HE L, et al. Mitochondrial function and disturbances in the septic kidney[J]. Semin Nephrol, 2015, 35(1):108-119.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.BROOKS C, WEI Q, CHO S G, et al. Regulation of mitochondrial dynamics in acute kidney injury in cell culture and rodent models. J Clin Invest. 2009;119(5):1275–1285. doi: 10.1172/JCI37829. [BROOKS C, WEI Q, CHO S G, et al. Regulation of mitochondrial dynamics in acute kidney injury in cell culture and rodent models[J]. J Clin Invest, 2009, 119(5):1275-1285.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.RITTIRSCH D, HUBER-LANG M S, FLIERL M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc. 2009;4(1):31–36. doi: 10.1038/nprot.2008.214. [RITTIRSCH D, HUBER-LANG M S, FLIERL M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1):31-36.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.GULERIA A, CHANDNA S. ATM kinase:much more than a DNA damage responsive protein. DNA Repair(Amst) 2016;39:1–20. doi: 10.1016/j.dnarep.2015.12.009. [GULERIA A, CHANDNA S. ATM kinase:much more than a DNA damage responsive protein[J]. DNA Repair(Amst), 2016, 39:1-20.] [DOI] [PubMed] [Google Scholar]
- 11.DUTTO I, TILLHON M, CAZZALINI O, et al. Biology of the cell cycle inhibitor p21(CDKN1A):molecular mechanisms and relevance in chemical toxicology. Arch Toxicol. 2015;89(2):155–178. doi: 10.1007/s00204-014-1430-4. [DUTTO I, TILLHON M, CAZZALINI O, et al. Biology of the cell cycle inhibitor p21(CDKN1A):molecular mechanisms and relevance in chemical toxicology[J]. Arch Toxicol, 2015, 89(2):155-178.] [DOI] [PubMed] [Google Scholar]
- 12.WISDOM R, JOHNSON R S, MOORE C. c-Jun regulates cell cycle progression and apoptosis by distinct mechanisms. EMBO J. 1999;18(1):188–197. doi: 10.1093/emboj/18.1.188. [WISDOM R, JOHNSON R S, MOORE C. c-Jun regulates cell cycle progression and apoptosis by distinct mechanisms[J]. EMBO J, 1999, 18(1):188-197.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.HUANG Q, ZHAN L, CAO H, et al. Increased mitochondrial fission promotes autophagy and hepatocellular carcinoma cell survival through the ROS-modulated coordinated regulation of the NFKB and TP53 pathways. Autophagy. 2016;12(6):999–1014. doi: 10.1080/15548627.2016.1166318. [HUANG Q, ZHAN L, CAO H, et al. Increased mitochondrial fission promotes autophagy and hepatocellular carcinoma cell survival through the ROS-modulated coordinated regulation of the NFKB and TP53 pathways[J]. Autophagy, 2016, 12(6):999-1014.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.MOSKALEV A A, SMIT-MCBRIDE Z, SHAPOSHNIKOV M V, et al. Gadd45 proteins:relevance to aging, longevity and age-related pathologies. Ageing Res Rev. 2012;11(1):51–66. doi: 10.1016/j.arr.2011.09.003. [MOSKALEV A A, SMIT-MCBRIDE Z, SHAPOSHNIKOV M V, et al. Gadd45 proteins:relevance to aging, longevity and age-related pathologies[J]. Ageing Res Rev, 2012, 11(1):51-66.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.KEARSEY J M, COATES P J, PRESCOTT A R, et al. Gadd45 is a nuclear cell cycle regulated protein which interacts with p21Cip1. https://www.deepdyve.com/lp/elsevier/gadd45-expression-in-cirrhosis-and-hepatocellular-carcinoma-6eYVy40e9w. Oncogene. 1995;11(9):1675–1683. [KEARSEY J M, COATES P J, PRESCOTT A R, et al. Gadd45 is a nuclear cell cycle regulated protein which interacts with p21Cip1[J]. Oncogene, 1995, 11(9):1675-1683.] [PubMed] [Google Scholar]
- 16.MEYER N J, HUANG Y, SINGLETON P A, et al. GADD45a is a novel candidate gene in inflammatory lung injury via influences on Akt signaling. FASEB J. 2009;23(5):1325–1337. doi: 10.1096/fj.08-119073. [MEYER N J, HUANG Y, SINGLETON P A, et al. GADD45a is a novel candidate gene in inflammatory lung injury via influences on Akt signaling[J]. FASEB J, 2009, 23(5):1325-1337.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.SHIN G T, KIM D R, LIM J E, et al. Upregulation and function of GADD45gamma in unilateral ureteral obstruction. Kidney Int. 2008;73(11):1251–1265. doi: 10.1038/ki.2008.93. [SHIN G T, KIM D R, LIM J E, et al. Upregulation and function of GADD45gamma in unilateral ureteral obstruction[J]. Kidney Int, 2008, 73(11):1251-1265.] [DOI] [PubMed] [Google Scholar]
- 18.YU S, CHO J, PARK I, et al. Urinary GADD45gamma expression is associated with progression of lgA nephropathy. Am J Nephrol. 2009;30(2):135–139. doi: 10.1159/000209317. [YU S, CHO J, PARK I, et al. Urinary GADD45gamma expression is associated with progression of lgA nephropathy[J]. Am J Nephrol, 2009, 30(2):135-139.] [DOI] [PubMed] [Google Scholar]
- 19.TAKEKAWA M, SAITO H. A family of stress-inducible GADD45-like proteins mediate activation of the stress-responsive MTK1/MEKK4 MAPKKK. Cell. 1998;95(4):521–530. doi: 10.1016/S0092-8674(00)81619-0. [TAKEKAWA M, SAITO H. A family of stress-inducible GADD45-like proteins mediate activation of the stress-responsive MTK1/MEKK4 MAPKKK[J]. Cell, 1998, 95(4):521-530.] [DOI] [PubMed] [Google Scholar]
- 20.PAPA S, ZAZZERONI F, PHAM C G, et al. Linking JNK signaling to NF-kappaB:a key to survival. http://www.ncbi.nlm.nih.gov/pubmed/15483317. J Cell Sci. 2004;117(Pt 22):5197–5208. doi: 10.1242/jcs.01483. [PAPA S, ZAZZERONI F, PHAM C G, et al. Linking JNK signaling to NF-kappaB:a key to survival[J]. J Cell Sci, 2004, 117(Pt 22):5197-5208.] [DOI] [PubMed] [Google Scholar]
- 21.LIEBERMANN D A, HOFFMAN B. Gadd45 in the response of hematopoietic cells to genotoxic stress. Blood Cells Mol Dis. 2007;39(3):329–335. doi: 10.1016/j.bcmd.2007.06.006. [LIEBERMANN D A, HOFFMAN B. Gadd45 in the response of hematopoietic cells to genotoxic stress[J]. Blood Cells Mol Dis, 2007, 39(3):329-335.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.KARIN M, LIN A. NF-kappaB at the crossroads of life and death. Nat Immunol. 2002;3(3):221–227. doi: 10.1038/ni0302-221. [KARIN M, LIN A. NF-kappaB at the crossroads of life and death[J]. Nat Immunol, 2002, 3(3):221-227.] [DOI] [PubMed] [Google Scholar]
- 23.CHOI S, CHEN Z, TANG L H, et al. Bcl-xL promotes metastasis independent of its anti-apoptotic activity. Nat Commun. 2016;7:10384. doi: 10.1038/ncomms10384. [CHOI S, CHEN Z, TANG L H, et al. Bcl-xL promotes metastasis independent of its anti-apoptotic activity[J/OL]. Nat Commun, 2016, 7:10384.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.ZHOU F, YANG Y, XING D. Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis. FEBS J. 2011;278(3):403–413. doi: 10.1111/j.1742-4658.2010.07965.x. [ZHOU F, YANG Y, XING D. Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J]. FEBS J, 2011, 278(3):403-413.] [DOI] [PubMed] [Google Scholar]
- 25.PT S, ANDERSEN M H. The anti-apoptotic members of the Bcl-2 family are attractive tumor-associated antigens. http://core.ac.uk/display/8663370. Oncotarget. 2010;1(4):239–245. doi: 10.18632/oncotarget.134. [PT S, ANDERSEN M H. The anti-apoptotic members of the Bcl-2 family are attractive tumor-associated antigens[J]. Oncotarget, 2010, 1(4):239-245.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.XIE M, DOETSCH P W, DENG X. Bcl2 inhibition of mitochondrial DNA repair. BMC Cancer. 2015;15:586. doi: 10.1186/s12885-015-1594-1. [XIE M, DOETSCH P W, DENG X. Bcl2 inhibition of mitochondrial DNA repair[J]. BMC Cancer, 2015, 15:586.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.LECLERE R, TORREGROSA-MUNUMER R, KIREEV R, et al. Effect of estrogens on base excision repair in brain and liver mitochondria of aged female rats. Biogerontology. 2013;14(4):383–394. doi: 10.1007/s10522-013-9431-x. [LECLERE R, TORREGROSA-MUNUMER R, KIREEV R et al. Effect of estrogens on base excision repair in brain and liver mitochondria of aged female rats[J]. Biogerontology, 2013, 14(4):383-394.] [DOI] [PubMed] [Google Scholar]


