Abstract
目的
研究阿尔茨海默病细胞模型中蛇床子素抑制淀粉样前体蛋白(APP)的作用及机制。
方法
脂质体2000转染建立APP高表达的SH-SY5Y细胞模型。利用MTT和乳酸脱氢酶(LDH)法检测蛇床子素对APP高表达细胞的存活率和损伤程度的影响。利用基因芯片技术筛选给予蛇床子素治疗后差异表达的微RNA(miRNA),然后通过生物信息学分析预测与差异表达miRNA靶向结合的基因。细胞内转入差异表达miRNA的抑制剂,然后采用免疫荧光细胞化学法观察细胞中APP、β淀粉样蛋白(Aβ)表达情况,RT-PCR法检测细胞中APP mRNA表达。
结果
实验成功构建了APP高表达的阿尔茨海默病细胞模型。MTT和LDH法检测结果显示,蛇床子素对于APP高表达的细胞具有一定的保护作用,可以减轻细胞的损伤。miRNA-101a-3p是蛇床子素调控较明显的miRNA,其与APP的3'非翻译区靶向结合。与模型对照组比较,miR-101a-3p抑制剂组APP和Aβ蛋白荧光强度增加,APP mRNA表达量增加(均 P < 0.01);加入蛇床子素后细胞中APP和Aβ蛋白荧光强度降低,APP mRNA表达量减少(均 P < 0.01)。
结论
在阿尔茨海默病细胞模型中,蛇床子素通过上调miR-101a-3p抑制APP表达。
Abstract
Objective
To investigate the effect of osthole on the expression of amyloid precursor protein (APP) in Alzheimer's disease (AD) cell model and its mechanism.
Methods
The SH-SY5Y cell with over expression of APP was established by transfection by liposome 2000. The cells were treated with different concentrations of osthole, and the cell viability was determined by MTT and lactate dehydrogenase (LDH) assay. The differentially expressed miRNAs with and without osthole treatment were detected by miRNA array, and the target genes binding to the differentially expressed miRNAs were identified and verified by databases and Cytoscape. After the inhibitor of the differentially expressed miRNA was transduced into cells, the changes of APP and amyloid β (Aβ) protein were determined by immunofluorescence cytochemistry, and the mRNA expression of APP was determined by RT-PCR.
Results
The AD cell model with over expression of APP was established successfully. The results of MTT and LDH assay showed that osthole had a protective effect on cells and alleviated cell damage. miR-101a-3p was identified as the differentially expressed miRNA, which was binding to the 3'-UTR of APP. Compared with APP group, the expression of APP and Aβ protein and APP mRNA increased in the miR-101a-3p inhibitor group (all P < 0.01), while the expression of APP and Aβ protein and APP mRNA decreased in the cells with osthole treatment (all P < 0.01).
Conclusion
Osthole inhibits the expression of APP by up-regulating miR-101a-3p in AD cell model.
Keywords: Alzheimer disease, Osthole/pharmacology, MicroRNAs, Amyloid beta-protein precursor, Protein array analysis, Microchip analytical procedures
阿尔茨海默病(Alzheimer's disease,AD)多发于中老年人,是一种病程较长且较隐匿的神经退行性疾病,其病理特征为淀粉样蛋白沉积、神经纤维缠结以及神经元凋亡丢失 [ 1] 。目前,AD的发病机制有多种假说,其中最公认的是β淀粉样蛋白(Aβ)学说,即AD患者脑内淀粉样前体蛋白(amyloid precursor protein, APP)表达量增多,经过β内切酶、γ内切酶水解形成大量Aβ,过量的Aβ在脑内异常沉积,引起炎症等反应,造成神经元丢失、脑组织萎缩 [ 2- 4] ,加速AD发病。
蛇床子素来源于伞形科草本植物,具有温肾壮阳等作用。我们前期研究发现,蛇床子素可以抑制Aβ对细胞造成的神经毒性 [ 5- 6] ,并可通过促进神经发生和抑制凋亡对AD有较好的治疗作用 [ 7- 8] 。
微RNA(miRNA)是一种非编码小RNA,主要通过抑制mRNA的翻译或促进其降解而发挥作用,人体内的生理过程几乎都受到miRNA的调控 [ 9] 。本文通过miRNA芯片筛选出蛇床子素调控较明显的miRNA,进一步研究蛇床子素治疗AD可能的作用机制,为AD的治疗开辟新途径。
APP/PS1双转基因小鼠购于北京中科泽晟生物技术有限公司;C57BL/6小鼠购于辽宁长生生物技术有限公司。293T细胞株、人神经母细胞瘤细胞株SH-SY5Y由首都医科大学提供;APP595/596质粒、GFP质粒,以及辅助质粒pLP1、pLP2、pMDG由天津医科大学提供。
蛇床子素购于中药食品药品研究所(批号:110822-200407);miR-101a-3p抑制剂为苏州吉玛基因股份有限公司产品;APP、Aβ引物为大连万泽生物技术有限责任公司产品;兔抗APP、兔抗Aβ1- 42和兔抗β-actin为北京博奥森生物技术有限公司产品;Cy3标记的驴抗兔IgG为美国Jackson Immuno Research公司产品;4',6-二脒基-2-苯基吲哚(DAPI染液)为美国Sigma公司产品;Bradford蛋白浓度测定试剂盒为江苏凯基生物技术股份有限公司产品。
Ti-S型荧光显微镜为日本Nikon公司产品;二氧化碳培养箱为美国Nuaire公司产品;MG96G PCR仪为杭州朗基科学仪器有限公司产品;水平核酸电泳仪和半干式蛋白转膜仪为美国Bio-Rad公司产品;凝胶成像系统为上海天能科技有限公司产品。
将APP595/596、GFP以及辅助质粒pLP1、pLP2、pMDG按照一定比例 [ 10] 转染293T细胞;收集转染24、48和72 h的病毒液混合后,超滤管16 785× g离心1 h浓缩病毒液;将浓缩病毒液混合并加入1 %聚凝胺转染SH-SY5Y细胞;用荧光倒置显微镜观察绿色荧光,转染3 d后分别用RT-PCR和蛋白质印迹法检测APP mRNA及蛋白的表达量 [ 11] 。单纯GFP转染的正常SH-SY5Y细胞为空白对照组。
将蛇床子素分别加入APP高表达的SH-SY5Y细胞中,药物终浓度分别为25、50、75、100 μg/mol。APP过表达的SH-SY5Y细胞为模型对照组,GFP转染的正常SH-SY5Y细胞为空白对照组。每组三个复孔,每孔中加入100 μL培养基,培养过夜,加入MTT试剂,避光培养4 h;弃培养液,加入DMSO溶液,摇床振摇10 min,最后在酶标仪570 nm处测量吸光度值。
APP高表达的SH-SY5Y细胞中加入终浓度为50 μg/mol的蛇床子素(蛇床子素组),同时按方法1.3设立模型对照组和空白对照组。将细胞接种到96孔板中,每组三个复孔,培养24 h取上清液,于紫外-可见分光光度计于波长510 nm处测定吸光度值。
9月龄APP/PS1双转基因小鼠经蛇床子素灌胃给药6周,另选取同月龄APP/PS1双转基因小鼠为模型对照组,正常C57BL/6小鼠为空白对照组。取各组小鼠脑组织,用Agilent miRNA芯片检测各组小鼠脑组织miRNA表达谱,根据差异倍数筛选差异表达miRNA。
利用TargetScan、miRDB、microRNA.org三个miRNA靶点预测数据库预测差异表达基因的下游靶基因,并用Cytoscape的插件CytargetLinker验证( https://projects.bigcat.unimaas.nl/cytargetlinker/linksets/)。
将5 μL miRNA-101a-3p抑制剂加至45 μL基础培养基中,同时将5 μL脂质体2000加至45 μL基础培养基,室温放置5 min; 将两种混合物融合20 min后加至APP高表达的SH-SY5Y细胞中,即为抑制剂组;在此基础上再加入终浓度为50 μg/mol的蛇床子素即为蛇床子素+抑制剂组。按照方法1.4设立蛇床子素组、模型对照组和空白对照组。各组按照相同密度接种于96孔板中,每组三个复孔,4 %多聚甲醛固定30 min,室温下聚乙二醇辛基苯基醚(Triton X-100)透化30 min,1 % BSA按照1: 400稀释一抗,4 ℃孵育过夜,次晨洗去一抗,加入Cy3标记的二抗(1: 1000),室温孵育1 h后DAPI染色15 min,PBS清洗后滴加抗荧光淬灭剂,显微镜下观察拍照,并用ImageJ软件进行荧光强度分析。
按方法1.7设立分组,各组加入TRIzol提取RNA,稀释后测定各组RNA纯度,将RNA逆转录成cDNA后-80 ℃保存。PCR扩增体系:DreamTaq PCR Master Mix 25 μL,上下游引物各1.5 μL,样本cDNA 2 μL,水20 μL。反应条件如下:95 ℃ 2 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。用ImageJ软件进行吸光度分析。实验所用引物由广州市锐博生物科技有限公司设计并合成,其中APP的引物序列为5'-AAAACGAAGTTGAGCCTGTTGAT-3'(正向)和5'-GAACCTGGTCGAGTGGTCAGT-3'(反向);β-actin的引物序列为5'-TGCTGTCCCTGTATGCCTCT-3'(正向)和5'-TTTGATGTCACGCACGATTT-3'(反向);miRNA-101a-3p引物序列因涉及保密,不予公开。
采用SPSS 13.0软件进行数据统计,GraphPad Prim 5.0软件绘制统计图。符合正态分布的计量数据以均数±标准差( x ± s)表示,多组间比较采用方差分析,组间两两比较采用 t检验。 P < 0.05为差异具有统计学意义。
细胞经GFP标记的APP质粒转染后在显微镜下可见绿色荧光,并且细胞生长趋势较缓慢( 图 1)。培养3 d后,APP质粒转染的细胞中APP mRNA和蛋白表达量增加,分别为0.30±0.006和0.866±0.042,而空白对照组APP mRNA和蛋白表达量分别为0.160±0.010和0.436±0.023,差异有统计学意义(均 P<0.01)。结果提示,APP高表达AD细胞模型构建成功。

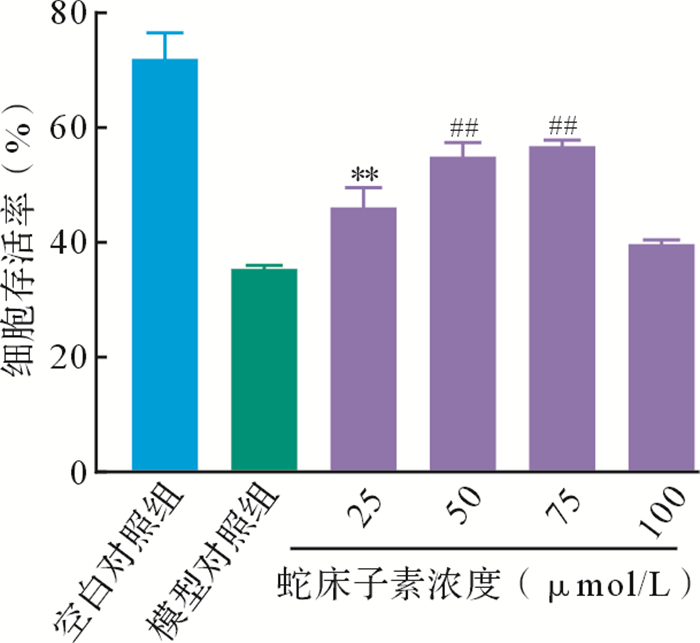
当蛇床子素为75、50 μmol/L时,细胞存活率较高( 图 2)。但由于浓度为75 μmol/L时药物有少量的析出,可能产生一定的偏差,遂后续实验中蛇床子素的终浓度设定为50 μmol/L。空白对照组、模型对照组和蛇床子素组乳酸脱氢酶释放量分别为100±5、167±6、135±5。其中,模型对照组乳酸脱氢酶释放量高于空白对照组( P<0.01),而蛇床子素组低于模型对照组( P<0.01),提示蛇床子素可以减轻AD引起的细胞损伤。
与空白对照组比较,模型对照组miRNA表达上调71个,miRNA表达下调40个;与模型对照组比较,蛇床子素组miRNA表达上调25个,miRNA表达下调53个。根据差异倍数筛选差异表达miRNA,其中miRNA-101a-3p的差异倍数大于2,较其他miRNA在三组之间表达差异明显( 图 3),提示miRNA-101a-3p是蛇床子素调控较明显的miRNA。

由TargetScan、miRDB和microRNA.org数据库预测miRNA-101a-3p可以与APP的256~263位点3'非翻译区靶向结合;进一步利用Cytoscape验证发现,miRNA-101a-3p与APP的结合性较好。
与空白对照组比较,模型对照组APP和Aβ荧光强度增加,而蛇床子素能有效减少APP高表达细胞中APP和Aβ蛋白的表达;与模型对照组比较,miR-101a-3p抑制剂组APP和Aβ荧光强度增加,而加入蛇床子素后细胞中APP和Aβ蛋白表达减少(均 P < 0.01),见 图 4、 5。


与空白对照组比较,模型对照组miRNA-101a-3p表达减少,而APP mRNA表达增多(均 P<0.01);与模型对照组比较,蛇床子素组miRNA-101a-3p表达量增加,APP mRNA表达量减少(均 P<0.01);与抑制剂组比较,蛇床子素+抑制剂组miRNA-101a-3p表达量增加,APP mRNA表达量减少(均 P<0.01),见 图 6。

结果提示,蛇床子素可能通过上调miRNA-101a-3p抑制AD细胞APP和Aβ表达。
AD是一种严重影响人们生活质量的常见疾病,其特征为脑内积聚老年斑及神经原纤维缠结。正常人脑中Aβ的产生和降解保持平衡,而APP过量表达会导致Aβ大量生成,进而出现Aβ沉积,产生神经毒性 [ 12] ,激活一系列病理改变,诱导神经细胞的凋亡。蛇床子素是一种天然香豆素类化合物,具有广泛的药理作用,如抗炎、抗氧化和神经保护作用等 [ 13- 15] 。前期研究发现,蛇床子素可以通过上调miRNA-107减少Aβ沉积 [ 16] ,并可以通过上调miRNA-9促进神经干细胞分化为神经元 [ 17] ,对神经元突触也具有神经保护作用 [ 18] ,提示蛇床子素可能可以通过调控miRNA表达治疗AD。
本研究利用基因芯片技术筛选蛇床子素调控的miRNA,首次发现蛇床子素能够明显调控miRNA-101a-3p,而miRNA-101a-3p的下游为APP基因。Long等 [ 19] 和Barbato等 [ 20] 发现APP作为miRNA-101的下游靶基因,与miRNA-101的表达呈负相关。本文资料显示,作为miRNA-101的亚型,miRNA-101a-3p与APP表达也呈负相关。
本研究还发现,在miRNA-101a-3p表达减少、APP表达增加的同时,Aβ的表达也同样增加,提示miRNA-101a-3p在上调APP表达的同时,可能也影响着β分泌酶的表达,从而加重AD的症状。
一直以来,AD的发病机制尚不清楚,因此一直缺乏安全有效的药物。本研究证明蛇床子素可以通过上调miRNA-101a-3p从而抑制APP表达,为治疗AD等神经系统难治性疾病开辟了新的思路和途径。
Funding Statement
国家自然科学基金(81173580)
References
- 1.傅 秋黎, 戴 海斌, 沈 耀, et al. 组胺对β淀粉样蛋白诱导PC12细胞阿尔茨海默病体外模型的保护作用. http://www.zjujournals.com/med/CN/abstract/abstract18576.shtml. 浙江大学学报(医学版) 2007;36(2):146–149. doi: 10.3785/j.issn.1008-9292.2007.02.008. [傅秋黎, 戴海斌, 沈耀, 等.组胺对β淀粉样蛋白诱导PC12细胞阿尔茨海默病体外模型的保护作用[J].浙江大学学报(医学版), 2007, 36(2):146-149.] [DOI] [PubMed] [Google Scholar]
- 2.REVETT T J, BAKER G B, JHAMANDAS J, et al. Glutamate system, amyloid β peptides and tau protein:functional interrelationships and relevance to Alzheimer disease pathology. J Psychiatry Neurosci. 2013;38(1):6–23. doi: 10.1503/jpn. [REVETT T J, BAKER G B, JHAMANDAS J, et al. Glutamate system, amyloid β peptides and tau protein:functional interrelationships and relevance to Alzheimer disease pathology[J]. J Psychiatry Neurosci, 2013, 38(1):6-23.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.SWOMLEY A M, FÖRSTER S, KEENEY J T, et al. Abeta, oxidative stress in Alzheimer disease:evidence based on proteomics studies. Biochim Biophys Acta. 2014;1842(8):1248–1257. doi: 10.1016/j.bbadis.2013.09.015. [SWOMLEY A M, FÖRSTER S, KEENEY J T, et al. Abeta, oxidative stress in Alzheimer disease:evidence based on proteomics studies[J]. Biochim Biophys Acta, 2014, 1842(8):1248-1257.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.查 芹芹, 阮 燕, 刘 中华, et al. β-淀粉样前体蛋白第二、三外显子删除突变抑制β-淀粉样蛋白分泌. 北京大学学报(医学版) 2003;35(3):261–265. doi: 10.3321/j.issn:1671-167X.2003.03.009. [查芹芹, 阮燕, 刘中华, 等.β-淀粉样前体蛋白第二、三外显子删除突变抑制β-淀粉样蛋白分泌[J].北京大学学报(医学版), 2003, 35(3):261-265.] [DOI] [Google Scholar]
- 5.胡昱, 赵丹, 孙东, 等.蛇床子素抑制Aβ 25-35诱导的神经细胞毒性的研究[C]//第三次中华中医药科技成果论坛论文集.中华中医药学会, 2013: 6.
- 6.HU Y, WEN Q, LIANG W, et al. Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation. Biol Pharm Bull. 2013;36(12):1950–1958. doi: 10.1248/bpb.b13-00561. [HU Y, WEN Q, LIANG W, et al. Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation[J]. Biol Pharm Bull, 2013, 36(12):1950-1958.] [DOI] [PubMed] [Google Scholar]
- 7.YAO Y, GAO Z, LIANG W, et al. Osthole promotes neuronal differentiation and inhibits apoptosis via Wnt/β-catenin signaling in an Alzheimer's disease model. Toxicol Appl Pharmacol. 2015;289(3):474–481. doi: 10.1016/j.taap.2015.10.013. [YAO Y, GAO Z, LIANG W, et al.Osthole promotes neuronal differentiation and inhibits apoptosis via Wnt/β-catenin signaling in an Alzheimer's disease model[J]. Toxicol Appl Pharmacol, 2015, 289(3):474-481.] [DOI] [PubMed] [Google Scholar]
- 8.KONG L, HU Y, YAO Y, et al. The coumarin derivative osthole stimulates adult neural stem cells, promotes neurogenesis in the hippocampus, and ameliorates cognitive impairment in APP/PS1 transgenic mice. Biol Pharm Bull. 2015;38(9):1290–1301. doi: 10.1248/bpb.b15-00142. [KONG L, HU Y, YAO Y, et al. The coumarin derivative osthole stimulates adult neural stem cells, promotes neurogenesis in the hippocampus, and ameliorates cognitive impairment in APP/PS1 transgenic mice[J]. Biol Pharm Bull, 2015, 38(9):1290-1301.] [DOI] [PubMed] [Google Scholar]
- 9.MIRANDA K C, HUYNH T, TAY Y, et al. A pattern-based method for the identification of MicroRNA binding sites and their corresponding heteroduplexes. Cell. 2006;126(6):1203–1217. doi: 10.1016/j.cell.2006.07.031. [MIRANDA K C, HUYNH T, TAY Y, et al. A pattern-based method for the identification of MicroRNA binding sites and their corresponding heteroduplexes[J]. Cell, 2006, 126(6):1203-1217.] [DOI] [PubMed] [Google Scholar]
- 10.教 亚男, 姚 璎珈, 孔 亮, et al. 蛇床子素对转染APP595/596基因的SH-SY5Y细胞的保护作用. 中国病理生理杂志. 2015;31(11):2053–2058. doi: 10.3969/j.issn.1000-4718.2015.11.021. [教亚男, 姚璎珈, 孔亮, 等.蛇床子素对转染APP595/596基因的SH-SY5Y细胞的保护作用[J].中国病理生理杂志, 2015, 31(11):2053-2058.] [DOI] [Google Scholar]
- 11.YANG J, YAN Y, XIA Y, et al. Neurotrophin 3 transduction augments remyelinating and immunomodulatory capacity of neural stem cells. Mol Ther. 2014;22(2):440–450. doi: 10.1038/mt.2013.241. [YANG J, YAN Y, XIA Y, et al. Neurotrophin 3 transduction augments remyelinating and immunomodulatory capacity of neural stem cells[J]. Mol Ther, 2014, 22(2):440-450.] [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 12.LING Y, MORGAN K, KALSHEKER N. Amyloid precursor protein (APP) and the biology of proteolytic processing:relevance to Alzheimer's disease. Int J Biochem Cell Biol. 2003;35(11):1505–1535. doi: 10.1016/S1357-2725(03)00133-X. [LING Y, MORGAN K, KALSHEKER N. Amyloid precursor protein (APP) and the biology of proteolytic processing:relevance to Alzheimer's disease[J]. Int J Biochem Cell Biol, 2003, 35(11):1505-1535.] [DOI] [PubMed] [Google Scholar]
- 13.JI H J, HU J F, WANG Y H, et al. Osthole improves chronic cerebral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus. Eur J Pharmacol. 2010;636(1-3):96–101. doi: 10.1016/j.ejphar.2010.03.038. [JI H J, HU J F, WANG Y H, et al. Osthole improves chronic cerebral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus[J]. Eur J Pharmacol, 2010, 636(1-3):96-101.] [DOI] [PubMed] [Google Scholar]
- 14.LI K, DING D, ZHANG M. Neuroprotection of osthole against cerebral ischemia/reperfusion injury through an anti-apoptotic pathway in rats. Biol Pharm Bull. 2016;39(3):336–342. doi: 10.1248/bpb.b15-00699. [LI K, DING D, ZHANG M. Neuroprotection of osthole against cerebral ischemia/reperfusion injury through an anti-apoptotic pathway in rats[J]. Biol Pharm Bull, 2016, 39(3):336-342.] [DOI] [PubMed] [Google Scholar]
- 15.HUA K F, YANG S M, KAO T Y, et al. Osthole mitigates progressive IgA nephropathy by inhibiting reactive oxygen species generation and NF-κB/NLRP3 pathway[J/OL]. PLoS One, 2013, 8(10): e77794. http://www.ncbi.nlm.nih.gov/pubmed/24204969. . [DOI] [PMC free article] [PubMed]
- 16.JIAO Y, KONG L, YAO Y, et al. Osthole decreases beta amyloid levels through up-regulation of miR-107 in Alzheimer's disease. Neuropharmacology. 2016;108:332–344. doi: 10.1016/j.neuropharm.2016.04.046. [JIAO Y, KONG L, YAO Y, et al. Osthole decreases beta amyloid levels through up-regulation of miR-107 in Alzheimer's disease[J]. Neuropharmacology, 2016, 108:332-344.] [DOI] [PubMed] [Google Scholar]
- 17.LI S H, GAO P, WANGL T, et al. Osthole stimulated neural stem cells differentiation into neurons in an Alzheimer's disease cell model via upregulation of MicroRNA-9 and rescued the functional impairment of hippocampal neurons in APP/PS1 transgenic mice. Front Neurosci. 2017;11:340. doi: 10.3389/fnins.2017.00340. [LI S H, GAO P, WANGL T, et al. Osthole stimulated neural stem cells differentiation into neurons in an Alzheimer's disease cell model via upregulation of MicroRNA-9 and rescued the functional impairment of hippocampal neurons in APP/PS1 transgenic mice[J]. Front Neurosci, 2017, 11:340.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.LI S, YAN Y, JIAO Y, et al. Neuroprotective effect of osthole on neuron synapses in an Alzheimer's disease cell model via upregulation of microRNA-9. J Mol Neurosci. 2016;60(1):71–81. doi: 10.1007/s12031-016-0793-9. [LI S, YAN Y, JIAO Y, et al. Neuroprotective effect of osthole on neuron synapses in an Alzheimer's disease cell model via upregulation of microRNA-9[J]. J Mol Neurosci, 2016, 60(1):71-81.] [DOI] [PubMed] [Google Scholar]
- 19.LONG J M, LAHIRI D K. MicroRNA-101 downregulates Alzheimer's amyloid-β precursor protein levels in human cell cultures and is differentially expressed. Biochem Biophys Res Commun. 2011;404(4):889–895. doi: 10.1016/j.bbrc.2010.12.053. [LONG J M, LAHIRI D K. MicroRNA-101 downregulates Alzheimer's amyloid-β precursor protein levels in human cell cultures and is differentially expressed[J]. Biochem Biophys Res Commun, 2011, 404(4):889-895.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.BARBATO C, PEZZOLA S, CAGGIANO C, et al. A lentiviral sponge for miR-101 regulates RanBP9 expression and amyloid precursor protein metabolism in hippocampal neurons. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000003585499. Front Cell Neurosci. 2014;8:37. doi: 10.3389/fncel.2014.00037. [BARBATO C, PEZZOLA S, CAGGIANO C, et al. A lentiviral sponge for miR-101 regulates RanBP9 expression and amyloid precursor protein metabolism in hippocampal neurons[J]. Front Cell Neurosci, 2014, 8:37.] [DOI] [PMC free article] [PubMed] [Google Scholar]


