Resumen
Introducción:
el conocimiento de la funcionalidad del injerto y la supervivencia del paciente es fundamental para valorar el éxito del trasplante renal.
Objetivo:
determinar la supervivencia de los pacientes trasplantados por tipo de donante y la funcionalidad de los injertos renales en una cohorte en México.
Material y métodos:
cohorte de trasplante renal de 2013 a 2017 en México. Se analizaron 790 pacientes seguidos por un año para valorar la supervivencia de los pacientes trasplantados por tipo de donante y la funcionalidad de los injertos renales. Para ello se usaron medidas de tendencia central y dispersión, así como tablas de supervivencia de Kaplan-Meier con SPSS, versión 25.
Resultados:
de los 790 pacientes, 518 fueron de donante vivo (65.56%) con supervivencia del paciente de 97.88% y de funcionalidad del injerto de 93.24% a 12 meses de seguimiento; 272 pacientes recibieron el injerto de donante fallecido con supervivencia del paciente de 91.18% y funcionalidad del injerto renal de 84.19%.
Conclusiones:
aún existe una diferencia de casi 5% en la supervivencia del paciente receptor de un donante vivo en referencia con un donante fallecido. Para la funcionalidad del injerto renal esta diferencia es > 7%. La donación cadavérica ha aumentado; sin embargo, incluso en cifras bajas es de aproximadamente el 35% en México.
Palabras clave: Trasplante de Riñón, Supervivencia de Injerto, Supervivencia del Paciente, Supervivencia al Año, Donante Fallecido, Donante Vivo
Abstract
Background:
Knowledge of the functionality of the graft and patient survival is essential to assess the success of kidney transplantation.
Objective:
To determine the survival of transplanted patients by type of donor and the functionality of kidney grafts in a cohort in Mexico.
Material and methods:
Kidney transplant cohort from 2013 to 2017 in Mexico. 790 patients followed up for one year were analyzed to assess the survival of transplanted patients by type of donor and the functionality of kidney grafts. For this, measures of central tendency and dispersion were used, as well as Kaplan-Meier survival tables with SPSS, version 25.
Results:
Out of the 790 patients, 518 were from living donors (65.56%) with patient survival of 97.88% and graft function of 93.24% at 12 months of follow-up; 272 patients received the graft from a deceased donor with patient survival of 91.18% and renal graft function of 84.19%.
Conclusions:
There is still a difference of almost 5% in the survival of the recipient patient from a living donor compared to a deceased donor. For the functionality of the kidney graft, this difference is > 7%. Cadaveric donation has increased; however, even at low figures is of approximately 35% in Mexico.
Keywords: Kidney Transplantation, Graft Survival, Patient Survival, One-year Survival, Deceased Donor, Living Donor
Introducción
En el trasplante renal (TR) aún existen diferencias importantes entre el tipo de donante vivo y el donante fallecido, y se intenta cada vez más disminuirlas. 1 La disponibilidad de donantes y las barreras sociales son una de las principales desventajas observadas. 2,3 Estas diferencias inician cuando se dispone o no de un potencial donante vivo que habitualmente incrementa la posibilidad de mayor compatibilidad y con ello una mejor funcionalidad del trasplante renal; además, se procura garantizar la salud del donante. 4 Cuando el paciente requiere de un donante cadavérico, la permanencia en lista de espera puede prolongarse por factores económicos, académicos, culturales, religiosos, inmunológicos o legales, o la tasa de donación puede ser baja, como ocurre en México. 5,6,7
Ha existido un aumento en la supervivencia del paciente trasplantado renal desde los primeros trasplantes renales hasta la actualidad. Entre los estudios más claros al respecto está el de Cecka et al., 8 quienes mencionan que en 1975 la supervivencia del paciente al año era de 77% frente a 45% de la funcionalidad del injerto renal. Este mismo estudio muestra que con el advenimiento de medicamentos como la ciclosporina en 1984 mejoró a 91% y 74% para la supervivencia del paciente e injerto, respectivamente; por último, en 1996, con la introducción del micofenolato de mofetilo a la inmunosupresión, se elevó la supervivencia a 94% y a 86% la funcionalidad.
Es conocido que existe una diferencia entre la supervivencia del paciente y la funcionalidad del injerto renal de acuerdo con el tipo de donante, ya sea vivo o fallecido; estas diferencias van desde comorbilidades renales y extrarrenales, 9,10,11 en relación con la compatibilidad, 12, 13 tiempos quirúrgicos, principalmente isquemia fría mayor en el donante fallecido, 14,15,16 tamaño renal, 17,18 tiempos entre la planeación del trasplante con el inicio del protocolo de estudio para tal efecto y la culminación en el procedimiento quirúrgico de la realización del trasplante, 19,20 y, por último, las marcadas diferencias en el estilo de vida, el menor número de complicaciones inmediatas y mediatas, además de todas las variables psicosociales involucradas, como las diferencias por el tipo de donante, las cuales son menores en aquel paciente que recibe un injerto renal de un donante vivo. 21,22, 23 En México es necesario conocer las diferencias, debido a que la proporción de pacientes por tipo de donante es diferente en el mundo. Para el 2019 la relación se establecía en una mayor proporción a favor del donante vivo, si se hace una comparación con países como España, líder en trasplante renal, cuya relación donante fallecido con vivo es mayor hacia el donante fallecido, además de que nuestro país cuenta con una alta incidencia y prevalencia de obesidad, diabetes mellitus e hipertensión arterial, comparado con otros países, lo cual hace necesario evaluar las diferencias. El objetivo de este estudio fue conocer la supervivencia de los pacientes trasplantados por tipo de donante.
Material y métodos
Se estudió una cohorte retrospectiva de pacientes que recibieron trasplante renal en la Unidad de Trasplante Renal (UTR) del Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Instituto Mexicano del Seguro Social (IMSS), en la Ciudad de México.
Se consideraron elegibles los pacientes que recibieron un trasplante renal entre el 1 de enero de 2013 y el 31 de diciembre de 2017. Se incluyeron pacientes mayores de 18 años, de ambos sexos, a los que se les realizaría su primer trasplante renal, con cualquier modalidad de terapia de remplazo renal previa y sin importar la etiología de la enfermedad renal crónica. También se incluyeron los pacientes que tuvieron datos clínicos (edad, sexo, tipo de donante, tipo de inducción, riesgo para citomegalovirus, uso de eritropoyetina previo al trasplante renal, peso y talla) y bioquímicos (valores de creatinina y hemoglobina previo al trasplante, al mes y al año de seguimiento), necesarios para el análisis en la etapa basal y durante el seguimiento por 12 meses. Se excluyeron los pacientes con información incompleta o que perdieron la cobertura de la seguridad social.
Los datos clínicos y bioquímicos se obtuvieron de bases de información de la Jefatura del Servicio de Trasplante Renal. Se recabó información de variables relacionadas con el trasplante, concretamente supervivencia del paciente y la funcionalidad del injerto renal. Para esto, se define supervivencia del paciente como todo aquel paciente trasplantado y que durante los próximos 12 meses de seguimiento continúa con vida; funcionalidad del injerto renal se define, por otro lado, como aquel paciente cuyo injerto renal se encuentra funcional durante el seguimiento de 12 meses, y se excluye de este grupo a los pacientes que fallecieron o pasaron a alguna terapia de sustitución de diálisis peritoneal o hemodiálisis, debido a la perdida de la función del injerto renal.
Los datos se presentan como promedios ± desviación estándar para las variables continuas, o como frecuencias o medianas y rangos intercuartílicos (RI) para las variables nominales o de libre distribución. Se hizo el cálculo de tamaño de muestra con el programa G*Power 3.1.9.7, con un alfa de 0.05 y beta de 0.80, por proporciones 3:1 (vivo: fallecido) con cálculo de 552 pacientes totales. Para los análisis de supervivencia su utilizaron curvas de Kaplan-Meier. La significación estadística se estableció con una p < 0.05. Para el análisis, se empleó el paquete estadístico SPSS, versión 25.
Resultados
Se recabó la información de expedientes clínicos de 790 pacientes trasplantados del 1 de enero de 2013 al 31 de diciembre de 2017, a los cuales se les hizo seguimiento por un año a cada uno, a partir de la fecha de su trasplante renal. No se excluyó ningún paciente, ya que se cuenta con un registro en la Jefatura del Servicio y no se obtuvieron pérdidas, puesto que por lo menos el primer año los pacientes fueron atendidos en la UTR del Hospital de Especialidades; de estos pacientes, 518 recibieron su injerto renal de donante vivo (65.56%) y 272 de donante fallecido (34.44%) (cuadro I).
Cuadro I. Características basales de 790 pacientes trasplantados por tipo de donante.

*La significación estadística se obtuvo con t de Student
†La significación estadística se obtuvo con chi cuadrada
px: paciente; RIC: rango intercuartílico; EPO: eritropoyetina; CMV: citomegalovirus; TRR: terapia de remplazo renal
Fueron pacientes en su mayoría jóvenes con 31 años (mediana), con un rango intercuartilar (RIC) de 24 a 42 años; hubo diferencia de 10 años entre las medianas del grupo de donante vivo y de donante fallecido (28 y 38 años, respectivamente). También hubo diferencias significativas en el peso, con 62 kilogramos (RIC: 53-71) para el grupo de donante vivo y 65 kg (55-74 kg) para el de donante fallecido, sin diferencia entre los grupos para la talla.
En relación con el género, 477 receptores renales fueron hombres (59.9%) y 477 personas antes del trasplante estaban en uso de eritropoyetina en distintas dosis (60.4%). Estas dos variables no tuvieron diferencias entre sus medias.
El riesgo de citomegalovirus establecido por anticuerpos IgM e IgG fue de 664 pacientes en riesgo intermedio (84%), alto en 95 receptores (12.1%) y riesgo bajo en 31 pacientes (3.9%) con su respectivo manejo profiláctico de acuerdo con las guías; existió una diferencia con chi cuadrada de 0.043.
Se analizaron seis factores que potencialmente pudieran incidir en la mortalidad de los pacientes trasplantados, y fue el donante fallecido el principal factor de riesgo relacionado con mortalidad, con una razón de momios (RM) de 3.273, intervalo de confianza al 95% (IC 95%) de 1.361-7875, p de 0.008, seguido de una hemoglobina (Hb) < 11 g/dL en el primer mes después del TR (RM 2.367, IC 95% 1.449-3.866, p 0.001). Una creatinina (Cr) > 1.2 mg/dL en el primer mes también representó un riesgo de mortalidad por regresión lineal simple con una RM de 2.213 (IC 95% 1.330-3.685, p 0.002) y, por último, el uso de agentes policlonales con una RM de 1.914 (IC 95% 1.188-3.083, p 0.008). Dos factores no presentaron significación estadística: el receptor masculino y la Hb < 11 g/dL antes del trasplante renal (cuadro II).
Cuadro II. Factores de riesgo relacionados con mortalidad en trasplante renal.
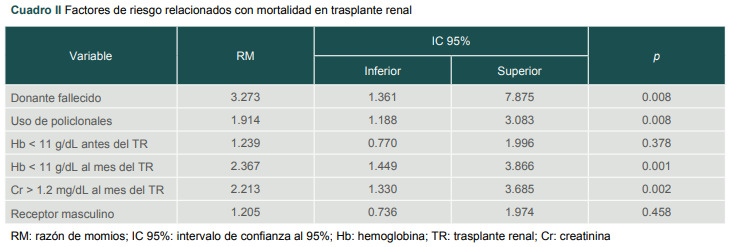
RM: razón de momios; IC 95%: intervalo de confianza al 95%; Hb: hemoglobina; TR: trasplante renal;
Cr: creatinina
La supervivencia del paciente global fue de 95.3% (753 de los 790 pacientes), con una diferencia importante entre los receptores de donante vivo con 97.88% de supervivencia al año frente a 93.24% a 12 meses de seguimiento de esta cohorte (chi cuadrada de 0.001). En la tabla de Kaplan-Meier hubo un Log Rank (Mantel-Cox) de 0.001 (figura 1).
Figura 1. Supervivencia del paciente a 12 meses de seguimiento posterior a su trasplante renal. Se establece diferencia según el tipo de donante (vivo o fallecido).

La funcionalidad del injerto renal global fue de 90.3% (713 de 790), con una diferencia de 93.24% y 84.19%, respectivamente, para el que recibió el trasplante de donante vivo y el de fallecido al año de seguimiento; el Log Rank (Mantel-Cox) fue de 0.001 (figura 2).
Figura 2. Funcionalidad del injerto renal a 12 meses. Se establece diferencia de acuerdo con el tipo de donante (vivo o fallecido).

Discusión
Este es uno de los pocos estudios en México que ha intentado mostrar en una cohorte retrospectiva la supervivencia del paciente trasplantado y la funcionalidad del injerto renal en el contexto del tipo de donante. Su limitante son los datos perdidos en la búsqueda dentro de los expedientes, lo cual nos ha orillado a hacerlo solo de forma descriptiva en relación con la variable supervivencia del paciente y la funcionalidad del injerto. Los resultados son alentadores respecto al resto del mundo: 97.88% del paciente de donante vivo y 93.24% del injerto al año; 24,25 en el caso del receptor de donante fallecido, con 91.18% de supervivencia del paciente y 84.19% del injerto renal.
La comparativa histórica mundial 8 es especial, ya que en 1975 la supervivencia era de 77% para el paciente y 45% para el injerto renal al año, lo cual mejoró hasta cifras de 93% y 87% para 1996, con el advenimiento de inmunosupresores como la ciclosporina, el micofenolato, etcétera. Ya para los tiempos actuales no solo la inmunosupresión ha mejorado, sino las técnicas quirúrgicas, la selección de pacientes y los protocolos de estudio; sin embargo, esto mismo ha permitido aventurarse a retos mayores, como los trasplantes altamente sensibilizados, los trasplantes con incompatibilidad de grupo, simultáneos, etcétera, los cuales modifican las estadísticas hacia una menor supervivencia temporalmente; al mejorar la experiencia y las técnicas estas estadísticas esperemos sean en favor de una mayor supervivencia tanto de los pacientes receptores como de los injertos funcionales.
El estudio de Simforoosh et al. 26 no ha demostrado una diferencia estadísticamente significativa entre la supervivencia de los receptores de donante vivo contra el fallecido: su sobrevida fue de 96 y 93% de donante fallecido para el paciente y el injerto, respectivamente; la supervivencia de donante vivo fue de 97% para el paciente y 92% para el injerto, sin significación estadística en el caso de la prueba Log-Rank con p de 0.081 y 0.078; esto contrasta con nuestro estudio sustancialmente, ya que nosotros tanto en la supervivencia del paciente como en la supervivencia del injerto encontramos en las curvas de Kaplan-Meier con Log-Rank una p de 0.001 para ambas categorías analizadas; es importante mencionar algunas diferencias entre ambos estudios. La principal es el tamaño de muestra, dado que en aquel estudio analizaron una población de 276 personas con grupos exactamente iguales (138 de donante fallecido y 138 de donante vivo), a diferencia de nosotros con 790 personas elegibles (518 y 272 para los grupos de donante vivo y fallecido, respectivamente), por lo que nuestra población fue mayor, aunque una proporción de casi 2:1 en vivo y fallecido. Ellos 26 además en un periodo más amplio, ocho años, contra solo cinco años de nuestra población de estudio. También la edad entre sus grupos fue similar, contrario a nuestra cohorte en la que había una diferencia de medianas de 10 años (28 años de mediana para receptores de donante vivo, contra 38 de mediana de donante fallecido, p = 0.001), factores que pudieron haber influido para que existiera esta diferencia de resultados sumamente llamativos en la supervivencia. Los tiempos de espera de los pacientes en lista de donante fallecido son mayores en México, factor que modifica las condiciones de estos potenciales receptores renales, que además tienen mayores comorbilidades, sobre todo de tipo cardiovascular, antes del proceso quirúrgico del trasplante renal.
Hay otro estudio que contrasta los resultados de Simforoosh y que apoya las diferencias encontradas por nosotros en relación con la supervivencia por tipo de donante. Se trata del estudio de Xiong et al., 27 con una supervivencia del injerto renal de 98.8% y 94.9% para donante vivo y fallecido, respectivamente. Estos resultados son similares en cuanto a un pronóstico mejor para el que recibe un riñón de donante vivo; sin embargo, a diferencia de lo que reportan nuestros resultados son mejores sus supervivencias con un 5.6% para los receptores de vivo y de 10.7% para los receptores de donante fallecido al año, lo cual, debido a la falta de datos por nuestra cohorte, nos genera la necesidad de búsqueda de causas y factores relacionados con dicha diferencia a fin de mejorar nuestra supervivencia local.
Conclusiones
De los 790 pacientes, 518 pacientes de donante vivo (65.56%) tuvieron una supervivencia del paciente de 97.88 % y una funcionalidad del injerto de 93.24 % a 12 meses de seguimiento; 272 pacientes recibieron el injerto de donante fallecido con supervivencia del paciente de 91.18% y del injerto renal de 84.19%. Existe una diferencia de casi 5% en la supervivencia del paciente receptor de un donante vivo frente a un donante fallecido, condición ante la que en una cohorte prospectiva deberán estudiarse todos los factores relacionados. Para la funcionalidad del injerto renal, la diferencia es mayor (de 7%); del mismo modo, se deberán buscar primeramente los factores relacionados con nuestra población y posteriormente mejorar las conductas en la práctica clínica, a fin de aumentar la supervivencia tanto del paciente como del injerto renal.
Limitantes del estudio
Al ser un estudio retrospectivo, no recabamos muchos de los parámetros socioeconómicos, condiciones de compatibilidad, como los haplotipos compartidos, además de que no contamos con datos precisos de función retardada del injerto, rechazo, disfunción aguda del injerto y sus causas. Sugerimos una cohorte prospectiva que permita un control óptimo de las variables y, con ello, datos más precisos de factores de influyen en dicha supervivencia.
Agradecimientos
A todo el personal de trasplante renal de la Unidad de Trasplante Renal del Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Instituto Mexicano del Seguro Social por sus ideas, aportaciones y por poder ser el vehículo de todos estos trasplantes realizados.
Notas
los autores han completado y enviado la forma traducida al español de la declaración de conflictos potenciales de interés del Comité Internacional de Editores de Revistas Médicas, y no fue reportado alguno relacionado con este artículo.
Referencias
- 1.Treviño-Becerra A. Insuficiencia renal crónica: enfermedad emergente, catastrófica y por ello prioritaria. Cir Ciruj. 2004;72:3–4. [PubMed] [Google Scholar]
- 2.García H, Calvanese N. Calidad de vida percibida y locus de control en pacientes con tratamiento sustitutivo de la función renal: diálisis y trasplante renal. Anales de la Universidad Metropolitana. 2007;7(1):205–222. [Google Scholar]
- 3.Hernández-Rivera JCH, Mojica OD, Mendoza MS, Barbosa LS, Alejandri LS, Silva-Rueda RI, et al. Factors That Influence the Attitude of the Population to Be a Donor in Mexico. Transplant Proc. 2020;52(4):1036–1041. doi: 10.1016/j.transproceed.2020.01.064. [DOI] [PubMed] [Google Scholar]
- 4.Reza H, Ghafari A, Hajizadeh E, Kazemnejad A. Factors of Long-Term Graft Loss in Renal Transplant Recipients with Chronic Allograft Dysfunction. Experimental and Clinical Transplantation. 2010;4:277–282. [PubMed] [Google Scholar]
- 5.Dib-Kuri A, Aburto-Morales S, Espinosa-Álvarez A, Sánchez-Ramírez O. Trasplante de órganos y tejidos en México. Rev Invest Clin. 2005;57(2):163–169. [PubMed] [Google Scholar]
- 6.Hernández-Rivera JCH, Salazar-Mendoza M, Pérez-López MJ, González-Ramos J, Espinoza-Pérez R, Martínez-Álvarez JC, et al. Alelos HLA más comunes y asociados con riesgo o protección en enfermedad renal crónica de etiología no determinada. Gac Med Mex. 2019;155(3):243–428. doi: 10.24875/GMM.19005033. [DOI] [PubMed] [Google Scholar]
- 7.Hernández Rivera, Ibarra Villanueva, Espinoza Pérez, Cancino López, Silva Rueda, Rodríguez Gómez, et al. Specific Antigens by Federal Entity in Patients at the Transplant Unit of Specialties Hospital, National Medical Center Twenty-First Century, Mexico. Transplant Proc. 2016;48(2):575–577. doi: 10.1016/j.transproceed.2016.02.027. [DOI] [PubMed] [Google Scholar]
- 8.Cecka M. Clinical outcome of renal transplantation. Factors influencing patient and graft survival. Surg Clin North Am. 1998;78(1):133–148. doi: 10.1016/s0039-6109(05)70639-3. [DOI] [PubMed] [Google Scholar]
- 9.Kandaswamy R, Kasiske B, Ibrahim H, Matas AJ. Living or deceased donor kidney transplants for candidates with significant extrarenal morbidity. Clin Transplant. 2006;20(3):346–350. doi: 10.1111/j.1399-0012.2006.00492.x. [DOI] [PubMed] [Google Scholar]
- 10.Najarian JS, Gillingham KJ, Sutherland DE, Reinsmoen NL, Payne WD, Matas AJ. The impact of the quality of initial graft function on cadaver kidney transplants. Transplantation. 1994;57(6):812–816. doi: 10.1097/00007890-199403270-00007. [DOI] [PubMed] [Google Scholar]
- 11.Rojas-Arzola L, Espinoza-Pérez R, Cruz-López M, Hernández-Rivera J, Paniagua-Sierra R. Kidney graft survival at a year, clinical evolution and associated factors in transplant patients with pre-existing diabetes. Trends in Transplant. 2020 doi: 10.15761/TiT.1000287. [DOI] [Google Scholar]
- 12.Hernández-Rivera JCH, González-Ramos J, Pérez-López MJ, Álvarez-Martínez LE, Salazar-Mendoza M, Paniagua-Sierra J. Disfunción y rechazo en trasplante renal asociado a haplotipos. Gac Med Bilbao. 2018;115(2):77–82. [Google Scholar]
- 13.Laging M, Kal-van Gestel, Haasnoot GW, Claas FHJ, van de Wetering J, Ijzermans JNM, et al. Transplantation results of completely HLA-mismatched living and completely HLA-matched deceased-donor kidneys are comparable. Transplantation. 2014;97(3):330–336. doi: 10.1097/01.TP.0000435703.61642.43. [DOI] [PubMed] [Google Scholar]
- 14.Xiong Y, Jiang J, Zhang H, Fu Q, Deng R, Li J, et al. Higher Renal Allograft Function in Deceased-Donor Kidney Transplantation Rather Than in Living-Related Kidney Transplantation. Transplant Proc. 2018;50(8):2412–2415. doi: 10.1016/j.transproceed.2018.03.041. [DOI] [PubMed] [Google Scholar]
- 15.Helantera I, Raiha J, Finne P, Lempinen M. Early failure of kidney transplants in the current era-a national cohort study. Transpl Int. 2018;31(8):880–886. doi: 10.1111/tri.13115. [DOI] [PubMed] [Google Scholar]
- 16.Fragoso Salinas SJ, Espinoza Pérez R, Cruz López M, Moreno Madrigal LG, Hernández Rivera JCH. Impact of Cold Ischemia Time in Clinical Outcomes in Deceased Donor Renal Transplant. Transplant Proc. 2020;52(4):1118–1122. doi: 10.1016/j.transproceed.2020.02.010. [DOI] [PubMed] [Google Scholar]
- 17.García-Covarrubias L, Pliego C, Bermudez L, Cicero A, Cancino J, Bautista R, et al. Correlation of Allograft Weight to Recipient Body Weight Index on Renal Function in Kidney Transplantation. Transplant Proc. 2016;48(2):578–585. doi: 10.1016/j.transproceed.2016.02.015. [DOI] [PubMed] [Google Scholar]
- 18.Garcia-Covarrubias L, Valdéz DR, Bermudez LA, Córdoba R, Avelar FJ, Villanueva RM, et al. Correlation of the Renal Cortex Volume With the Glomerular Filtration Rate in Live Donors for Renal Transplantation. Transplant Proc. 2018;50(2):428–432. doi: 10.1016/j.transproceed.2017.12.045. [DOI] [PubMed] [Google Scholar]
- 19.Wainright JL, Kucheryavaya AY, Klassen DK, Stewart DE. The Impact of the New Kidney Allocation System on Prior Living Kidney Donors' Access to Deceased Donor Kidney Transplants: An Early Look. Am J Transplant. 2017;17(4):1103–1111. doi: 10.1111/ajt.14102. [DOI] [PubMed] [Google Scholar]
- 20.Hernández Rivera JCH, Cruz Santiago J, Mera Jiménez E, Muñoz Menjivar C, Bobadilla Lugo RA, Aceves Flores EA, et al. Compliance With Biochemical Objectives in Patients on Renal Replacement Therapy Before Kidney Transplantation in Mexico. Transplant Proc. 2020;;52(4):1090–1093. doi: 10.1016/j.transproceed.2020.01.050. [DOI] [PubMed] [Google Scholar]
- 21.Basiri A, Taheri M, Khoshdel A, Golshan S, Mohseni-Rad H, Borumandnia N, et al. Living or deceased-donor kidney transplant: the role of psycho-socioeconomic factors and outcomes associated with each type of transplant. Int J Equity Health. 2020;19(1):79. doi: 10.1186/s12939-020-01200-9.. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.de Groot IB, Veen JI, van der Boog PJ, van Dijk S, Stiggelbout AM, Marang-van de Mheen PJ. PARTNER-study group. Difference in quality of life, fatigue and societal participation between living and deceased donor kidney transplant recipients. Clin Transplant. 2013;27(4):E415–E423. doi: 10.1111/ctr.12165. [DOI] [PubMed] [Google Scholar]
- 23.Gozdowska J, Zatorski M, Torchalla P, Białek Ł, Bojanowska A, Tomaszek A, et al. Living-Donor Versus Deceased-Donor Kidney Transplantation: Comparison of Psychosocial Consequences for Recipients. Transplant Proc. 2016;48(5):1498–1505. doi: 10.1016/j.transproceed.2016.01.075. [DOI] [PubMed] [Google Scholar]
- 24.United States Renal Data System. United States Renal Data System. Annual Data Report // End Stage Renal Disease // 5: Mortality. 2020. Disponible en: https://adr.usrds.org/2020/end-stage-renal-disease/5-mortality.
- 25.Álvarez-Rangel LE, Martínez-Guillén P, Granados-Ventura L, Cuamba-Nambo I, Pérez-López MJ, Chávez-López EL, et al. Supervivencia del paciente y del injerto a largo plazo en receptores de trasplante renal. Rev Med Inst Mex Seguro Soc. 2019;57(6):348–356. [PubMed] [Google Scholar]
- 26.Simforoosh N, Gooran S, Tabibi A, Bassiri A, Ghraati MR. Cadaver transplantation in Recent Era: Is Cadaveric Graft Survival Similar to Living Kidney Transplantation? Int J Organ Transplant Med. 2011;2(4):167–170. [PMC free article] [PubMed] [Google Scholar]
- 27.Xiong Y, Jiang J, Zhang H, Fu Q, Deng R, Li J, et al. Higher renal allograft function in deceased-donor kidney transplantation rather than in living-related kidney transplantation. Transplant Proc. 2018;50(8):2412–2415. doi: 10.1016/j.transproceed.2018.03.041. [DOI] [PubMed] [Google Scholar]


