Abstract
目的
探索极低频电磁场对人骨肉瘤细胞增殖凋亡的影响及其分子机制。
方法
采用50 Hz、1 mT的极低频电磁场作用于人骨肉瘤细胞MG-63, 通过MTT法检测MG-63细胞的存活率, 通过流式细胞术检测MG-63细胞的凋亡率及活性氧水平, 并检测MG-63细胞给予活性氧抑制剂N-乙酰半胱氨酸(NAC)及p38MAPK抑制剂SB203580作用后细胞凋亡率的变化; 通过蛋白质印迹法检测极低频电磁场处理及NAC干预后MG-63细胞p38MAPK蛋白水平。
结果
极低频电磁场能够显著抑制MG-63细胞的存活率, 诱导MG-63细胞凋亡及活性氧生成; 给予2.5 mmol/L NAC或SB203580干预后MG-63细胞凋亡率显著下降; 极低频电磁场处理MG-63细胞后胞内p38MAPK表达增多, 而NAC干预后磷酸化p38MAPK减少。
结论
极低频电磁场可诱导人骨肉瘤细胞MG-63凋亡, 其机制可能与活性氧生成增加、p38MAPK激活有关。
Abstract
Objective
To investigate the effects of extremely low frequency electromagnetic field (ELF-EMF) on human osteosarcoma cells and its mechanisms.
Methods
Human osteosarcoma MG-63 cells were exposed to 50 Hz, 1 mT ELF-EMF for 1, 2 and 3 h in vitro, with or without pretreatment by reactive oxygen species (ROS) inhibitor N acetylcysteine (NAC) or p38MAPK inhibitor SB203580. The proliferation of MG-63 cells was determined by MTT method; the apoptosis rate and ROS level in MG-63 cells were detected by flow cytometry. The expression of p38MAPK in MG-63 cells was determined by Western blotting.
Results
ELF-EMF decreased the viability of MG-63 cells, inhibited cell growth, induced cell apoptosis and increased the level of ROS significantly. The apoptosis rate declined significantly after treatment with ROS inhibitor NAC or p38MAPK inhibitor SB203580. After exposure to ELF-EMF, p38MAPK in MG-63 cells was activated, and the phosphorylation level was also inhibited after treatment with NAC.
Conclusion
ELF-EMF can induce the apoptosis of MG-63 cells. Increased ROS and p38MAPK activation may be involved in the mechanism.
Keywords: Electromagnetic fields; Apoptosis/radiation effects; Radiation injuries; Osteosarcoma/pathology; Cell line, tumor/radiation effects; p38 Mitogen-activated protein kinases; Reactive oxygen species
极低频电磁场(extremely low frequency electromagnetic field)是指磁场频率为0~300 Hz的电磁场。近年来,多项研究显示,极低频电磁场对不同来源的肿瘤治疗效果迥异。极低频电磁场对肝癌、前列腺癌、黑色素瘤细胞等具有生长抑制及杀伤作用,对乳腺癌细胞却可促进其耐药性的产生,其对骨肉瘤细胞的生长影响研究甚少 [ 1, 2, 3] 。骨肉瘤是一种具有高度侵袭性的恶性肿瘤,近年来联合化疗及支持治疗的水平有很大改进。但由于耐药率仍较高,骨肉瘤患者的预后改善不多,亟须探讨新的治疗措施。极低频电磁场是否能抑制骨肉瘤细胞的生长?有研究发现极低频电磁场可通过改变活性氧等自由基水平导致DNA损伤 [ 4, 5] 。故本研究拟观察极低频电磁场对人骨肉瘤细胞MG-63存活率、凋亡的影响和细胞内活性氧的变化,并通过给予活性氧抑制剂N-乙酰半胱氨酸(NAC)及p38丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)抑制剂SB203580干预MG-63细胞,进一步探索其相关分子生物学机制。
人骨肉瘤细胞株MG-63购自美国模式培养物保藏所(ATCC);RPMI 1640培养液购自美国Life Technologies公司;胎牛血清购自杭州四季青生物工程有限公司;0.25%胰酶溶液(含EDTA)、磷酸缓冲盐溶液(PBS)、青霉素和链霉素购自杭州吉诺生物医药技术有限公司;二甲基亚砜(DMSO)、四甲基偶氮硅盐(MTT)、DCFH-DA荧光试剂、NAC购自美国Sigma-Aldrich公司;AnnexinV-FITC凋亡试剂盒购自美国Thermo公司;GAPDH抗体购自美国Santa Cruz公司;p38MAPK、磷酸化p38MAPK抗体购自美国Abcam公司。
Becton流式细胞仪(美国BD公司)、紫外分光光度计(英国Biochrom公司)、电泳及凝胶成像系统(美国Bio-Rad公司)。自制极低频电磁场发生器( 图 1)由辐照系统、频率扼流线圈和调控系统功率调制器两部分组成,额定电压220 V,均匀闭合磁场,磁场频率为50 Hz,磁场强度为1 mT,双向脉冲波(Vp-p=80,脉宽15 ms)。上述指标均由浙江省生物电磁学重点实验室检测。发生器置于37 ℃、5%二氧化碳培养箱内。

人骨肉瘤细胞株MG-63分为正常对照组和极低频电磁场干预组,正常对照组MG-63细胞维持在含有10%胎牛血清的DMEM完全培养液中,置于37 ℃、5%二氧化碳培养箱中培养。极低频电磁场干预组将MG-63细胞接种于培养板中,并置于极低频电磁场发生器中,细胞分别作用1、2、3 h后取出。极低频电磁场干预组中活性氧抑制剂NAC及p38MAPK抑制剂SB203580均在置于极低频电磁场发生器1 h前加入。
将处于对数生长期的MG-63细胞用胰酶消化后制成细胞悬液,接种于96孔板中,共4板,每板接种48孔,每孔细胞数调整为1×10 4个,接种1 d后取出3板作为极低频电磁场干预组置于低频电磁场发生器中,发生器置于37 ℃、5%二氧化碳培养箱中,以使培养环境与对照组保持一致,分别作用1、2和3 h。对照组96孔板则置于普通二氧化碳培养箱中。MTT检测时取出96孔板,每孔加入5 mg/mL的MTT 20 μL,轻轻摇晃后将培养板置于细胞培养箱中。4 h后弃去上清液,每孔加入150 μL DMSO终止反应,并于平衡振荡器中振荡10 min,最后将培养板置于680型酶标仪检测490 nm处吸光度值。细胞存活率(%)=(实验组吸光度均值/对照组吸光度均值)×100%。
将MG-63细胞接种于5 cm培养皿中,每个培养皿中细胞数约为1×10 6。极低频电磁场分别作用1、2和3 h后,细胞经胰酶消化后,离心收集细胞。PBS洗涤2遍后制成100 μL细胞数约为1×10 5的细胞悬液,加入100 μL结合缓冲液,并加入10 μL Annexin V-FITC和10 μL碘化丙啶(PI),轻轻混匀,避光室温反应10 min后用流式细胞仪检测。
装载探针:将DCFH-DA用无血清培养液1:1000稀释至终浓度10 μmol/L,再将MG-63细胞悬浮于稀释好的DCFH-DA,并接种于5 cm培养皿中,使细胞密度达到1.0×10 6~2.0×10 7/mL;置于37 ℃、5%二氧化碳培养箱内孵育20 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触;用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。对照组和极低频电磁场干预组细胞经胰酶消化后离心收集细胞,并用流式细胞仪检测活性氧含量。
正常对照组和极低频电磁场干预组细胞经胰酶消化后,离心收集细胞,通过RIPA裂解缓冲液裂解得到总蛋白,并通过二喹啉甲酸(BCA)法进行蛋白定量。定量后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)将蛋白进行分离,并通过湿转法将凝胶中蛋白转至PVDF膜上。用5%脱脂奶粉封闭PVDF膜1 h后,加入已稀释浓度的相应待测蛋白特异性抗体,并于4 ℃结合过夜。使用洗膜缓冲液(TBST)洗涤后加入标记的相应二抗,孵育1 h后再次TBST洗涤,后经化学发光试剂处理后至凝胶成像系统曝光成像。使用Adobe Photoshop CC 14.0及Adobe illustrator CS6软件处理成像条带并进行定量分析。
采用统计软件SPSS 16.0进行数据统计。所有实验重复至少3次,结果以均数±标准差( x ± s)表示。两样本比较采用 t检验,多样本组间比较采用单因素方差分析。 P < 0.05为差异具有统计学意义。
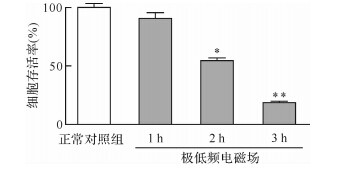
MTT结果显示,在极低频电磁场作用2、3 h后,MG-63细胞的存活率均降低(均 P < 0.05);作用3 h后,细胞存活率已降至(20.0±0.3)%,见 图 2
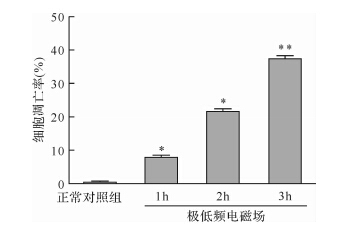
流式细胞术检测结果显示,极低频电磁场处理1、2、3 h后,MG-63细胞的凋亡率均高于正常对照组(均 P < 0.01);极低频电磁场处理2、3 h时MG-63细胞凋亡率为(21.7±0.5)%、(37.4±1.3)%。见 图 3。
与正常对照组比较,极低频电磁场处理不同时间后MG-63细胞活性氧增多(均 P < 0.05),见 图 4A;在极低频电磁场处理前加入了活性氧抑制剂NAC后,MG-63细胞活性氧水平与细胞凋亡率均下降(均 P < 0.05),见 图 4B、C。提示极低频电磁场对人骨肉瘤细胞的促凋亡作用可能依赖于活性氧的合成。

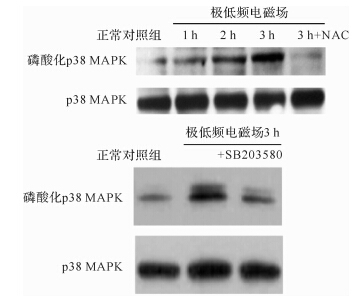
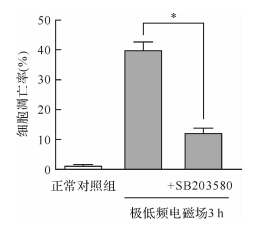
极低频电磁场处理后MG-63细胞p38MAPK蛋白表达无明显变化,但磷酸化p38MAPK蛋白增多,见 图 5。在极低频电磁场处理前加入活性氧抑制剂NAC,磷酸化p38MAPK蛋白减少,表明p38MAPK的表达与活性氧增多有关。另外在极低频电磁场处理前加入了p38MAPK蛋白抑制剂SB203580,结果MG-63细胞凋亡率减少( P < 0.05),见 图 6。提示p38MAPK蛋白表达可能参与了活性氧促进MG-63细胞凋亡的机制。
极低频电磁场由于其抗肿瘤效应而广泛被人们所关注,其抗肿瘤的机制亦有深入研究 [ 2, 3, 6] 。本研究在参考了大量关于极低频电磁场对其他肿瘤的研究文献 [ 7] 后,采用电磁场频率为50 Hz、强度为1 mT的极低频电磁场。研究结果表明,极低频电磁场对人骨肉瘤细胞具有显著的生长抑制和促凋亡作用,极低频电磁场作用3 h后可使细胞凋亡率高达37.3%。
活性氧是细胞内氧化代谢中最为重要的自由基,极低频电磁场通过增加活性氧的产生及改变活性氧的代谢,从而增加活性氧在细胞内的浓度,并产生各种生物学效应 [ 4, 8, 9, 10, 11, 12] 。近期研究发现,活性氧在极低频电磁场引起的细胞凋亡过程中亦发挥作用 [ 13] 。Koh等 [ 2] 学者研究发现,磁场频率为60 Hz的极低频电磁场可使前列腺癌细胞发生凋亡并伴随着活性氧水平的显著增加,而使用天冬酰胺半胱氨酸蛋白酶3(Caspase-3) 抑制剂或抗氧化剂后细胞凋亡显著减少,从而表明前列腺癌的细胞凋亡作用主要通过极低频电磁场介导产生的活性氧发挥作用。本研究结果亦表明,极低频电磁场对人骨肉瘤细胞的促凋亡作用亦伴随着活性氧水平的明显增加,极低频电磁场作用3 h后活性氧水平高达50%,在使用活性氧抑制剂NAC后,活性氧水平与细胞凋亡率下降,提示活性氧在极低频电磁场诱导人骨肉瘤细胞凋亡中亦可能有重要作用。
MAPK家族在细胞增殖、分化、凋亡过程中发挥重要作用 [ 14] 。多项研究显示,p38MAPK在活性氧介导的细胞凋亡中有重要作用,抑制p38MAPK的激活可拮抗多种抗肿瘤药物诱导细胞凋亡的作用 [ 15, 16, 17, 18] 。本研究结果亦表明,极低频电磁场作用后在引起活性氧增加的同时,磷酸化p38MAPK显著增加,而在NAC抑制活性氧产生后其磷酸化水平明显下降,另外在加入p38MAPK抑制剂SB203580后细胞凋亡率随之减少,提示极低频电磁场产生的活性氧可能通过激活p38MAPK发挥促细胞凋亡作用。
综上所述,本研究首次对极低频电磁场与人骨肉瘤细胞间的作用及其作用机制进行探讨,研究发现磁场频率为50 Hz、强度为1 mT的极低频电磁场对人骨肉瘤细胞具有显著生长抑制作用和促进细胞凋亡作用。极低频电磁场作用下活性氧可能在发挥促凋亡效应中起重要作用,而p38MAPK的激活可能为其发挥促凋亡效应的机制之一。
References
- 1.HARLAND J D, LIBURDY R P. Environmental magnetic fields inhibit the antiproliferative action of tamoxifen and melatonin in a human breast cancer cell line. Bioelectromagnetics. 1997;18(8):555–562. doi: 10.1002/(ISSN)1521-186X. [DOI] [PubMed] [Google Scholar]
- 2.KOH E K, RYU B K, JEONG D Y, et al. A 60-Hz sinusoidal magnetic field induces apoptosis of prostate cancer cells through reactive oxygen species. Int J Radiat Biol. 2008;84(11):945–955. doi: 10.1080/09553000802460206. [DOI] [PubMed] [Google Scholar]
- 3.NIE Y, DU L, MOU Y, et al. Effect of low frequency magnetic fields on melanoma: tumor inhibition and immune modulation. BMC Cancer. 2013;13:582. doi: 10.1186/1471-2407-13-582. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SIMKO M. Induction of cell activation processes by low frequency electromagnetic fields. Scientific World Journal. 2004;4(2):4–22. doi: 10.1100/tsw.2004.174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.SIMKO M. Cell type specific redox status is responsible for diverse electromagnetic field effects. Curr Med Chem. 2007;14(10):1141–1152. doi: 10.2174/092986707780362835. [DOI] [PubMed] [Google Scholar]
- 6.SARIMOV R, MARKOVA E, JOHANSSON F, et al. Exposure to ELF magnetic field tuned to Zn inhibits growth of cancer cells. Bioelectromagnetics. 2005;26(8):631–638. doi: 10.1002/(ISSN)1521-186X. [DOI] [PubMed] [Google Scholar]
- 7.王 益民, 王 怡, 张 伯礼, et al. 国内研究磁场对细胞作用效果进展. http://www.cnki.com.cn/Article/CJFDTOTAL-TZYY200103043.htm 天津中医学院学报. 2001;20(3):51–53. [Google Scholar]
- 8.SIMKOM, MATTSSON M O. Extremely low frequency electromagnetic fields as effectors of cellular responses in vitro: possible immune cell activation . J Cell Biochem. 2004;93(1):83–92. doi: 10.1002/jcb.v93:1. [DOI] [PubMed] [Google Scholar]
- 9.ROY S, NODA Y, ECKERT V, et al. The phorbol 12-myristate 13-acetate (PMA)-induced oxidative burst in rat peritoneal neutrophils is increased by a 0.1 mT (60 Hz) magnetic field. FEBS Lett. 1995;376(3):164–166. doi: 10.1016/0014-5793(95)01266-X. [DOI] [PubMed] [Google Scholar]
- 10.BULDAK R J, POLANIAK R, BULDAK L, et al. Short-term exposure to 50 Hz ELF-EMF alters the cisplatin-induced oxidative response in AT478 murine squamous cell carcinoma cells. Bioelectromag-netics. 2012;33(8):641–651. doi: 10.1002/bem.v33.8. [DOI] [PubMed] [Google Scholar]
- 11.GARIP A I, AKAN Z. Effect of ELF-EMF on number of apoptotic cells; correlation with reactive oxygen species and HSP. Acta Biol Hung. 2010;61(2):158–167. doi: 10.1556/ABiol.61.2010.2.4. [DOI] [PubMed] [Google Scholar]
- 12.AYSE I G, ZAFER A, SULE O, et al. Differentiation of K562 cells under ELF-EMF applied at different time courses. Electromagn Biol Med. 2010;29(3):122–130. doi: 10.3109/15368378.2010.502451. [DOI] [PubMed] [Google Scholar]
- 13.JAJTE J M. Programmed cell death as a biological function of electromagnetic fields at a frequency of (50/60 Hz)--review. Med Pr. 2000;51(4):383–389. [PubMed] [Google Scholar]
- 14.WIDMANN C, GIBSON S, JARPE M B, et al. Mitogen-activated protein kinase: conservation of a three-kinase module from yeast to human. Physiol Rev. 1999;79(1):143–180. doi: 10.1152/physrev.1999.79.1.143. [DOI] [PubMed] [Google Scholar]
- 15.XIONG X X, LIU J M, QIU X Y, et al. Piperlongumine induces apoptotic and autophagic death of the primary myeloid leukemia cells from patients via activation of ROS-p38/JNK pathways. Acta Pharmacol Sin. 2015;36(3):362–374. doi: 10.1038/aps.2014.141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.DONG Y, YIN S, SONG X, et al. Involvement of ROS-p38-H2AX axis in novel curcumin analogues-induced apoptosis in breast cancer cells. Mol Carcinog. 2015 doi: 10.1002/mc.22280. [DOI] [PubMed] [Google Scholar]
- 17.KHAN N I, CISTERNE A, BARAZ R, et al. Para-NO-aspirin inhibits NF-kappaB and induces apoptosis in B-cell progenitor acute lymphoblastic leukemia. Exp Hematol. 2012;40(3):207–215. doi: 10.1016/j.exphem.2011.11.001. [DOI] [PubMed] [Google Scholar]
- 18.CHENG H B, BO Y, SHEN W X, et al. Longikaurin E induces apoptosis of pancreatic cancer cells via modulation of the p38 and PI3K/AKT pathways by ROS. Naunyn Schmiedebergs Arch Pharmacol. 2015;388(6):623–634. doi: 10.1007/s00210-015-1107-4. [DOI] [PubMed] [Google Scholar]


