Abstract
目的
探讨骨性关节炎(OA)关节软骨基质金属蛋白酶-2(MMP-2)、单核细胞趋化蛋白-1(MCP-1)、CD47、L-选择素及高级氧化蛋白产物(AOPP)表达的变化以及姜黄素(Cur)的干预作用。
方法
建立C57BL/6小鼠OA模型,20只小鼠随机分为手术对照组、模型对照组、Cur25组和Cur50组(术后分别每日接受25 μmol/L和50 μmol/L浓度姜黄素腹腔注射)。4周后取材,采用免疫组织化学法观察各组大体标本形态学变化,电子显微镜下观察软骨组织超微结构;培养各组软骨细胞,运用蛋白质印迹法检测各组MMP-2、MCP-1和CD47表达,ELISA和分光光度法检测L-选择素水平及AOPP浓度变化。
结果
软骨组织标本形态学变化模型对照组最明显,Cur25组次之;与手术对照组比较,模型对照组、Cur25组、Cur50组软骨细胞MMP-2、MCP-1表达均增多(均 P < 0.05),CD47表达均下降(均 P < 0.05),L-选择素水平及AOPP浓度均增加(均 P < 0.05);与模型对照组比较,Cur25组和Cur50组软骨细胞MMP-2、MCP-1、L-选择素及AOPP的表达下降(均 P < 0.05),CD47的表达上升(均 P < 0.05),且与Cur25组比较,Cur50组的上述变化更为显著(均 P < 0.05)。
结论
MMP-2、MCP-1、CD47、L-选择素及AOPP的异常表达与OA软骨退变的病理过程相关。姜黄素可缓解关节软骨的退变,减轻软骨炎症,提高软骨细胞的代谢活性,且此作用与姜黄素的浓度有关。
Abstract
Objective
To observe the influence of matrix metalloproteinases-2 (MMP-2), monocyte chemoattractant protein-1 (MCP-1), CD47, L-selectin and advanced oxidation proteinproducts (AOPP) in osteoarthritis and the intervention of curcumin.
Methods
A total of 20 male C57BL/6 mice (10.05-15.00 g) were randomly divided into control group, OA group, Cur25 group and Cur50 group (intraperitoneal injected 25 μmol/L or 50 μmol/L of curcumin everyday after modeling). After 4 weeks treatment, we observed the morphological changes of the gross specimen by immunohistochemical method, and observed the ultrastructure of cartilage tissue under electron microscope. The expression of MMP-2, MCP-1 and CD47 were detected by western blotting, and L-selectin and AOPP were detected by ELISA and spectrophotometer, respectively.
Results
In the cartilage tissue morphology, the chondrocytes of OA group showed obvious change, while Cur25 and Cur50 groups maintained the good cartilage cell membrane intact. Compared with control group, the expressions of MMP-2, MCP-1, L-selectin and AOPP in OA group, Cur25 group and Cur50 group were increased (all P < 0.05), while CD47 levels were decreased (all P < 0.05). Compared with OA group, the expressions of MMP-2, MCP-1, L-selectin and AOPP in Cur25 group and Cur50 group were decreased (all P < 0.05), while CD47 levels were increased (all P < 0.05), and such changes were more significant in Cur50 group (all P < 0.05).
Conclusion
The MMP-2, MCP-1, CD47, L-selectin and AOPP are closely associated with the pathology course of OA. Curcumin has protection effect on cartilage, which can relieve joint cartilage degeneration, reduce cartilage inflammation and increase the metabolic activity of chondrocytes.
Keywords: Osteoarthritis/pathology; Curcumin/pharmacology; Curcumin/administration & dosage; Matrix metalloproteinase 2; Chemokine CCL2; Antigens, CD47; L-selectin; Protein hydrolysates; Disease models, animal
骨性关节炎(osteoarthritis, OA)是一种以关节软骨退行性变和关节周围骨质增生为病理性特征的慢性进行性骨关节病, 临床表现以关节疼痛、僵硬、肿胀、畸形等功能障碍为主 [ 1] , 易导致老年人疼痛和伤残, 进而严重影响日常工作和生活。持续的软骨细胞凋亡、滑膜炎和骨破坏等致使OA患者病情进行性加重 [ 2] , OA发病时血清及关节液的多种炎症介质[IL、单核细胞趋化蛋白(monocyte chemoattractant protein, MCP)和TNF等]明显增加, 炎性因子的浸润在关节软骨的降解中贯穿始终。因而, 深入探索多种炎症介质在OA病理过程中的影响及采用合理药物对OA中早期进行干预尤为重要。
基质金属蛋白酶族群(matrix metalloproteinases, MMP)具有降解变性Ⅰ、Ⅱ、Ⅲ型胶原、切割天然Ⅳ、Ⅴ、Ⅶ、Ⅺ型胶原等一系列功能。MMP-2以酶原形式分泌到细胞外, 可降解细胞外基质中胶原和层黏连蛋白、纤维结合素、蛋白多糖等, MMP-2表达水平升高有可能是早期软骨分解的信号。MCP-1在机体内可通过调节单核细胞/巨噬细胞、树突状细胞、NK细胞和记忆T淋巴细胞的迁移和聚集, 引起嗜碱性粒细胞和肥大细胞脱颗粒作用。此外, MCP-1还具有刺激单核/巨噬细胞释放IL-1和IL-6, 通过自分泌和旁分泌反馈回路促进趋化因子和促炎性细胞因子的产生。CD47是细胞表面的重要靶点, 其不仅可以通过影响多形性白细胞的活化抑制炎症反应, 还可以在骨形成过程中诱导破骨细胞的生成。L-选择素属黏附分子选择素家族, 具有介导淋巴细胞归巢、介导白细胞与内皮细胞的初始作用和在炎症区域的移行、介导已与内皮粘附的中性粒细胞的滚动以及具有负反馈免疫调节功能。随着OA的进展, 患者体内软骨基质内聚积大量的晚期糖基化终末产物, 这类物质与晚期氧化蛋白产物(advanced oxidation protein products, AOPP)不仅结构相似, 而且拥有共同的受体, 最终可通过诱导氧化应激, 激活软骨细胞内核蛋白转录因子, 增加炎性因子表达, 抑制软骨基质的合成。姜黄素(curcumin, Cur)是从姜科、天南星科植物的根茎中提取的有效的天然物质 [ 3] 。既往研究发现姜黄素分子中含有多个双键、羟基和羰基等活性基团, 具有抗肿瘤、抗炎、抗氧化、清除自由基、抗微生物等作用, 且其不良反应发生率较低, 是当前临床研究领域极具开发前景的天然药物 [ 4] 。
基于前期研究结果, 本研究拟通过一系列研究模型和实验方法, 探讨MMP-2、MCP-1、CD47、L-选择素及AOPP表达与OA病理过程中软骨退变之间的相关性和不同浓度姜黄素对此病变过程的影响, 为临床治疗OA提供新的思路和依据。
C57BL/6小鼠, 雄性20只, 体质量为10.05~15.00 g, 平均(12.8±5.5) g, 由第四军医大学动物实验中心提供; 姜黄素、苏木精、番红O、多聚甲醛、DMEM低糖培养液、胰蛋白酶和DMSO购自美国Sigma-Aldrich公司; 蛋白酶抑制剂和β-actin抗体购自美国Santa Cruz公司; HRP羊抗小鼠、羊抗兔和兔抗羊IgG二抗购自北京中杉金桥生物技术有限公司; 小牛血清购自杭州四季青生物工程材料有限公司; RIPA裂解液和蛋白上样缓冲液购自上海碧云天生物技术有限公司。
将20只小鼠随机分为手术对照组、模型对照组、Cur25组和Cur50组(根据先期预实验确定较适宜的姜黄素作用浓度)。模型对照组小鼠采用腹腔麻醉后, 乙醇消毒, 于解剖显微镜下进行无菌手术操作。眼科剪沿膝关节内侧纵向剪开皮肤、黏膜(避免剪断附着于黏膜上的血管), 使内侧副韧带暴露; 换用维纳斯剪在视野中央的内侧副韧带做一小切口, 在内侧副韧带切口处划断半月板上下缘的关节囊, 用神经剥离子钩出内侧半月板并剪断, 切口留下剪断的内侧副韧带及半月板; 消毒后依次进行缝合。模型对照组暴露内侧副韧带后即消毒缝合。Cur25组和Cur50组在模型对照组处理的基础上, 术后分别每日接受25 μmol/L和50 μmol/L浓度的姜黄素腹腔注射。4周后用脱颈法处死所有小鼠。
组织学观察:将四组软骨组织标本按照常规病理石蜡切片法处理, 进行软骨标本组织脱钙。经脱水、透明、石蜡包埋, 用组织切片机进行5 μm厚度的连续切片, 按常规方法对切片进行HE和甲苯胺蓝染色, 光学显微镜下观察软骨组织标本的组织形态。组织化学检查:标本常规10%甲醛固定、石蜡包埋、组织切片后, 用0.1%的番红O染色液染色6 s, 根据软骨细胞细胞质染色深浅变化以了解酸性黏多糖的含量, 从而明确软骨组织标本中软骨细胞的代谢活性。
将标本用0.2 mol/L 3%戊二醛固定2 h, 经PBS缓冲液清洗、锇酸固定、脱水、乙酸异戊酯置换、临界点干燥程序处理后, 在标本样品表面镀金, 观察各组处理的半月板的形态和结构。
将分离的膝关节软骨组织置于培养瓶中, 于1 mg/mL胶原酶Ⅰ的HEPES缓冲液(硫酸镁溶液0.8 mmol/L、氯化镁溶液116.0 mmol/L、氯化钾溶液5.4 mmol/L、磷酸氢钠溶液10.0 mmol/L、葡萄糖5.1 mmol/L、HEPES 20.0 mmol/L, 酸碱度值7.3)中消化, 重复消化三次, 每次3~5 min。用含10%血清的DMEM溶液终止消化, 置于低速离心机中离心, 相对离心力为200× g, 5 min。弃去上清液, 用含10%血清和0.01 mmol/L的DMEM溶液重悬细胞。用200目的筛网过滤没有贴壁的细胞, 去除未消化的组织块。收集过滤的细胞悬液, 接种至培养瓶进行原代培养。然后, 分别取部分原代培养细胞进行传代处理, 收集第2、3、4、5代的细胞, 分别以2×10 3个细胞每孔接种于96孔板测生长曲线, 根据细胞生长情况最终选取第3代软骨细胞进行下一步处理。传代细胞使用前进行软骨细胞鉴定, 具体操作为将传代细胞消化成细胞悬液, 接种于放置有细胞生长玻片的24孔板中, 待细胞生长48 h后用PBS冲洗并用4%多聚甲醛固定, 然后用1%甲苯胺蓝染色30 min, 无水乙醇漂洗后室温干燥, 取下玻片置于载玻片并封片, 在光学显微镜下观察细胞形态, 确认其为软骨细胞, 计数以确认软骨细胞纯度符合实验要求。
SDS-PAGE进行电泳分离, 半干法将蛋白转移至硝酸纤维素膜, 封闭, 洗膜, 加入1:600稀释的兔抗大鼠MMP-2、MCP-1、CD47一抗, 4 ℃下过夜, 用洗膜液漂洗后加入1:1000稀释的二抗, 摇床1 h, TBST缓冲液冲洗三遍, 每次5 min, 加ECL荧光液显色, 上机检测。用目标条带与内标条带(β-actin)的积分吸光度值(Integrated absorbance, IA)的比值百分率表示MMP-2、MCP-1和CD47的表达水平。
按照ELISA试剂盒说明书要求测定L-选择素水平, 采用分光光度法检测AOPP浓度。
采用SPSS 16.0统计软件进行统计分析, 所有实验数据均以均数±标准差( x ± s)表示, 各组数据比较前先进行方差齐性检验, 各组总的组间差异比较采用单因素方差分析(One-Way ANOVA), 以Newman-Keuls检验进行组间的两两比较。 P < 0.05为差异有统计学意义。
手术对照组关节无肿胀、充血, 软骨组织标本呈白色, 半透明状, 光滑而有光泽; Cur25组和Cur50组关节轻微肿胀, 无充血, 软骨组织标本呈白色, 关节面光滑度下降; 模型对照组关节肿胀、充血明显, 关节面粗糙, 表面变薄、有轻度破损现象, 部分软骨组织标本表面出现小裂隙。提示姜黄素具有维持软骨正常形态的作用, 浓度为50 μmol/L时的作用效果更好。
甲苯胺蓝染色观察软骨细胞和HE染色观察细胞质和细胞外基质结果显示, 与手术对照组比较, 模型对照组软骨组织损伤严重, 部分软骨细胞肿胀, 软骨表面失去连续性, 软骨细胞基质紊乱、破坏严重; Cur25组和Cur50组软骨细胞形态完整、细胞质染色均一, Cur50组在维持软骨表面形态及细胞质方面较好, 见 图 1。提示姜黄素可减少软骨细胞凋亡和有利于保护细胞质的完整, 浓度为50 μmol/L时的作用效果更好。
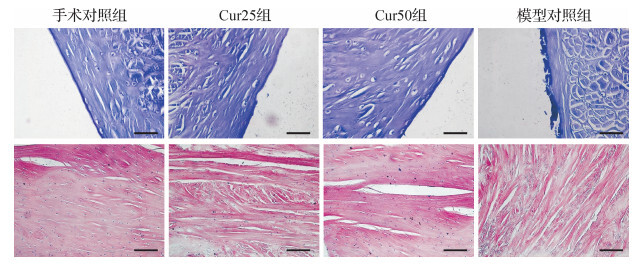
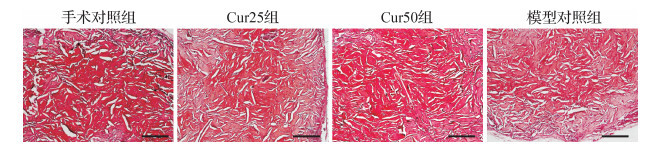
四组软骨细胞和基质被番红O均染成红色, 见 图 2。因番红O染色与多聚阴离子(硫酸软骨素和硫酸角质素)的浓度成正比, 结果提示, 在软骨组织蛋白聚糖的含量和分布方面, 手术对照组、Cur50组、Cur25组、模型对照组中软骨蛋白聚糖量呈逐渐降低趋势, 其中手术对照组最优, Cur50组次之, 模型对照组软骨组织蛋白聚糖分布不均匀且含量较另三组少。提示姜黄素可降低软骨基质的破坏程度, 浓度为50 μmol/L时的作用效果更好。
电镜下观察各组软骨组织超微结构, 200倍及1000倍电镜下均显示模型对照组标本组织表面损伤与手术对照组差异大, 200倍电镜下显示模型对照组标本表面失去平整性, 且部分区域暴露出胶原纤维束, 经不同浓度姜黄素作用后, 软骨组织标本表面形态维持较完整; 1000倍电镜下发现, Cur50组比Cur25组的胶原纤维暴露更少, 组织表面完整性及粗细均匀得到更好地维护, 见 图 3。提示姜黄素对软骨组织及胶原纤维有保护作用, 浓度为50 μmol/L时的保护效果更好。

各组软骨细胞中MMP-2、MCP-1及CD47蛋白表达见 图 4。与手术对照组比较, 模型对照组和Cur25组MMP-2、MCP-1蛋白表达水平均升高(均 P < 0.05), CD47蛋白表达水平均下降(均 P < 0.05);与模型对照组比较, Cur50组和Cur25组MMP-2、MCP-1蛋白表达水平均下降(均 P < 0.05), CD47蛋白表达水平均升高(均 P < 0.05), 上述改变Cur50组更明显, 见 表 1。提示模型对照组炎症指标表达增加, 姜黄素组可抑制炎症指标的表达, 且50 μmol/L时的抑制效果更为明显。
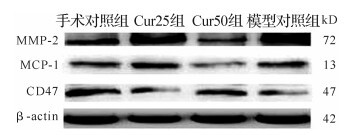
表1 各组MMP-2、MCP-1及CD47蛋白表达水平积分吸光度值比值的百分率变化
Table 1 The percentage change in absorbance integral value ratio of MMP-2, MCP-1 and CD47 protein in each group
|
( x ± s, %) | ||||
|
组别 |
n |
MMP-2 |
MCP-1 |
CD47 |
|
手术对照组 |
5 |
0.48±0.05 |
0.22±0.03 |
0.61±0.06 |
|
Cur25组 |
5 |
0.71±0.07 * |
0.41±0.05 * |
0.39±0.04 * |
|
Cur50组 |
5 |
0.50±0.05 # |
0.24±0.03 # |
0.63±0.06 # |
|
模型对照组 |
5 |
0.82±0.08 *#△ |
0.50±0.06 *#△ |
0.28±0.03 *#△ |
MMP-2:基质金属蛋白酶-2;MCP-1:单核细胞趋化蛋白-1.与手术对照组比较, * P < 0.05;与Cur25组比较, # P < 0.05;与Cur50组比较, △ P < 0.05.
与手术对照组比较, 模型对照组、Cur25组和Cur50组L-选择素水平和AOPP含量表达均升高(均 P < 0.05);与模型对照组比较, Cur25和Cur50组L-选择素水平和AOPP含量表达均下降(均 P < 0.05), 且当姜黄素浓度为50 μmol/L时作用更明显, 见 表 2。提示姜黄素干预后软骨细胞氧化应激损伤减轻。
表2 各组L-选择素水平及AOPP含量表达比较
Table 2 Expression of L-selectin and AOPP in each group
|
( x ± s) | |||
|
组别 |
n |
L-选择素(ng/mL) |
AOPP (mmol/L) |
|
手术对照组 |
5 |
1.14±0.10 |
1.02±0.07 |
|
Cur25组 |
5 |
1.51±0.12 * |
1.48±0.12 * |
|
Cur50组 |
5 |
1.26±0.12 # |
1.24±0.12 # |
|
模型对照组 |
5 |
1.75±0.15 *#△ |
1.69±0.15 *#△ |
AOPP:晚期氧化蛋白产物.与手术对照组比较, * P < 0.05;与Cur25组比较, # P < 0.05;与Cur50组比较, △ P < 0.05.
OA是由机械和生物因素共同作用所导致关节软骨细胞、细胞外基质、软骨下骨合成和降解动态失衡所致的病理改变 [ 5] , 在最常见的三大老年性疾病中位居首位 [ 6] 。OA为渐进性疾病, 与年龄、不恰当活动、个人体质等宏观因素和多种分子信号通路都有着密切的关系 [ 7] 。有报道表明, 在OA的进展过程中, 血清及关节液的炎症介质和单核细胞水平明显增加 [ 8] 。
姜黄素对于OA软骨的保护作用已有研究证实 [ 9] , 但姜黄素对软骨细胞代谢影响的作用机制研究目前报道不多, 动物实验报道更少。Henrotin等 [ 10] 通过检测Cox-2、MMP-9和Bcl-2、integrin-β的mRNA表达, 发现姜黄素对软骨细胞的增殖有着明显的作用。Mobasheri等 [ 11] 证实姜黄素对于软骨细胞的保护是在多个作用途径下进行的。
本实验中, 我们首先对不同浓度姜黄素作用后的软骨组织标本大体形态进行观察分析, 结果发现:与手术对照组比较, Cur25组和Cur50组关节组织出现不同程度肿胀, 关节面光滑度下降; 模型对照组关节标本充血明显, 关节面粗糙程度增加, 并出现表明破损现象。在组织病理学方面, 手术对照组、Cur25组和Cur50组软骨组织标本表面完整程度、光滑度及软骨细胞形态、细胞膜、细胞质等均优于模型对照组, 而模型对照组软骨组织标本损伤最严重, 部分软骨细胞膜破裂, 个别细胞呈多形性改变。番红O染色结果提示, 在软骨组织蛋白聚糖的含量和分布方面, 手术对照组和Cur50组分布均匀且含量较高, 模型对照组软骨组织蛋白聚糖分布不均匀且含量最低。其原因可能为:姜黄素直接或者间接作用于细胞外基质中的胶原、蛋白多糖以及其他的细胞外基质分子, 保护软骨细胞赖以生存的土壤, 维持软骨细胞的正常增殖, 有利于降低膝关节OA发生率, 当姜黄素浓度为50 μmol/L时, 其对OA发生的抑制作用最强。观察各组软骨标本组织超微结构发现, 经过姜黄素处理后, 标本在软骨表面光滑度、胶原纤维排列、暴露、完整度方面均优于模型对照组, 且姜黄素浓度50 μmol/L比25 μmol/L对标本组织保护作用更好。我们建立小鼠OA模型后, 通过软骨细胞分组检测炎症因子MMP-2、MCP-1、CD47及机体氧化应激的标志物L-选择素和AOPP证实:MMP-2能特异性降解变性胶原、基底膜Ⅳ型胶原及弹性蛋白, 破坏基底膜、促进炎症过程中有关细胞的迁移以及细胞外基质重建 [ 12] 。与手术对照组比较, Cur25组和模型对照组MMP-2蛋白表达水平均升高; 与模型对照组比较, Cur25组和Cur50组MMP-2的蛋白表达水平表达均下降, 且呈剂量依赖性。实验结果揭示模型对照组的MMP-2含量发生明显改变, 原因可能与其促发炎性反应导致层黏连蛋白、纤维结合素、蛋白多糖等破坏相关, 而姜黄素干预后可明显降低MMP-2的表达, 抑制其降解特性 [ 13] 。MCP-1在模型对照组中明显升高, 但在Cur25组和Cur50组均下降。其作用机制可能为:①姜黄素影响MCP-1的存活和抑制其募集作用; ②与受体KDR/FIk-1信号通路相关; ③姜黄素可通过影响MCP-1和神经胶质细胞的相互激发效应, 抑制MCP-1表达等; ④姜黄素具有抑制MCP-1激活单核细胞和巨噬细胞、释放溶菌酶、上调单核细胞和巨噬细胞黏附分子和细胞因子IL-1、IL-6的作用 [ 14- 15] 。本研究发现CD47在模型对照组中明显降低, 但在Cur25组和Cur50组中表达升高, 这与国外报道CD47缺陷小鼠易产生炎性反应、促进白细胞从血管内向炎症部位浸润的结论相符 [ 16] 。分析本研究CD47蛋白表达变化结果, 其机制可能为CD47有效介导炎症细胞因子如IL-12、TNF-α、干扰素-γ的释放, 而姜黄素显著增加CD47的表达, 进而减少炎症递质的合成和释放。与手术对照组比较, 模型对照组、Cur25组和Cur50组L-选择素水平和AOPP含量表达均升高; 与模型对照组比较, Cur25组和Cur50组L-选择素水平和AOPP含量表达下降, 表明软骨细胞氧化应激损伤与OA的发病密切相关。其原因可能为:L-选择素与其配体或者抗体的交联能增强TNF-α和IL-8的表达 [ 17] , 同时可引起具有调节炎性反应作用的集落刺激因子-1(CSF-1)基因的表达 [ 18] 。有证据表明, AOPP不仅是蛋白氧化应激的标志物, 同时起到炎症介质的作用 [ 19] 。而本实验中姜黄素对软骨细胞氧化应激损伤的抑制作用明显, 当姜黄素浓度为50 μmol/L时效果更为显著。其作用机制可能为:①可溶性L-选择素是L-选择素在白细胞表面脱落的部分, 与临床疾病紧密相关, 在机体中起负反馈免疫调节作用, 姜黄素抑制可溶性L-选择素的生成; ②姜黄素具有阻断L-选择素与其内皮配体的作用, 产生减少白细胞趋化粘附于活化的内皮细胞的效果; ③姜黄素具有防止抗炎介质水平下降、维持抗炎介质水平的效用; ④姜黄素可清除活性氧自由基和阻断脂质过氧化的链式反应; ⑤姜黄素能显著提高过氧化氢酶、超氧化物歧化酶、谷胱甘肽还原酶等抗氧化酶活性、抑制细胞环氧合酶-2 RNA表达。
综上所述, MMP-2、MCP-1、CD47、L-选择素及AOPP等细胞因子与OA病理改变过程密切相关, 而姜黄素由于其天然药物特性可明显抑制其破坏作用, 减轻软骨炎症, 通过降低炎症因子表达、增强细胞抗氧化作用进而提高软骨细胞的生物活性, 在临床工作中有广泛而更进一步的应用前景, 但其具体作用信号通路有待进一步研究。
志谢
感谢兰州军区总医院李慎松、高明喧、田琦副主任医师及陈慧主管护师在研究过程中给予的指导, 感谢甘肃省中医药大学王荣、石杰硕士在数据分析中的帮助
Funding Statement
国家自然科学基金(81371983);甘肃省科技支撑计划(S04671);甘肃省青年科技基金(1606RJYA300);甘肃省自然科学基金(1606RJZA208)
References
- 1.KRAUS V B, KILFOIL T M, HASH T W, et al. Atlas of radiographic features of osteoarthritis of the ankle and hindfoot. Osteoarthritis Cartilage. 2015;23(12):2059–2085. doi: 10.1016/j.joca.2015.08.008. [KRAUS V B, KILFOIL T M, HASH T W, et al.Atlas of radiographic features of osteoarthritis of the ankle and hindfoot[J].Osteoarthritis Cartilage, 2015, 23(12):2059-2085.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.NAKAGAWA Y, MUKAI S, YAMADA S, et al. Short-term effects of highly-bioavailable curcumin for treating knee osteoarthritis:a randomized, double-blind, placebo-controlled prospective study. J Orthop Sci. 2014;19(6):933–939. doi: 10.1007/s00776-014-0633-0. [NAKAGAWA Y, MUKAI S, YAMADA S, et al.Short-term effects of highly-bioavailable curcumin for treating knee osteoarthritis:a randomized, double-blind, placebo-controlled prospective study[J].J Orthop Sci, 2014, 19(6):933-939.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.TAMBURELLA A, MICALE V, NAVARRIA A, et al. Antidepressant properties of the 5-HT4 receptor partial agonist, SL65.0155:behavioral and neurochemical studies in rats. Prog Neuropsychopharmacol Biol Psychiatry. 2009;33(7):1205–1210. doi: 10.1016/j.pnpbp.2009.07.001. [TAMBURELLA A, MICALE V, NAVARRIA A, et al.Antidepressant properties of the 5-HT4 receptor partial agonist, SL65.0155:behavioral and neurochemical studies in rats[J].Prog Neuropsychopharmacol Biol Psychiatry, 2009, 33(7):1205-1210.] [DOI] [PubMed] [Google Scholar]
- 4.WHITE D K, TUDOR-LOCKE C, ZHANG Y, et al. Prospective change in daily walking over 2 years in older adults with or at risk of knee osteoarthritis:the MOST study. Osteoarthritis Cartilage. 2016;24(2):246–253. doi: 10.1016/j.joca.2015.08.004. [WHITE D K, TUDOR-LOCKE C, ZHANG Y, et al.Prospective change in daily walking over 2 years in older adults with or at risk of knee osteoarthritis:the MOST study[J].Osteoarthritis Cartilage, 2016, 24(2):246-253.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.HENROTIN Y, GHARBI M, DIERCKXSENS Y, et al. Decrease of a specific biomarker of collagen degradation in osteoarthritis, Coll2-1, by treatment with highly bioavailable curcumin during an exploratory clinical trial. BMC Complement Altern Med. 2014;14:159. doi: 10.1186/1472-6882-14-159. [HENROTIN Y, GHARBI M, DIERCKXSENS Y, et al.Decrease of a specific biomarker of collagen degradation in osteoarthritis, Coll2-1, by treatment with highly bioavailable curcumin during an exploratory clinical trial[J].BMC Complement Altern Med, 2014, 14:159.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.EMMANUEL K, QUINN E, NIU J, et al. Quantitative measures of meniscus extrusion predict incident radiographic knee osteoarthritis-data from the osteoarthritis initiative. Osteoarthritis Cartilage. 2016;24(2):262–269. doi: 10.1016/j.joca.2015.08.003. [EMMANUEL K, QUINN E, NIU J, et al.Quantitative measures of meniscus extrusion predict incident radiographic knee osteoarthritis-data from the osteoarthritis initiative[J].Osteoarthritis Cartilage, 2016, 24(2):262-269.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LI Y, ZHANG Y, CHEN C, et al. Establishment of a rabbit model to study the influence of advanced glycation end products accumulation on osteoarthritis and the protective effect of pioglitazone. Osteoarthritis Cartilage. 2016;24(2):307–314. doi: 10.1016/j.joca.2015.08.001. [LI Y, ZHANG Y, CHEN C, et al.Establishment of a rabbit model to study the influence of advanced glycation end products accumulation on osteoarthritis and the protective effect of pioglitazone[J].Osteoarthritis Cartilage, 2016, 24(2):307-314.] [DOI] [PubMed] [Google Scholar]
- 8.YANG Q, WU S, MAO X, et al. Inhibition effect of curcumin on TNF-α and MMP-13 expression induced by advanced glycation end products in chondrocytes. Pharmacology. 2013;91(1-2):77–85. doi: 10.1159/000345345. [YANG Q, WU S, MAO X, et al.Inhibition effect of curcumin on TNF-α and MMP-13 expression induced by advanced glycation end products in chondrocytes[J].Pharmacology, 2013, 91(1-2):77-85.] [DOI] [PubMed] [Google Scholar]
- 9.CLUTTERBUCK A L, ALLAWAY D, HARRIS P, et al. Curcumin reduces prostaglandin E2, matrix metalloproteinase-3 and proteoglycan release in the secretome of interleukin 1β-treated articular cartilage. https://www.researchgate.net/publication/260272653_Curcumin_reduces_prostaglandin_E2_matrix_metalloproteinase-3_and_proteoglycan_release_in_the_secretome_of_interleukin_1b-treated_articular_cartilage. F1000Res. 2013;2:147. doi: 10.12688/f1000research.2-147.v1. [CLUTTERBUCK A L, ALLAWAY D, HARRIS P, et al.Curcumin reduces prostaglandin E2, matrix metalloproteinase-3 and proteoglycan release in the secretome of interleukin 1β-treated articular cartilage[J].F1000Res, 2013, 2:147.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.HENROTIN Y, PRIEM F, MOBASHERI A. Curcumin:a new paradigm and therapeutic opportunity for the treatment of osteoarthritis:curcumin for osteoarthritis management. Springerplus. 2013;2(1):56. doi: 10.1186/2193-1801-2-56. [HENROTIN Y, PRIEM F, MOBASHERI A.Curcumin:a new paradigm and therapeutic opportunity for the treatment of osteoarthritis:curcumin for osteoarthritis management[J].Springerplus, 2013, 2(1):56.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.MOBASHERI A, HENROTIN Y, BIESALSKI H K, et al. Scientific evidence and rationale for the development of curcumin and resveratrol as nutraceutricals for joint health. https://www.researchgate.net/publication/224979941_Scientific_Evidence_and_Rationale_for_the_Development_of_Curcumin_and_Resveratrol_as_Nutraceutricals_for_Joint_Health?_sg=KBiN9oF3AFrJytgJUM9JAHuQSPyRfKmNttZnc0tJMeiAWeI0Ufr5lUO7bJmaSRPrqfqckrbEUSNSMYPlsdMRVw. Int J Mol Sci. 2012;13(4):4202–4032. doi: 10.3390/ijms13044202. [MOBASHERI A, HENROTIN Y, BIESALSKI H K, et al.Scientific evidence and rationale for the development of curcumin and resveratrol as nutraceutricals for joint health[J].Int J Mol Sci, 2012, 13(4):4202-4032.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.CHEN F, DENG J, LIU X, et al. HCRP-1 regulates cell migration and invasion via EGFR-ERK mediated up-regulation of MMP-2 with prognostic significance in human renal cell carcinoma. Sci Rep. 2015;5:13470. doi: 10.1038/srep13470. [CHEN F, DENG J, LIU X, et al.HCRP-1 regulates cell migration and invasion via EGFR-ERK mediated up-regulation of MMP-2 with prognostic significance in human renal cell carcinoma[J].Sci Rep, 2015, 5:13470.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.JIA XH, DU Y, MAO D, et al. Zoledronic acid prevents the tumor-promoting effects of mesenchymal stem cells via MCP-1 dependent recruitment of macrophages. Oncotarget. 2015;6(28):26018–26028. doi: 10.18632/oncotarget. [JIA XH, DU Y, MAO D, et al.Zoledronic acid prevents the tumor-promoting effects of mesenchymal stem cells via MCP-1 dependent recruitment of macrophages[J].Oncotarget, 2015, 6(28):26018-26028.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.GREENE J, BANASR M, LEE B, et al. Vascular endothelial growth factor signaling is required for the behavioral actions of antidepressant treatment:pharmacological and cellular characterization. Neuropsychopharmacology. 2009;34(11):2459–2468. doi: 10.1038/npp.2009.68. [GREENE J, BANASR M, LEE B, et al.Vascular endothelial growth factor signaling is required for the behavioral actions of antidepressant treatment:pharmacological and cellular characterization[J].Neuropsychopharmacology, 2009, 34(11):2459-2468.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.VAN DEN BERG T K, VAN DER SCHOOT C E. Innate immune 'self' recognition:a role for CD47-SIRPalpha interactions in hematopoietic stem cell transplantation. Trends Immunol. 2008;29(5):203–206. doi: 10.1016/j.it.2008.02.004. [VAN DEN BERG T K, VAN DER SCHOOT C E.Innate immune 'self' recognition:a role for CD47-SIRPalpha interactions in hematopoietic stem cell transplantation[J].Trends Immunol, 2008, 29(5):203-206.] [DOI] [PubMed] [Google Scholar]
- 16.SARFATI M, FORTIN G, RAYMOND M, et al. CD47 in the immune response:role of thrombospondin and SIRP-alpha reverse signaling. Curr Drug Targets. 2008;9(10):842–850. doi: 10.2174/138945008785909310. [SARFATI M, FORTIN G, RAYMOND M, et al.CD47 in the immune response:role of thrombospondin and SIRP-alpha reverse signaling[J].Curr Drug Targets, 2008, 9(10):842-850.] [DOI] [PubMed] [Google Scholar]
- 17.HUSS R S, HUDDLESTON J I, GOODMAN S B, et al. Synovial tissue-infiltrating natural killer cells in osteoarthritis and periprosthetic inflammation. Arthritis Rheum. 2010;62(12):3799–3805. doi: 10.1002/art.27751. [HUSS R S, HUDDLESTON J I, GOODMAN S B, et al.Synovial tissue-infiltrating natural killer cells in osteoarthritis and periprosthetic inflammation[J].Arthritis Rheum, 2010, 62(12):3799-3805.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.WITKO-SARSAT V, GAUSSON V, NGUYEN A T, et al. AOPP-induced activation of human neutrophil and monocyte oxidative metabolism:a potential target for N-acetylcysteine treatment in dialysis patients. Kidney Int. 2003;64(1):82–91. doi: 10.1046/j.1523-1755.2003.00044.x. [WITKO-SARSAT V, GAUSSON V, NGUYEN A T, et al.AOPP-induced activation of human neutrophil and monocyte oxidative metabolism:a potential target for N-acetylcysteine treatment in dialysis patients[J].Kidney Int, 2003, 64(1):82-91.] [DOI] [PubMed] [Google Scholar]
- 19.ENGLUND M, HAUGEN I K, GUERMAZI A, et al. Evidence that meniscus damage may be a component of osteoarthritis:the Framingham study. Osteoarthritis Cartilage. 2016;24(2):270–273. doi: 10.1016/j.joca.2015.08.005. [ENGLUND M, HAUGEN I K, GUERMAZI A, et al.Evidence that meniscus damage may be a component of osteoarthritis:the Framingham study[J].Osteoarthritis Cartilage, 2016, 24(2):270-273.] [DOI] [PMC free article] [PubMed] [Google Scholar]


