Abstract
目的
探究血清和卵泡液中胎球蛋白B水平与体外受精结局的相关性。
方法
收集2016年6-12月在浙江大学医学院附属妇产科医院行体外受精的女性患者(受精低下组28个周期,受精正常组44个周期)。利用ELISA法检测血清和卵泡液中胎球蛋白B的水平。采用Pearson相关性分析和受试者工作特征曲线等方法分析血清和卵泡液中胎球蛋白B水平与受精结局的关系。
结果
血清中胎球蛋白B水平与卵泡液中胎球蛋白B的水平呈正相关( r=0.675, P < 0.01)。受精低下组与受精正常组血清中胎球蛋白B的水平分别为(6.09±1.31)μg/mL和(7.13±1.47)μg/mL,差异有统计学意义( t=3.050, P < 0.05);两组卵泡液中胎球蛋白B的水平分别为(5.13±0.96)μg/mL和(6.22±1.33)μg/mL,差异有统计学意义( t=3.755, P < 0.01)。当血清中胎球蛋白B的水平低于6.08 μg/mL时,受精率下降(AUC=0.832,95% CI:0.729~0.934, P < 0.01)。
结论
血清中胎球蛋白B的水平可以反映卵泡液中胎球蛋白B的水平,并可在一定程度上预测受精结局。
Abstract
Objective
To investigate the relationship between serum/follicular fluid fetuin B levels and outcome of in vitro fertilization (IVF).
Methods
Infertility women (28 with low fertilization rates, 44 with normal fertilization rates) receiving IVF in Women's Hospital of Zhejiang University School of Medicine during June and December 2016 were enrolled in the study. Serum/follicular fluid fetuin B levels were measured with ELISA method. Correlations of serum and follicular fetuin B level with fertilization outcome of IVF were analyzed with Pearson correlation coefficient and receiver operating characteristic (ROC) curve.
Results
A positive correlation between serum fetuin B and follicular fluid fetuin B levels was observed ( r=0.675, P < 0.01). Both serum and follicular fluid fetuin B levels in women with low fertilization rates of IVF were lower than those in women with normal fertilization rates[(6.09±1.31) μg/mL vs. (7.13±1.47) μg/mL, t=3.050, P < 0.05; (5.13±0.96)μg/mL vs. (6.22±1.33) μg/mL, t=3.755, P < 0.01]. ROC analysis showed that the area under curve (AUC) of serum fetuin B level in predicting fertilization rate was 0.832 (95% CI:0.729-0.934, P < 0.01), and 6.08 μg/mL could be used as cut-off value.
Conclusion
Serum fetuin B level is correlated with follicular fluid fetuin B level, and it may be used for predicting the fertilization outcome of IVF.
Keywords: Infertility, female/etiology; Fertilization in vitro ; Alpha-fetoproteins/blood; Serum; Follicular fluid; Fertilization; Enzyme-linked immunosorbent assay
近年来,我国不孕不育的发生率不断攀升,并呈现出年轻化趋势。目前,常用的现代辅助生殖技术包括体外受精和单精子卵胞浆内注射(intracytoplasma sperm injection,ICSI)。对于体外受精来说,精子穿透透明带的能力是成功受精的关键 [ 1] 。透明带是包围卵母细胞和胚胎的一种细胞外结构,其主要成分是糖蛋白。人类卵母细胞的透明带蛋白包括ZP1~ZP4四种蛋白,主要作用是调控精子与透明带的接触和穿透 [ 2- 4] 。正常的透明带硬化发生在受精后,当精子进入卵子时,卵子皮质颗粒释放朊酶类物质使得透明带蛋白破裂,引起透明带硬化。透明带提前硬化是指透明带在精子进入卵母细胞前发生硬化,导致受精失败。
Ovastacin是卵母细胞的特异蛋白,主要作用是将完整的ZP2断裂成若干个ZP2片段引起透明带硬化,从而阻止多精子受精 [ 5] 。ZP2提前断裂将使得精子无法穿透透明带,导致受精失败 [ 6- 7] 。胎球蛋白B是ovastacin蛋白抑制剂 [ 5] ,可在受精前抑制ovastacin蛋白的活性,从而维持透明带的可穿透性。实验表明,胎球蛋白B不足的雌性小鼠会因为透明带提前硬化导致受精完全失败 [ 8] 。在人卵母细胞受精的研究中发现,胎球蛋白B也具有相似作用 [ 9] ,但其样本量过小,有待进一步研究。本试验通过测量血清和卵泡液中的胎球蛋白B水平与受精率的关系来明确其对体外受精结局的影响,希望为患者选择体外受精或ICSI方式提供依据。
收集2016年6—12月在浙江大学医学院附属妇产科医院行体外受精治疗的女性患者,其中受精低下组共28个周期,男方精液常规及形态学正常,受精率小于30%;受精正常组系同日取卵者,共44个周期,男方精液常规及形态学正常,受精率大于75%。
两组患者均知情同意自愿参加,并满足下列条件:① 生育年龄妇女,年龄在35周岁以下;② 染色体无异常、无家族遗传病史;③ 不孕原因均为输卵管阻塞,排除多囊卵巢综合征、子宫内膜异位症及盆腹腔手术史;④ 无内分泌疾病史、卵巢低反应等;⑤ 有正常的月经周期(25~35 d);⑥ 排除免疫性不孕(含抗精子抗体)。
所有患者采用促性腺激素释放激素激动剂(GnRH-a)长方案促排卵。当有1~2个优势卵泡平均直径大于18 mm或4个卵泡平均直径大于16 mm时,测定雌激素水平,并于当晚注射人绒毛膜促性腺激素(hCG)8000~10 000 IU。36 h后在阴道超声引导下经阴道穿刺取卵,行体外受精。
于取卵日通过静脉穿刺术采集血液,室温静置1 h后,1500× g、4 ℃离心10 min,将血清转移至干净的离心管中-20 ℃保存。卵泡液通过常规的经阴道超声穿刺术采集,200× g、4 ℃离心5 min,将上清液转移至干净的离心管中-20 ℃保存。采用Ray Bio ®Human Fetuin B ELISA Kit(美国RayBiotech公司)试剂盒检测血清和卵泡液中的胎球蛋白B水平。
采用SPSS 19.0软件进行分析。计量资料以均数±标准差( x ± s)表示,组间比较采用 t检验;计数资料以例数和百分数表示,采用 χ 2检验。血清和卵泡液中胎球蛋白B水平的相关性分析采用Pearson相关系数,使用受试者工作特征曲线(ROC)分析血清中的胎球蛋白B水平评估体外受精结局的准确性。 P<0.05为差异有统计学意义。
受精正常组的受精率明显高于受精低下组(84.3%与19.3%, P<0.01),但两组在年龄、不孕时间、各种激素水平、促排卵用药时间、促性腺激素用药总量等方面差异无统计学意义( 表 1)。
表1 两组患者临床资料比较
Table 1 Clinical data of two groups
|
[( x ± s)或%( n)] | |||||||||||||||||
|
组别 |
周期数 |
年龄(岁) |
不孕时间(年) |
体质指数(kg/m 2) |
基础卵泡刺激素(IU/L) |
基础黄体生成素(IU/L) |
基础雌二醇(pg/mL) |
基础催乳素(ng/mL) |
基础睾酮(nmol/mL) |
促排卵用药时间(d) |
注射hCG日雌二醇水平(pg/mL) |
注射hCG日子宫内膜厚度(mm) |
促性腺激素总量(IU/L) |
卵母细胞异形率 |
受精率 |
可利用胚胎率 |
临床妊娠率 |
|
受精正常组 |
44 |
30±5 |
3.8±2.2 |
23.6±3.2 |
6.8±2.0 |
5.4±2.4 |
116±49 |
21±6 |
0.8±0.5 |
14±4 |
8829±1692 |
10.5±2.0 |
2862±956 |
5.9(34/574) |
84.3(484/574) |
62.4(302/484) |
42.9(18/42) |
|
受精低下组 |
28 |
31±4 |
3.2±2.3 |
23.8±3.1 |
7.0±1.9 |
4.5±2.0 |
120±77 |
22±5 |
0.7±0.3 |
13±4 |
8782±1540 |
10.7±1.9 |
2638±847 |
5.4(19/352) |
19.3(68/352) |
55.9(38/68) |
39.1(9/23) |
|
t值/χ 2值 |
— |
0.892 |
1.108 |
0.262 |
0.422 |
1.652 |
0.270 |
0.734 |
0.730 |
1.034 |
0.119 |
0.422 |
1.012 |
0.112 |
382.9 |
1.070 |
0.085 |
|
P值 |
— |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
<0.01 |
>0.05 |
>0.05 |
“—”:无相关数据; hCG:人绒毛膜促性腺激素.
所有患者取卵当日血清中胎球蛋白B的水平为4~8 μg/mL,卵泡液中胎球蛋白B的水平为4~7 μg/mL,两者呈正相关( r=0.675, P<0.01),见 图 1。
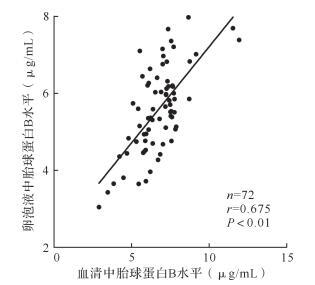
受精低下组与受精正常组血清中胎球蛋白B的水平分别为(6.09±1.31)μg/mL和(7.13±1.47)μg/mL,差异有统计学意义( t=3.050, P<0.05);受精低下组与受精正常组卵泡液中胎球蛋白B的水平分别为(5.13±0.96)μg/mL和(6.22±1.33)μg/mL,差异有统计学意义( t=3.755, P<0.01)。结果提示血清和卵泡液中的胎球蛋白B水平与受精率呈正相关。
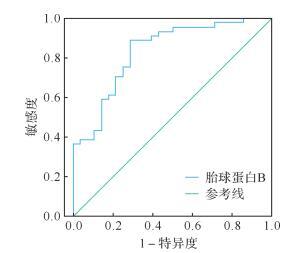
血清中胎球蛋白B水平与受精结局的ROC曲线显示,当血清中的胎球蛋白B水平低于6.08 μg/mL时,受精率下降(AUC=0.832,95% CI:0.729~0.934, P<0.01),见 图 2。说明血清中胎球蛋白B水平对受精结局的预测有一定的参考价值。
体外受精是模拟体内精卵结合的过程,而维持卵母细胞透明带的可穿透性是体外受精成功的关键 [ 1] 。有研究发现,当小鼠体内胎球蛋白B不足或缺乏时可导致透明带提前硬化,导致受精失败 [ 8] 。人卵母细胞因透明带提前硬化而导致的受精障碍也逐渐引起重视,并且人胎球蛋白B基因序列与小鼠有61%的同源性 [ 9] ,因此我们研究血清和卵泡液中胎球蛋白B水平与人卵母细胞受精结局的相关性。
首先测量了血清和卵泡液中的胎球蛋白B水平,结果显示血清与卵泡液中胎球蛋白B的水平密切相关,表明血清中的胎球蛋白B水平可以反映卵泡液中的胎球蛋白B水平。有研究表明,伴随着卵泡的生长发育,卵泡液中的胎球蛋白B水平逐渐升高 [ 9- 11] 。因此,卵泡液中的胎球蛋白B水平可以反映该卵泡是否成熟 [ 12- 13] 。本试验中有两个卵泡的胎球蛋白B水平明显低于正常范围,拆除颗粒细胞后观察两枚卵母细胞均处于第一次减数分裂中期。由于血清和卵泡液中胎球蛋白B水平的相关性,因此血清中的胎球蛋白B水平也可以间接反映卵母细胞的成熟度,希望在未来临床工作中可通过测量患者血清中胎球蛋白B水平作为促排卵治疗过程中卵母细胞是否成熟、用药是否合理的参考依据。
同时,我们比较了受精正常组和受精低下组血清和卵泡液中胎球蛋白B的水平,发现受精正常组血清和卵泡液中的胎球蛋白B水平明显高于受精低下组,说明当血清和卵泡液中胎球蛋白B含量不足时,会导致受精失败。ROC曲线分析结果显示,血清中的胎球蛋白B水平可在一定程度上预测受精结局,当血清中的胎球蛋白B水平低于6.08 μg/mL时,受精率下降。因此,临床可通过测量患者血清中的胎球蛋白B水平来预测体外受精的结局,为患者选择受精方式提供依据。
此外,本文资料还提示,受精正常组和受精低下组卵母细胞的异形率差异无统计学意义,说明受精低下并非因卵母细胞的形态异常导致,也提示了胎球蛋白B水平与卵母细胞形态无明显相关性。受精低下组与受精正常组的可利用胚胎率和临床妊娠率差异无统计学意义,表明胎球蛋白B只参与精卵结合,对胚胎的发育和妊娠无影响。
最后,我们认为胎球蛋白B在体外受精过程中起着关键作用,胎球蛋白B不足可能是引起不孕的原因之一。希望未来能够进一步研究胎球蛋白B与激素调控的关系,为促排方案提供参考,并且为患者选择体外受精或ICSI受精方式提供依据,避免因透明带提前硬化导致受精失败。
Funding Statement
国家自然科学基金(81370761)
References
- 1.RUBINSTEIN E, ZIYYAT A, WOLF J P, et al. The molecular players of sperm-egg fusion in mammals. Semin Cell Dev Biol. 2006;17(2):254–263. doi: 10.1016/j.semcdb.2006.02.012. [RUBINSTEIN E, ZIYYAT A, WOLF J P, et al. The molecular players of sperm-egg fusion in mammals[J]. Semin Cell Dev Biol, 2006, 17(2):254-263.] [DOI] [PubMed] [Google Scholar]
- 2.BÓDIS J, PETI A M, SULYOK E, et al. Serum and follicular fluid fetuin-A in women undergoing in vitro fertilization. http://www.ncbi.nlm.nih.gov/pubmed/24778347. Clin Chem Lab Med. 2014;52(9):1313–1318. doi: 10.1515/cclm-2014-0211. [BÓDIS J, PETI A M, SULYOK E, et al. Serum and follicular fluid fetuin-A in women undergoing in vitro fertilization[J]. Clin Chem Lab Med, 2014, 52(9):1313-1318.] [DOI] [PubMed] [Google Scholar]
- 3.ANDERSEN M M, KROLL J, BYSKOV A G, et al. Protein composition in the fluid of individual bovine follicles. J Reprod Fertil. 1976;48(1):109–118. doi: 10.1530/jrf.0.0480109. [ANDERSEN M M, KROLL J, BYSKOV A G, et al. Protein composition in the fluid of individual bovine follicles[J]. J Reprod Fertil, 1976, 48(1):109-118.] [DOI] [PubMed] [Google Scholar]
- 4.SCHROEDER A C, SCHULTZ R M, KOPF G S, et al. Fetuin inhibits zona pellucida hardening and conversion of ZP2 to ZP2f during spontaneous mouse oocyte maturation in vitro in the absence of serum . Biol Reprod. 1990;43(5):891–897. doi: 10.1095/biolreprod43.5.891. [SCHROEDER A C, SCHULTZ R M, KOPF G S, et al. Fetuin inhibits zona pellucida hardening and conversion of ZP2 to ZP2f during spontaneous mouse oocyte maturation in vitro in the absence of serum[J]. Biol Reprod, 1990, 43(5):891-897. ] [DOI] [PubMed] [Google Scholar]
- 5.BURKART A D, XIONG B, BAIBAKOV B, et al. Ovastacin, a cortical granule protease, cleaves ZP2 in the zona pellucida to prevent polyspermy. J Cell Biol. 2012;197(1):37–44. doi: 10.1083/jcb.201112094. [BURKART A D, XIONG B, BAIBAKOV B, et al. Ovastacin, a cortical granule protease, cleaves ZP2 in the zona pellucida to prevent polyspermy[J]. J Cell Biol, 2012, 197(1):37-44.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.WASSARMAN P M. Zona pellucida glycoproteins. Annu Rev Biochem. 1988;57:415–442. doi: 10.1146/annurev.bi.57.070188.002215. [WASSARMAN P M. Zona pellucida glycoproteins[J]. Annu Rev Biochem, 1988, 57:415-442.] [DOI] [PubMed] [Google Scholar]
- 7.SPITZER D, MURACH K F, LOTTSPEICH F, et al. Different protein patterns derived from follicular fluid of mature and immature human follicles. Hum Reprod. 1996;11(4):798–807. doi: 10.1093/oxfordjournals.humrep.a019257. [SPITZER D, MURACH K F, LOTTSPEICH F, et al. Different protein patterns derived from follicular fluid of mature and immature human follicles[J]. Hum Reprod, 1996, 11(4):798-807.] [DOI] [PubMed] [Google Scholar]
- 8.DIETZEL E, WESSLING J, FLOEHR J, et al. Fetuin-B, a liver-derived plasma protein is essential for fertilization. Dev Cell. 2013;25(1):106–112. doi: 10.1016/j.devcel.2013.03.001. [DIETZEL E, WESSLING J, FLOEHR J, et al. Fetuin-B, a liver-derived plasma protein is essential for fertilization[J]. Dev Cell, 2013, 25(1):106-112.] [DOI] [PubMed] [Google Scholar]
- 9.FLOEHR J, DIETZEL E, NEULEN J, et al. Association of high fetuin-B concentrations in serum with fertilization rate in IVF:a cross-sectional pilot study. Hum Reprod. 2016;31(3):630–637. doi: 10.1093/humrep/dev340. [FLOEHR J, DIETZEL E, NEULEN J, et al. Association of high fetuin-B concentrations in serum with fertilization rate in IVF:a cross-sectional pilot study[J]. Hum Reprod, 2016, 31(3):630-637.] [DOI] [PubMed] [Google Scholar]
- 10.INOUE N, IKAWA M, ISOTANI A, et al. The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs. Nature. 2005;434(7030):234–238. doi: 10.1038/nature03362. [INOUE N, IKAWA M, ISOTANI A, et al. The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs[J]. Nature, 2005, 434(7030):234-238.] [DOI] [PubMed] [Google Scholar]
- 11.DE LESEGNO C V, REYNAUD K, PECHOUX C, et al. Ultrastructure of canine oocytes during in vivo maturation. Mol Reprod Dev. 2008;75(1):115–125. doi: 10.1002/(ISSN)1098-2795. [DE LESEGNO C V, REYNAUD K, PECHOUX C, et al. Ultrastructure of canine oocytes during in vivo maturation[J]. Mol Reprod Dev, 2008, 75(1):115-125. ] [DOI] [PubMed] [Google Scholar]
- 12.ZHU J, JIANG H, HE R B, et al. Association between etiologic factors in infertile couples and fertilization failure in conventional in vitro fertilization cycles. Andrology. 2015;3(4):717–722. doi: 10.1111/andr.2015.3.issue-4. [ZHU J, JIANG H, HE R B, et al. Association between etiologic factors in infertile couples and fertilization failure in conventional in vitro fertilization cycles[J]. Andrology, 2015, 3(4):717-722. ] [DOI] [PubMed] [Google Scholar]
- 13.OKADA M, MATSUMOTO K, NIKI T, et al. DJ-1, a target protein for an endocrine disrupter, participates in the fertilization in mice. Biol Pharm Bull. 2002;25(7):853–856. doi: 10.1248/bpb.25.853. [OKADA M, MATSUMOTO K, NIKI T, et al. DJ-1, a target protein for an endocrine disrupter, participates in the fertilization in mice[J]. Biol Pharm Bull, 2002, 25(7):853-856.] [DOI] [PubMed] [Google Scholar]


