Abstract
目的
体外研究放射线照射后的人肺成纤维细胞(HLFs)对人脐带间充质干细胞(HUMSCs)中经典Wnt/β-catenin信号通路的影响。
方法
实验细胞分为共培养组和单纯HUMSCs组,共培养组为5Gy X射线照射后的HLFs通过Transwell系统与HUMSCs共培养。细胞培养3d后,蛋白质印迹法检测HUMSCs中GSK-3β、p-GSK-3β、FRAT1和胞核内β-catenin蛋白表达,酶联免疫吸附试验检测细胞培养上清液中WISP-1蛋白表达。
结果
共培养组HUMSCs中p-GSK-3β/GSK-3β相对比值(0.15±0.05)和FRAT1表达水平(0.48±0.07)较单纯HUMSCs组(0.55±0.05和1.16±0.13)明显下降,共培养组HUMSCs胞核内β-catenin(0.50±0.07)也较单纯HUMSCs组(2.39±0.15)明显下降;共培养组HUMSCs培养上清液中WISP-1蛋白表达[(602.23±161.47)ng/mL]较单纯HUMSCs组[(977.77±110.56)ng/mL]明显下降,差异均有统计学意义(均 P<0.05)。
结论
放射线照射后的HLFs对HUMSCs中经典Wnt/β-catenin通路具有抑制作用。
Abstract
Objective
To investigate the effect of irradiated human lung fibroblasts (HLFs) on the canonical Wnt/β-catenin signaling pathway in human umbilical cord mesenchymal stem cells (HUMSCs).
Methods
HUMSCs were cultured alone (single group) or co-cultured with HLFs exposed to 5Gy X-rays (co-culture group). The protein levels of GSK-3β, p-GSK-3β, FRAT1 and β-catenin in HUMSCs were examined by Western blotting 3 days after culture or co-culture. WISP-1 protein levels in conditioned medium were examined by ELISA.
Results
The levels of p-GSK3β/GSK3β(0.15±0.05), FRAT1(0.48±0.07) and β-catenin(0.50±0.07) in co-cultured HUMSCs significantly decreased compared to those in single group (0.55±0.05, 1.16±0.13 and 2.39±0.15, all P < 0.05).The supernatant level of WISP-1 in co-culture group was significantly decreased[(602.23±161.47) ng/mL], compared to the single group[(977.77±110.56) ng/mL, P < 0.05].
Conclusion
Irradiated HLFs attenuate the activation of canonical Wnt/β-catenin signaling pathway in HUMSCs in vitro.
Keywords: Fibroblasts, Mesenchymal stem cells/physiology, Umbilical cord, Radiation pneumonitis, Wnt proteins/biosynthesis, Beta-catenin/biosynthesis, Intercellular signaling peptides and proteins, Signal transduction
目前已广泛开展运用外源性间充质干细胞治疗放射性肺炎、放射性肺纤维化的研究。研究发现外源性间充质干细胞可向受损部位归巢并向肺泡上皮细胞分化 [ 1, 2] ,但肺损伤局部微环境会左右输注的外源性间充质干细胞归巢和分化[ 3- 4],从而影响了治疗。其具体的机制不完全清楚。有研究表明经典Wnt (wingless-type MMTV integration site family)/β-catenin通路参与了间充质干细胞的归巢及分化 [ 5] 。Wnt /β-catenin信号通路在细胞的增殖及分化过程中有重要作用。在缺少活化的Wnt配体时,β-catenin被位于结肠腺瘤样息肉蛋白(APC)和轴蛋白(axin)复合体上的糖原合成激酶3-β(glycogen synthase kinase 3 beta,GSK-3β)磷酸化,在细胞浆内降解。当有Wnt配体存在时,膜受体(FZD)或共同受体低密度脂蛋白受体相关蛋白(LRP5/6) 与配体结合,诱导通路活化。在细胞浆内,GSK-3β被磷酸化,使其磷酸化β-catenin作用减弱,因此β-catenin在胞浆中聚集增多,向细胞核内转移。在核内,β-catenin与T细胞因子/淋巴样增强因子(TCF/LEF)结合,诱导下游的靶基因转录,如Wnt1诱导信号通路蛋白(Wnt1 inducible signaling pathway protein 1,WISP-1) 等,在信号通路活化时表达升高 [ 6, 7] 。而磷酸化GSK-3β(p-GSK-3β)是反映经典Wnt/β-catenin信号通路活动性的敏感指标 [ 8] 。
为探讨外源性间充质干细胞在放射线照射后肺组织中趋化、归巢以及分化所受影响的可能机制,本研究拟通过transwell非接触共培养系统,观察放射线照射后的人肺成纤维细胞(human lung fibroblasts,HLFs)对人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUMSCs)中经典Wnt /β-catenin通路的影响,以初步探讨肺损伤微环境对外源性间充质干细胞影响的可能机制。
HLFs由解放军医学院陈洁博士惠赠。HUMSCs源于人脐带,经海军总医院伦理委员会批准,孕妇及家属签署知情同意书后,留取健康孕妇剖宫产后脐带,经组织块法贴壁培养 [ 9] ,实验采用第3代细胞。HUMSCs已进行分化及免疫表型鉴定 [ 9] 。
DMEM-F12培养基、胎牛血清均购自美国Gibco公司;Transwell小室(孔径0.4μm)6孔板购自美国Corning公司;p-GSK-3β(Ser9) 兔单克隆抗体、GSK-3β兔单克隆抗体购自美国Cell Signaling公司;FRAT1(frequently rearranged in advanced T-cell lymphomas-1) 兔单克隆抗体、GAPDH兔单克隆抗体、Histone H3兔多克隆抗体购自美国Abcam公司;β-catenin兔单克隆抗体购自美国Epitomics公司;HRP标记羊抗兔IgG抗体、总蛋白及细胞核蛋白提取试剂盒均购自北京普利莱生物技术公司;WISP-1酶联免疫吸附试验(ELISA)试剂盒购自上海朗顿生物技术有限公司。
取HUMSCs对数生长期细胞,以2×10 5/孔密度接种于6孔板,细胞分为共培养组、单纯HUMSCs组,每组设6个复孔。采用含10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素的DMEM/F12培养液,在37℃、5%二氧化碳饱和湿度条件下培养。HLFs以1.5×10 5/孔密度接种于Transwell上室,12h后观察,细胞完全贴壁后经无菌密封,于直线加速器(5Gy、530mV、源距1m、照射野20cm×10cm)进行X线照射。照射后,将接种HLFs的transwell上室与HUMSCs共培养,而单纯HUMSCs组不与HLFs共培养。各组培养液体系均调整至2mL,之后转移至培养箱培养。培养3天后,提取HUMSCs蛋白并留取培养上清液。
根据蛋白提取试剂盒说明,提取HUMSCs总蛋白及核蛋白,BCA法测定蛋白浓度。样本于100℃变性5min,在15道双垂直电泳槽内每孔加入40μg蛋白质,经10% SDS-PAGE电泳,转移至PVDF膜,50mL脱脂牛奶封闭2h,杂交一抗(1:500稀释),4℃过夜,洗膜后加入二抗(1:1000稀释),37℃孵育2h。洗膜后加入增强化学发光剂,置于X射线摄影暗盒内曝光显影,根据同时进行电泳的蛋白分子量标志物判断各目的条带位置。结果采用Gel-Pro analyzer 4.0软件对条带灰度进行分析。
细胞上清液中WISP-1水平的检测根据ELISA试剂盒操作说明书进行,用酶标仪在波长450nm处测吸光度值,参照标准曲线计算其浓度值,每个样本重复3次。
采用CHISS统计软件进行分析,数据采用均数±标准差( x ± s)表示,两组比较采用两独立样本 t检验。 P<0.05为差异有统计学意义。
倒置显微镜下观察可见正常HLFs形态呈梭形、三角形或不规则形( 图 1A);培养至第3代第3天的HUMSCs呈梭形或多角形( 图 1B)。
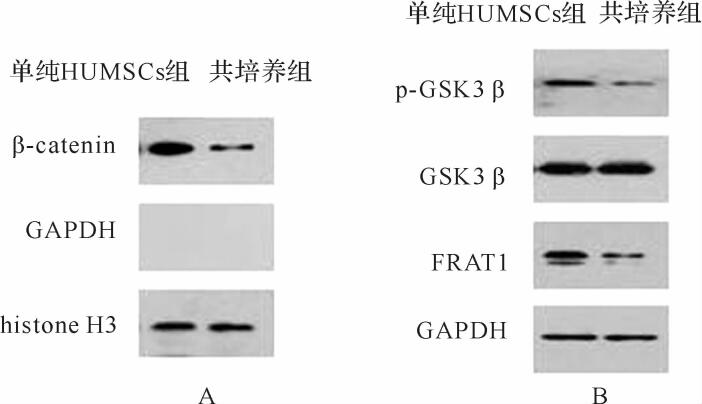
HUMSCs细胞核中GAPDH未见表达,而Histone H3可见表达( 图 2A),说明HUMSCs细胞核蛋白提取成功。共培养组β-catenin表达水平明显低于单纯HUMSCs组,差异有统计学意义( P<0.01),见 图 2A、 表 1。说明放射线照射后的HLFs可降低HUMSCs胞核中β-catenin的表达。
表1 HUMSCs中β-catenin、p-GSK/GSK、FRAT1蛋白表达比较
Table 1 The relative levels of β-catenin, p-GSK/GSK and FRAT1 protein in HUMSCs
|
( x ± s) | |||
|
组别 |
β-catenin |
p-GSK/GSK |
FRAT1 |
|
单纯HUMSCs组 |
2.39±0.15 |
0.55±0.05 |
1.16±0.13 |
|
共培养组 |
0.50±0.07 |
0.15±0.05 |
0.48±0.07 |
|
t值 |
19.78 |
9.80 |
7.80 |
|
P值 |
<0.01 |
<0.01 |
<0.01 |
共培养组HUMSCs中p-GSK-3β/GSK-3β和FRAT1蛋白表达明显低于单纯HUMSCs组,差异有统计学意义( P<0.01),见 图 2B、 表 1。说明放射线照射后的HLFs可降低HUMSCs中p-GSK-3β和FRAT1的表达。
共培养组和单纯HUMSCs组细胞上清液中WISP-1表达水平分别为(602.23±161.47) ng/mL和(977.77±110.56) ng/mL,差异有统计学意义( P=0.009),提示放射线照射后的HLFs可降低HUMSCs细胞上清液中WISP-1表达。
目前关于外源性间充质干细胞移植治疗肺损伤、肺纤维化研究中发现,晚期输注间充质干细胞减轻肺纤维化效果不明显 [ 3, 4] 。间充质干细胞多存在于肺间质区域,可向肌成纤维细胞分化而未能分化为肺泡上皮细胞,其原因可能是肺内微环境的变化影响了间充质干细胞的趋化、归巢,同时影响了其分化 [ 4] 。而放射性肺炎、放射性肺纤维化均涉及大量细胞及细胞因子,不同细胞与外源性间充质干细胞之间的相互作用、影响,均有可能导致上述情况。而肺成纤维细胞是放射性肺损伤中重要的效应细胞,在肺纤维化形成过程中有重要作用 [ 6] 。放射线照射之后,肺成纤维细胞可向肌成纤维细胞分化,并合成和分泌大量参与肺损伤和纤维化的细胞因子 [ 10] 。因此本研究采用放射线照射后的HLFs,观察其对外源性HUMSCs的影响。
目前发现经典的Wnt/β-catenin通路参与间充质干细胞分化的调控,β-catenin在间充质干细胞分化时上调 [ 5, 11] 。在体外实验中,活化的经典Wnt/β-catenin通路可促进小鼠骨间充质干细胞向肺泡上皮细胞分化和向损伤组织趋化、迁移 [ 5] 。Wnt3a可活化该信号通路促进间充质干细胞迁移和创伤愈合,而Wnt3a抗体可减弱间充质干细胞的迁移 [ 12] 。同时发现,与放射线照射后HLFs非接触共培养的HUMSCs的p-GSK-3β、β-catenin和WISP-1蛋白表达水平均较正常的HUMSCs降低,该结果提示:放射线照射后的HLFs抑制了HUMSCs中经典Wnt/β-catenin信号通路。同时发现,共培养的HUMSCs中FRAT1蛋白表达水平相对于单纯HUMSCs下降。作为经典Wnt/β-catenin信号通路的活化因子之一,FRAT1蛋白可与Axin竞争结合GSK3,导致GSK/Axin/APC复合体解体,形成FRAT/GSK3复合体,抑制β-catenin的磷酸化和降解,激活该通路下游的基因 [ 13] 。这提示放射线照射后的HLFs有可能通过影响HUMSCs中FRAT1的表达,抑制该信号通路。
上述结果可在一定程度解释以往研究中外源性间充质干细胞治疗放射性肺损伤效果欠佳的原因 [ 4] 。当放射线照射后,肺内成纤维细胞大量增殖,输注的间充质干细胞中经典Wnt/β-catenin信号通路受到抑制,不但到达损伤部位的间充质干细胞数量下降,同时其向受损细胞分化的能力也下降。目前间充质干细胞治疗肺损伤的机制仍不完全清楚,肺损伤后局部微环境对外源性间充质干细胞影响的研究仍较少。如何改善肺损伤后局部微环境影响,尽可能发挥间充质干细胞归巢以及修复受损组织的作用,需要进一步深入研究。
但值得注意的是,本研究仅采用了单一的HLFs观察其对间充质干细胞的影响。而放射性肺损伤的局部微环境还包含其他细胞,如上皮细胞、成纤维细胞、巨噬细胞等,需要考虑到多种细胞之间复杂的相互作用及影响,才有可能较客观地解释其机制。我们将在今后深入开展这方面的研究。另一方面,放射性肺损伤后肺内微环境随着时间的改变是不断变化的。在不同的阶段,受损的肺泡上皮细胞以及肺成纤维细胞向肌成纤维细胞的分化和增殖对外源性间充质干细胞的影响如何,需要进一步深入研究。
Funding Statement
国家自然科学基金青年科学基金(81300050)
References
- 1.XUE J, LI X, LU Y, et al. Gene-modified mesenchymal stem cells protect against radiation-induced lung injury. Mol Ther. 2013;21(2):456–465. doi: 10.1038/mt.2012.183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.ROJAS M, XU J, WOODS C R, et al. Bone marrow-derived mesenchymal stem cells in repair of the injured lung. Am J Respir Cell Mol Biol. 2005;33(2):145–152. doi: 10.1165/rcmb.2004-0330OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.崔 瑷, 代 华平, 戴 建武, et al. 骨髓间充质干细胞对博来霉素致大鼠肺纤维化形成的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-ZHJH200709015.htm. 中华结核和呼吸杂志. 2007;30(9):677–682. [PubMed] [Google Scholar]
- 4.YAN X, LIU Y, HAN Q, et al. Injured microenvironment directly guides the differentiation of engrafted Flk-1t mesenchymal stem cell in lung. Exp Hematol. 2007;35(9):1466–1475. doi: 10.1016/j.exphem.2007.05.012. [DOI] [PubMed] [Google Scholar]
- 5.LIU A R, LIU L, CHEN S, et al. Activation of canonical wnt pathway promotes differentiation of mouse bone marrow-derived MSCs into type II alveolar epithelial cells, confers resistance to oxidative stress, and promotes their migration to injured lung tissue in vitro. J Cell Physiol. 2013;228(6):1270–1283. doi: 10.1002/jcp.v228.6. [DOI] [PubMed] [Google Scholar]
- 6.GURUNG A, UDDIN F, HILL R P, et al. Beta-catenin is a mediator of the response of fibroblasts to irradiation. Am J Pathol. 2009;174(1):248–255. doi: 10.2353/ajpath.2009.080576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.徐 思慧, 宋 春敬, 孟 海建, et al. 骨髓间充质干细胞分化为心肌细胞过程中Wnt信号通路的作用研究. http://www.cnki.com.cn/Article/CJFDTOTAL-SMKY201406014.htm 生命科学研究. 2014;18(6):539–542. [Google Scholar]
- 8.FORDE J E, DALE T C. Glycogen synthase kinase 3: a key regulator of cellular fate. Cell Mol Life Sci. 2007;64(15):1930–1944. doi: 10.1007/s00018-007-7045-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.GAO L R, ZHANG N K, DING Q A, et al. Common expression of stemness molecular markers and early cardiac transcription factors in human Wharton's jelly-derived mesenchymal stem cells and embryonic stem cells. Cell Transplant. 2013;22(10):1883–1900. doi: 10.3727/096368912X662444. [DOI] [PubMed] [Google Scholar]
- 10.LI Y Y, LIN D J, GAO G X. Pathogenesis of radiation-induced lung injury. Int J Respir. 2012;21(10):784–788. [Google Scholar]
- 11.OKOYE U C, MALBON C C, WANG H Y. Wnt and Frizzled RNA expression in human mesenchymal and embryonic (H7) stem cells. J Mol Signal. 2008;3:16. doi: 10.1186/1750-2187-3-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.KASAI M, SATOH K, AKIYAMA T. Wnt signaling regulates the sequential onset of neurogenesis and gliogenesis via induction of BMPs. Genes Cells. 2005;10(8):777–783. doi: 10.1111/gtc.2005.10.issue-8. [DOI] [PubMed] [Google Scholar]
- 13.VAN AMERONGEN R, BERNS A. Re-evaluating the role of Frat in Wnt-signal transduction. Cell Cycle. 2005;4(8):1065–1072. [PubMed] [Google Scholar]