Abstract
目的
分析急性大动脉闭塞的缺血性卒中患者基线磁敏感加权成像(SWI)上毛刷征与静脉溶栓后发生出血转化的相关性。
方法
回顾性分析2009年8月至2014年10月期间在浙江大学医学院附属第二医院神经内科接受静脉溶栓治疗的前循环大动脉闭塞(颈内动脉、大脑中动脉M1和M2) 患者, 在SWI图像上将两侧静脉显影程度评分相减(患侧-健侧)得到不对称指数(AI)。采用有序logistic回归分析毛刷征的影响因素, 二元logistic多元回归分析静脉溶栓后出血转化和毛刷征之间的相关性。最后分析毛刷征联合早期再灌注对出血转化的影响。
结果
最后纳入分析66例患者, 平均年龄(68±13) 岁, 女性22例(占33%), 男性44例(占67%), 共计26例(39.4%)患者出现出血转化。根据AI将其分为三组:AI=0( n=9)、AI=1( n=39)、AI=2( n=18)。各组间出血转化率差异有统计学意义( P=0.026)。二元logistic回归分析显示, AI分级升高(即毛刷征越显著)是急性缺血性卒中患者溶栓后发生出血转化的独立危险因素( OR=2.589, 95% CI:1.080~6.210, P=0.033)。非再灌注亚组分析结果提示毛刷征越显著者出血转化率越高( P=0.023)。
结论
SWI毛刷征与急性缺血性卒中患者静脉溶栓后发生出血转化相关, 有临床预测价值。
Abstract
Objective
To assess brush sign (BS) on susceptibility-weighted imaging (SWI) in prediction of hemorrhagic transformation (HT) in patients with acute ischemic stroke (AIS) after intravenous thrombolysis(IVT).
Methods
Patients with acute cerebral ischemic stroke, who had major cerebral artery occlusion (internal carotid artery, middle cerebral artery M1 and M2), treated with intravenous recombinant tissue plasminogen activator (rt-PA) from August 2009 to October 2014 in the Second Affiliated Hospital, Zhejiang University School of Medicine, were enrolled in the study. All patients underwent SWI scanning. The asymmetry index (AI) was defined as the difference of intensity between ischemic and normal hemispheres on the SWI phase map; according to AI values patients were divided into 3 groups: BS=0( n=9), BS=1 ( n=39) and BS=2 ( n=18). The relationships between BS and HT and the clinical outcome among the 3 groups were analyzed.
Results
Sixty-six patients aged 68±13 years were included in the study, including 44 males (67%) and 22 females (33%), and 44 (67%) with acute ischemic stroke. The mean pre-treatment National Institutes of Health Stroke Scale (NIHSS) score was 13 (6-17), and the onset to needle time was (252±88) min. Twenty-six (39.4%) patients had HT, including 18 cases (27.3%) with HI and 8 cases (12.1%) with PH; BS was observed more frequently in HT group than non-HT group. Binary logistic regression analysis showed that BS was independently associated with HT of patients with acute ischemic stroke following IVT ( OR=2.589, 95% CI: 1.080-6.210, P=0.033). In those without reperfusion after IVT, patients with higher BS grade had higher HT rate ( P=0.023).
Conclusion
Brush sign on SWI can be used for predicting hemorrhagic transformation after intravenous thrombolysis in patients with acute ischemic stroke.
Keywords: Stroke/drug therapy; Acute disease; Brain ischemia; Magnetic resonance imaging; Tissue plasminogen activator/therapeutic use; Thrombolytic therapy; Infusions, intravenous
缺血性卒中(ischemic stroke)是最常见的脑血管疾病,随着我国人口老龄化程度的加重,缺血性卒中发病率已经占到脑血管疾病的75%,患者致死率和致残率居高不下 [ 1] 。对于起病4.5 h内的缺血性卒中患者,静脉溶栓治疗是目前国内外指南均推荐的有效治疗手段 [ 2] 。出血转化是静脉溶栓后最严重的并发症 [ 3] ,限制了溶栓治疗的临床应用,因此有效预测静脉溶栓后出血转化具有较高的临床指导价值。
磁敏感加权成像(susceptibility-weighted imaging,SWI)是新近发展起来的一种可以反映组织磁化属性的序列,尤其对于顺磁性物质(如脱氧血红蛋白和含铁血黄素)具有很高的敏感性 [ 4] 。有研究显示,起病12 h内大血管闭塞的缺血性卒中患者中,大约96%在SWI上可见侧脑室旁大量扩张的深部髓质静脉(deep medullary vein),因类似毛刷,称之为毛刷征(brush sign) [ 5] 。最近一项关于烟雾病的研究显示,毛刷征的出现反映了深部脑组织的缺血和低灌注,并可以用来预测病情的严重程度 [ 6] 。那么,SWI上毛刷征是否影响静脉溶栓后出血转化,影响神经功能结局?本研究通过缺血性卒中患者临床资料的多因素分析,旨在探讨SWI上毛刷征与出血转化的关系。
研究对象为2009年8月至2014年10月期间在浙江大学医学院附属第二医院神经内科接受重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓治疗的急性缺血性卒中患者(纳入标准和排除标准详见文献 [ 7] )。收集所有患者的性别、年龄、基线美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分、弥散加权成像(DWI)病灶体积、灌注加权成像(PWI)低灌注体积、起病至溶栓时间(onset to needle time,ONT)、起病至检查时间(onset to imaging,OIT)、卒中危险因素及基线检查资料、3个月改良Rankin量表(mRS)评分。所有入组患者溶栓前和溶栓后24 h内均行多模式MRI检查,序列包括DWI、SWI、PWI、磁共振血管成影(MRA)。本研究纳入前循环大动脉闭塞(颈内动脉、大脑中动脉M1和M2) 的患者。
本研究经浙江大学医学院附属第二医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
所有序列均在3.0 T磁共振仪器(Signa Excite HD,美国通用电气公司)上完成,所用线圈为8通道头颅线圈。扫描序列和所用参数如下:DWI:TR/TE=4000/69.3 ms,矩阵大小=160 × 160,b值=1000 s/mm 2,沿着3个正交方向,单次激发,扫描时间32 s。PWI: TR/TE=1500/30 ms,矩阵大小= 128 × 128,单次激发,重复扫描次数50次,扫描时间75 s。扫描开始后5 s注射造影剂,造影剂流速4~5 mL/s,造影剂剂量15 mL,等剂量生理盐水推注。MRA:TR/TE=20/3.2 ms,翻转角=15°,扫描大小=320×224,层厚=1.4 mm,32×3层,扫描时间226 s。SWI:平行前联合至后联合(AC-PC)连线的轴向扫描,使用包含11个等距回波时间的三维梯度回波,参数如下:TR/TE=58/4.5 ms,视野=24 cm×24 cm;矩阵大小=256×256,翻转角=20°,层厚=2.0 mm,无层间距,分辨率=(0.4688 mm×0.4688 mm)/像素。
采用MIstar软件(澳大利亚Apollo医学影像技术)测量DWI与PWI病灶体积,体积测量方法如下:将DWI原始图像导入工作站获得表观弥散系数图,在不同层面中将表现弥散系数值<600×10 -6 mm 2/s的区域设定为感兴趣区(regions of interest) [ 8] ,该软件自动根据数学模型(即以体素个体乘以每一个像素的体积),计算出各个层面病变体积之和。在MIstar生成的PWI参数图之脑血流达峰时间(Tmax)图上,用阈值过滤法显示Tmax>6 s的区域 [ 8] ,将其定义为低灌注体积。再灌注率(%)=(1-复查低灌注体积/基线低灌注体积)×100%,将溶栓24 h后再灌注率达到80%及以上且体积差≥10 mL者定义为再灌注 [ 9] 。
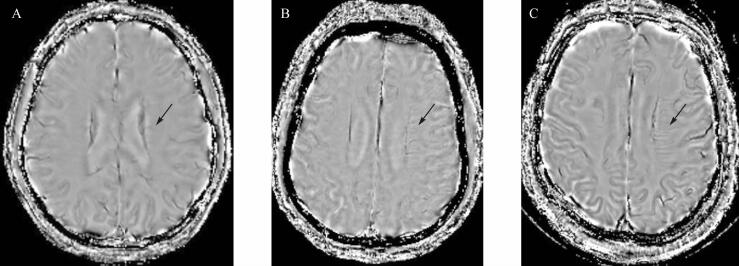
使用SWI相位图分别评价两侧深部髓质静脉,使用3分法描述:0(未见)、1(轻度可见)、2(明显可见) [ 10] 。两侧静脉评分相减(患侧-健侧)得到不对称指数(AI),分别为0分、1分、2分。见 图 1。
以上所有入组病例的数据评价均由两位高年资神经内科住院医师在患者临床信息未知的情况下独立完成。相隔一月,由其中一位医师将另外一位医师的数据进行结果分析。
均选用德国勃林格英格翰公司生产的rt-PA(商品名爱通立),规格为50 mg/支或20 mg/支的干粉制剂。溶栓剂量按照指南规定的0.9 mg/kg体质量 [ 11] ,最大剂量不超过90 mg,10%剂量先予静脉推注,1 min内推完,余下剂量持续静脉微泵60 min注入。
溶栓后24 h复查SWI,与基线SWI相比新出现的低信号病灶定义为出血转化。参照ECASSⅡ标准 [ 12] ,分为以下两个类型:① 出血性脑梗死(hemorrhagic infarction,HI):梗死灶边缘少量渗血或梗死范围内片状出血灶,但无占位效应;② 脑实质血肿(parenchymal hematoma,PH):有血肿,并伴占位效应。
应用SPSS 19.0软件包进行统计学处理。正态分布的计量资料以均数±标准差( x ± s)表示,三组间比较采用单向方差分析,两组间比较采用独立样本 t检验;非正态分布的计量资料以中位数和四分位距[ M(Q 1~Q 3) ]表示,三组间比较和两组间比较均采用Kruskal-Wall H检验。二分类计量数据采用 n(%)表示,组间比较采用 χ 2检验。将HT组和非HT组的单因素分析中 P < 0.1的变量纳入二元logistic回归分析模型,并强制纳入与出血转化可能有关的因素,包括基线NIHSS和心房颤动史。 P < 0.05认为差异有统计学意义。
114例患者接受溶栓治疗并行SWI检查,其中29例为小血管闭塞,10例为后循环梗死,9例因检查时患者欠合作导致图像质量差予以排除。最后纳入66例前循环大动脉闭塞患者进行分析,平均年龄(68±13) 岁;女性22例(占33%),男性44例(占67%);发病至溶栓时间(252±88) min,溶栓前NIHSS评分为13(6~17) 分。
不同AI分级患者之间的基线NIHSS评分、低灌注体积差异有统计学意义(均 P < 0.05),AI分级越高者神经功能缺失严重、低灌注体积大,其他基线资料差异均无统计学意义(均 P>0.05)。详见 表 1。
表1 不同AI分级急性缺血性卒中患者的基线特征比较
Table 1 Univariate analysis of the baseline variables in patients with acute ischemic stroke according to different asymmetry index grades of deep medullary vein
|
[( x ± s)或 n(%)或 M(Q 1~Q 3) ] | ||||
|
特征 |
AI=0( n=9) |
AI=1( n=39) |
AI=2( n=18) |
P值 |
|
年龄(岁) |
72±14 |
67±13 |
67±12 |
0.476 |
|
女性 |
4(44) |
13(33) |
5(28) |
0.416 |
|
基线NIHSS |
7(3~12) |
12(6~15) |
18(16~19) |
< 0.001 |
|
OIT(min) |
182±91 |
228±90 |
186±59 |
0.279 |
|
ONT(min) |
223±108 |
271±92 |
226±58 |
0.279 |
|
收缩压(mmHg) |
164±40 |
150±22 |
145±22 |
0.095 |
|
舒张压(mmHg) |
89±22 |
83±15 |
82±15 |
0.464 |
|
血糖(mmol/L) |
7.3±1.1 |
7.7±2.2 |
7.5±1.7 |
0.853 |
|
DWI病灶体积(mL) |
7(1~19) |
8(1~55) |
25(5~101) |
0.088 |
|
低灌注体积(mL) |
55(23~75) |
67(38~129) |
132(84~178) |
0.027 |
|
高血压 |
6(67) |
25(64) |
10(56) |
0.513 |
|
心房颤动 |
4(44) |
23(59) |
4(22) |
0.075 |
|
糖尿病 |
2(22) |
6(15) |
3(17) |
0.814 |
|
冠心病 |
1(11) |
6(15) |
3(17) |
0.737 |
|
OIT:起病至检查时间, ONT:起病至溶栓时间. |
以基线NIHSS、低灌注体积、DWI病灶体积、收缩压、心房颤动史为自变量,毛刷征为因变量,行有序logistic回归分析。结果基线NIHSS ( OR=1.157,95% CI:1.071~1.249, P<0.001)、收缩压( OR=0.983,95% CI:0.968~0.998, P=0.024) 和心房颤动史( OR=2.282,95% CI:1.459~7.057, P=0.004) 是毛刷征AI分级的独立影响因素,而低灌注体积( OR=1.002,95% CI: 0.997~1.007, P=0.396)、DWI病灶体积( OR=1.000,95% CI: 0.994~1.006, P=0.996) 则非毛刷征AI分级的独立影响因素。
共有26例(39.4%)患者出现出血转化,其中HI型18例(27.3%)、PH型8例(12.1%)。 表 2为不同类型出血转化患者的基线情况。无出血、HI型出血、PH出血三组间单因素分析结果显示:三组间的基线AI分级差异有统计学趋势( P=0.055),其他参数差异无统计学意义。无出血组与出血组(包括HI和PH)组间单因素分析结果显示:出血转化组DWI病灶体积较无出血组大,且AI的分级更高(即毛刷征更显著),差异有统计学意义(均 P < 0.05)。详见 表 2。
表2 静脉溶栓治疗患者发生不同类型出血转化的单因素分析
Table 2 Univariate analysis of different types of hemorrhagic transformation after intravenous thrombolysis in patients with acute ischemic stroke
|
[( x ± s)或 n(%)或 M(Q 1~Q 3) ] | ||||||
|
因素 |
无出血( n=40) |
HI型出血转化( n=18) |
PH型出血转化( n=8) |
P值 # |
出血转化(HI和PH)( n=26) |
P值 * |
|
年龄(岁) |
67±13 |
67±12 |
72±10 |
0.679 |
68±11 |
0.706 |
|
女性 |
16(40) |
5(28) |
1(13) |
0.271 |
6(23) |
0.188 |
|
基线NIHSS |
11(6~17) |
14(9~16) |
16(14~19) |
0.072 |
15(10~17) |
0.115 |
|
收缩压(mmHg) |
154±26 |
142±22 |
156±18 |
0.213 |
146±22 |
0.251 |
|
舒张压(mmHg) |
83±17 |
80±13 |
94±15 |
0.142 |
84±15 |
0.700 |
|
血糖水平(mmol/L) |
7.5±1.9 |
7.9±2.2 |
7.2±1.6 |
0.655 |
7.6±2.0 |
0.792 |
|
DWI病灶体积(mL) |
5(1~49) |
41(6~76) |
21(10~31) |
0.766 |
28(7~68) |
0.028 |
|
低灌注体积(mL) |
68(32~137) |
108(63~163) |
93(14~203) |
0.362 |
108(56~162) |
0.065 |
|
高血压病史 |
25(63) |
12(67) |
4(50) |
0.719 |
16(61.5) |
1.000 |
|
心房颤动史 |
17(43) |
9(50) |
5(62) |
0.559 |
14(54) |
0.452 |
|
糖尿病史 |
8(20) |
3(17) |
0(0) |
0.383 |
3(12) |
0.505 |
|
冠心病史 |
5(13) |
4(22) |
1(13) |
0.618 |
5(19) |
0.498 |
|
卒中史 |
7(18) |
3(17) |
0(0) |
0.442 |
3(12) |
0.728 |
|
AI分级 |
1(1~1) |
1(1~2) |
2(1~2) |
0.055 |
1(1~2) |
0.026 |
|
#无出血、HI型出血转化、PH型出血转化三组间的单因素分析; *出血转化患者与无出血转化患者间的单因素分析. |
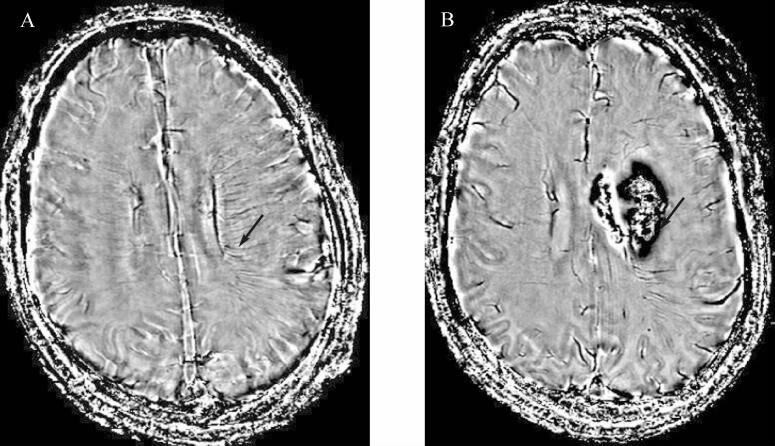
以静脉溶栓后是否出血转化为因变量,行二元logistic回归分析,结果显示:AI分级是溶栓后出血转化的独立危险因素,详见 表 3。溶栓前毛刷征明显患者发生出血转化的SWI图像见 图 2。
表3 静脉溶栓后出血转化的二元logistic回归分析
Table 3 Binary logistic regression analysis of hemorrhagic transformation after intravenous thrombolysis in patients with acute ischemic stroke
|
自变量 |
OR值 |
95% CI |
P值 |
|
基线NIHSS |
0.997 |
0.888~1.120 |
0.960 |
|
DWI病灶体积(mL) |
0.999 |
0.990~1.008 |
0.795 |
|
低灌注体积(mL) |
1.004 |
0.998~1.010 |
0.209 |
|
AI分级 |
2.589 |
1.080~6.210 |
0.033 |
|
心房颤动史 |
2.339 |
0.764~7.162 |
0.137 |
进一步对再灌注进行分析,发现其中24例患者静脉溶栓后获得再灌注,42例无再灌注。再灌注患者中,AI分级[1(1.0~1.5)]与出血转化(占54%)的发生无显著相关性( P=0.392),但在未再灌注患者中,AI分级[1(1.0~2.0)]与出血转化(占31%)的发生显著相关( P=0.023),出血转化患者的AI较无出血转化者高。
本研究发现:NIHSS评分、收缩压和心房颤动史是毛刷征AI分级的独立影响因素,同时,前循环大动脉闭塞的急性缺血性卒中患者中,基线SWI上毛刷征的AI分级越高者更容易出现静脉溶栓后出血转化。
近年来SWI在缺血性卒中的研究日益增多,尤其在大血管闭塞的患者中可以用来排除出血、检测动脉内血栓等。本研究入选的66例静脉溶栓患者中,基线SWI序列上毛刷征阳性率高达86.4%,且多见于患侧半球。这与Morita等 [ 5] 研究结果类似,他们在24例大脑中动脉闭塞的患者中发现23例出现毛刷征,阳性率高达95.8%;而21例小血管闭塞的患者均无毛刷征出现。SWI上观察到毛刷征的原因可能是:脑组织供血中断时,为代偿血流动力学损害造成的缺氧,组织增加氧摄取率,动脉持续反应性扩张,导致血液内脱氧血红蛋白比例增高和静脉回流速度减慢。而脱氧血红蛋白在SWI上为低信号,故在SWI上可见侧脑室旁线条状低信号,类似“毛刷样” [ 6] 。由此提示SWI静脉的显影程度可能间接反映缺血区脑组织氧代谢率。
进一步研究发现,NIHSS评分、收缩压和心房颤动史均是毛刷征AI分级的独立影响因素。原因可能如下:NIHSS评分可反映急性缺血性卒中患者的病情严重程度,其分值越高,往往意味着病变范围越大和(或)组织缺血缺氧越严重,静脉中脱氧血红蛋白的水平增加,导致局部磁敏感性改变,故SWI上患侧大脑半球的深部髓质静脉显影程度明显增加。而心房颤动是最常见的心源性卒中的病因。既往研究已证实,心源性栓子体积较大,常堵塞颅内外大血管,而且因为栓子掉落迅速,常常无法在短时间内形成侧支循环,造成大范围组织梗死 [ 13] 。这可以解释为什么合并心房颤动的急性缺血性卒中患者在SWI上更容易见到静脉毛刷征。本研究发现收缩压与毛刷征的AI分级独立负相关,笔者推测原因是:缺血性卒中患者收缩压的代偿性升高使侧支循环顺利地开放,故收缩压低可能反映侧支循环代偿差,静脉中更多的脱氧血红蛋白导致毛刷征更明显 [ 14] 。
静脉溶栓治疗急性缺血性卒中最危险和影响预后最大的并发症是溶栓后出血转化。本研究结果显示毛刷征的AI分级越高的缺血性卒中患者静脉溶栓后出血转化的比例越高。目前关于毛刷征引起静脉溶栓后出血转化病理生理机制仍没有定论,既往推测可能的机制包括:毛刷征出现常见于大动脉闭塞的急性缺血性卒中患者,大动脉闭塞导致脑部大面积缺血缺氧,水肿更为严重,溶栓后侧支血管开放,更容易发生出血 [ 15] 。另一方面,由血栓引起的缺血性卒中侧支循环未能充分建立,缺血再灌注后已发生血脑屏障损伤的血管会承受较大的血流冲击也是导致溶栓后出血转化的可能原因。Ohta等 [ 16] 对急性大脑中动脉闭塞溶栓治疗后进行血管造影发现,早期缺血区静脉异常充盈可能提示不可逆脑损伤,成为脑实质血肿形成的先兆。因此,在脑组织缺血早期,SWI上出现深部静脉血管的异常扩张和增粗可能预示溶栓后更大的出血转化风险。在本研究做再灌注亚组分析时还发现,静脉溶栓后未得到再灌注的患者中,AI分级越高,出血转化的比例越高。推测其机制可能是AI分级越高的患者有着更严重更大范围的缺血缺氧,容易导致出血转化。
作为单中心回顾性研究,本研究存在样本量偏少的缺陷,统计分析可能会产生偏差,为了进一步验证本文的结论,笔者将进一步扩大样本量进行深入研究。另外,由于本研究采取的是半定量评估分析研究方法,SWI上静脉信号的改变程度能否进一步量化分析也值得进一步探讨。
综上所述,SWI上毛刷征是溶栓后出血转化的独立危险因素。溶栓前基线SWI上患侧毛刷征的AI等级越高提示急性缺血性卒中患者静脉溶栓后发生出血转化风险越大,临床上尤其需要警惕那些静脉溶栓后未获得再灌注的患者。因此,评估基线SWI上毛刷征可为静脉溶栓前的临床决策提供更多参考信息。
志谢 本研究系国际卒中灌注影像登记(International Stroke Perfusion Imaging Registry,INSPIRE)合作项目,研究对象为INSPIRE项目的一部分病例,采用的MIStar软件同属于该项目,由澳大利亚Mark Parsons教授提供.
Funding Statement
国家自然科学基金(81171095, 81471170);浙江省重大科技专项计划(2013C03043-3);浙江省自然科学基金(LQ16H090003)
References
- 1.王 永亭, 曾 丽莉, 吕 海燕, et al. 缺血性卒中病因学与发病机制研究的十年进展. http://www.cnki.com.cn/Article/CJFDTOTAL-XDJB201001006.htm 中国现代神经疾病杂志. 2010;2(10):22–27. [Google Scholar]
- 2.HACKE W, KASTE M, BLUHMKI E, et al. Thrombolysis with alteplase 3 to 4. N Engl J Med. 2008;359(13):1317–1329. doi: 10.1056/NEJMoa0804656. [DOI] [PubMed] [Google Scholar]
- 3.The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med. 1995;333(24):1581–1587. doi: 10.1056/NEJM199512143332401. [DOI] [PubMed] [Google Scholar]
- 4.SANTHOSH K, KESAVADAS C, THOMAS B, et al. Susceptibility weighted imaging: a new tool in magnetic resonance imaging of stroke. Clin Radiol. 2009;64(1):74–83. doi: 10.1016/j.crad.2008.04.022. [DOI] [PubMed] [Google Scholar]
- 5.MORITA N, HARADA M, UNO M, et al. Ischemic findings of T2 *-weighted 3-tesla MRI in acute stroke patients . Cerebrovasc Dis. 2008;26(4):367–375. doi: 10.1159/000151640. [DOI] [PubMed] [Google Scholar]
- 6.HORIE N, MORIKAWA M, NOZAKI A, et al. "Brush Sign" on susceptibility-weighted MR imaging indicates the severity of moyamoya disease. AJNR Am J Neuroradiol. 2011;32(9):1697–1702. doi: 10.3174/ajnr.A2568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.林 悦涵, 楼 敏, 朱 仁洋, et al. 多模式MRI指导缺血性卒中静脉溶栓降低出血转化的研究. http://www.cnki.com.cn/Article/CJFDTOTAL-ZJYB201206012.htm. 浙江大学学报(医学版) 2012;41(6):665–671. doi: 10.3785/j.issn.1008-9292.2012.06.010. [DOI] [PubMed] [Google Scholar]
- 8.LOU M, CHEN Z, WAN J, et al. Susceptiblity-diffusion mismatch predicts thrombolytic outcomes: a retrospective cohort study. AJNR Am J Neuroradiol. 35(11):2061–2067. doi: 10.3174/ajnr.A4017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.MITEFF F, LEVI C R, BATEMAN G A, et al. The independent predictive utility of computed tomography angiographic collateral status in acute ischaemic stroke. Brain. 2009;132(Pt 8):2231–2238. doi: 10.1093/brain/awp155. [DOI] [PubMed] [Google Scholar]
- 10.ROSSO C, BELLEVILLE M, PIRES C, et al. Clinical usefulness of the visibility of the transcerebral veins at 3T on T2 *-weighted sequence in acute stroke patients . Eur J Radiol. 2012;81(6):1282–1287. doi: 10.1016/j.ejrad.2011.03.025. [DOI] [PubMed] [Google Scholar]
- 11.中华医学会神经病学会脑血管病学组急性缺血性脑卒中诊治指南撰写组 中国急性缺血性脑卒中诊治指南2010. http://www.cnki.com.cn/Article/CJFDTOTAL-ZJSA201603029.htm 中华神经科杂志. 2010;43(2):146–152. [Google Scholar]
- 12.LARRUE V, VON KUMMER R R, MVLLER A, et al. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator:a secondary analysis of the European-Australasian Acute Stroke Study(ECASS II) Stroke. 2001;32(2):438–441. doi: 10.1161/01.STR.32.2.438. [DOI] [PubMed] [Google Scholar]
- 13.KIMURA K, IGUSHI Y, YAMASHITA S, et al. Atrial fibrillation as an independent predictor for no early recanaliztion after IV-t-PA in acute ischemic stroke. J Neurol Sci. 2008;267(1-2):57–61. doi: 10.1016/j.jns.2007.09.036. [DOI] [PubMed] [Google Scholar]
- 14.RUSANEN H, SAARINEN J T, SILLANPAA N. The association of blood pressure and collateral circulation in hyperacute ischemic stroke patients treated with intravenous thrombolysis. Cerebrovasc Dis. 2015;39(2):130–137. doi: 10.1159/000371339. [DOI] [PubMed] [Google Scholar]
- 15.DEREX L, HEMIER M, ADELEINE P, et al. Clinical and imaging predictors of intracerebral hemorrhage in stroke patients treated with intravenous tissue plasminogen activator. J Neurol Neurosurg Psychiatry. 2005;76(1):70–75. doi: 10.1136/jnnp.2004.038158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.OTHA H, NAKNO S, YOKOGAMI K, et al. Appearance of early venous filling during intra-arterial reperfusion therapy for acute middle cerebral artery occlusion: a predictive sign for hemorrhagic complications. Stroke. 2004;35(4):893–898. doi: 10.1161/01.STR.0000119751.92640.7F. [DOI] [PubMed] [Google Scholar]