Abstract
目的
本研究旨在发现黄葵胶囊肾保护活性物质。
方法
采用组分制备结合液相色谱—质谱联用(LC/MS)导向筛选技术,快速发现黄葵胶囊中具有肾保护活性的物质,在盐酸阿霉素损伤HK-2细胞模型上验证其活性,并检测这些活性物质对损伤HK-2细胞中丙二醛(MDA)含量、ATP含量、线粒体耗氧率的影响。
结果
筛选发现黄葵胶囊中四个组分具有肾保护活性,运用LC/MS分析推测出15个黄酮类化合物,其中鉴定出金丝桃苷、杨梅素、槲皮素、芦丁和异槲皮素五个化合物。验证结果表明,金丝桃苷、杨梅素、槲皮素、芦丁对损伤HK-2细胞的保护作用呈一定的量效关系,均能降低损伤细胞MDA含量、升高ATP含量、提高线粒体耗氧率,其中金丝桃苷能降低MDA含量,槲皮素和芦丁能升高ATP含量,杨梅素能提高线粒体耗氧率。
结论
金丝桃苷、杨梅素、槲皮素、芦丁可能是黄葵胶囊中潜在的肾保护活性物质,其保护作用可能与抗脂质过氧化、减轻线粒体损伤有关。
Abstract
Objective
To discover the nephroprotective substances from Huangkui capsule.
Methods
The components of Huangkui capsule were isolated by preparative liquid chromatography, and the active components were screened by LC/MS and identified. The adriamycine-injured HK-2 cells were treated with various active components with different concentrations, and the malonaldehyde (MDA) content, adenosine triphosphate (ATP) level and mitochondrial oxygen consumption rate were measured to verify the protective activity of the compounds.
Results
Four active components in Huangkui capsule were identified to exert nephroprotective effects. Fifteen flavanoids from these four components were tentatively identified by LC/MS, and hyperin, myricetin, quercetin, rutin and isoquercetin were confirmed. Hyperin, myricetin quercetin and rutin showed dose-dependent protective effects on injured HK-2 cells. Espacially, hyperin significantly reduced MDA content, quercetin and rutin significantly increased ATP level, and myricetin significantly increased mitochondrial oxygen consumption rate.
Conclusion
Hyperin, myricetin, querctein and rutin might be the potential nephroprotective compounds in Huangkui capsule, their effects may be related to the inhibition of lipid peroxidation and the alleviation of mitochondrial damage.
Keywords: Abelmoschus/drug effects; Capsules; Epithelial cells/cytology; Kidney tubules, proxima/cytology; Kidney/injuries; Mass spectrometry; Chromatography, liquid; Disease models, animal
黄蜀葵花为锦葵科植物黄蜀葵的干燥花冠,归肾、膀胱经,具有清利湿热、消肿解毒之功效。黄葵胶囊是黄蜀葵花经提取制成的胶囊剂,常用于治疗多种慢性肾病,如IgA肾病、糖尿病肾病等 [ 1- 2] 。研究表明,黄葵胶囊对阿霉素引起的肾损伤具有干预效果 [ 3] ,但确切的肾保护活性物质仍不清楚。本研究采用盐酸阿霉素损伤HK-2细胞模型,结合组分制备和液相色谱—质谱 (liquid chromatography/mass spectrometer, LC/MS) 联用导向技术,对黄葵胶囊的肾保护活性物质进行筛选和分析,并初步探讨其作用机制。
1 材料与方法
1.1 主要仪器、试剂和药物
Tecan Infinite F200型多功能酶标仪 (瑞士Tecan公司);二氧化碳细胞培养箱、Thermo Scientific 1300系列二级A 2型生物安全柜 (美国Thermo Fisher Scientific公司);DMI 6000B倒置显微镜 (德国Leica公司);Agilent 1100型高效液相色谱仪 (美国Agilent公司),配四元梯度泵、UV检测器、Agilent化学工作站;Agilent 1200型制备液相色谱仪 (美国Agilent公司),配G-1361A制备型二元泵、G1365D型二极管阵列检测器;LCQ Deca XP plus离子阱质谱检测器 (美国Finnigan公司);UPLC-Triple TOF 5600 +液质联用高分辨质谱仪 (美国AB公司);Oxytherm液相氧电极 (英国Hansatech公司),Rotavapor R-200旋转蒸发仪 (瑞士Buchi公司)。甲醇、乙腈 (色谱纯,德国Merck公司);甲酸 (色谱纯,德国ROC公司);DMSO (北京百灵威科技有限公司);DMEM/F12基础培养基、消化液 (美国Corning公司);FBS (美国Sigma公司);CellTiter-Glo ® Luminescent Cell Viability Assay试剂盒 (美国Promega公司);蛋白质印迹及IP细胞裂解液、丙二醛 (MDA) 检测试剂盒 (上海碧云天生物技术研究所);BCA蛋白浓度测定试剂盒 (美国Thermo Fisher Scientific公司)。盐酸阿霉素 (中国食品药品检定研究院);芦丁、槲皮素、杨梅素、金丝桃苷、异槲皮素 (上海融禾医药科技发展有限公司);黄葵胶囊及其干浸膏混合物 (江苏苏中药业集团股份有限公司)。人近端肾小管上皮细胞系 (HK-2) 由中国科学院上海生科院细胞资源中心提供。
1.2 黄葵胶囊化学组分的制备
采用制备液相对多个批次的黄葵干浸膏混合物 (总组分) 进行分离,色谱条件:Agilent ZORBAX SB-C 18液相色谱柱 (21.2 mm×250 mm,7 μm),流速:17 mL/min;流动相:0.05%甲酸水溶液 (A)-乙腈 (B);洗脱梯度:0~20.0 min (10%→13% B),20.0~40.0 min (13% B),40.0~55.0 min (13%→25% B),55.0~75.0 min (25%→65% B)。收集保留时间为0~10.5 min,>10.5~21.0 min,>21.0~31.0 min,>31.0~44.0 min,>44.0~58.0 min及58.0~75.0 min六个时间段流出液,浓缩得到黄葵胶囊的六个干浸膏组分,分别标记为1、2、3、4、5、6组分。
1.3 MTT法检测黄葵胶囊总组分及六个组分对盐酸阿霉素损伤细胞存活率的影响
取对数生长期的HK-2细胞以5000个/孔接种于96孔板,培养24 h后更换培养液,加入50 mg/L的含待筛选组分混合物孵育15 min后加入5 μmol/L的盐酸阿霉素,孵育24 h后吸去培养液,再加入0.5 mg/mL的MTT溶液,37 ℃振摇5 min,580 nm处测定吸光度值。实验另设溶剂对照组 (含0.1% DMSO)、模型对照组 (含5 μmol/L盐酸阿霉素) 和阳性对照组 (含5 μmol/L盐酸阿霉素和100 μmol/L异槲皮素)。细胞存活率计算公式:细胞存活率 (%)=样品组/溶剂对照组×100%。
1.4 采用LC/MS技术分析黄葵胶囊四个组分的活性成分
采用LC/MS技术对四个组分进行分析鉴定。色谱柱为Agilent ZORBAX SB-C 18液相色谱柱 (4.6 mm×250 mm,5 μm);柱温:35 ℃;流动相:0.05%甲酸水溶液 (A)-乙腈 (B);流速:0.8 mL/min;洗脱梯度0~20.0 min (12%→15% B),20.0~40.0 min (15% B),40.0~55.0 min (15%→27% B),55.0~75.0 min (27%→67% B),75.0~76.0 min (67%→100% B),76.0~80.0 min (100% B)。
1.5 倒置显微镜观察各组细胞形态学变化
取对数生长期的HK-2细胞以3×10 5/孔接种于35 mm细胞培养皿中,培养24 h后更换培养液,分别加入100 μmol/L黄葵胶囊活性成分的培养液,15 min后加入5 μmol/L盐酸阿霉素。另设溶剂对照组 (含0.1% DMSO)、模型对照组 (含5 μmol/L盐酸阿霉素)、阳性对照组 (含5 μmol/L盐酸阿霉素和100 μmol/L异槲皮素)。24 h后在显微镜下观察细胞形态。
1.6 MTT法检测黄葵胶囊活性成分对盐酸阿霉素损伤细胞存活率的影响
取对数生长期HK-2细胞以5000个/孔接种于96孔板,培养24 h后更换培养液,分别加入10、25、50、100 μmol/L不同质量浓度待测化合物,15 min后加入5 μmol/L盐酸阿霉素。另设溶剂对照组 (含0.1% DMSO) 和模型对照组 (含5 μmol/L盐酸阿霉素),24 h后用MTT法检测细胞存活率,方法同1.3。
1.7 硫代巴比妥酸法测定MDA含量
取对数生长期的HK-2细胞以3×10 5/孔接种于35 mm细胞培养皿中,培养24 h后更换培养液,分别加入含100 μmol/L黄葵胶囊活性成分的培养液,15 min后加入5 μmol/L盐酸阿霉素。另设溶剂对照组 (含0.1% DMSO)、模型对照组 (含5 μmol/L盐酸阿霉素) 和阳性对照组 (含5 μmol/L盐酸阿霉素和100 μmol/L异槲皮素),24 h后提取细胞匀浆液,采用二喹啉甲酸 (BCA) 法测定蛋白质浓度,硫代巴比妥酸法测定MDA含量,计算单位重量蛋白质内MDA含量。
1.8 化学发光法测定ATP含量
取对数生长期的HK-2细胞以5000个/孔接种于96孔全白板中,培养24 h后更换培养液,分别加入100 μmol/L黄葵胶囊活性成分的培养液,15 min后加入5 μmol/L盐酸阿霉素。另设溶剂对照组 (含0.1% DMSO)、模型对照组 (含5 μmol/L盐酸阿霉素) 和阳性对照组 (含5 μmol/L盐酸阿霉素和100 μmol/L异槲皮素)。孵育24 h后,每孔分别加入12.5 μL CellTiter-Glo试剂,37 ℃避光振摇10 min,用酶标仪检测化学发光强度。ATP相对含量计算公式:ATP相对含量 (%)=样品组化学发光强度/溶剂对照组化学发光强度×100%。
1.9 液相氧电极测定各组线粒体耗氧率
取对数生长期的HK-2细胞以2.5×10 5/孔接种于100 mm细胞培养皿中,培养24 h后更换培养液,分别加入含100 μmol/L黄葵胶囊活性成分的培养液,15 min后加入5 μmol/L盐酸阿霉素。另设溶剂对照组 (含0.1% DMSO)、模型对照组 (含5 μmol/L盐酸阿霉素) 和阳性对照组 (含5 μmol/L盐酸阿霉素和100 μmol/L异槲皮素),24 h后消化收集细胞,重悬于37 ℃的培养液,配成1×10 6个/mL细胞悬液。取2 mL细胞悬液,用液相氧电极测定线粒体耗氧率。
1.10 统计学方法
所有实验重复进行三次。采用GraphPad Prism 5数据处理软件进行统计分析。所有数据均用均数±标准差 ( x ± s) 表示,多组样本均数之间差异采用单因素方差分析, P < 0.05表示差异有统计学意义。
2 结果
2.1 黄葵胶囊六个组分对HK-2细胞的保护作用
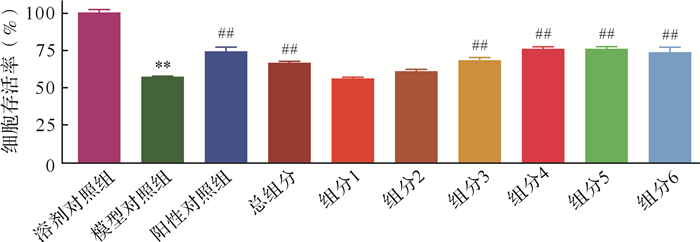
加入黄葵胶囊总组分和组分3、4、5、6后,HK-2细胞存活率均比模型对照组提高,见 图 1。提示黄葵胶囊总组分和组分3、4、5、6均能预防细胞毒性损伤。
2.2 黄葵胶囊活性成分分析
黄葵胶囊四个组分及对照品的高效液相色谱—二极管阵列检测器 (HPLC-PDA) 色谱图见 图 2。通过与对照品的保留时间、紫外吸收和质谱信息进行比对,鉴定出峰8、9、10、13、15分别为芦丁、金丝桃苷、异槲皮素、杨梅素和槲皮素。峰1~7、11、12、14由于缺乏对照品,通过多级质谱数据及精确分子质量进行推测。峰1在负离子模式下的准分子离子峰为 m/z 495,子离子峰为 m/z 333,由精确分子质量推测可能的分子式为C 21H 20O 14,根据二级质谱信息结合文献[ 4]推测,该化合物的苷元为木槿素,其侧链含有一个六碳糖,推测峰1为Floramanoside B [ 5- 6] 。同理推测,峰2~7分别为杨梅素-3- O-芸香糖苷 [ 7] 、杨梅素-3- O- β- D-半乳糖苷 [ 4] 、杨梅素-3- O- β- D-葡萄糖苷 [ 4] 、槲皮素-3- O- β- D-木糖基 (1→2)- O- β- D-半乳糖苷 [ 8- 9] 、Floramanoside C [ 6] 、槲皮素-3- O-刺槐糖苷 [ 9- 10] ;峰11推测为杨梅素-3′- O- β- D-葡萄糖苷 [ 4, 11] ;峰12为棉皮素-8- O-β- D-葡萄糖醛酸 [ 11] ;峰14推测为槲皮素-3′- O-葡萄糖苷 [ 12- 13] ,具体结果见 表 1。
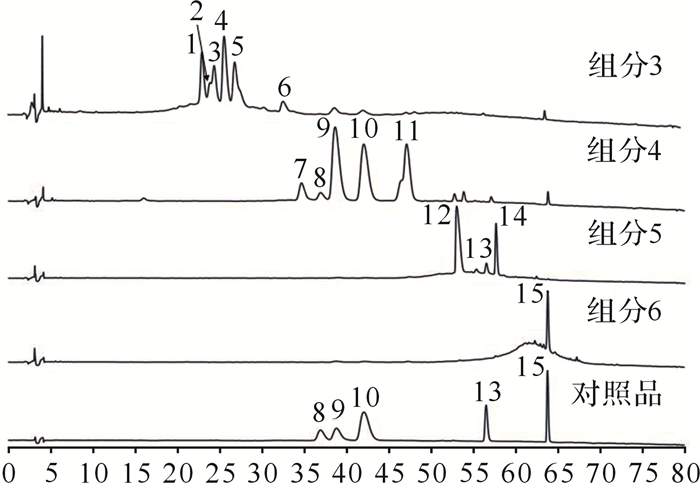
表1 组分3~6中化合物的色谱和质谱信息
|
活性成分编号 |
转速 ( t R/min) |
化合物 |
[M-H] -峰 ( m/z) |
HPLC-ESI-MS/MS检测 ( m/z) |
|
1 |
23.1 |
Floramanoside B |
495 |
333[M-H-Glc] - |
|
2 |
24.3 |
杨梅素-3- O-芸香糖苷 |
625 |
317 [M-H-Rha-Glc] - 316 [M-2H-Rha-Glc] - |
|
3 |
24.7 |
杨梅素-3- O-β-D-半乳糖苷 |
479 |
317[M-H-Gal] - 316 [M-2H-Gal] - |
|
4 |
25.8 |
杨梅素-3- O-β-D-葡萄糖苷 |
479 |
317[M-H-Glc] - 316 [M-2H-Glc] - |
|
5 |
27.1 |
槲皮素-3- O-β-D-木糖基 |
595 |
463 [M-H-Gal] - 301 [M-H-Xyl-Gal] - |
|
(1→2)- O-β-D-半乳糖苷 |
300 [M-2H-Xyl-Gal] - |
|||
|
6 |
32.8 |
Floramanoside C |
509 |
333[M-H-GluA] - |
|
7 |
34.7 |
槲皮素-3- O-刺槐糖苷 |
609 |
463 [M-H-Rha] - 301[M-H-Rha-Gal] - |
|
8 * |
36.4 |
芦丁 |
609 |
463 [M-H-Rha] - 301[M-H-Rha-Glc] - |
|
9 * |
38.9 |
金丝桃苷 |
463 |
301[M-H-Gal] - |
|
10 * |
42.9 |
异槲皮素 |
463 |
301[M-H-Glc] - |
|
11 |
46.5 |
杨梅素-3′- O-β-D-葡萄糖苷 |
479 |
317[M-H-Glc] - |
|
12 |
53.6 |
棉皮素-8- O-β-D-葡萄糖醛酸 |
493 |
317[M-H-GluA] - |
|
13 * |
56.5 |
杨梅素 |
317 |
317[M-H] - 299[M-H-H 2O] - |
|
14 |
57.7 |
槲皮素-3′- O-葡萄糖苷 |
463 |
301 [M-H-Glc] - |
|
15 * |
63.9 |
槲皮素 |
301 |
179[M-H-C 7H 6O 2] - 151[M-H-C 8H 6O 3] - |
*与对照品比对,已确定的化合物;HPLC-ESI-MS/MS:高效液相色谱—电喷雾电离质谱.
2.3 黄葵胶囊活性成分对盐酸阿霉素损伤HK-2细胞形态的影响
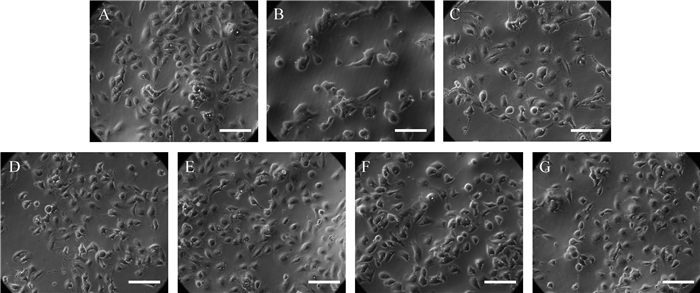
溶剂对照组HK-2细胞生长良好,呈卵圆形或短梭形,体积较大,形成“铺路石”样贴壁生长;模型对照组细胞失去原有形态,呈多种不规则形状,细胞数量减少, 见 图 3。与模型对照组比较,100 μmol/L的金丝桃苷、杨梅素、槲皮素、芦丁预保护后,细胞形态改善,细胞数量增加,提示黄葵胶囊活性成分能改善损伤HK-2细胞的形态。
2.4 黄葵胶囊活性成分对盐酸阿霉素损伤HK-2细胞的保护作用
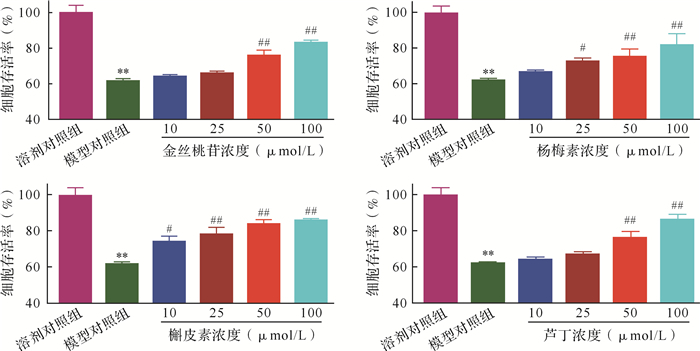
四个化合物对盐酸阿霉素损伤后的HK-2细胞均有保护作用,且在10~100 μmol/L浓度范围内呈一定的量效关系,见 图 4。与模型对照组比较,100 μmol/L的金丝桃苷、杨梅素、槲皮素、芦丁分别使细胞存活率提高了21.00%、19.80%、24.25%、24.41%,提示这四个化合物均能提高损伤HK-2细胞的活性。
2.5 黄葵胶囊活性成分对盐酸阿霉素损伤HK-2细胞MDA含量的影响
盐酸阿霉素损伤后,HK-2细胞内MDA含量增加 ( P<0.01);与模型对照组比较,100 μmol/L的金丝桃苷、杨梅素、槲皮素、芦丁均能降低损伤HK-2细胞内MDA含量,金丝桃苷组与模型对照组的MDA含量差异有统计学意义 ( P<0.05),见 表 2。提示金丝桃苷抗脂质过氧化作用最明显。
表2 金丝桃苷、杨梅素、槲皮素及芦丁对盐酸阿霉素损伤HK-2细胞MDA含量、ATP相对含量和线粒体耗氧率的影响
|
( n=3, x ± s) | |||
|
组别 |
MDA含量(nmol/mg) |
ATP相对含量(%) |
线粒体耗氧率 Δ |
|
溶剂对照组 |
5.09±1.25 |
100.00±9.86 |
3.08±0.30 |
|
模型对照组 |
11.52±4.79 ** |
50.63±7.32 ** |
1.57±0.26 ** |
|
阳性对照组 |
7.55±1.79 |
85.33±12.67 ## |
2.57±0.53 # |
|
金丝桃苷组 |
5.67±0.46 # |
73.72±0.16 |
2.37±0.46 |
|
杨梅素组 |
7.89±1.33 |
74.32±9.77 |
2.67±0.44 # |
|
槲皮素组 |
7.14±1.08 |
87.61±13.83 ## |
2.23±0.32 |
|
芦丁组 |
6.52±0.80 |
88.29±10.99 ## |
2.26±0.35 |
MDA:丙二醛.与溶剂对照组比较, ** P < 0.01;与模型对照组比较, # P < 0.05, ## P < 0.01. Δ单位:nmol·min -1·10 6 cells -1.
2.6 黄葵胶囊活性成分对盐酸阿霉素损伤HK-2细胞ATP含量的影响
盐酸阿霉素损伤后,细胞ATP含量减少 ( P<0.01);与模型对照组比较,100 μmol/L的金丝桃苷、杨梅素、槲皮素、芦丁均增加了损伤HK-2细胞内ATP含量,其中槲皮素和芦丁组与模型对照组ATP含量差异有统计学意义 (均 P<0.01),见 表 2。提示槲皮素和芦丁能促进损伤HK-2细胞ATP的合成。
2.7 黄葵胶囊活性成分对盐酸阿霉素损伤HK-2细胞线粒体耗氧率的影响
盐酸阿霉素损伤后,HK-2细胞线粒体耗氧率降低 ( P<0.01);与模型对照组比较,100 μmol/L的金丝桃苷、杨梅素、槲皮素、芦丁均提高了损伤HK-2细胞线粒体耗氧率,其中杨梅素组与模型对照组差异有统计学意义 ( P<0.05),见 表 2。提示杨梅素能改善损伤HK-2细胞线粒体功能。
3 讨论
本研究采用组分制备结合LC/MS技术导向分析,筛选黄葵胶囊的肾保护活性物质, 发现金丝桃苷、杨梅素、槲皮素、芦丁是黄葵胶囊中潜在的肾保护活性物质。相较于传统的中药提取分离技术,LC/MS技术集高效液相色谱法高效的分离能力和质谱法优越的定性能力于一体,具有专属性好、灵敏度高、结构解析能力强、分析速度快等优势 [ 14] 。本研究采用LC/MS技术分析四个活性组分的主要化学物质组成,鉴定和推测出芦丁、金丝桃苷、异槲皮素、杨梅素、槲皮素、槲皮素-3′- O-葡萄糖苷和棉皮素-8- O-β-D-葡萄糖醛酸等15个化合物,均为黄酮醇及其苷类,其中七个化合物为槲皮素及其苷类,五个化合物为杨梅素及其苷类。从化学结构上看,这类成分主要是以槲皮素或杨梅素为母核的黄酮醇类化合物,故推测母核为槲皮素或杨梅素的黄酮醇类成分可能具有肾保护活性。此外,已有文献报道对黄葵胶囊中芦丁、金丝桃苷、异槲皮苷、杨梅素、槲皮素这五个化合物进行含量测定,结果显示芦丁、金丝桃苷、异槲皮苷、杨梅素、槲皮素分别约占0.88、3.92、2.75、0.82、0.23 mg/g,且不同批次间一致性较好 [ 15] 。本研究选择金丝桃苷、杨梅素、槲皮素和芦丁进行肾保护活性验证,因文献报道异槲皮素对盐酸阿霉素损伤HK-2细胞有明显的保护作用 [ 16] ,故本研究将其作为阳性对照药物。研究结果显示,金丝桃苷、杨梅素,槲皮素和芦丁均可改善由盐酸阿霉素引起的HK-2细胞损伤。研究表明,槲皮素能通过减少过氧化物和炎症介质聚集减轻大鼠肾细胞损害 [ 17] ;金丝桃苷能通过抑制NF-κB炎症信号通路,保护内毒素所致的小鼠急性肾损伤 [ 18] ;芦丁能通过调节血糖、血脂、清除自由基等减少糖尿病大鼠肾组织病变 [ 19] ;杨梅素可以通过激活谷胱甘肽过氧化物酶及黄嘌呤氧化酶活性抵抗糖尿病大鼠肾损伤 [ 20] ,上述研究从不同的角度证明了筛选结果的准确性。
此外,本研究测定了金丝桃苷、杨梅素、槲皮素和芦丁这四个化合物对损伤HK-2细胞MDA含量、ATP相对含量及线粒体耗氧率的影响,提示黄葵胶囊的肾保护作用可能与抗脂质过氧化、减轻线粒体损伤有关。MDA是脂质过氧化反应的重要产物,其含量是氧自由基引起细胞膜损伤的一个重要指标。盐酸阿霉素损伤细胞后会引起氧自由基堆积,氧自由基与细胞膜脂质发生脂质过氧化反应,产生大量脂质过氧化产物,引起细胞膜损伤。金丝桃苷能通过降低损伤HK-2细胞内MDA含量来起到保护作用。ATP是细胞生命活动的直接能量来源,主要通过线粒体有氧呼吸产生,而盐酸阿霉素进入细胞后会破坏线粒体的结构和功能,使细胞内ATP无法正常合成。本研究发现,槲皮素、芦丁均能提高损伤HK-2细胞ATP相对含量,杨梅素通过提高线粒体耗氧率,从而发挥对细胞的保护作用,提示这些化合物的肾保护作用可能与减轻线粒体损伤有关。
综上所述,本研究采用组分制备结合LC/MS导向技术,筛选发现金丝桃苷、杨梅素、槲皮素、芦丁是黄葵胶囊潜在的肾保护活性物质,且其保护作用可能与抗脂质过氧化、减轻线粒体损伤有关。
Funding Statement
浙江中医药大学科技创新团队项目(JCIT2016-1)
References
- 1.蒋 易容, 张 紫媛, 文 集, et al. 黄葵胶囊治疗IgA肾病疗效和安全性的系统评价. 中国循证医学杂志. 2012;12(9):1135–1140. doi: 10.7507/1672-2531.20120177. [DOI] [Google Scholar]
- 2.MAO Z M, SHEN S M, WAN Y G, et al. Huangkui capsule attenuates renal fibrosis in diabetic nephropathy rats through regulating oxidative stress and p38MAPK/Akt pathways, compared to α-lipoic acid. J Ethnopharmacol. 2015;173:256–265. doi: 10.1016/j.jep.2015.07.036. [DOI] [PubMed] [Google Scholar]
- 3.赵 青, 万 毅刚, 孙 伟, et al. 黄葵胶囊对阿霉素肾病肾组织炎症信号通路p38MAPK的干预作用. 中国中药杂志. 2012;37(19):2926–2934. [PubMed] [Google Scholar]
- 4.池 玉梅, 朱 华云, 居 羚, et al. 高效液相-四极杆飞行时间串联质谱分析黄蜀葵花中黄酮醇类化合物. 分析化学. 2009;37(2):227–231. [Google Scholar]
- 5.张 元媛, 贾 晓妮, 曹 永翔, et al. 黄蜀葵花化学成分研究. 西北药学杂志. 2008;23(2):80–82. [Google Scholar]
- 6.ZHANG Y, HE W, LI C, et al. Antioxidative flavonol glycosides from the flowers of Abelmouschus manihot. J Nat Med. 2013;67(1):78–85. doi: 10.1007/s11418-012-0651-1. [DOI] [PubMed] [Google Scholar]
- 7.李 春梅, 王 涛, 张 祎, et al. 中药黄蜀葵花化学成分的分离与鉴定 (Ⅱ) 沈阳药科大学学报. 2011;27(7):803–807. [Google Scholar]
- 8.ABLAJAN K, ABLIZ Z, SHANG X Y, et al. Structural characterization of flavonol 3, 7-di-O-glycosides and determination of the glycosylation position by using negative ion electrospray ionization tandem mass spectrometry. J Mass Spectrom. 2006;41(3):352–360. doi: 10.1002/(ISSN)1096-9888. [DOI] [PubMed] [Google Scholar]
- 9.温 锐, 谢 国勇, 李 旭森, et al. 黄蜀葵化学成分与药理活性研究进展. 中国野生植物资源. 2015;34(2):37–44. [Google Scholar]
- 10.NAM T G, LEE S M, PARK J H, et al. Flavonoid analysis of buckwheat sprouts. Food Chem. 2015;170:97–101. doi: 10.1016/j.foodchem.2014.08.067. [DOI] [PubMed] [Google Scholar]
- 11.HILBERT G, TEMSAMANI H, BORDENAVE L, et al. Flavonol profiles in berries of wild Vitis accessions using liquid chromatography coupled to mass spectrometry and nuclear magnetic resonance spectrometry. Food Chem. 2015;169:49–58. doi: 10.1016/j.foodchem.2014.07.079. [DOI] [PubMed] [Google Scholar]
- 12.LAI X, LIANG H, ZHAO Y, et al. Simultaneous determination of seven active flavonols in the flowers of Abelmoschus manihot by HPLC. J Chromatogr Sci. 2009;47(3):206–210. doi: 10.1093/chromsci/47.3.206. [DOI] [PubMed] [Google Scholar]
- 13.GUO J, XUE C, DUAN J A, et al. Anticonvulsant, antidepressant-like activity of Abelmoschus manihot ethanol extract and its potential active components in vivo. Phytomedicine. 2011;18(14):1250–1254. doi: 10.1016/j.phymed.2011.06.012. [DOI] [PubMed] [Google Scholar]
- 14.陈 晓雨, 李 银峰, 林 秀云, et al. LC-MS技术在化学药杂质分析中的研究进展. 现代药物与临床. 2014;29(6):696–700. [Google Scholar]
- 15.刘 霖, 唐 海涛, 刘 汉清, et al. 黄葵胶囊中5种黄酮类成分的含量测定及其特征图谱研究. 中药材. 2013;36(1):132–136. [Google Scholar]
- 16.兰 小红, 肖 舜, 龚 婉, et al. 基于三色荧光探针的红花肾保护活性物质筛选研究. 中国中药杂志. 2014;39(10):1880–1885. [PubMed] [Google Scholar]
- 17.王 蓝天, 王 天然. 槲皮素对慢性肾衰大鼠肾脏细胞的保护作用研究. 西南国防医药. 2014;24(2):144–146. [Google Scholar]
- 18.白 鑫宇, 杨 晓峰, 赵 叶利, et al. 金丝桃苷对内毒素 (LPS) 诱导的小鼠急性肾损伤的保护作用. 沈阳药科大学学报. 2014;30(10):799–803. [Google Scholar]
- 19.苗 建红, 白 静, 李 建成, et al. 芦丁对糖尿病肾病大鼠肾功能及肾组织病理变化的影响. 中国实验方剂学杂志. 2015;21(13):122–125. [Google Scholar]
- 20.OZCAN F, OZMEN A, AKKAYA B, et al. Beneficial effect of myricetin on renal functions in streptozotocin-induced diabetes. Clin Exp Med. 2012;12(4):265–272. doi: 10.1007/s10238-011-0167-0. [DOI] [PubMed] [Google Scholar]


