Abstract
目的
评估动态增强磁共振成像(DCE-MRI)参照物模型定量参数与乳腺浸润性导管癌患者预后相关因素和乳腺癌分子病理分型之间的相关性。
方法
回顾性分析50例经病理学检查证实的浸润性导管癌患者的MRI和病理学检查资料,运用DCE-MRI参照物模型测量药代动力学定量参数,包括病灶相对肌肉的容量转运常数(RR K trans)、病灶的速率常数(K ep)、病灶的容量转运常数与肌肉的血管外细胞外间隙容积比值(K trans/V e),分析上述定量参数与乳腺癌患者预后相关因素和乳腺癌分子病理分型之间的相关性。
结果
组织学分级为3级的病灶的平均RR K trans和K ep值高于组织分级为1~2级的病灶(均 P < 0.05);雌激素受体(ER)阴性者和孕激素受体(PR)阴性者的平均RR K trans值和K ep值分别高于ER阳性者和PR阳性者(均 P < 0.05)。三阴性乳腺癌患者的RR K trans和K ep高于Luminal型乳腺癌患者(均 P < 0.05)。
结论
DCE-MRI参照物模型所得定量参数RR K trans和K ep有助于预测乳腺癌的预后和鉴别乳腺癌的分子病理分型。
Abstract
Objective
To investigate the association of parameters in dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) using reference region model with prognostic factors and molecular subtypes of breast cancer.
Methods
MRI and pathological data of 50 patients with pathologically confirmed invasive ductal carcinoma of the breast were retrospectively analyzed. Reference region model was applied to analyze pharmacokinetic quantitative parameters including volume transfer constant (RR K trans), rate constant (K ep) and the ratio of K trans to extracellular space volume (K trans/V e). The associations of the above parameters with prognostic factors and molecular subtypes of breast cancer were analyzed.
Results
RR K trans and K ep were significantly higher in patients of histological grade 3 compared with those of histological grade 1 & 2 (all P < 0.05); and the patients with estrogen receptor (ER)-negative and/or progesterone receptor (PR)-negative also had higher RR K trans and K ep than those with ER-positive or PR-positive (all P < 0.05). For immunohistochemistry, RR K trans and K ep were significantly higher in triple negative breast cancer compared with luminal type breast cancer (all P < 0.05).
Conclusion
High RR K trans and K ep are associated with poor prognosis of breast cancer, and which can also be used to distinguish molecular subtypes of breast cancer.
Keywords: Breast neoplasms/diagnosis; Magnetic resonance imaging/methods; Gadolinium/diagnostic use; Hemodynamics; Prognosis; Models, biological; Retrospective studies
乳腺癌是一种异质性肿瘤,准确预测乳腺癌的预后对选择合适的治疗方式至关重要。传统的预后因素如肿瘤大小、组织学分型和分级、腋窝淋巴结转移以及免疫组织化学检测指标如雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮增长因子受体(human epidermal growth factor receptor 2,HER2)等需要通过穿刺活检或手术等有创方式获得。动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)定量分析是近年来应用于肿瘤影像学诊断中的一种功能性MRI,目前国内外学者开始尝试将这种新方法应用于乳腺癌的诊断、鉴别诊断,以及对乳腺癌新辅助化疗疗效的评估等 [ 1- 2] 。国内外有文献报道,DCE-MRI药代动力学定量参数与乳腺癌的部分预后因素具有相关性 [ 3- 5] 。在分析药代动力学定量参数时,大多数学者选用的是经典的双室模型 [ 6] ,但该模型对数据采集的时间和空间分辨率要求较高。有学者认为,药代动力学参照物模型的应用可以降低对磁共振扫描仪的要求 [ 7] 。在本研究中,我们通过回顾性分析50例乳腺浸润性导管癌患者的DCE-MRI资料,利用DCE-MRI的参照物模型测量药代动力学定量参数,探讨不同预后因素及病理学分型之间各定量参数的差异,为DCE-MRI的参照物模型应用于预测乳腺癌患者预后积累资料。
连续收集2014年7月至2016年12月宁波市第二医院的乳腺浸润性导管癌患者。纳入标准:①组织病理学检查证实为乳腺浸润性导管癌;②治疗前行DCE-MRI检查;③DCE-MRI检查前未行化疗、放疗及其他抗肿瘤治疗。排除标准:①有MRI检查禁忌证或患者无法配合完成MRI检查;②影像质量不佳,不能满足临床诊断需要;③对磁共振对比剂过敏。
共50例患者纳入本研究,均为女性,年龄32~74岁,平均年龄为(52±11)岁。本研究经医院伦理委员会批准,检查前患者均签署知情同意书。
MRI扫描采用德国Siemens avanto 1.5T磁共振扫描仪,乳房相控线圈。对比剂采用爱尔兰GE Healthcare公司生产的钆双胺注射液(欧乃影)。采用DCE-MRI血流动力学定量分析软件Omni Kinetics(美国GE Healthcare公司)测量药代动力学定量参数。
患者采用头先进、俯卧位,双侧乳房自然悬垂于线圈空洞中心。常规三平面定位扫描后,采用快速自旋回波序列行T 1加权像(T 1WI)[重复激发时间380 ms,回波时间80 ms,矩阵384×224,激励次数2,层厚3 mm,层间隔1 mm,成像野34 cm×34 cm]和T 2加权像(T 2WI)(重复激发时间3800 ms,回波时间80 ms,矩阵384×224,激励次数2,层厚3 mm,层间隔1 mm,成像野34 cm×34 cm)横断面扫描。
定量动态增强扫描首先利用多反转角技术(5°、10°、15°、20°、25°)进行T 1图扫描,定量T 1值是采用多个反转角的T 1图拟合计算而得,然后用相同参数进行动态增强扫描,共20期(1期蒙片和19期增强),分别在注射药物前、注射药物后即刻至注射药物后324 s进行连续横断面扫描,每期时相18 s。检查前用12G静脉留置针埋在右手背静脉,对比剂0.2 mmol/kg,注射速率0.2 mL/s,注射完毕后推注10 mL等渗氯化钠溶液。
将数据传至DCE-MRI血流动力学定量分析软件Omni Kinetics,运用参照物模型计算MRI各项定量参数。T 1图由5个不同的反转角拟合、计算得出。以病灶对侧胸大肌为参照区域,通过选取感兴趣区计算三个药代动力学定量参数来评估组织和血管通透性并用伪彩图显示。定量参数包括:相对肌肉的容量转运常数(RR K trans)、病灶的速率常数(K ep)、病灶的容量转运常数与肌肉的血管外细胞外间隙容积比值(K trans/V e)。
组织病理学信息来源于病理检查报告。肿瘤大小定义为手术标本的最大径。组织学分级的指标包括:腺管形成、细胞核大小形状及染色质异型性、核分裂像等 [ 8] 。1级为高分化,2级为中分化,3级为低分化。ER、PR和HER2采用SP法检测。ER、PR的结果判断标准:在10倍镜视野,阳性肿瘤细胞核至少10%为阳性, 否则为阴性 [ 9] 。HER2的免疫组织化学结果判断标准:HER2的表达半定量记分为0、+、++、+++, 其中0、+判定为阴性;+++判定为阳性;++需进一步采用荧光原位杂交(FISH)法检测,基因扩增者定义为HER2阳性,反之为阴性。根据免疫组织化学检测ER、PR、HER2的表达情况将乳腺癌分为三型 [ 5, 10] :Luminal型乳腺癌(ER和/或PR阳性),三阴性乳腺癌(ER、PR、HER2均阴性),HER2过表达型乳腺癌(ER和PR阴性,HER2阳性)。
采用Excel 2007录入并建立数据库。计量资料以均数±标准差( x ± s)表示。按照预后因素分组的各组别之间DCE-MRI定量参数比较采用Mann-Whitney U检验;不同分型之间DCE-MRI定量参数比较采用Kruskal-Wallis检验,对差异具有统计学意义的定量参数再利用Bonferroni检验进行两两比较。采用PASW Statistics 18.0软件进行统计学分析, P<0.05为差异具有统计学意义。
50例患者中,组织学分级为3级的病灶的平均RR K trans和K ep值高于组织学分级为1~2级的病灶( U=190.5和179.0,均 P<0.05);ER阴性者平均RR K trans值和K ep值高于ER阳性者( U=192.0和193.0,均 P<0.05);PR阴性者平均RR K trans值和K ep值高于PR阳性者( U=210.5和193.0,均 P<0.05), 见 表 1。典型病例的DCE-MRI图像和伪彩图见 图 1、 2。上述结果提示,肿瘤的组织学分级和ER、PR状态与RR K trans和K ep值存在相关性。
表1 乳腺癌动态增强磁共振参照物模型定量参数与患者预后相关因素的关系
Table 1 Quantitative DCE-MRI parameters in patients with different prognostic factors
|
预后相关因素 |
n |
RR K trans(min -1) |
K ep(min -1) |
K trans/V e |
||
|
肿瘤大小 |
>2 cm |
27 |
4.036±1.949 |
1.950±1.020 |
0.883±0.491 |
|
|
≤2 cm |
23 |
3.510±1.123 |
1.500±0.672 |
0.929±0.414 |
||
|
淋巴结转移 |
阴性 |
28 |
3.528±1.160 |
1.899±0.955 |
0.855±0.488 |
|
|
阳性 |
22 |
4.085±2.010 |
1.524±0.777 |
0.965±0.408 |
||
|
组织学分级 |
1~2级 |
22 |
3.232±0.913 |
1.402±0.828 |
0.950±0.459 |
|
|
3级 |
28 |
4.223±1.903 * |
1.951±0.882 * |
0.868±0.453 |
||
|
雌激素受体 |
阴性 |
24 |
4.326±1.921 |
2.024±0.853 |
0.911±0.501 |
|
|
阳性 |
26 |
3.306±1.029 # |
1.451±0.870 # |
0.897±0.411 |
||
|
孕激素受体 |
阴性 |
26 |
4.245±1.906 |
2.035±0.943 |
0.878±0.495 |
|
|
阳性 |
24 |
3.310±0.992 # |
1.464±0.761 # |
0.935±0.404 |
||
|
人类表皮增长因子受体2 |
阴性 |
29 |
4.106±1.849 |
1.887±0.968 |
0.811±0.401 |
|
|
阳性 |
21 |
3.368±1.047 |
1.624±0.817 |
0.937±0.409 |
RR K trans:相对肌肉的容量转运常数;K ep:病灶的速率常数;K trans/V e:病灶的容量转运常数与肌肉的血管外细胞外间隙容积比值.与组织学分级1~2级比较, * P<0.05;与雌(孕)激素受体阴性比较, # P<0.05.
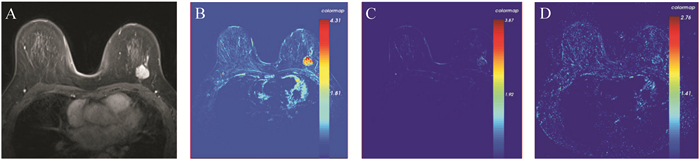
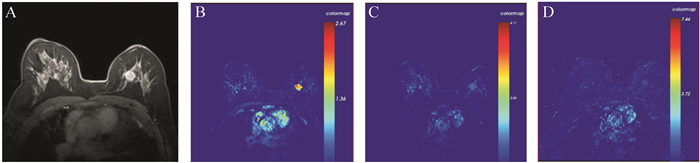
RR K trans和K ep在乳腺癌不同分子病理分型之间的差异具有统计学意义( P < 0.05)。其中,三阴性乳腺癌的RR K trans和K ep高于Luminal型乳腺癌(均 P<0.05),见 表 2。结果提示,利用定量参数RR K trans和K ep有助于鉴别三阴性和Luminal型乳腺癌。
表2 乳腺癌动态增强磁共振参照物模型定量参数与乳腺癌分子病理分型的关系
Table 2 Quantitative DCE-MRI parameters in patients with different molecular subtypes of breast cancer
|
分子病理分型 |
n |
RR K trans(min -1) |
K ep(min -1) |
K trans/V e |
|
Luminal型 |
19 |
3.10±0.22 |
1.46±0.20 |
0.88±0.07 |
|
HER2过表达型 |
17 |
4.30±0.55 |
1.73±1.19 |
0.93±0.13 |
|
三阴性 |
14 |
4.13±0.26 * |
2.13±0.24 * |
0.91±0.12 |
|
检验值 |
— |
8.74 |
5.40 |
0.03 |
|
P值 |
— |
<0.05 |
<0.05 |
>0.05 |
HER2:人类表皮增长因子受体2;RR K trans:相对肌肉的容量转运常数;K ep:病灶的速率常数;K trans/V e:病灶的容量转运常数与肌肉的血管外细胞外间隙容积比值.“—”:无相关数据.与Luminal型比较, * P<0.05.
DCE-MRI定量分析通过动态监测对比剂浓度的变化,评估其在体内的药代动力学过程,获得定量的血流动力学参数,从而反映细胞分子功能水平的生理信息。DCE-MRI定量分析可提供RR K trans、K ep、V e等定量参数,用以评估与肿瘤相关的药代动力学参数如血容量、渗透性等。然而,DCE-MRI定量分析尚未常规应用于临床,原因主要有以下两点:首先定量参数需要引入合适的模型才能得出,经典Tofts“两室”模型是DCE-MRI最常用的药代动力学模型,用以描述血浆与血管周围间隙的造影剂交换,但这种方法需要较高的空间分辨率及信噪比,对磁共振扫描仪和序列设置要求较高。其次,需要得到血浆中的造影剂浓度—时间变化率,才能将DCE-MRI得到的信号强度—时间过程的数据转化为造影剂浓度。因此,选择合适的动脉输入函数也是一个重要因素。利用动脉导管在多个时间点直接测量血液标本可能是测量造影剂浓度最准确的方法 [ 5] ,但这种方法是有创的,也很难实施。
参照物模型可以在一定程度上克服动脉输入函数选择困难的问题 [ 7, 11] 。参照物模型中,感兴趣区的曲线与一个较稳定的参照区域(一般选择对侧胸大肌)的曲线作对照。这样就避免了直接测量动脉输入函数,同时不用受空间分辨率的影响,可以在较低场强的磁共振扫描仪上实现。因此,本研究中选择了参照物模型作为DCE-MRI定量分析的药代动力学模型。
本文资料显示,组织级别高和ER、PR阴性的乳腺癌组织中RR K trans值增高,与文献报道一致 [ 4- 5] 。有研究发现,在生长迅速的肿瘤中,细胞生长旺盛,毛细血管密度增高,结构紊乱,这是由于血管内皮生长因子增多导致肿瘤血管生成而致血管通透性增加引起的 [ 11] ,而RR K trans值反映的正是造影剂从血管向血管周围间隙渗出的速度。因此,RR K trans增高与血管数量增多、通透性增加有关,RR K trans高可能提示预后不良。
K ep值反映的是对比剂返回脉管系统的速度。本文资料中,组织级别高和ER、PR阴性的乳腺癌组织中K ep值增高,说明对比剂返回脉管系统的速度加快,而这可能是毛细血管通透性增加所致。因此,K ep值增高也可能提示预后不良。需要注意的是,有研究表明,K ep比RR K trans可更好地描述肿瘤毛细血管的通透性,因为RR K trans测量可能会受到心输出量或高血压等影响血流灌注的因素的干扰,而K ep则不易受到这些因素的影响 [ 12] 。
曾有文献报道,在组织级别高和ER表达阴性的肿瘤中平均V e值降低 [ 5] ,表明V e值降低也是乳腺癌预后差的预测因素。V e减低与细胞环境活跃有关,以血管外细胞外间隙更紧凑为特征。Tofts等 [ 13] 研究表明,V e值不稳定,这可能与病变周围水肿影响V e值有关。本文资料中,K trans/V e与各预后因素均无相关性,这可能是由于不同参照区域间的V e值范围存在一定重叠性所致。
不同分子病理分型乳腺癌的生物学行为和疾病发展不同。本研究对DCE-MRI定量参数与乳腺癌分子病理分型之间的关系进行了分析,结果显示,三阴性乳腺癌的RR K trans和K ep值高于Luminal型乳腺癌,与相关研究结果一致 [ 14- 15] ,分析原因可能与三阴性乳腺癌的内皮生长因子水平最高且新生血管最丰富有关 [ 16] 。
综上所述,DCE-MRI参照物模型所得定量参数有助于预测乳腺癌患者的预后和鉴别乳腺癌的分子病理分型。但本项研究还存在以下几点不足:首先,纳入的样本数量较少,可能不足以反映定量参数的微弱变化,且无法对Luminal型作进一步分型,可能会导致结果的细微偏差;其次,仅纳入了乳腺浸润性导管癌,其他组织病理学类型的乳腺癌与定量参数之间是否具有相同的相关性有待于进一步研究;此外,在测量时采用的是手工勾画感兴趣区,这可能会导致与全病灶测量不同。因此,关于DCE-MRI参照物模型所得定量参数与乳腺癌之间的关系,还需进一步研究来证实。
Funding Statement
宁波市自然科学基金(2016A610140);宁波市科技惠民科技项目(2016C51013);浙江省公益技术应用研究计划(2017C35003);宁波市社发领域重大科技专项(2015C50004);浙江省医药卫生重大科技计划(WKJ-ZJ-1807)
References
- 1.BERG W A, GUTIERREZ L, NESSAIVER M S, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology. 2004;233(3):830–849. doi: 10.1148/radiol.2333031484. [BERG W A, GUTIERREZ L, NESSAIVER M S, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer[J]. Radiology, 2004, 233(3):830-849.] [DOI] [PubMed] [Google Scholar]
- 2.李 海歌, 刘 斐, 韩 晖云, et al. 动态增强磁共振多时相减影技术在常见乳腺肿瘤诊断中的应用. 中华医学杂志. 2013;93(17):1318–1320. doi: 10.3760/cma.j.issn.0376-2491.2013.17.011. [李海歌, 刘斐, 韩晖云, 等.动态增强磁共振多时相减影技术在常见乳腺肿瘤诊断中的应用[J].中华医学杂志, 2013, 93(17):1318-1320.] [DOI] [PubMed] [Google Scholar]
- 3.KIM J Y, KIM S H, KIM Y J, et al. Enhancement parameters on dynamic contrast enhanced breast MRI:do they correlate with prognostic factors and subtypes of breast cancers. https://www.researchgate.net/publication/265170366_Enhancement_parameters_on_dynamic_contrast_enhanced_breast_MRI_Do_they_correlate_with_prognostic_factors_and_subtypes_of_breast_cancers. Magn Reson Imaging. 2015;33(1):72–80. doi: 10.1016/j.mri.2014.08.034. [KIM J Y, KIM S H, KIM Y J, et al. Enhancement parameters on dynamic contrast enhanced breast MRI:do they correlate with prognostic factors and subtypes of breast cancers[J]. Magn Reson Imaging, 2015, 33(1):72-80.] [DOI] [PubMed] [Google Scholar]
- 4.BELLI P, COSTANTINI M, BUFI E, et al. Diffusion magnetic resonance imaging in breast cancer characterisation:correlations between the apparent diffusion coefficient and major prognostic factors. Radiol Med. 2015;120(3):268–276. doi: 10.1007/s11547-014-0442-8. [BELLI P, COSTANTINI M, BUFI E, et al. Diffusion magnetic resonance imaging in breast cancer characterisation:correlations between the apparent diffusion coefficient and major prognostic factors[J]. Radiol Med, 2015, 120(3):268-276.] [DOI] [PubMed] [Google Scholar]
- 5.KOO H R, CHO N, SONG I C, et al. Correlation of perfusion parameters on dynamic contrast-enhanced MRI with prognostic factors and subtypes of breast cancers. J Magn Reson Imaging. 2012;36(1):145–151. doi: 10.1002/jmri.23635. [KOO H R, CHO N, SONG I C, et al. Correlation of perfusion parameters on dynamic contrast-enhanced MRI with prognostic factors and subtypes of breast cancers[J]. J Magn Reson Imaging, 2012, 36(1):145-151.] [DOI] [PubMed] [Google Scholar]
- 6.李 瑞敏, 顾 雅佳, 毛 健, et al. 定量动态增强MRI鉴别乳腺良恶性病变的研究. http://www.cnki.com.cn/Article/CJFDTOTAL-SCZF201604003.htm. 中华放射学杂志. 2011;45(2):164–169. [李瑞敏, 顾雅佳, 毛健, 等.定量动态增强MRI鉴别乳腺良恶性病变的研究[J].中华放射学杂志, 2011, 45(2):164-169.] [Google Scholar]
- 7.LEE J, PLATT S, KENT M, et al. An analysis of the pharmacokinetic parameter ratios in DCE-MRI using the reference region model. Magn Reson Imaging. 2012;30(1):26–35. doi: 10.1016/j.mri.2011.09.005. [LEE J, PLATT S, KENT M, et al. An analysis of the pharmacokinetic parameter ratios in DCE-MRI using the reference region model[J]. Magn Reson Imaging, 2012, 30(1):26-35.] [DOI] [PubMed] [Google Scholar]
- 8.王 林伟, 袁 静萍, 李 雁. 乳腺癌组织学分级系统的研究进展和发展方向. http://www.doc88.com/p-1092203378220.html. 实用肿瘤学杂志. 2014;28(2):160–164. [王林伟, 袁静萍, 李雁.乳腺癌组织学分级系统的研究进展和发展方向[J].实用肿瘤学杂志, 2014, 28(2):160-164.] [Google Scholar]
- 9.于 洋, 霍 天龙, 赖 云耀, et al. 不同分子亚型乳腺癌的MRI和病理特征初探. 中华放射学杂志. 2014;48(3):184–188. [于洋, 霍天龙, 赖云耀, 等.不同分子亚型乳腺癌的MRI和病理特征初探[J].中华放射学杂志, 2014, 48(3):184-188.] [Google Scholar]
- 10.杨 钱, 陈 洁, 李 宏江, et al. 不同分子亚型乳腺癌的临床病理特征及预后分析. http://www.doc88.com/p-7068693606286.html. 中华肿瘤学杂志. 2008;30(6):456–461. [杨钱, 陈洁, 李宏江, 等.不同分子亚型乳腺癌的临床病理特征及预后分析[J].中华肿瘤学杂志, 2008, 30(6):456-461.] [Google Scholar]
- 11.YU Y, JIANG Q, MIAO Y, et al. Quantitative analysis of clinical dynamic contrast-enhanced MR imaging for evaluating treatment response in human breast cancer. Radiology. 2010;257(1):47–55. doi: 10.1148/radiol.10092169. [YU Y, JIANG Q, MIAO Y, et al. Quantitative analysis of clinical dynamic contrast-enhanced MR imaging for evaluating treatment response in human breast cancer[J]. Radiology, 2010, 257(1):47-55.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.LI S P, PADHANI A R, TAYLOR N J, et al. Vascular characterisation of triple negative breast carcinomas using dynamic MRI. Eur Radiol. 2011;21(7):1364–1373. doi: 10.1007/s00330-011-2061-2. [LI S P, PADHANI A R, TAYLOR N J, et al. Vascular characterisation of triple negative breast carcinomas using dynamic MRI[J]. Eur Radiol, 2011, 21(7):1364-1373.] [DOI] [PubMed] [Google Scholar]
- 13.TOFTS P S. Modeling tracer kinetics in dynamic Gd-DTPA MR imaging. J Magn Reson Imaging. 1997;7(1):91–101. doi: 10.1002/(ISSN)1522-2586. [TOFTS P S. Modeling tracer kinetics in dynamic Gd-DTPA MR imaging[J]. J Magn Reson Imaging, 1997, 7(1):91-101.] [DOI] [PubMed] [Google Scholar]
- 14.李 丽环, 刘 万花, 王 瑞, et al. MRI定量增强参数与乳腺癌预后因子及分型的相关性. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhfsx201605003. 中华放射学杂志. 2016;50(5):329–333. [李丽环, 刘万花, 王瑞, 等.MRI定量增强参数与乳腺癌预后因子及分型的相关性[J].中华放射学杂志, 2016, 50(5):329-333.] [Google Scholar]
- 15.赵 莉芸, 周 纯武, 张 仁知, et al. 动态增强MRI定量参数与乳腺癌分子亚型的关系. http://www.cnki.com.cn/Article/CJFDTOTAL-XDZD201509064.htm. 中国医学影像技术. 2013;29(7):1126–1130. [赵莉芸, 周纯武, 张仁知, 等.动态增强MRI定量参数与乳腺癌分子亚型的关系[J].中国医学影像技术, 2013, 29(7):1126-1130.] [Google Scholar]
- 16.LINDERHOLM B K, HELLBORG H, JOHANSSON U, et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer. Ann Oncol. 2009;20(10):1639–1646. doi: 10.1093/annonc/mdp062. [LINDERHOLM B K, HELLBORG H, JOHANSSON U, et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer[J]. Ann Oncol, 2009, 20(10):1639-1646.] [DOI] [PubMed] [Google Scholar]


