Abstract
目的
观察藏红花素对小鼠颞叶癫痫形成过程和大发作的影响。
方法
利用C57小鼠海马电点燃癫痫模型,观察藏红花素对癫痫形成过程中的发作等级、累积后放电时间、在各等级停留的刺激次数、动物最终停留阶段等指标的影响,以及其对癫痫大发作动物的大发作概率、平均发作等级、后放电持续时间等指标的影响。
结果
与溶剂对照组比较,20 mg/kg藏红花素能抑制小鼠海马电点燃癫痫形成过程的每日平均发作等级( P < 0.05),缩短每日累积后放电持续时间( P < 0.01),同时延长癫痫在1~2级停留的刺激次数( P < 0.05),并降低小鼠完全点燃的比例( P < 0.01)。10或50 mg/kg藏红花素对上述指标均无明显影响( P>0.05)。对于已经完全点燃的动物,100或200 mg/kg藏红花素均能降低其大发作的概率(均 P < 0.01),降低平均发作等级(均 P < 0.01);50 mg/kg藏红花素则仅对平均发作等级有降低作用( P < 0.05)。
结论
藏红花素在小鼠海马电点燃模型中能抑制癫痫形成过程和癫痫大发作,其效果呈现一定的剂量依赖性,可能是一种有开发和应用前景的潜在抗癫痫药物。
Abstract
Objective
To investigate the effect of crocin on the progression and generalized seizure of temporal lobe epilepsy in mice.
Methods
Hippocampus rapid kindling model was established in C57BL/6J mice. The effects of crocin on seizure stage, afterdischarge duration (ADD), number of stimulation in each stage and final state, the incidence of generalized seizure (GS), average seizure stage and ADD were observed.
Results
Crocin (20 mg/kg) significantly retarded behavioral seizure stages ( P < 0.05) and shortened cumulative ADD ( P < 0.01) during hippocampus rapid kindling acquisition in mice compared with vehicle group. Meanwhile, number of stimulations in stage 1-2 was significantly increased ( P < 0.05) and the incidence of fully kindled animals was significantly decreased ( P < 0.01). However, 10 or 50 mg/kg crocin showed no significant effect on the above indexes (all P>0.05). Crocin (100 or 200 mg/kg) significantly decreased the incidence of GS (all P < 0.01) and reduced average seizure stages (all P < 0.01) in fully-kindled mice compared with vehicle group; Fifty mg/kg crocin only reduced average seizure stages ( P < 0.05).
Conclusion
Low-dose crocin can retard the progression in hippocampus rapid kindling acquisition in mice, while high-dose crocin relieves the GS in fully-kindled mice, which suggests that crocin may be a potential anti-epileptic compound.
Keywords: Epilepsy, temporal lobe; PICROCROCIN/therapeutic use; PICROCROCIN/administration&dosage; Kndling, neurologic/drug effects; Dose-response relationship, drug; Disease models, animal
癫痫是临床较为常见的一种慢性中枢神经系统疾病,在人群中的患病率为0.5%~1% [ 1] 。癫痫的发病机制非常复杂,其神经环路及相关分子机制尚未完全阐明,主要临床表现为突然发作并伴有短暂大脑功能障碍,严重影响患者的生活质量。目前,癫痫的临床治疗仍以药物控制为主,但一些传统的抗癫痫药物存在副作用较多、治疗窗较窄等问题。尽管多年来新型抗癫痫药物不断应用于临床,但仍有约30%的患者对多种抗癫痫药物耐受,进而发展为难治性癫痫 [ 2] 。颞叶癫痫是最常见的难治性癫痫之一,其中以海马、海马旁回及杏仁核为灶点的正中颞叶癫痫最终发展为难治性癫痫的比例约为75% [ 3] 。虽有少部分患者可采取手术切除病灶治疗,但多数患者由于灶点不明确、多发灶点或灶点在重要脑功能区等原因无法进行手术 [ 4] 。此外,颞叶区的核团与人的情绪、学习记忆等脑功能密切相关,手术切除容易损伤这些核团,引发严重的并发症和脑功能损伤。因此,临床上迫切需要寻找一种能有效干预和治疗颞叶癫痫的新型抗癫痫药物。
传统中草药是天然化合物的宝库。近年来有研究报道,石菖蒲 [ 5] 、雷公藤 [ 6] 、柴胡 [ 7] 、全蝎 [ 8] 、川芎 [ 9] 、藏红花 [ 10] 等传统中草药可能具有抗癫痫的活性成分。其中,藏红花是一种原产于伊朗等地的是鸢尾科番红花属球根类草本植物,现今在我国浙江省建德一带亦有大量栽培。我国传统医学认为,藏红花性味甘平,具有活血化瘀、凉血解毒、散郁开结之功效,可用于产后瘀阻、温毒发斑、忧郁痞闷、惊悸发狂等症 [ 10] 。近年来,藏红花的主要活性成分藏红花素的作用受到了广泛的关注。研究发现,藏红花素具有多种药理活性,如抑制炎症 [ 11] 、抗肿瘤 [ 12] 、保护神经元 [ 13] 、镇静催眠 [ 14] 、改善学习记忆 [ 15] 、抗帕金森病 [ 16] 等,可能是一种具有较好临床应用前景的中药活性成分。然而,目前对藏红花素抗癫痫活性的报道相对较少,且存在一定的争议。Hosseinzadeh等 [ 17] 发现藏红花素对戊四唑诱导的实验性癫痫无效;但Tamaddonfard等 [ 18] 则发现其对青霉素诱导的癫痫样活动有显著抑制作用,并能与地西泮联用,发挥协同抗癫痫作用。出现这样的争议,可能与癫痫模型的选择有关。不同的癫痫模型模拟了癫痫不同类型的发作,而抗癫痫药物的作用又往往与发作类型有关,因此模型的选择对药效评价的结果有极大的影响,有必要在更多的癫痫模型上对藏红花素的抗癫痫作用作进一步的药效评价 [ 19] 。
小鼠海马电点燃模型是国际公认的颞叶癫痫模型之一,其灶点位于海马,经过反复的电刺激可诱发癫痫发作,发作时小鼠的行为及脑电均可清晰记录,且造模过程较短,是研究癫痫形成过程和大发作的一种常用模型,也是评价抗癫痫药物药效的一种有效模型 [ 20] 。本研究选择该模型来评价藏红花素对小鼠颞叶癫痫形成过程和大发作的影响,以期为后续研究提供更多的参考。
1 材料与方法
1.1 实验动物
清洁级雄性C57BL/6J小鼠76只 (上海斯莱克实验动物有限责任公司提供),体质量为22~35 g。每只小鼠单笼饲养,食物和水自由摄取,每天给予12 h的光照 (光照时间为8:00至20:00)。实验在9:00至17:00进行。实验遵守杭州医学院实验动物中心动物伦理相关规定。
1.2 仪器和试剂
脑立体定位仪68001购自深圳市瑞沃德生命科技有限公司;FE180隔离刺激器购自美国埃德仪器有限公司;Synamps RT脑电记录仪购自美国Neuroscan公司;不锈钢双股螺旋电极购自美国A-M Systems公司。戊巴比妥钠 (1507002-200MG)、藏红花素 (17304-5G)、丙戊酸钠 (P4543-10G)、拉莫三嗪 (L3791-50MG) 均购自美国西格玛奥德里奇 (Sigma-Aldrich) 公司;牙科水泥 (YY0270.1-2011) 购自江苏省昆山市大进齿科材料有限公司。
1.3 小鼠癫痫模型的建立及癫痫发作行为学评估
小鼠海马快速点燃模型的建立参考课题组前期研究 [ 21] 。小鼠腹腔注射40 mg/kg戊巴比妥钠麻醉后固定于脑立体定位仪。根据小鼠脑图谱 [ 22] ,以前囟为参照点,在右侧海马 (前囟前后:-2.9 mm、-3.0 mm、-3.0 mm) 立体定位,垂直植入电极。所用电极为不锈钢双股螺旋电极,末端剥去绝缘层0.5 mm,电极丝为Teflon绝缘,直径为0.2 mm,两股电极间隔0.5 mm。电极用牙科水泥固定于小鼠颅骨表面,电极上端与微型插座焊接,用牙科水泥固定于颅骨。动物手术后休息7 d,之后使用隔离刺激器测定动物的后放电阈值 (afterdischarge threshold,ADT),并使用脑电记录仪放大并记录海马区脑电图。刺激参数:单相方波,频率20 Hz,波宽1 ms,时长2 s。电流强度从40 μA开始,间隔1 min增加20%,当脑电图记录到至少5 s的后放电,则该电流强度定为ADT。只有测得阈值小于400 μA的动物,才能用于后续实验。在后续的海马快速点燃过程中,我们将动物根据测得的ADT进行分组,采用400 μA给予阈值进行点燃刺激,刺激参数为单相方波,频率20 Hz,波宽1 ms,刺激时长2 s,每天刺激六次,每次间隔30 min [ 23] 。在点燃过程中,记录动物的癫痫发作等级和海马区EEG。癫痫行为等级采用Racine评分 [ 24] :1级,面部抽动,咀嚼明显;2级,点头;3级,单侧前肢阵挛抬起;4级,双侧前肢阵挛抬起和站立;5级,双侧前肢阵挛,站立以及失去平衡跌倒。1~3级为局灶性发作,4~5级为全身性发作 (大发作)。当动物连续三次癫痫发作等级达到5级,则认为已经完全点燃。
1.4 模型动物颞叶癫痫形成过程的干预实验
根据测得的ADT将40只小鼠分为五组:溶剂对照组 (给予等量的等渗氯化钠溶液, n=9),阳性对照组 (给予丙戊酸钠200 mg/kg, n=8),藏红花素10 mg/kg组 ( n=8)、20 mg/kg组 ( n=8)、50 mg/kg组 ( n=7)。每日首次点燃刺激前30 min给药一次,刺激方法和参数同1.3,持续8 d。记录各组动物的癫痫发作等级和海马区EEG,并测算出各组动物的后放电持续时间 (afterdischarge duration,ADD)。实验结束后统计各组动物在点燃过程中首次到达各等级的刺激次数、在各等级停留的刺激次数、截止日动物4~5级发作次数和动物最终停留阶段等指标。
1.5 模型动物颞叶癫痫大发作的干预实验
将未经用药处理且已经完全点燃的动物 (共36只) 重新测定其ADT,根据测得的ADT分成六组:藏红花素20、50、100、200 mg/kg组,溶剂对照组 (给予等量的等渗氯化钠溶液),阳性对照组 (给予拉莫三嗪15 mg/kg),每组均为6只。各组动物每日给予相应剂量的药物或等渗氯化钠溶液30 min后,进行每日一次的刺激诱发大发作,刺激参数为单相方波,频率20 Hz,波宽1 ms,刺激时长2 s,电流400 μA,共进行10 d。记录各组动物的癫痫发作等级和海马区脑电图,并测算出各组动物的大发作概率、平均发作等级、ADD、大发作持续时间等指标。
1.6 统计学方法
使用SPSS 16.0统计软件进行分析。数据以均数±标准差 ( x ± s) 表示,形成过程等级和ADD进展趋势比较采用重复测量方差分析,动物最终状态比例和大发作概率比较采用 χ 2检验。大发作平均等级数据统计采用非参数Mann-Whitney U检验。计量资料采用单因素方差分析,组间比较采用Tukey检验, P<0.05为差异有统计学意义。
2 结果
2.1 藏红花素对模型动物颞叶癫痫形成过程的影响
2.1.1 藏红花素对癫痫平均发作等级和累积ADD的影响
如 图 1所示,与溶剂对照组比较,20 mg/kg藏红花素可抑制小鼠每日平均发作等级 ( P<0.05),并缩短每日累积ADD ( P<0.01),其作用强度与阳性对照组相近 ( P>0.05);10、50 mg/kg藏红花素对癫痫形成的抑制作用虽不如20 mg/kg藏红花素明显,但在后期依然表现出一定的延缓和抑制癫痫形成的趋势。各组动物在癫痫形成过程中的代表性脑电图见 图 2,可见随着刺激时间的增加,阳性对照组和藏红花素20 mg/kg组典型动物癫痫样后放电的时长均比溶剂对照组增长缓慢。提示藏红花素具有延缓和抑制癫痫形成的作用,当剂量为20 mg/kg时的作用效果最为明显。
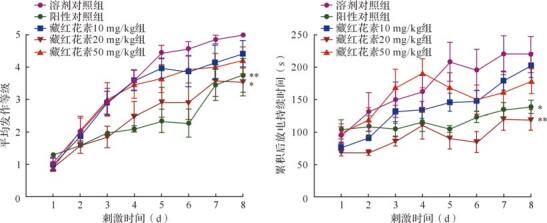

2.1.2 藏红花素对海马电点燃刺激次数和动物最终停留阶段的影响
如 图 3所示,与溶剂对照组比较,藏红花素20 mg/kg组和阳性对照组首次到达3~5级的刺激次数增加 ( P<0.05或 P<0.01),在1~2级停留的刺激次数增加 ( P<0.05或 P<0.01)。其中,在实验截止日的六次刺激中,溶剂对照组、阳性对照组和藏红花素各剂量组发生全身性大发作的次数分别为 (6.0±0.0)、(4.0±2.0)、(5.1±1.8)、(2.9±1.9) 和 (4.7±1.9) 次,其中,藏红花素20 mg/kg组动物全身性发作的次数低于溶剂对照组 ( P<0.01),但其他剂量藏红花素组对该指标的作用均不明显。此外,藏红花素20 mg/kg组动物最终停留在局灶性发作、全身性发作和完全点燃阶段的动物比例分别为2/8、3/8和3/8,与溶剂对照组比较差异均有统计学意义 ( P<0.05或 P<0.01);50 mg/kg组的动物最终停留在全身性发作阶段的动物比例为3/7,与溶剂对照组比较差异有统计学意义 ( P<0.01)。上述结果提示,藏红花素对小鼠海马电点燃癫痫的形成过程有抑制作用,其最佳剂量可能为20 mg/kg。

2.2 藏红花素对模型动物颞叶癫痫大发作的影响
如 表 1所示,溶剂对照组的点燃刺激可以稳定地诱导大发作,大发作概率为96.7%,平均发作等级为4.85±0.18,大发作持续时间为 (23.35±4.75) s,ADD为 (34.03±3.85) s。100和200 mg/kg的藏红花素可以将大发作概率降低至55.0%和60.0%(均 P<0.01),并降低发作等级至3.48±0.47和3.58±0.37(均 P<0.01),但大发作持续时间和ADD与溶剂对照组比较差异无统计学意义 (均 P>0.05);50 mg/kg藏红花素除能降低平均发作等级 ( P<0.05) 外,对其他指标的影响均不明显;20 mg/kg藏红花素则对各项指标均无明显影响。此外,在实验过程中我们还发现,尽管藏红花素的剂量已经很大,但小鼠并未出现明显的行为和脑电异常,说明藏红花素的毒性可能较小。上述结果提示,较大剂量 (100或200 mg/kg) 的藏红花素有抑制小鼠颞叶癫痫大发作的作用。
表1 不同剂量藏红花素对小鼠颞叶癫痫大发作抑制作用的比较
|
( x ± s) | |||||
|
组别 |
n |
癫痫大发作概率 (%) |
癫痫发作等级 |
后放电持续时间 (s) |
大发作持续时间 (s) |
|
溶剂对照组 |
6 |
96.7 |
4.85±0.18 |
34.03±3.85 |
23.35±4.75 |
|
阳性对照组 |
6 |
15.0 ** |
2.28±0.75 ** |
23.13±5.79 |
14.81±5.09 * |
|
藏红花素20 mg/kg组 |
6 |
91.7 |
4.31±0.40 |
35.42±8.88 |
25.36±7.32 |
|
藏红花素50 mg/kg组 |
6 |
73.3 |
4.04±0.74 * |
28.30±6.29 |
19.82±6.12 |
|
藏红花素100 mg/kg组 |
6 |
55.0 ** |
3.48±0.47 ** |
28.98±7.20 |
16.51±5.29 |
|
藏红花素200 mg/kg组 |
6 |
60.0 ** |
3.58±0.37 ** |
35.65±6.31 |
23.95±12.22 |
与溶剂对照组比较, * P<0.05, ** P<0.01.
3 讨论
起源于海马的正中颞叶癫痫是临床常见的颞叶癫痫类型,也是极易对抗癫痫药物产生耐受的癫痫类型 [ 25] 。本研究采用小鼠海马电点燃癫痫模型,发现较小剂量的藏红花素可以抑制小鼠颞叶癫痫的形成过程,其作用强度与丙戊酸钠相当;而较大剂量则可以抑制大发作,其作用略逊于拉莫三嗪,但其毒性可能相对较小,因此藏红花素可能成为一种较有应用前景的潜在抗癫痫药物。
以往有关藏红花素抗癫痫作用的报道较少。本研究通过小鼠海马电点燃模型,发现在小鼠颞叶癫痫的形成过程中,每天给予一次20 mg/kg的藏红花素可抑制其癫痫行为等级的进展,延缓其ADD的延长。这一作用与丙戊酸钠相似。由于该实验在第八天截止,此时部分给药组动物尚未完全点燃,因此我们也单独分析了截止日的动物发作情况和动物最终停留阶段。结果表明:在截止日的六次刺激中,藏红花素20 mg/kg组的动物出现4~5级大发作的平均次数最少,只有溶剂对照组的一半,且略优于阳性对照组;而该组动物在最终停留阶段这一指标上也体现出了一定的优势,停留在局灶性发作的动物比例在各组中最高,完全点燃的动物比例在各组中最低,优于阳性对照组。这些结果均提示藏红花素可能具有抑制小鼠颞叶癫痫形成过程的作用,且其作用存在一定的剂量依赖效应。因此,我们认为,藏红花素抑制小鼠颞叶癫痫形成的最佳剂量可能在20 mg/kg左右,其作用强度在总体上接近且略优于丙戊酸钠,剂量过低或过高均有可能影响其作用的发挥。此外,我们还分析了各组动物到达各等级和在各等级停留的刺激次数,发现给予20 mg/kg藏红花素的动物到达3~5级所需要的刺激次数和在1~2级停留的刺激次数均多于溶剂对照组;但在癫痫的形成达到中后期 (3~5级) 阶段时,其抑制作用则不明显。这说明藏红花素对癫痫形成过程的抑制作用主要体现在将癫痫控制于其形成过程的早期阶段。无独有偶,课题组前期进行低频率电刺激抗癫痫作用研究时,也发现过与之类似的早期效应现象 [ 26] 。出现这一现象,我们认为可能与癫痫形成的环路机制有关。最近的研究表明,癫痫是一种环路性的疾病,异常环路的形成最终导致了癫痫 [ 27] 。早期癫痫的异常环路尚未完全形成,此时进行某种干预可能会干扰异常环路的形成,从而体现出较为显著的疗效;而到癫痫形成的中后期,异常环路已经基本形成,再进行干预则可能无法阻断异常环路,故效果不理想。
另一方面,我们发现100、200 mg/kg的藏红花素对小鼠颞叶癫痫大发作的发作概率和平均发作等级也有抑制作用,提示较大剂量的藏红花素可能对癫痫大发作有抑制作用,且存在一定的剂量依赖性。我们注意到这与以往的研究结果 [ 17] 并不完全一致,可能有两方面的原因:一是模型选择不同,本实验所用模型是海马起源的颞叶癫痫大发作,而以往研究中选用的MES或戊四唑模型其癫痫灶点不一定在颞叶;二是以往研究藏红花素对癫痫大发作的作用往往只给一次药,而本实验连续10 d进行测试,藏红花素的作用可能因累积而逐渐增强,提示可能需要持续给药一段时间后才能发挥出藏红花素抑制大发作的作用。此外,虽然本实验中藏红花素的给药剂量较大,并且连续给药10 d,但并没有造成动物明显的不适行为或异常脑电波,可能提示藏红花素的毒性较小,能够满足持续给药的需求,但其准确的毒性数据还需要通过毒理学实验来进一步检测。
关于藏红花素的抗癫痫作用机制目前尚不十分清楚。部分研究认为其可能与加强了苯二氮受体系统以及γ-氨基丁酸的功能有关 [ 18] ,但这一假说并不能完全解释现有的实验结果。例如,100 μg藏红花素在青霉素诱发癫痫模型中的抗癫痫作用大约等效于10 μg地西泮;但在戊四唑诱导的癫痫模型中,地西泮有抗癫痫作用而等效剂量的藏红花素却完全无效 [ 17- 18] ,说明藏红花素的抗癫痫作用可能还存在其他潜在机制。脑源性神经营养因子 (brain-derived neurotrophic factor,BDNF) 是神经营养因子家族的重要成员之一。研究发现,BDNF在癫痫的形成和发作过程中有着重要的作用。BDNF及其下游原肌球蛋白受体激酶B (TrkB) 受体直接参与了癫痫的发生和发展 [ 28] 。过去的研究结果提示,BDNF可能促进癫痫的发生并向慢性发展,但近年来的研究表明,BDNF对癫痫的形成和发生可能有一定的抑制作用 [ 29] 。如Cai等 [ 30] 发现BDNF系统的激活对锂盐—匹罗卡品诱导的癫痫持续状态有保护作用。课题组前期研究也已发现,藏红花素对大鼠海马区BDNF的分泌有明显的促进作用 [ 31] ,因此我们推测藏红花素对小鼠海马电点燃癫痫的抑制作用可能是通过其促进小鼠海马区BDNF的分泌,进而加强下游TrkB受体的功能来实现的,这将在我们的后续研究中进一步验证。此外,我们还注意到一些炎症因子如TNF、IL-1β、IL-6等对癫痫的发生有明显的促进作用 [ 32] ;而藏红花素对这些炎症因子具有不同程度的抑制作用,这在多个其他疾病的研究中已有报道和证实 [ 11, 33] ,因此, 这可能是藏红花素发挥其抗癫痫作用的潜在机制之一,值得我们进一步研究和探索。
综上所述,本研究发现藏红花素对小鼠颞叶癫痫的形成过程和大发作均有抑制作用,可能是一种较有应用前景的潜在抗癫痫药物。但其对癫痫的抑制作用存在一定的剂量依赖性,因此剂量的选择可能是其作用发挥的关键因素,而对于最佳剂量的确定则有待进一步研究。
Funding Statement
国家自然科学基金(81402914);浙江省自然科学基金(LQ14H310001);浙江省大学生新苗人才计划(2016R436009);浙江医学高等专科学校校级科研项目(2014B02)
References
- 1.ELLIS T L, STEVENS A. Deep brain stimulation for medically refractory epilepsy. Neurosurg Focus. 2008;25(3):E11. doi: 10.3171/FOC/2008/25/9/E11. [DOI] [PubMed] [Google Scholar]
- 2.SCHMIDT D, LÖSCHER W. Drug resistance in epilepsy:putative neurobiologic and clinical mechanisms. Epilepsia. 2005;46(6):858–877. doi: 10.1111/epi.2005.46.issue-6. [DOI] [PubMed] [Google Scholar]
- 3.KWAN P, BRODIE M J. Early identification of refractory epilepsy. N Engl J Med. 2000;342(5):314–319. doi: 10.1056/NEJM200002033420503. [DOI] [PubMed] [Google Scholar]
- 4.BERG A T. Epilepsy:efficacy of epilepsy surgery:what are the questions today? Nat Rev Neurol. 2011;7(6):311–312. doi: 10.1038/nrneurol.2011.73. [DOI] [PubMed] [Google Scholar]
- 5.SU J, ZHU W, LIU J, et al. The involvement of neuronal nitric oxide synthase in antiepileptic action of alpha-asarone on pentylenetetrazol molding rats. Biomed Mater Eng. 2014;24(6):3645–3655. doi: 10.3233/BME-141192. [DOI] [PubMed] [Google Scholar]
- 6.杨 宜承, 赵 薇, 曾 常茜, et al. 雷公藤内酯对海人酸致痫大鼠神经元caspase3和caspase9蛋白表达的影响. 辽宁中医药大学学报. 2013;15(2):48–50. [Google Scholar]
- 7.YE M, BI Y F, DING L, et al. Saikosaponin a functions as anti-epileptic effect in pentylenetetrazol induced rats through inhibiting mTOR signaling pathway. Biomed Pharmacother. 2016;81:281–287. doi: 10.1016/j.biopha.2016.04.012. [DOI] [PubMed] [Google Scholar]
- 8.ZOU X, HE Y, QIAO J, et al. The natural scorpion peptide, BmK NT1 activates voltage-gated sodium channels and produces neurotoxicity in primary cultured cerebellar granule cells. Toxicon. 2016;109:33–41. doi: 10.1016/j.toxicon.2015.11.005. [DOI] [PubMed] [Google Scholar]
- 9.喻 小红, 张 临洪, 张 端莲. 川芎嗪对青霉素致痫大鼠神经元内神经细胞黏附分子-140表达的作用. 中国医院药学杂志. 2010;30(8):665–668. [Google Scholar]
- 10.刘 正, 郭 凌鸿, 徐 昕红, et al. 西红花有效成分的神经药理学研究进展. 时珍国医国药. 2011;22(5):1202–1204. [Google Scholar]
- 11.KAZI H A, QIAN Z. Crocetin reduces TNBS-induced experimental colitis in mice by downregulation of NFκB. Saudi J Gastroenterol. 2009;15(3):181–187. doi: 10.4103/1319-3767.54750. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.MOUSAVI S H, TAVAKKOL-AFSHARI J, BROOK A, et al. Role of caspases and Bax protein in saffron-induced apoptosis in MCF-7 cells. Food Chem Toxicol. 2009;47(8):1909–1913. doi: 10.1016/j.fct.2009.05.017. [DOI] [PubMed] [Google Scholar]
- 13.OCHIAI T, SHIMENO H, MISHIMA K, et al. Protective effects of carotenoids from saffron on neuronal injury in vitro and in vivo. Biochim Biophys Acta. 2007;1770(4):578–584. doi: 10.1016/j.bbagen.2006.11.012. [DOI] [PubMed] [Google Scholar]
- 14.MASAKI M, ARITAKE K, TANAKA H, et al. Crocin promotes non-rapid eye movement sleep in mice. Mol Nutr Food Res. 2012;56(2):304–308. doi: 10.1002/mnfr.201100181. [DOI] [PubMed] [Google Scholar]
- 15.PITSIKAS N, ZISOPOULOU S, TARANTILIS P A, et al. Effects of the active constituents of Crocus sativus L., crocins on recognition and spatial rats' memory. Behav Brain Res. 2007;183(2):141–146. doi: 10.1016/j.bbr.2007.06.001. [DOI] [PubMed] [Google Scholar]
- 16.AHMAD A S, ANSARI M A, AHMAD M, et al. Neuroprotection by crocetin in a hemi-parkinsonian rat model. Pharmacol Biochem Behav. 2005;81(4):805–813. doi: 10.1016/j.pbb.2005.06.007. [DOI] [PubMed] [Google Scholar]
- 17.HOSSEINZADEH H, TALEBZADEH F. Anticonvulsant evaluation of safranal and crocin from Crocus sativus in mice. Fitoterapia. 2005;76(7-8):722–724. doi: 10.1016/j.fitote.2005.07.008. [DOI] [PubMed] [Google Scholar]
- 18.TAMADDONFARD E, HAMZEH G N, SEIEDNEJAD-YAMCHI S. Central effect of crocin on penicillin-induced epileptiform activity in rats. Pharmacol Rep. 2012;64(1):94–101. doi: 10.1016/S1734-1140(12)70735-1. [DOI] [PubMed] [Google Scholar]
- 19.ALAVIZADEH S H, HOSSEINZADEH H. Bioactivity assessment and toxicity of crocin:a comprehensive review. Food Chem Toxicol. 2014;64:65–80. doi: 10.1016/j.fct.2013.11.016. [DOI] [PubMed] [Google Scholar]
- 20.LÖSCHER W. Animal models of epilepsy for the development of antiepileptogenic and disease-modifying drugs. A comparison of the pharmacology of kindling and post-status epilepticus models of temporal lobe epilepsy. Epilepsy Res. 2002;50(1-2):105–123. doi: 10.1016/S0920-1211(02)00073-6. [DOI] [PubMed] [Google Scholar]
- 21.陶 安风, 许 正浩, 吴 承昊, et al. 不同波形低频率电刺激对小鼠海马电点燃癫痫的作用比较. 浙江大学学报 (医学版) 2015;44(3):315–322. doi: 10.3785/j.issn.1008-9292.2015.05.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.FRANKLIN K B J, PAXINOS G. The Mouse Brain in Stereotaxic Coordinates. San Diego: Academic Press; 2001. p. 1. [Google Scholar]
- 23.JIN M, DAI Y, XU C, et al. Effects of meclofenamic acid on limbic epileptogenesis in mice kindling models. Neurosci Lett. 2013;543:110–114. doi: 10.1016/j.neulet.2013.03.029. [DOI] [PubMed] [Google Scholar]
- 24.RACINE R J. Modification of seizure activity by electrical stimulation. Ⅱ. motor seizure. Electroencephalogr Clin Neurophysiol. 1972;32(3):281–294. doi: 10.1016/0013-4694(72)90177-0. [DOI] [PubMed] [Google Scholar]
- 25.GARRIGA-CANUT M, SCHOENIKE B, QAZI R, et al. 2-deoxy-D-glucose reduces epilepsy progression by NRSF-CtBP-dependent metabolic regulation of chromatin structure. Nat Neurosci. 2006;9(11):1382–1387. doi: 10.1038/nn1791. [DOI] [PubMed] [Google Scholar]
- 26.ZHONG K, WU D C, JIN M M, et al. Wide therapeutic time-window of low-frequency stimulation at the subiculum for temporal lobe epilepsy treatment in rats. Neurobiol Dis. 2012;48(1):20–26. doi: 10.1016/j.nbd.2012.05.011. [DOI] [PubMed] [Google Scholar]
- 27.ALEXANDER A, MAROSO M, SOLTESZ I. Organization and control of epileptic circuits in temporal lobe epilepsy. Prog Brain Res. 2016;226:127–154. doi: 10.1016/bs.pbr.2016.04.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.REIBEL S, DEPAULIS A, LARMET Y. BDNF and epilepsy-the bad could turn out to be good. Trends Neurosci. 2001;24(6):318–319. doi: 10.1016/S0166-2236(00)01869-5. [DOI] [PubMed] [Google Scholar]
- 29.EFTEKHARI S, MEHRABI S, KARIMZADEH F, et al. Brain derived neurotrophic factor modification of epileptiform burst discharges in a temporal lobe epilepsy model. Basic Clin Neurosci. 2016;7(2):115–120. doi: 10.15412/J.BCN.03070205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.CAI Z, LI S, LI S, et al. Antagonist targeting microRNA-155 protects against lithium-pilocarpine-induced status epilepticus in C57BL/6 mice by activating brain-derived neurotrophic factor. Front Pharmacol. 2016;7:129. doi: 10.3389/fphar.2016.00129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.何 新康, 叶 夷露, 潘 蓓蓓, et al. 西红花素对大鼠脑缺血再灌注损伤的神经保护作用及神经行为学影响. 中国临床药理学与治疗学. 2016;21(3):282–286. [Google Scholar]
- 32.陈 忠, 孙 红柳. 星形胶质细胞在癫痫发病中的作用. 浙江大学学报 (医学版) 2013;42(3):245–252. [PubMed] [Google Scholar]
- 33.NAM K N, PARK Y M, JUNG H J, et al. Anti-inflammatory effects of crocin and crocetin in rat brain microglial cells. Eur J Pharmacol. 2010;648(1-3):110–116. doi: 10.1016/j.ejphar.2010.09.003. [DOI] [PubMed] [Google Scholar]


