Abstract
目的
观察结节病患者辅助性T细胞17(Th17)和调节性T细胞(Treg)的变化及与疾病活动的关系。
方法
选择2009年1月~2013年12月在鄞州人民医院治疗的23例结节病患者作为研究对象,以25例健康志愿者作为正常对照组,在糖皮质激素治疗前后分别用酶反应连续监测法测定血清血管紧张素转化酶(SACE),流式细胞术测定外周血和支气管肺泡灌洗液(BALF)中Th17细胞和Treg细胞比例,酶联免疫吸附试验法测定血清及BALF上清液中相关细胞因子水平,实时荧光定量PCR测定外周血转录因子ROR-γt和Foxp3 mRNA表达水平,分析Th17/Treg比值与病情活动的相关性。
结果
结节病患者活动期外周血Th17细胞比例较正常对照组明显升高(4.34%±0.89% vs 1.60%±0.42%),而Treg细胞比例明显降低(1.28%±0.37% vs 3.39%±0.50%);转录因子ROR-γt mRNA表达水平较正常对照组明显升高(21.31±3.55 vs 3.63±1.00),而Foxp3 mRNA明显降低(1.60±0.24 vs 3.12±0.76),差异均有统计学意义(均 P<0.01)。糖皮质激素治疗后上述指标均显著改善(外周血Th17细胞比例2.16%±0.68%,Treg细胞比例2.21%±0.42%,转录因子ROR-γt mRNA水平10.15±1.93,Foxp3 mRNA水平2.44±0.38),差异均有统计学意义(均 P<0.05)。外周血Th17和Treg细胞相关细胞因子的变化与两类细胞比例变化一致;激素治疗后BALF中上述指标变化趋势与外周血一致。Th17/Treg细胞比值与外周血SACE水平呈显著正相关(r=0.781, P<0.01)。
结论
Th17/Treg细胞平衡失调与结节病的活动密切相关,可能参与了结节病的发病过程。
Abstract
Objective
To investigate the Th17 cell and Treg cell levels in patients with sarcoidosis, and their relation to disease activation and glucocorticoids treatment.
Methods
Twenty-three sarcoidosis patients admitted in Yinzhou People's Hospital from January 2009 to December 2013 and 25 healthy subjects (controls) were included in this study. The blood samples and bronchoalveolar lavage fluid (BALF) samples were collected in all patients before and after glucocorticoids treatment. The serum angiotensin converting enzyme (SACE) levels were detected. The percentages of Th17 cells and Treg cells in peripheral blood and BALF were determined by flow cytometry, the concentrations of cytokines in serum and supernatants of BALF were measured by enzyme-linked immunosorbent assay (ELISA). The levels of ROR-γt and Foxp3 mRNA transcripts in peripheral blood mononuclear cells (PBMC) were determined by real-time quantitative PCR. The potential correlation between the percentages of Th17 or Treg cells and SACE levels was evaluated.
Results
Compared with healthy controls, significantly higher frequencies of Th17 cells (4.34%±0.89% vs 1.60%±0.42%), lower frequencies of Treg cells (1.28%±0.37% vs 3.39%±0.50%) in peripheral blood were observed. Higher level of ROR-γt mRNA (21.31±3.55 vs 3.63±1.00) and lower level of Foxp3 mRNA (1.60±0.24 vs 3.12±0.76) in peripheral blood were detected in sarcoidosis patients in active stage (before glucocorticoids treatment) (all P < 0.01). After the treatment of glucocorticoids, these index in peripheral blood were significantly improved (Th17 cells 2.16%±0.68%, Treg cells 2.21%±0.42%, ROR-γt mRNA 10.15±1.93, Foxp3 mRNA 2.44±0.38) (all P < 0.05). The changing trends of Th17 and Treg cell cytokines levels in serum were consistent with two type cells. Meanwhile, the changing trends of above index in BALF of patients treated by glucocorticoids were consistent with those in sarcoidosis patients in active stage. The increased ratios of Th17 cells to Treg cells were positively correlated with the level of serum SACE ( r= 0.781).
Conclusion
The imbalance of Th17 cells and Treg cells in peripheral blood and airway may be involved in the pathogenesis of sarcoidosis, which was associated with the activity of disease, and the treatment of glucocorticoids may achieve a therapeutic effect by correcting the immune imbalance.
Keywords: Sarcoidosis; T-lymphocytes; T-lymphocytes, helper-inducer; Glucocorticoids
结节病是一种系统性的肉芽肿性疾病,可以累及全身多个系统和器官,包括肺、淋巴结和皮肤,其中胸部是其最常累及的部位 [ 1] 。结节病的病因和发病机制尚不明确,但普遍认为CD4 + T细胞介导的免疫病理机制参与了结节病的发生和发展,尤其是辅助性T细胞(Th细胞)1型免疫反应增强是结节病发病中重要的机制之一 [ 2] 。然而,活化的CD4 +T细胞能分化为多种功能的效应性T细胞,如Th1、Th2、Th17、调节性T细胞(Treg细胞)等,其中Th17细胞通过分泌白细胞介素(IL)-17A、IL-22等炎性细胞因子在支气管哮喘、炎症性肠病、实验性自身免疫性脑脊髓炎等多种疾病中介导炎性反应 [ 3] ,并且在肉芽肿组织形成过程中发挥重要的作用,与Th1细胞协同作用,参与结节病的发病过程 [ 4] ;而Treg细胞则通过分泌抑炎性细胞因子如IL-10来抑制自身免疫应答达到免疫耐受的作用 [ 5] 。Th17/Treg细胞反应平衡状态在保持免疫耐受、抑制自身免疫反应中起着至关重要的作用。我们以结节病患者作为研究对象,以健康志愿者作为正常对照组,在糖皮质激素治疗前、后分别用酶反应连续监测法测定血清血管紧张素转化酶(serum angiotensin converting enzyme,SACE)含量,并采集外周血和支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF),采用流式细胞术测定外周血和BALF中Th17细胞和Treg细胞比例,酶联免疫吸附试验(ELISA)法测定血清及BALF上清液中相关细胞因子,实时荧光定量PCR测定相应的转录因子ROR-γt和Foxp3 mRNA表达水平,分析Th17/Treg细胞平衡与结节病患者疾病活动的相关性。
选择2009年1月~2013年12月在宁波市鄞州人民医院初次就诊的门诊或住院结节病患者,均经临床、影像学和病理学确诊,符合以下标准: ① 有明显临床症状:如咳嗽咳痰、胸闷气促、胸痛、关节疼痛、皮肤结节或红斑、发热、乏力、体质量减小等;② 胸部影像学检查可见明显异常:包括肺门或纵隔淋巴结肿大、肺实质浸润、胸腔积液等;③ SACE≥45 IU/L;④ 根据结节病的治疗建议 [ 6] ,需要接受系统性糖皮质激素的治疗(泼尼松片初始剂量为每天0.5mg/kg)。这些患者经糖皮质激素治疗4~6周后进入临床稳定期,符合以下标准: ① 无明显临床症状;② 胸部影像学表现较初诊时明显好转; ③ SACE<45 IU/L。同时排除以下患者:① 合并自身免疫性疾病,如支气管哮喘、系统性红斑狼疮、类风湿性关节炎、系统性硬化症、炎症性肠病、自身免疫性肝炎等;② 6个月内曾接受糖皮质激素治疗;③ 6个月内曾接受免疫抑制剂治疗。
共23例患者,其中女性12例,男性11例,平均年龄(50±11) 岁。表现咳嗽咳痰5例(21.74%)、胸闷气促6例(26.09%)、胸痛13例(56.52%)、关节疼痛3例(13.04%)、发热8例(34.78%)、乏力20例(86.96%)、体质量下降15例(65.22%)、皮肤结节或红斑5例(21.74%)。糖皮质激素治疗前作为活动期,糖皮质激素治疗后病情稳定作为稳定期。同时选取25名年龄和性别相匹配的健康志愿者为正常对照组,其中女性15名,男性10名,平均年龄(48±9) 岁。研究经本院医学伦理委员会讨论并通过,所有对象参加研究前须签署知情同意书。
流式细胞术采用的抗体(CD3a-FITC、CD4-FITC、CD8-PE-Cy5、CD25-PE-Cy5、Foxp3-PE、IL-17A-PE)均购自美国eBioscience公司。细胞刺激培养所需离子霉素、豆蔻酰佛波醇乙酯(Phorbol 12-myristate 13-acetate,PMA)、布雷菲德菌素(Brefeldin,BFA)购自美国ENZO Alexis-Biomol公司,胞内检测所需固定破膜试剂盒、外周血总RNA提取试剂盒及荧光定量PCR所需试剂购自美国Invitrogen公司,所需引物、探针由上海生工生物工程技术服务有限公司合成。ELISA试剂盒[IL-1β、IL-6、IL-17A、转化生长因子β(TGF-β)和IL-10]均购自美国eBiosicene公司。SACE检测试剂购自宁波美康生物科技有限公司。主要仪器为FACSCantoTMⅡ流式细胞仪(美国BD公司),ABI 7500 Sequence Detection System荧光定量PCR仪(美国Applied Biosystems公司),Model 680型酶标仪(美国BIO-RAD公司),D-37520低温高速离心机(德国Legend RT公司),COBAS C501全自动生化分析仪(瑞士Roche公司)。
结节病患者糖皮质激素治疗前及治疗后均行常规支气管镜检查,检查过程中采用温生理盐水50mL进行支气管肺泡灌洗,留取20 mL BALF,2h内提取BALF中的细胞供流式细胞术检测;另取BALF 5mL以1000 × g离心5 min,留取上清液冻存于-20℃待测细胞因子。
采取静脉血2~3mL,加入不抗凝试管,血液凝固后2500 × g离心5min,分离血清,采用酶反应连续监测法在全自动生化分析仪上检测SACE水平。
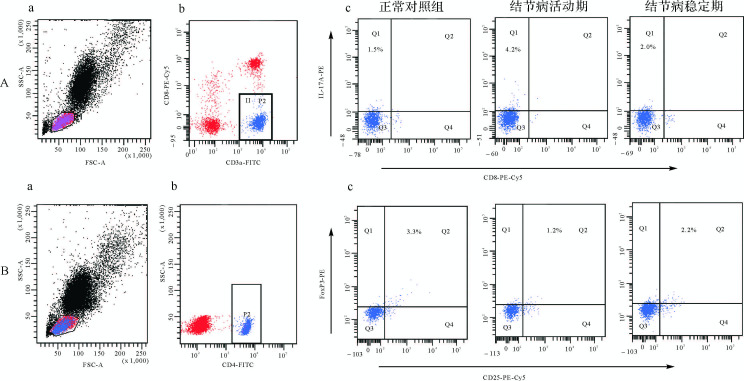
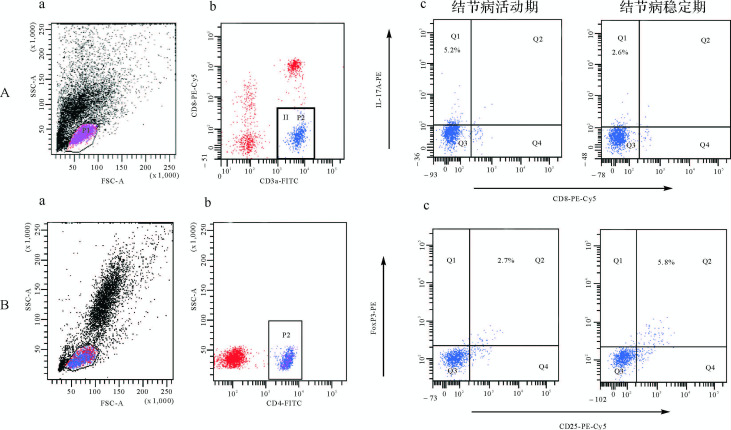
采取抗凝处理的外周血2mL用于分离外周血单个核细胞。外周血单个核细胞和BALF分离所得细胞均用磷酸盐缓冲液(PBS)调节为2×10 6/mL的浓度,铺至24孔细胞培养板,并在RPMI 1640培养液中加入10%胎牛血清。每孔加入PMA 2.5μL(终浓度50ng/mL)和离子霉素2μL(终浓度1μg/mL),混匀后放入37℃、5%二氧化碳细胞培养箱中进行刺激培养。4h后每孔加入BFA 2μL(终浓度10μg/mL)进行阻断。阻断2 h后收集细胞,分别加入FITC标记的CD3a抗体和PE-Cy5标记的CD8抗体,4℃避光孵育30 min,用PBS洗涤后加入固定破膜试剂盒(Fix & Perm Kit)中的A剂(固定剂)100μL进行固定,混匀后室温避光孵育15min。用PBS洗涤后每管加入Fix & Perm Kit中试剂B(破膜剂)100μL,加入PE标记的IL-17A单克隆抗体,4℃避光孵育30 min。用PBS洗涤一次后用500μL PBS重悬细胞,上机分析检测Th17细胞。外周血单个核细胞和BALF细胞加入FITC标记的CD4单克隆抗体、PE-Cy5标记的CD25单克隆抗体和PE标记的Foxp3抗体,根据操作说明书检测Treg细胞。每次检测均设立同型对照。Th17细胞比例表示CD3a +CD8 -IL-17A + T细胞(即Th17细胞)占CD3a +CD8 - T细胞(即CD4 + T细胞)的比值;Treg细胞比例表示Treg细胞(即CD4 +CD25 +-Foxp3 + T细胞)占CD4 + T细胞的比值。
用试剂盒提取外周血总RNA,并逆转录成cDNA。以GAPDH作为内参照,采用实时荧光定量PCR法检测外周血Treg细胞转录因子Foxp3 mRNA和Th17细胞转录因子ROR-γt mRNA。引物序列:GAPDH:上游引物:5’-CAA CAG CGA CAC CCA CTC CT-3’、下游引物:5’-CAC CCT GTT GCT GTA GCC AAA-3’ [ 7] ;Foxp3:上游引物:5’-GAG AAG CTG AGT GCC ATG CA-3’、下游引物:5’-AGA GCC CTT GTC GGA TGA T-3’ [ 8] ;ROR-γt:上游引物:5’-TGA GAA GGA CAG GGA GCC AA-3’、下游引物:5’-CCA CAG ATT TTG CAA GGG ATC A-3’ [ 9] 。结果以Foxp3和ROR-γt对GAPDH的CT校正值表示(CT校正值=目的基因CT值/内参基因CT值)。
采用ELISA法检测血清和BALF上清液中IL-1β、IL-6、IL-17A、TGF-β和IL-10的浓度,实验步骤按试剂盒说明书进行。
采用SPSS 11.0统计软件进行统计学处理,所有的计量数据均表示为均值±标准差( x ± s)。组间比较采用单因素方差分析。相关性分析采用Pearson分析,相关系数用 r表示。 P<0.05为差异有统计学意义。
与正常对照组[(23.96±4.25) IU/L]比较,活动期患者SACE水平[(69.70±16.34) IU/L]明显增高( P<0.01),稳定期患者SACE水平[(33.43±7.38) IU/L]明显下降( P<0.01),但仍未降至正常,提示SACE水平与结节病活动程度相关。
与正常对照组比较,结节病活动期患者外周血Th17细胞比例明显增高( P<0.01),稳定期患者Th17细胞比例较活动期患者显著下降( P<0.01),但仍高于正常对照组( P<0.05)。而外周血Treg细胞比例则呈现与Th17细胞相反的趋势。同时,结节病稳定期患者BALF中Th17细胞比例较活动期患者显著下降( P<0.01),Treg细胞比例则显著上升( P<0.01),见 图 1、 图 2和 表 1。
表1 各组外周血和BALF中Th17细胞、Treg细胞比例比较
Table 1 The ratio of Th17 cells/ Treg cells in peripheral blood and BALF in different groups
|
(X x ± s,pg/mL) | |||||||
|
检测指标 |
外周血 |
BALF |
|||||
|
正常对照组( n=25) |
结节病活动期( n=23) |
结节病稳定期( n=23) |
结节病活动期( n=23) |
结节病稳定期( n=23) |
|||
|
Th17细胞比例(%) |
1.60±0.42 |
4.34±0.89 ** |
2.16±0.68 *△△ |
5.20±0.77 |
2.60±0.57 △△ |
||
|
Treg细胞比例(%) |
3.39±0.50 |
1.28±0.37 ** |
2.21±0.42 **△△ |
2.54±0.53 |
5.83±0.67 △△ |
||
|
Th17/Treg比值 |
0.48±0.17 |
3.70±1.44 ** |
1.00±0.33 **△△ |
2.15±0.60 |
0.45±0.11 △△ |
||
|
与正常对照组比较, ** P<0.01;与结节病活动期比较, △△ P<0.01. |
同时,结节病患者外周血Th17 / Treg细胞比值明显失衡。与正常对照组相比,结节病活动期患者外周血Th17 / Treg细胞比值显著增加( P<0.01),而稳定期患者该比值则明显下降( P<0.01),但仍高于正常对照组( P<0.01)。此外,经过糖皮质激素治疗后的结节病稳定期患者BALF中Th17 / Treg细胞比值较结节病活动期患者亦明显下降( P<0.01)。见 表 1。
正常对照组、结节病活动期、结节病稳定期患者外周血Foxp3 mRNA表达水平分别为3.12±0.76、1.60±0.2、2.44±0.38,结节病活动期患者明显低于正常对照组( P<0.01),结节病稳定期患者外周血Foxp3表达明显升高( P<0.01),但仍低于正常对照组( P<0.05)。正常对照组、结节病活动期、结节病稳定期患者RORγt mRNA表达水平分别为3.63±1.00、21.31±3.5、10.15±1.93,结节病活动期患者明显高于正常对照组( P<0.01),结节病稳定期患者外周血RORγt表达明显下降( P<0.01),但也仍高于正常对照组( P<0.01)。Pearson相关分析显示,Th17细胞比例与ROR-γt的相关系数为0.854,Treg细胞比例与Foxp3相关系数为0.640,均呈显著正相关( P<0.01),表明外周血转录因子ROR-γt和Foxp3的表达变化趋势与Th17细胞和Treg细胞比例变化趋势一致。
结节病活动期患者血清中IL-1β、IL-6、IL-17A和TGF-β水平均明显高于正常对照组(均 P<0.01),结节病稳定期患者血清中上述细胞因子水平均明显下降(均 P<0.01),但仍高于正常对照组(均 P<0.01)。与正常对照组相比,结节病活动期患者血清中IL-10的水平明显降低,结节病稳定期患者血清IL-10水平则显著回升( P<0.01),但仍低于正常对照组( P<0.01)。同时,结节病稳定期患者BALF上清液中IL-1β、IL-6、IL-17A和TGF-β水平较结节病活动期患者亦明显下降(均 P<0.01),而IL-10水平则明显回升( P<0.01)。见 表 2。
表2 各组血清和BALF上清液细胞因子水平比较
Table 2 The levels of cytokines in serum and BALF supernatants in different groups(X x ± s, pg/mL)
|
(X x ± s,pg/mL) | |||||||
|
细胞因子 |
血清 |
BALF上清液 |
|||||
|
正常对照组( n=25) |
结节病活动期( n=23) |
结节病稳定期( n=23) |
结节病活动期( n=23) |
结节病稳定期( n=23) |
|||
|
IL-1β |
4.00±0.94 |
21.17±2.89 ** |
7.53±2.56 **△△ |
16.78±2.02 |
6.26±1.03 △△ |
||
|
IL-6 |
16.64±2.13 |
76.19±12.88 ** |
31.23±7.38 **△△ |
67.33±10.54 |
28.26±7.21 △△ |
||
|
IL-17A |
8.23±2.22 |
48.53±12.35 ** |
19.25±6.43 **△△ |
30.54±9.25 |
12.62±5.89 △△ |
||
|
TGF-β |
237.39±34.44 |
1344.02±231.95 ** |
320.30±105.44 **△△ |
789.35±108.26 |
278.10±38.51 △△ |
||
|
IL-10 |
167.96±24.55 |
43.25±11.00 ** |
131.06±25.27 **△△ |
65.88±15.15 |
125.55±23.60 △△ |
||
|
与正常对照组比较, ** P<0.01;与结节病活动期比较, △△ P<0.01. |
Pearson相关性分析结果显示,SACE水平与外周血Th17细胞比例、Th17/Treg细胞比值呈正相关( r=0.808、0.781,均 P<0.01),而与外周血Treg细胞比例呈负相关( r=-0.731, P<0.01)。由于SACE水平是结节病患者疾病活动程度的标志,推测Th17/Treg细胞平衡失调程度与结节病患者的疾病活动程度相关。
本研究发现,活动期结节病患者外周血及BALF中Th17细胞比例、相关细胞因子IL-1β、IL-6、IL-17A、TGF-β及转录因子ROR-γt mRNA表达水平明显升高,糖皮质激素治疗后上述指标均下降;而Treg细胞比例、细胞因子IL-10及转录因子Foxp3 mRNA表达水平则明显下降,糖皮质激素治疗后上述指标均回升。Th17/Treg细胞比值与外周血SACE水平呈显著正相关。因而推测细胞免疫学机制尤其是CD4 +T细胞的数量和功能变化在结节病的发病以及疾病活动中发挥着重要作用。
CD4 +T细胞通过协助其他细胞的分化在免疫应答的起始过程中发挥着重要的作用。抗原刺激以后,初始型CD4 +T细胞分化为不同的效应性T细胞亚群。Th17是近年来发现的重要效应性T细胞 [ 10] ,能选择性地产生促炎症细胞因子IL-17、IL-21和IL-22。在小鼠中,Th17的分化是由TGF-β、IL-6 [ 11, 12] 和IL-21通过诱导转录因子RORγt [ 13] 和活化STAT3的表达来起始的。IL-23也能活化STAT3,有助于小鼠体内Th17细胞的持续存在。在人类,IL-1β、IL-6和IL-23促进了Th17细胞的分化 [ 14] 。IL-17(或IL-17A)是IL-17家族细胞因子的原型,主要由T细胞产生。IL-17的受体(IL-17R或IL-17AR)在各种器官如肺、肾、肝和脾等分布广泛 [ 15] 。当IL-17R介导的信号途径被激活时,就产生趋化因子如CXCL8/IL-8和细胞因子如G-CSF、IL-6等,从而导致中性粒细胞的增殖和聚集。IL-17被认为是T细胞介导的慢性炎症性疾病中的一种重要的致病因子,也是这些疾病的一个有前景的治疗靶点。结节病的发病机制目前尚不明确,但免疫病理学机制在结节病的发病中发挥了重要作用。既往研究发现结节病患者体内Th1型免疫应答增强,而Th17细胞以及相关细胞在结节病发病中的作用目前国内外研究尚少。有学者发现,在结节病患者的皮肤结节中Th17细胞发育相关细胞因子通路如IL-21、IL-23通路功能异常 [ 16] 。另一项研究发现,在结节病患者外周血及肉芽肿组织中IL-17A +T细胞和IL-22 +T细胞的比例明显增加 [ 17] 。我们的研究结果也发现,在结节病患者活动期外周血及BALF中Th17细胞比例以及相关细胞因子IL-17A明显升高,表明在结节病的发病中Th17型免疫反应明显增强,可能与结节病的发病有关。
业已发现,Treg细胞与Th17细胞的分化和功能相互抑制,Th17/Treg细胞平衡对维持免疫内环境的稳定起重要作用 [ 18] ,Th17/Treg细胞失衡可引起全身或局部免疫应答异常,导致自身免疫性疾病、持续感染、肿瘤等疾病。众多因素可影响两者数量或功能的平衡。TGF-β在Treg细胞分化过程中具有双重作用,当机体处于稳定状态或无病原体刺激的情况下,TGF-β抑制效应性T细胞的功能,诱导初始T细胞分化为Foxp3 +Treg细胞,从而维持免疫耐受,防止自身免疫性疾病的发生。当感染、病原体入侵或自身抗原刺激时,IL-6和其他炎症因子大量分泌,与TGF-β共同作用抑制Treg细胞分化,并促进Th17细胞分化,从而介导炎症反应 [ 11] 。由此可见,Treg细胞或Th17细胞在免疫应答中是否占主导地位取决于周围环境中IL-6含量。除了IL-6,其他的一些因素如维甲酸、雷帕霉素或者IL-2、IL-27等细胞因子也对Th17/Treg细胞平衡起重要作用。关于Treg细胞比例在结节病患者中的变化,既往的研究结果尚无定论。Mroz等 [ 19] 发现肺结节病患者痰及BALF中Treg细胞比例是增加的;而我们的研究发现,结节病活动期患者外周血及BALF中Treg细胞比例及相关细胞因子IL-10水平是降低的,与另一项研究结果一致 [ 20] 。究其原因,可能与研究选择的患者群体、患者数量以及检测方式不尽相同有关。另外,我们还发现,结节病活动期患者外周血及BALF上清液中细胞因子IL-1β、IL-6、TGF-β水平明显增高。根据Th17细胞和Treg细胞分化发育特点,当周围环境中IL-1β、IL-6、TGF-β均高分泌时,CD4 +T细胞将会向Th17细胞方向分化发育,从而抑制Treg细胞的分化发育。这与本研究中外周血ROR-γt和Th17细胞比例上升、Foxp3和Treg细胞比例下降相符合,并最终导致Th17/Treg细胞比值明显增高,Th17/Treg细胞失衡,这也可能是结节病发病和疾病进展的免疫学机制之一。
SACE是由结节病肉芽肿中活化的巨噬细胞及上皮样细胞分泌的,它的升高能反映结节病病情活动且与结节病病变范围有一定相关性 [ 21] 。本研究发现结节病活动期患者SACE水平明显增高,经激素治疗后SACE水平明显下降,其变化趋势与Th17细胞以及Th17/Treg细胞比值变化趋势一致,表明Th17/Treg细胞失衡程度与结节病的疾病活动程度密切相关。而且,作为一种免疫抑制剂,糖皮质激素的治疗是通过抑制免疫病理变化来控制疾病活动及进展的,因此可以解释,经过激素治疗后,结节病患者外周血及BALF中Th17细胞及相关细胞因子水平下降,而Treg细胞比例回升,Th17/Treg细胞失衡得到一定程度的纠正。这从另一个角度说明结节病的发病、疾病进展和预后可能都与CD4 +T细胞免疫功能异常尤其是Th17/Treg细胞失衡密切相关。
综上所述,Th17/Treg细胞失衡参与了结节病的发生和疾病进展过程,并可能导致结节病肉芽肿的产生和持续存在。该细胞失衡程度可能与结节病的疾病严重程度密切相关。本研究结果为揭示结节病的发病机制提供了新的视点,上述T淋巴细胞以及相关细胞因子可能成为结节病诊断和疗效判断以及预后的新型生物标志物,也为研制结节病免疫调节或免疫治疗的新药提供一定的理论依据。
Funding Statement
宁波市自然科学基金(2013A610237)
References
- 1.BAUGHMAN R P, LOWER E E, DU BOIS R M. Sarcoidosis. Lancet. 2003;361:1111e. doi: 10.1016/S0140-6736(03)12888-7. [DOI] [PubMed] [Google Scholar]
- 2.MORGENTHAU A S, IANNUZZI M C. Recent advances in sarcoidosis. Chest. 2011;139:174–182. doi: 10.1378/chest.10-0188. [DOI] [PubMed] [Google Scholar]
- 3.HIROTA K, MARTIN B, VELDHOEN M. Development, regulation and functional capacities of Th17 cells. Semin Immunopathol. 2010;32:3–16. doi: 10.1007/s00281-009-0187-y. [DOI] [PubMed] [Google Scholar]
- 4.FACCO M, CABRELLE A, TERAMO A, et al. Sarcoidosis is a Th1/Th17 multisystem disorder. Thorax. 2011;66(2):144–150. doi: 10.1136/thx.2010.140319. [DOI] [PubMed] [Google Scholar]
- 5.LEE Y K, MUKASA R, HATTON R D, et al. Developmental plasticity of Th17 and Treg cells. Curr Opin Immunol. 2009;21:274–280. doi: 10.1016/j.coi.2009.05.021. [DOI] [PubMed] [Google Scholar]
- 6.BRADLEY B, BRANLEY H M, EGAN J J, et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax. 2008;63 doi: 10.1136/thx.2008.101691. [DOI] [PubMed] [Google Scholar]
- 7.CAO X M, LUO X G, LIANG J H, et al. Critical selection of internal control genes for quantitative real-time RT-PCR studies in lipopolysaccharide-stimulated human THP-1 and K562 cells. Biochem Biophys Res Commun. 2012;427:366–372. doi: 10.1016/j.bbrc.2012.09.066. [DOI] [PubMed] [Google Scholar]
- 8.CHENG X, YU X, DING Y J, et al. The Th17/Treg imbalance in patients with acute coronary syndrome. Clin Immunol. 2008;127:89–97. doi: 10.1016/j.clim.2008.01.009. [DOI] [PubMed] [Google Scholar]
- 9.MOSMANN T R, COFFMAN R L. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145–173. doi: 10.1146/annurev.iy.07.040189.001045. [DOI] [PubMed] [Google Scholar]
- 10.LANGRISH C L, CHEN Y, BLUMENSCHEIN W M, et al. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med. 2005;201(2):233–240. doi: 10.1084/jem.20041257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.BETTELLI E, CARRIER Y, GAO W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 2006;441(7090):235–238. doi: 10.1038/nature04753. [DOI] [PubMed] [Google Scholar]
- 12.MANGAN P R, HARRINGTON L E, O'QUINN D B, et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature. 2006;441(7090):231–234. doi: 10.1038/nature04754. [DOI] [PubMed] [Google Scholar]
- 13.IVANOV I I, MCKENZIE B S, ZHOU L, et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17(+) T helper cells. Cell. 2006;126(6):1121–1233. doi: 10.1016/j.cell.2006.07.035. [DOI] [PubMed] [Google Scholar]
- 14.STETSON D B, MEDZHITOV R. T Helper 17 Cells Get the NOD. Immunity. 2007;27(4):546–548. doi: 10.1016/j.immuni.2007.10.005. [DOI] [PubMed] [Google Scholar]
- 15.MOSELEY T A, HAUDENSCHILD D R, ROSE L, et al. Interleukin-17 family and IL-17 receptors. Cytokine Growth Factor Rev. 2003;14(2):155–174. doi: 10.1016/S1359-6101(03)00002-9. [DOI] [PubMed] [Google Scholar]
- 16.JUDSON M A, MARCHELL R M, MASCELLI M, et al. Molecular profiling and gene expression analysis in cutaneous sarcoidosis: the role of interleukin-12, interleukin-23, and the T-helper 17 pathway. J Am Acad Dermatol. 2012;66(6):901–10. doi: 10.1016/j.jaad.2011.06.017. [DOI] [PubMed] [Google Scholar]
- 17.TEN BERGE B, PAATS M S, BERGEN I M, et al. Increased IL-17A expression in granulomas and in circulating memory T cells in sarcoidosis. Rheumatology (Oxford) 2012;51(1):37–46. doi: 10.1093/rheumatology/ker316. [DOI] [PubMed] [Google Scholar]
- 18.WEAVER C T, HARRINGTON L E, MANGAN P R, et al. Th17: an effector CD4 T cell lineage with regulatory T cell ties. Immunity. 2006;24(6):677–688. doi: 10.1016/j.immuni.2006.06.002. [DOI] [PubMed] [Google Scholar]
- 19.MROZ R M, KORNILUK M, STASIAK-BARMUTA A, et al. Increased levels of Treg cells in bronchoalveolar lavage fluid and induced sputum of patients with active pulmonary sarcoidosis. Eur J Med Res. 2009;14 doi: 10.1186/2047-783X-14-S4-165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.HUANG H, LU Z, JIANG C, et al. Imbalance between Th17 and regulatory T-cells in sarcoidosis. Int J Mol Sci. 2013;14(11):21463–21473. doi: 10.3390/ijms141121463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.PRASSE A, KATIC C, GERMANN M, et al. Phenotyping sarcoidosis from a pulmonary perspective. Am J Respir Crit Care Med. 2008;177:330–336. doi: 10.1164/rccm.200705-742OC. [DOI] [PubMed] [Google Scholar]