Abstract
目的
研究他汀类药物能否协同增强组蛋白去乙酰化酶抑制剂辛二酰苯胺异羟肟酸(SAHA)对非小细胞肺癌A549细胞的生长抑制和凋亡诱导作用。
方法
采用磺酰罗丹明B比色法检测不同浓度的SAHA与洛伐他汀/辛伐他汀合用对A549细胞存活率的影响; 采用Annexin V/PI双染结合流式细胞术检测2.5μmol/L SAHA与不同浓度的洛伐他汀联合应用对A549细胞凋亡的影响; 并采用蛋白质印迹法检测2.5μmol/L SAHA与5μmol/L洛伐他汀联合作用对凋亡相关标志蛋白聚腺苷二磷酸核糖聚合酶(c-PARP)及p21蛋白表达水平影响。
结果
与SAHA组比较, 洛伐他汀/辛伐他汀与SAHA合用组减少A549细胞的存活率。不同浓度的洛伐他汀能协同增加SAHA对A549细胞的凋亡诱导作用, 同时合用组c-PARP的表达较单用两组增加, 说明洛伐他汀能协同SAHA诱导A549细胞凋亡。2.5μmol/L SAHA单独作用A549细胞48 h可以上调A549细胞p21蛋白的表达, 5μmol/L洛伐他汀与2.5μmol/L SAHA合用可以回调p21蛋白的表达。
结论
洛伐他汀及辛伐他汀能增加SAHA对非小细胞肺癌A549细胞的生长抑制作用, 其中洛伐他汀增强SAHA对A549细胞的生长抑制作用可能与其共同作用后p21蛋白表达下调相关。
Abstract
Objective
To evaluate the anti-tumor effect of the combination of suberoylanilide hydroxamic acid(SAHA) with statins(lovastatin or simvastatin) on non-small cell lung carcinoma(NSCLC) cells.
Methods
Human NSCLC A549 cells were treated with SAHA in combination of lovastatin or simvastatin. The cell growth was analyzed by SRB method, and the apoptosis of A549 cells was assessed by flow cytometer. The expression of cleaved poly-ADP-ribose polymerase(cleaved-PARP) and p21 protein was analyzed by Western-blotting when A549 cells were challenged with 2.5μmol/L SAHA and 5μmol/L lovastatin.
Results
Lovastatin and simvastatin synergized SAHA in the inhibition of A549 cells. SAHA induced apoptosis was also enhanced by lovastatin. Treatment with 2.5μmol/L SAHA significantly up-regulated the expression of p21 protein in 48 h, while the protein expression was reduced in combined treatment with 5μmol/L lovastatin.
Conclusion
Statins can synergize the anti-tumor effect of SAHA in human NSCLC cells through a p21-dependent way.
Keywords: Carcinoma, non-small-cell lung/drug therapy; Lovastatin/pharmacology; Simvastatin/pharmacology; Drug synergism; Proto-oncogene proteins p21(ras)
辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)是经典的组蛋白去乙酰化酶抑制剂,2006年10月获美国食品药品监督管理局批准用于治疗加重、持续和复发或用两种全身性药物治疗后无效的皮肤T细胞淋巴瘤。尽管大量的临床试验表明实体瘤患者对SAHA具有良好的耐受性,但其单药对实体瘤的疗效不显著,在SAHA单药治疗非小细胞肺癌、乳腺癌、前列腺癌、头颈部肿瘤、甲状腺癌等的临床试验中均不能使病例缓解 [ 1, 2, 3, 4] 。因此,寻求合适的药物联合应用方案,以期拓展SAHA的临床应用显得尤为重要。
洛伐他汀是胆固醇合成过程中的羟甲戊二酰辅酶A还原酶的抑制剂。近年来,有大量实验证明,洛伐他汀可能对结肠癌、卵巢癌、前列腺癌、乳腺癌、非小细胞肺癌等实体瘤有一定的抑制作用 [ 5, 6, 7, 8] 。辛伐他汀与洛伐他汀结构非常相似,是在对洛伐他汀化学结构改造后得到的新一代羟甲戊二酰辅酶A还原酶抑制剂。因此,本研究尝试将SAHA分别与洛伐他汀或辛伐他汀联用,初步探讨两者联合治疗非小细胞肺癌的可行性。
人非小细胞肺癌A549购自中国科学院上海生命科学研究院细胞资源中心。SAHA、洛伐他汀和辛伐他汀购自美国Selleck公司;F-12培养基和FBS购自美国Hyclone公司;磺酰罗丹明B(SRB)粉末购自美国Sigma公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国Invitrogen公司;剪切的聚腺苷二磷酸聚合酶(cleaved poly ADP-ribose polymerase, c-PARP)抗体、p21抗体和肌动蛋白β-actin抗体均购自美国Santa Cruz公司;HRP标记的二抗购自中国联科生物公司;蛋白含量测定试剂盒购自美国Bio-Rad公司;ECL化学发光试剂盒购自美国Pierce公司。FACS Calibur流式细胞仪购自美国BD biosciences公司。
分别用DMSO将SAHA、洛伐他汀或辛伐他汀配制成50 mmol/L、100 mmol/L和20 mmol/L储备液,20 ℃储存。A549细胞用含10%FBS的F-12培养基培养于含5%二氧化碳、37 ℃细胞培养箱中。当细胞密度达90%时,将其消化并接种于96孔板中,每孔3×10 3,贴壁后分别给予不同浓度的SAHA(0.625、1.25、2.5、5、10 μmol/L)和洛伐他汀(3.125、6.25、12.5、25、50 μmol/L)或辛伐他汀(3.125、6.25、12.5、25、50 μmol/L),作用72 h后,用100 μL预冷的10%三氯乙酸固定。自来水冲洗5遍,空气中自然干燥。然后每孔加入100 μL 4 mg/mL SRB溶液染色15 min,弃去染色液,用1%冰醋酸洗5次,去除未结合的染料。自然干燥后每孔加入100 μL 10 mmol/L Tris碱溶液,酶标仪515 nm波长下测定吸光度值,计算细胞存活率。细胞存活率(%)=吸光度值(处理组—空白组)/对照组吸光度值×100%。
根据不同浓度的药物单用及合用抑制率,采用Calcusyn软件对两种药物不同浓度单用抑制率及相应浓度合用抑制率等数据进行分析处理,得到合用指数值。根据合用指数定义,小于0.9为协同作用,0.9~1.10为叠加作用,大于1.10为拮抗作用。
将A549细胞接种于六孔板中,每孔2×10 5,贴壁后分别单独或者共同给予2.5 μmol/L SAHA和不同浓度的洛伐他汀(1.25、2.5、5 μmol/L),收集药物作用24 h后的细胞,PBS洗两遍,按照说明书指导分别加入PI和Annexin V各5 μL避光染色15 min,过400目尼龙网,流式细胞仪检测细胞凋亡比例。
将A549细胞接种于六孔板中,每孔2×10 5,贴壁后分别单独或者共同给予2.5 μmol/L SAHA和5 μmol/L洛伐他汀,收集经药物作用48 h后的细胞,用预冷的PBS洗两遍,加入适量的细胞裂解液,冰上裂解30 min,4 ℃ 16 100× g离心30 min后收集上清液,采用蛋白定量试剂盒测定上清液中蛋白浓度。取40 μg蛋白上样于SDS-PAGE电泳分离,电转移将蛋白转移至PVDF膜上。加入5%脱脂牛奶的T-PBS溶液作为封闭液封闭1 h,分别加入p21(1:500)、c-PARP(1:500) 和β-actin抗体(1:1000),4 ℃摇床孵育过夜,洗膜,加入二抗(1:5000) 室温孵育1 h,洗膜,用ECL化学发光试剂盒检测靶蛋白的表达。采用Image J 1.34i软件对蛋白条带进行光密度分析。
所有统计数据均来自于至少3次重复实验,计量数据以均数±标准差( x ± s)表示,均数间的差异用 t检验(双侧),多组均数差异比较采用方差分析, P < 0.05为差异具有统计学意义。
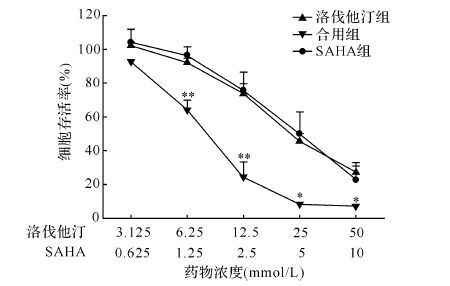
将不同浓度的洛伐他汀(3.125、6.25、12.5、25、50 μmol/L)单用、SAHA(0.625、1.25、2.5、5、10 μmol/L)单用或共同作用于A549细胞72 h后,不同浓度的洛伐他汀和SAHA对A549细胞存活率均有一定的抑制作用,合用组对细胞存活的抑制作用更强(均 P < 0.05)。其中2.5 μmol/L SAHA组、12.5 μmol/L洛伐他汀组和两药合用组A549细胞存活率分别为(75.6±10.8)%、(73.6±5.7)%和(24.2±9.1)%,见 图 1,提示洛伐他汀和SAHA对细胞抑制具有协同作用。0.625 μmol/L SAHA和3.125 μmol/L洛伐他汀合用指数值为0.62±0.25;1.25 μmol/L SAHA和6.25 μmol/L洛伐他汀合用指数值为0.59±0.09;2.5 μmol/L SAHA和12.5 μmol/L洛伐他汀合用指数值为0.68±0.16;合用指数均小于0.9,提示两药合用具有协同效果。上述结果提示,洛伐他汀与SAHA合用能协同抑制人非小细胞肺癌A549细胞的存活。
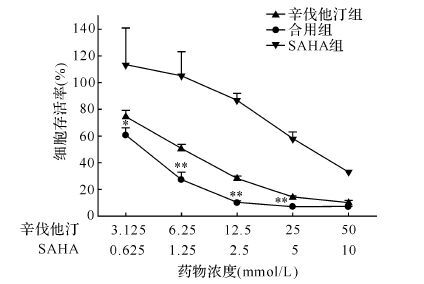
采用SRB法在人非小细胞肺癌A549单独或共同给予不同浓度的SAHA(0.625、1.25、2.5、5、10 μmol/L)和不同浓度的辛伐他汀(3.125、6.25、12.5、25、50 μmol/L),作用72 h后检测细胞存活率。结果显示,辛伐他汀与SAHA在不同浓度下对A549细胞都具有一定的生长抑制作用,当两药合用时,细胞生长抑制作用有一定程度增强(均 P < 0.05)。其中2.5 μmol/L SAHA、12.5 μmol/L辛伐他汀单用及合用时,三组的A549细胞存活率分别为(86.7±6.4)%、(28.0±2.3)%和(9.9±1.6)%,合用组细胞存活率低于单用药两组(均 P < 0.05,见 图 2)。0.625 μmol/L SAHA和3.125 μmol/L辛伐他汀合用指数值为0.79±0.07;1.25 μmol/L SAHA和6.25 μmol/L辛伐他汀合用指数值为0.56±0.10;2.5 μmol/L SAHA和12.5 μmol/L辛伐他汀合用指数值为0.52±0.23;合用指数均小于0.9,提示两药合用具有协同效果。以上结果提示,辛伐他汀在一定程度上能够协同SAHA抑制人非小细胞肺癌A549生长。
将2.5 μmol/L SAHA分别与不同浓度的洛伐他汀(1.25、2.5、5 μmol/L)作用A549细胞24 h,SAHA组细胞凋亡比例为(7.6±0.7)%,当分别与1.25、2.5、5 μmol/L的洛伐他汀合用时,细胞凋亡比例分别上升至(9.7±0.9)%、(12.7±0.8)%和(21.4±2.5)%,合用组细胞凋亡比例增加(均 P < 0.05)。
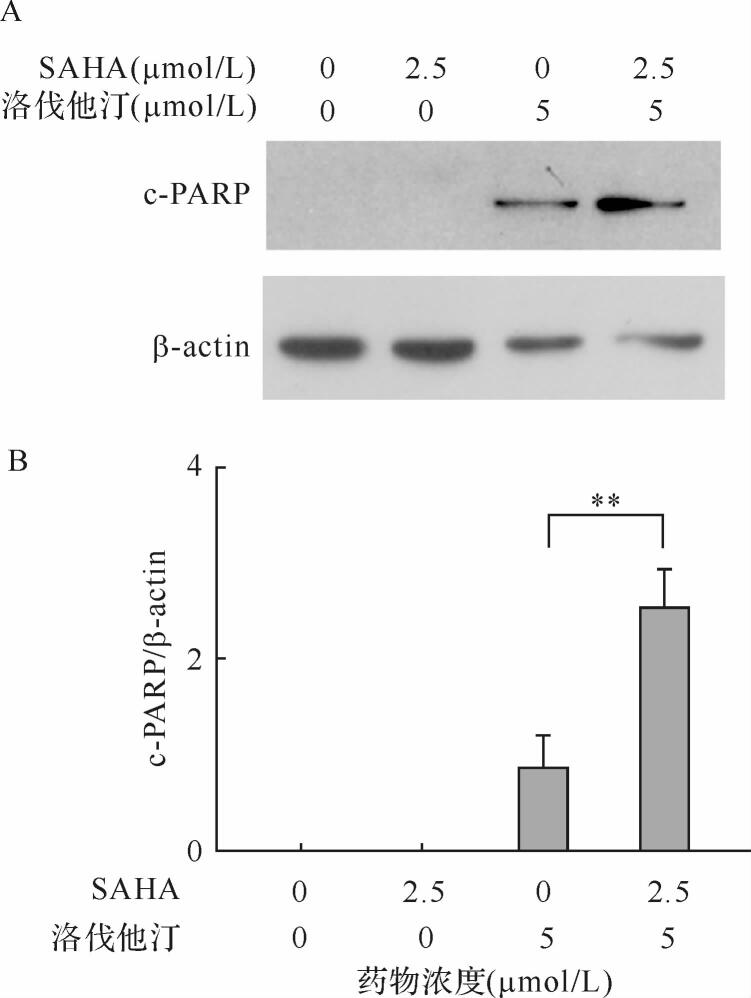
PARP蛋白的剪切是细胞凋亡的一个重要指标。为了进一步验证两药合用对A549细胞凋亡的影响,将2.5 μmol/L SAHA与5 μmol/L洛伐他汀单独或共同作用于A549细胞48 h,检测c-PARP蛋白的表达情况。如 图 3所示,合用组c-PARP表达较洛伐他汀组增加( P < 0.01)。提示洛伐他汀能协同增强SAHA对A549的凋亡诱导作用。
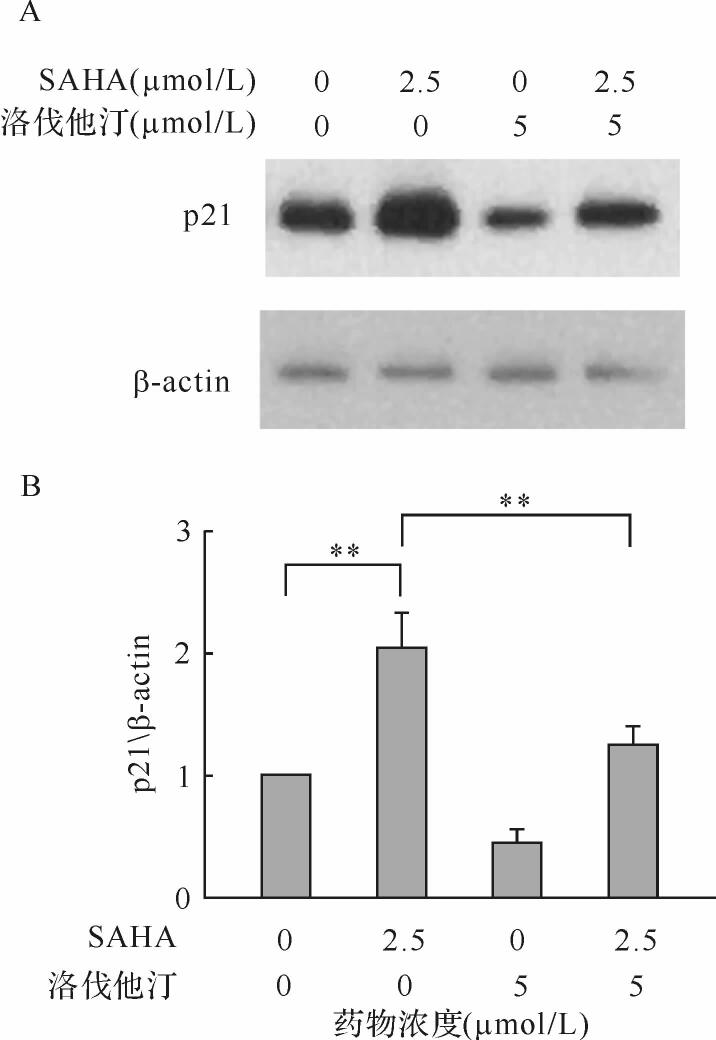
SAHA能上调A549细胞周期调控蛋白p21的表达水平;当洛伐他汀与SAHA合用时A549细胞p21蛋白表达下调(均 P < 0.01),见 图 4。该结果提示,洛伐他汀协同SAHA抑制人非小细胞肺癌细胞可能与p21蛋白的表达水平相关。
SAHA是羟胺酸类化合物,是第一个被批准上市的组蛋白去乙酰化酶抑制剂。至少有40个关于SAHA的临床试验正在开展,这是因为组蛋白去乙酰化酶抑制剂类药物可作用于细胞周期 [ 9] 、凋亡 [ 10] 、血管生成 [ 11] 、细胞分化和转型 [ 12] ,具有通过不同的作用机制治疗多种类型肿瘤的潜力。然而,结果并不乐观。尽管Ramalingam等 [ 13] 在I期临床试验中证明与顺铂和紫杉醇联合应用(SAHA每天一次口服400 mg或者每天两次口服300 mg)过程中,患者对SAHA表现出良好的耐受性,但在随后的II期临床试验中,SAHA单独应用对急性髓性白血病 [ 1] 、头颈癌 [ 2] 、卵巢癌 [ 3] 等患者并无明显治疗效果。鉴于SAHA单用在大部分实体瘤及白血病中疗效不佳,寻求合适的药物联合应用有望拓宽其在肿瘤治疗中的应用范围。因此,本研究分别将洛伐他汀或辛伐他汀与SAHA联合应用,观察其能否增加治疗肿瘤效果的作用。
洛伐他汀和辛伐他汀都是临床上广泛使用的降血脂药物。近年来,有大量文献报道,洛伐他汀和辛伐他汀可能降低肿瘤发生的风险,在体外对卵巢癌、非小细胞肺癌、结肠癌、神经胶质瘤等多种实体瘤具有一定的抑制作用 [ 14, 15] 。这启发我们洛伐他汀和辛伐他汀可能作为肿瘤治疗的辅助手段。
本研究采用对SAHA不敏感的人非小细胞肺癌A549细胞株 [ 16] ,发现不管是洛伐他汀还是辛伐他汀与SAHA合用都表现出良好的增效作用,可以显著抑制A549细胞生长。研究中检测洛伐他汀与SAHA合用对A549细胞凋亡影响时,选用的SAHA浓度为2.5 μmol/L,这是因为临床试验中SAHA普遍采用口服400 mg/d剂量,能达到的最大血药浓度为(1.8±0.7) μmol/L [ 17] ,选择2.5 μmol/L浓度与临床上能达到的血药浓度较为接近。
p21是近年来发现的细胞周期蛋白依赖性及酶抑制剂家族的重要成员,其与细胞凋亡密切相关,但其对细胞凋亡的影响仍然是众说纷纭。有文献报道,p21可阻止细胞凋亡,其机制可能是p21可以将细胞阻滞在S期或者G 2/M期,从而阻止DNA损伤或者是促进DNA修复 [ 18, 19, 20] 。在本研究中,我们发现SAHA作用后p21蛋白表达上升,可能发挥抗细胞凋亡作用,同时给予洛伐他汀后,p21蛋白的表达存在明显回调,故洛伐他汀可能通过下调p21蛋白的表达增强SAHA对人非小细胞肺癌生长的抑制作用。
综上所述,本研究结果表明洛伐他汀或辛伐他汀能够协同SAHA抑制人非小细胞肺癌A549细胞的增殖,促进肿瘤细胞的凋亡,其作用机制可能与调节p21蛋白表达有关。
Funding Statement
浙江省自然科学基金(LY14H310008);浙江省教育厅科研项目(Y201226213)
References
- 1.SCHAEFER E W, LOAIZA-BONILLA A, JUCKETT M, et al. A phase 2 study of vorinostat in acute myeloid leukemia. Haematologica. 2009;94(10):1375–1382. doi: 10.3324/haematol.2009.009217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.BLUMENSCHEIN R, KIES S, PAPA DIMITRAKOPOULOU A, et al. Phase II trial of the histone deacetylase inhibitor vorinostat(zolinzatrade mark, suberoylanilide hydroxamic acid, SAHA) in patients with recurrent and/or metastatic head and neck cancer. Invest New Drugs. 2008;26(1):81–87. doi: 10.1007/s10637-007-9075-2. [DOI] [PubMed] [Google Scholar]
- 3.MODESITT S C, SILL M, HOFFMAN J S, et al. A phase Ⅱ study of vorinostat in the treatment of persistent or recurrent epithelial ovarian or primary peritoneal carcinoma:a Gynecologic Oncology Group study. Gynecol Oncol. 2008;109(2):182–186. doi: 10.1016/j.ygyno.2008.01.009. [DOI] [PubMed] [Google Scholar]
- 4.GALANIS E, JAECKLE K A, MAURER M J, et al. Phase Ⅱ trial of vorinostat in recurrent glioblastoma multiforme:a north central cancer treatment group study. J Clin Oncol. 2009;27(12):3262–3263. doi: 10.1200/JCO.2008.19.0694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.MARCELLI M, CUNNINGHAM G R, HAIDACHER S J, et al. Caspase-7 is activated during lovastatin-induced apoptosis of the prostate cancer cell line LNCaP. Cancer Res. 1998;58(1):76–83. [PubMed] [Google Scholar]
- 6.SIDDIQUI R A, HARVEY K A, XU Z, et al. Characterization of lovastatin-docosahexaenoate anticancer properties against breast cancer cells. Bioorg Med Chem. 2014;22(6):1899–1908. doi: 10.1016/j.bmc.2014.01.051. [DOI] [PubMed] [Google Scholar]
- 7.OSMAK M. Statins and cancer:current and future prospects. Cancer Lett. 2012;324(1):1–12. doi: 10.1016/j.canlet.2012.04.011. [DOI] [PubMed] [Google Scholar]
- 8.SANLI T, LIU C, RASHID A, et al. Lovastatin sensitizes lung cancer cells to ionizing radiation:modulation of molecular pathways of radioresistance and tumor suppression. J Thorac Oncol. 2011;6(3):439–450. doi: 10.1097/JTO.0b013e3182049d8b. [DOI] [PubMed] [Google Scholar]
- 9.YAZBECK V Y, BUGLIO D, GEORGAKIS G V, et al. Temsirolimus downregulates p21 without altering cyclin D1 expression and induces autophagy and synergizes with vorinostat in mantle cell lymphoma. Exp Hematol. 2008;36(4):443–450. doi: 10.1016/j.exphem.2007.12.008. [DOI] [PubMed] [Google Scholar]
- 10.CAREW J S, MEDINA E C, ESQUIVEL II, et al. Autophagy inhibition enhances vorinostat-induced apoptosis via ubiquitinated protein accumulation. J Cell Mol Med. 2010;14(10):2448–2459. doi: 10.1111/jcmm.2010.14.issue-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.ELLIS L, HAMMERS H, PILI R. Targeting tumor angiogenesis with histone deacetylase inhibitors. Cancer Lett. 2009;280(2):145–153. doi: 10.1016/j.canlet.2008.11.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.MILDE T, KLEBER S, KORSHUNOV A, et al. A novel human high-risk ependymoma stem cell model reveals the differentiation-inducing potential of the histone deacetylase inhibitor vorinostat. Acta Neuropathol. 2011;122(5):637–650. doi: 10.1007/s00401-011-0866-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.RAMALINGAM S S, PARISE R A, RAMANANTHAN R K, et al. Phase I and pharmacokinetic study of vorinostat, a histone deacetylase inhibitor, in combination with carboplatin and paclitaxel for advanced solid malignancies. Clin Cancer Res. 2007;13(12):3605–3610. doi: 10.1158/1078-0432.CCR-07-0162. [DOI] [PubMed] [Google Scholar]
- 14.STINE J. The HMG-CoA reductase inhibitor, simvastatin, has anti-tumorigenic effects in ovarian cancer cell lines and a genetically engineered serous ovarian cancer mouse model. Gynecol Oncol. 2015;137:63–64. [Google Scholar]
- 15.WANG T, SEAH S, CHAN C, et al. Simvastatin induced apoptosis and suppressed proliferation of breast cancer through deactivating PI3K/Akt/mTOR pathway. Cancer Res. 2014;74(19 Suppl):2630. [Google Scholar]
- 16.OWONIKOKO T K, RAMALINGAM S S, KANTEREWICZ B, et al. Vorinostat increases carboplatin and paclitaxel activity in non-small-cell lung cancer cells. Int J Cancer. 2010;126(3):743–755. doi: 10.1002/ijc.v126:3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.DOI T, HAMAGUCHI T, SHIRAO K, et al. Evaluation of safety, pharmacokinetics, and efficacy of vorinostat, a histone deacetylase inhibitor, in the treatment of gastrointestinal(GI) cancer in a phase I clinical trial. Int J Clin Oncol. 2013;18(1):87–95. doi: 10.1007/s10147-011-0348-6. [DOI] [PubMed] [Google Scholar]
- 18.XIA M, KNEZEVIC D, VASSILEV L T. p21 does not protect cancer cells from apoptosis induced by nongenotoxic p53 activation. Oncogene. 2011;30(3):346–355. doi: 10.1038/onc.2010.413. [DOI] [PubMed] [Google Scholar]
- 19.DE RENTY C, DEPAMPHILIS M L, ULLAH Z. Cytoplasmic localization of p21 protects trophoblast giant cells from DNA damage induced apoptosis. PLoS One. 2014;9(5):e97434. doi: 10.1371/journal.pone.0097434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.KRACIKOVA M, AKIRI G, GEORGE A, et al. A threshold mechanism mediates p53 cell fate decision between growth arrest and apoptosis. Cell Death Differ. 2013;20(4):576–588. doi: 10.1038/cdd.2012.155. [DOI] [PMC free article] [PubMed] [Google Scholar]