Abstract
目的
研究外源过氧化物酶体增殖子激活受体(PPAR)γ高表达对小鼠原代肝细胞脂肪变性的影响。
方法
从5~6周龄C57BL/6J小鼠分离培养原代肝细胞, 分别用LacZ腺病毒(Ad/LacZ)或PPARγ腺病毒(Ad/PPARγ)感染细胞48 h, 油红O染色检测原代肝细胞脂肪积聚情况; 实时定量PCR和蛋白质印迹法分析PPARγ、成脂相关基因aP2和CideA等mRNA和蛋白表达水平。
结果
原代分离培养的小鼠肝细胞透光度好, 胞核圆且透亮, 细胞呈圆形生长, 有双核, 连接成片状或岛状。用Ad/LacZ或Ad/PPARγ感染48 h后, Ad/LacZ组肝细胞几乎无脂肪积聚, 而Ad/PPARγ感染肝细胞中有大量脂肪滴沉积。外源PPARγ刺激作用下, 肝细胞中PPARγ、aP2、FGF21、CideA mRNA表达增加, 而adiponectin mRNA表达下降(均 P < 0.05)。Ad/PPARγ感染后, PPARγ和aP2蛋白表达也增加。
结论
高表达PPARγ诱导小鼠原代肝细胞脂肪变性和脂肪相关基因表达。
Abstract
Objective
To investigate the effects of PPARγ overexpression on steatosis in mouse primary hepatocytes.
Methods
Primary hepatocytes isolated from C57BL/6J mice were infected with either Ad/LacZ or Ad/PPARγ for 48 h. Steatosis of the primary hepatocytes was checked by Oil Red O staining. The mRNA and protein expression of adipocyte-specific genes PPARγ, aP2 and CideA were analyzed by using RT Real-time PCR and Western Blot.
Results
Primary hepatocytes were small and even. Hepatocyte nuclei were round with dispersed chromatin and prominent nucleoli. Accumulated lipid droplets were observed in Ad/PPARγ-infected hepatocytes, but in Ad/LacZ-infected hepatocytes. Moreover, compared with Ad/LacZ-infected hepatocytes, the mRNA expression of PPARγ, aP2, FGF21 and CideA in Ad/PPARγ-infected hepatocytes were significantly induced, the protein expression of PPARγ and its target aP2 strongly increased.
Conclusion
over expression of PPARγ induces adipogenic steatosis in mouse primary hepatocytes.
Keywords: Mice, inbred C57BL; Hepatocytes/cytology; PPAR gamma/biosynthesis; Lipogenesis; Cells, cultured
肝脏是机体新陈代谢的中心站,发挥去氧化、解毒、储存肝糖、合成分泌性蛋白质等作用。众多研究表明,肝脏是脂质代谢的主要调控器官,调控脂肪生成、脂肪酸氧化、脂蛋白摄取和分泌等各个方面 [ 1, 2] 。肝脏脂肪代谢一旦发生紊乱,就会导致肥胖、脂肪肝、2型糖尿病和动脉粥样硬化等代谢综合征 [ 3] 。肝细胞是肝脏的实质细胞,占肝脏体积及数量的80%。肝细胞内代谢活跃,可合成人体必需的凝血因子、脂肪酸、胆固醇和磷脂等,并贮存糖原和脂类等。因而,研究肝细胞的脂肪代谢具有重要意义。
研究发现,肝脏脂肪代谢主要受过氧化物酶体增殖子激活受体(peroxisome proliferator-activated receptor,PPAR)家族调控 [ 4] 。PPAR家族主要有三个成员:PPARα、PPARγ和PPARβ/δ。PPARα和PPARβ/δ主要参与脂肪酸氧化代谢与能量消耗,而PPARγ主要参与脂肪细胞分化和能量储存 [ 5, 6] 。文献报道,外源表达PPARγ能促使NIH3T3成纤维细胞向脂肪细胞分化,并诱导脂肪生成相关基因的表达 [ 7] 。在正常肝脏中,PPARγ表达水平比较低,但在病理状态下,如脂肪肝模型(ob/ob和PPARα -/-)小鼠肝脏中PPARγ的表达明显增加 [ 8, 9] 。AZIP小鼠是一种脂肪缺乏性糖尿病小鼠模型,具有严重的胰岛素抵抗、高血糖和高脂血症。特异性敲除其肝脏PPARγ能缓解肝脏脂肪积聚 [ 10] 。外源表达PPARγ能够促进小鼠脂肪肝的形成 [ 11] 。那么,高表达PPARγ是否会导致原代肝细胞脂肪变性,并诱导脂肪特异性基因的大量表达呢?
本实验利用原代培养的C57BL/6J小鼠肝细胞,通过感染Ad/LacZ和Ad/PPARγ,研究了外源高表达PPARγ对肝细胞脂肪变性和成脂相关基因表达的影响。
5~6周龄,体质量为20 g左右的SPF级C57BL/6J小鼠由西安交通大学医学部医学实验动物中心SPF级动物房提供。小鼠在12 h/12 h明暗交替的环境中饲养,自由饮水。实验遵从西安交通大学动物中心的动物伦理规定以及相关条例,处理程序均符合美国NIH实验动物管理法和陕西省实验动物管理办法。
Hank's平衡盐溶液购自美国Hyclone公司;4-羟乙基哌嗪乙磺酸(HEPES)购自美国Gibco公司;胰酶抑制剂、胶原酶Ⅱ购自美国Sigma公司;RNAiso Plus、反转录酶试剂盒和SYBR试剂均购自日本TaKaRa公司;aP2和β-actin抗体购自美国Santa Cruz生物公司;PPARγ抗体购自英国abcam生物公司;引物序列由生工生物工程(上海)股份有限公司合成。Nikon Eclipse TE2000-U倒置显微镜购自日本尼康公司;Thermal Cycler Dice TP-800购自日本TaKaRa公司。
原代肝细胞取自C57BL/6J小鼠肝脏,用原位胶原酶灌流法分离肝细胞。首先,37 ℃预热溶液Ⅰ(不含钙离子和镁离子的Hank’s平衡盐溶液加入0.5 mmol/L EDTA)和溶液Ⅱ(含钙离子和镁离子的Hank’s平衡盐溶液加入10 mmol/L Hepes液、84 U/mL胶原酶Ⅱ和0.13 mg/mL胰酶抑制剂);然后,用苯巴比妥麻醉小鼠,打开腹部暴露出门静脉和下腔静脉,用12号针头插入门静脉,开始灌流溶液Ⅰ,同时剪断下腔静脉;用溶液Ⅰ灌流4 min,溶液Ⅱ灌流6 min;之后,钝性分离取出肝脏,用小梳子轻轻刮肝脏,使肝细胞分离出来,过滤细胞悬液,50× g离心5 min;弃上清液,加入含10%胎牛血清的DMEM培养基,细胞计数,接种;接种后4 h,待细胞贴壁,更换培养液,去掉死细胞和没有贴壁的细胞,感染Ad/LacZ或Ad/PPARγ 12 h,更换为正常培养液,继续培养36 h,收集细胞。
从二氧化碳培养箱中取出Ad/LacZ或Ad/PPARγ感染的原代肝细胞,弃掉培养液,用PBS冲洗三次,10%甲醛固定5 min;蒸馏水轻轻冲洗三次,加入100%丙二醇5 min,0.5%油红O染液60 ℃孵育8 min;之后,用85%丙二醇洗涤5 min,蒸馏水轻轻冲洗三次,用倒置显微镜观察拍照。
从小鼠肝细胞中提取总RNA检测RNA浓度及纯度;取1 μg总RNA进行反转录;做实时定量PCR,每个样品设置三个重复,以18S核糖体RNA为内参。20 μL实时定量PCR反应体系:2×SYBR Green Master Mix 10 μL,灭菌双蒸水6.4 μL,10 μmol/L的正向和反向引物各0.8 μL(引物序列见 表 1),cDNA 2.0 μL,PCR引物见 表 1。运用2 -ΔΔCt来分析基因相对表达水平,ΔΔCt=(Ct靶基因-Ct内参) 处理组-(Ct靶基因-Ct内参) 未处理组。
表1 实时定量PCR引物
Table 1 Primers for Real time PCR
|
基因名称 |
引物序列(5’-3’) |
|
PPARγ |
正向:CCACAGTTGATTTCTCCAGCATTTC |
|
反向:CAGGTTCTACTTTGATCGCACTTTG | |
|
aP2 |
正向:GAAGTGGGAGTGGGCTTTGC |
|
反向:TGTGGTCGACTTTCCATCCC | |
|
FGF21 |
正向:CTGCTGGGGGTCTACCAAG |
|
反向:CTGCGCCTACCACTGTTCC | |
|
CideA |
正向:TGACATTCATGGGATTGCAGAC |
|
反向:GGCCAGTTGTGATGACTAAGAC | |
|
adiponectin |
正向:GATGGCACTCCTGGAGAGAA |
|
反向:TCTCCAGGCTCTCCTTTCCT | |
|
Hkdc1 |
正向:GCCCACATTCGTCAGGGCCA |
|
反向:GGTGAAGCCCAGAGGCAGCTT | |
|
18S |
正向:AAACGGCTACCACATCCAAG |
|
反向:CCTCCAATGGATCCTCGTTA |
收集肝细胞蛋白样品,加入细胞裂解液,16 200× g 4 ℃离心20 min,取上清液进行蛋白定量。之后,加入5×SDS-PAGE蛋白上样缓冲液,100 ℃水浴3~5 min使蛋白变性。取20 μg总蛋白样品,用4%~20% SDS-PAGE电泳约90 min,用硝酸纤维素膜转膜,5%牛奶封闭液封闭60 min,一抗4 ℃孵育过夜,二抗室温孵育1 h,使用ECL试剂发光,在暗室中用暗盒压片、洗片,扫描记录结果。
实验数据以均数±标准差( x ± s)表示,用Student's t 检验对两组数据进行差异性检验, P < 0.05为差异有统计学意义。
采用原位胶原酶灌流法从C57BL/6J小鼠肝脏分离获取原代肝细胞。细胞接种6 h后开始贴壁,显微镜下观察细胞小而均匀、透光度好,细胞核圆形且透亮。细胞呈圆形生长,有双核,连接成片状或岛状( 图 1A, 1B)。Ad/LacZ或Ad/PPARγ感染12 h后,细胞仍然健康,贴壁细胞伸出多个伪足,呈多边形,相邻细胞连接成小片状( 图 1C, 1D)。
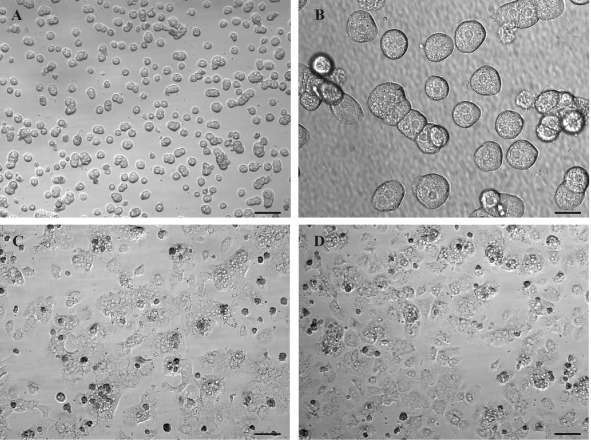
Ad/LacZ或Ad/PPARγ感染肝细胞48 h后,油红O染色显示,Ad/LacZ感染肝细胞几乎无脂肪积聚( 图 2A, 2B)。相反,Ad/PPARγ感染的小鼠肝细胞中有大量的脂肪积聚( 图 2C, 2D)。这些现象提示,外源高表达PPARγ能够增加肝细胞脂肪合成,促进肝细胞脂肪变性。

实时定量PCR检测结果表明,与Ad/LacZ感染比较,Ad/PPARγ感染的原代肝细胞中PPARγ mRNA表达升高276倍,aP2 mRNA表达升高192倍,FGF21 mRNA表达升高5.92倍,CideA mRNA表达升高5.41倍;而adiponectin的mRNA表达水平下降;Hkdc1 mRNA表达在两组间差异无统计学意义。见 表 2。
表2 Ad/PPARγ感染的原代肝细胞成脂基因mRNA表达变化
Table 2 Experssion of adipogenic related genes in Ad/PPARγ infected primary hepatocytes
|
( x ± s) | ||
|
基因 |
Ad/LacZ感染 |
Ad/PPARγ感染 |
|
PPARγ |
1.00±0.07 |
276.00±11.46 ** |
|
aP2 |
1.00±0.03 |
192.00±6.59 ** |
|
FGF21 |
1.00±0.16 |
5.92±0.46 * |
|
CideA |
1.00±0.05 |
5.41±1.31 * |
|
adiponectin |
1.00±0.15 |
0.42±0.06 * |
|
Hkdc1 |
1.00±0.16 |
0.94±0.13 |
|
与Ad/LacZ感染比较, * P < 0.05, ** P < 0.01. |
蛋白质印迹法检测结果表明,原代肝细胞Ad/PPARγ感染后,PPARγ、aP2蛋白表达增加;但在Ad/LacZ感染的原代肝细胞中几乎检测不到PPARγ、aP2蛋白表达,见 图 3。这些结果提示,外源PPARγ能刺激小鼠肝细胞脂肪变性所需的基因和蛋白表达。

PPARγ是脂肪组织发育和脂肪细胞分化所必需的转录因子 [ 12] 。研究发现,脂肪细胞分化诱导PPARγ表达,PPARγ通过刺激成脂关键基因表达,促进成熟脂肪细胞脂质的生成和储存 [ 7, 13] 。在培养的成纤维细胞中外源表达PPARγ能促进脂肪生成,并诱导成脂相关基因表达。PPARγ激动剂能以剂量依赖的方式促使PPARγ表达的细胞向成脂分化 [ 7] 。与此一致,PPARγ嵌合体小鼠表现出脂肪萎缩、脂肪肝和多处出血 [ 14] 。PPARγ缺失的细胞不能生成脂肪 [ 13] 。在肝脏中,虽然PPARγ表达较少,但也发挥着重要调控作用。PPARγ表达增加是脂肪肝的一个重要指标 [ 10] 。ob/ob小鼠呈现脂肪肝,这种表型与肝脏中PPARγ及脂肪生成基因如脂肪酸合酶、乙酰辅酶A羧化酶和硬脂酰辅酶A去饱和酶等表达的增加密切相关 [ 10, 15] 。体内研究表明,给小鼠尾静脉注射PPARγ导致脂肪肝生成,并诱导脂肪特异性基因和成脂相关基因的强烈表达 [ 16, 17] 。本研究中,外源给予PPARγ刺激,能够诱导原代肝细胞发生脂肪变性,且表达成脂相关基因,如PPARγ、aP2和CideA等。这是研究肝细胞脂质代谢的另外一种新形式。
PPARγ信号通路调控脂肪生成、胆固醇代谢、脂肪酸运输、脂肪酸氧化、脂肪细胞分化等多种脂类活动 [ 12] 。aP2是PPARγ的直接靶基因,在脂肪细胞中高表达,是脂肪细胞分化的标志基因,参与调控细胞内脂肪酸代谢。脂滴作为细胞质内主要的动态内含物,是细胞内脂肪的贮存库,脂滴表面覆盖有一些蛋白,称之为脂滴相关蛋白 [ 18] 。在甘油三酯合成过程中,脂滴蛋白覆盖在新生脂滴表面,发挥脂质储存功能 [ 18] 。研究发现,脂肪肝营养障碍小鼠的脂肪肝中脂滴相关蛋白表达显著上升 [ 19] 。脂滴相关蛋白主要包括PAT蛋白家族和Cide蛋白家族。研究报道,Cide蛋白家族成员CideA定位于脂滴表面,主要调控脂滴大小和脂肪水解。为了探讨高表达PPARγ诱导肝细胞脂肪变性的分子机制,我们也检测了脂滴相关蛋白的表达。结果显示,在PPARγ高表达的原代肝细胞中,脂肪分化的标志基因aP2和脂滴蛋白CideA表达水平升高,表明PPARγ能诱导脂肪合成相关基因的表达,促进肝细胞脂肪变性。
除了脂滴相关蛋白之外,研究发现,其他代谢通路也影响肝脏脂质积聚 [ 1, 20] 。代谢激素内分泌亚家族成员FGF21是肝脏葡萄糖和脂肪代谢的另一个关键调控子 [ 21, 22] 。FGF21通过降低甘油三酯水平来逆转肝脏的脂肪变性。FGF21减轻脂肪肝的这一功能主要是通过抑制SREBP-1和肝脏生脂通路及葡萄糖生成通路来实现的 [ 22] 。而且,在高脂日粮诱导的肥胖小鼠中,FGF21通过促进脂肪酸氧化和提高胰岛素敏感性来增加能量消耗 [ 22] 。本研究表明,肝细胞高表达PPARγ促进FGF21的表达,可能与FGF21是PPARγ的靶基因有关,也可能是肝脏脂肪变性的一种保护性反馈作用。
adiponectin是一种脂肪细胞分泌因子,参与调节血糖水平以及脂肪酸分解代谢,其表达量和血浆水平与肥胖和胰岛素抵抗成反比 [ 23] 。脂肪组织高表达adiponectin转基因小鼠脂肪细胞分化受阻,能量消耗增加 [ 24] 。adiponectin在治疗2型糖尿病、肥胖、非酒精性脂肪肝和动脉粥样硬化方面具有重要作用 [ 25, 26] 。有报道adiponectin能够通过降低肥胖小鼠肌肉和肝脏甘油三酯水平来降低胰岛素抵抗 [ 27] 。与以上研究一致,本研究中,我们发现在肝细胞脂肪变性过程中,adiponectin表达减少。此外,Hkdc1具有己糖激酶活性,在糖代谢中发挥重要调控作用。以往研究表明,外源表达PPARγ能够促进小鼠脂肪肝的形成,基因芯片和实时定量PCR检测结果表明Hkdc1在高表达PPARγ的肝脏组织中显著上调 [ 11] 。所以,PPARγ可能调控Hkdc1。然而,本研究结果显示,原代肝细胞中PPARγ高表达后,Hkdc1表达并无变化,可能由于体内与体外实验差别的缘故。
综上所述,高表达PPARγ能够诱导小鼠肝细胞脂肪变性,其分子生物学机制之一是通过PPARγ信号通路激活后,脂肪生成基因的表达增加,导致细胞质中脂滴过度积聚。本研究可以为深入研究肝脏脂质代谢分子生物学机制奠定实验基础。
Funding Statement
国家自然科学基金(81200207);中央高校基本科研业务费专项资金
References
- 1.ANDERSON N, BORLAK J. Molecular mechanisms and therapeutic targets in steatosis and steatohepatitis. Pharmacol Rev. 2008;60(3):311–357. doi: 10.1124/pr.108.00001. [DOI] [PubMed] [Google Scholar]
- 2.REDDY J K, RAO M S. Lipid metabolism and liver inflammation. II. Fatty liver disease and fatty acid oxidation. Am J Physiol Gastrointest Liver Physiol. 2006;290(5):G852–G858. doi: 10.1152/ajpgi.00521.2005. [DOI] [PubMed] [Google Scholar]
- 3.BOPPIDI H, DARAM S R. Nonalcoholic fatty liver disease:hepatic manifestation of obesity and the metabolic syndrome. Postgrad Med. 2008;120(2):E01–E07. doi: 10.3810/pgm.2008.07.1800. [DOI] [PubMed] [Google Scholar]
- 4.JIA Y, VISWAKARMA N, REDDY J K. Med1 subunit of the mediator complex in nuclear receptor-regulated energy metabolism, liver regeneration, and hepatocarcinogenesis. Gene Expr. 2014;16(2):63–75. doi: 10.3727/105221614X13919976902219. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.REDDY J K, GUO D, JIA Y, et al. Nuclear receptor transcriptional coactivators in development and metabolism. Adv Dev Biol. 2006;16:389–420. doi: 10.1016/S1574-3349(06)16012-3. [DOI] [Google Scholar]
- 6.SHAO X, WANG M, WEI X, et al. Peroxisome proliferator-activated receptor-gamma:master regulator of adipogenesis and obesity. Curr Stem Cell Res Ther. 2015 doi: 10.2174/1574888x10666150528144905. [DOI] [PubMed] [Google Scholar]
- 7.TONTONOZ P, HU E, SPIEGELMAN B M. Stimulation of adipogenesis in fibroblasts by PPAR gamma 2, a lipid-activated transcription factor. Cell. 1994;79(7):1147–1156. doi: 10.1016/0092-8674(94)90006-X. [DOI] [PubMed] [Google Scholar]
- 8.COSTET P, LEGENDRE C, MORE J, et al. Peroxisome proliferator-activated receptor alpha-isoform deficiency leads to progressive dyslipidemia with sexually dimorphic obesity and steatosis. J Biol Chem. 1998;273(45):29577–29585. doi: 10.1074/jbc.273.45.29577. [DOI] [PubMed] [Google Scholar]
- 9.MEMON R A, TECOTT L H, NONOGAKI K, et al. Up-regulation of peroxisome proliferator-activated receptors (PPAR-alpha) and PPAR-gamma messenger ribonucleic acid expression in the liver in murine obesity:troglitazone induces expression of PPAR-gamma-responsive adipose tissue-specific genes in the liver of obese diabetic mice. Endocrinology. 2000;141(11):4021–4031. doi: 10.1210/endo.141.11.7771. [DOI] [PubMed] [Google Scholar]
- 10.GAVRILOVA O, HALUZIK M, MATSUSUE K, et al. Liver peroxisome proliferator-activated receptor gamma contributes to hepatic steatosis, triglyceride clearance, and regulation of body fat mass. J Biol Chem. 2003;278(36):34268–34276. doi: 10.1074/jbc.M300043200. [DOI] [PubMed] [Google Scholar]
- 11.BAI L, JIA Y, VISWAKARMA N, et al. Transcription coactivator mediator subunit MED1 is required for the development of fatty liver in the mouse. Hepatology. 2011;53(4):1164–1174. doi: 10.1002/hep.24155. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.WANG Y X. PPARs:diverse regulators in energy metabolism and metabolic diseases. Cell Res. 2010;20(2):124–137. doi: 10.1038/cr.2010.13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.ROSEN E D, SARRAF P, TROY A E, et al. PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro. Mol Cell. 1999;4(4):611–617. doi: 10.1016/S1097-2765(00)80211-7. [DOI] [PubMed] [Google Scholar]
- 14.BARAK Y, NELSON M C, ONG E S, et al. PPAR gamma is required for placental, cardiac, and adipose tissue development. Mol Cell. 1999;4(4):585–595. doi: 10.1016/S1097-2765(00)80209-9. [DOI] [PubMed] [Google Scholar]
- 15.MATSUSUE K, HALUZIK M, LAMBERT G, et al. Liver-specific disruption of PPARgamma in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes. J Clin Invest. 2003;111(5):737–747. doi: 10.1172/JCI200317223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.WANG Y X, LEE C H, TIEP S, et al. Peroxisome-proliferator-activated receptor delta activates fat metabolism to prevent obesity. Cell. 2003;113(2):159–170. doi: 10.1016/S0092-8674(03)00269-1. [DOI] [PubMed] [Google Scholar]
- 17.YU S, VISWAKARMA N, BATRA S K, et al. Identification of promethin and PGLP as two novel up-regulated genes in PPARgamma1-induced adipogenic mouse liver. Biochimie. 2004;86(11):743–761. doi: 10.1016/j.biochi.2004.09.015. [DOI] [PubMed] [Google Scholar]
- 18.WOLINS N E, QUAYNOR B K, SKINNER J R, et al. OXPAT/PAT-1 is a PPAR-induced lipid droplet protein that promotes fatty acid utilization. Diabetes. 2006;55(12):3418–3428. doi: 10.2337/db06-0399. [DOI] [PubMed] [Google Scholar]
- 19.HALL A M, BRUNT E M, CHEN Z, et al. Dynamic and differential regulation of proteins that coat lipid droplets in fatty liver dystrophic mice. J Lipid Res. 2010;51(3):554–563. doi: 10.1194/jlr.M000976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.HUANG J, IQBAL J, SAHA P K, et al. Molecular characterization of the role of orphan receptor small heterodimer partner in development of fatty liver. Hepatology. 2007;46(1):147–157. doi: 10.1002/hep.v46:1. [DOI] [PubMed] [Google Scholar]
- 21.BADMAN M K, KOESTER A, FLIER J S, et al. Fibroblast growth factor 21-deficient mice demonstrate impaired adaptation to ketosis. Endocrinology. 2009;150(11):4931–4940. doi: 10.1210/en.2009-0532. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.XU J, LLOYD D J, HALE C, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice. Diabetes. 2009;58(1):250–259. doi: 10.2337/db08-0392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Díez J J, IGLESIAS P. The role of the novel adipocyte-derived hormone adiponectin in human disease. Eur J Endocrinol. 2003;148(3):293–300. doi: 10.1530/eje.0.1480293. [DOI] [PubMed] [Google Scholar]
- 24.BAUCHE I B, EL MKADEM S A, POTTIER A M, et al. Overexpression of adiponectin targeted to adipose tissue in transgenic mice:impaired adipocyte differentiation. Endocrinology. 2007;148(4):1539–1549. doi: 10.1210/en.2006-0838. [DOI] [PubMed] [Google Scholar]
- 25.UKKOLA O, SANTANIEMI M. Adiponectin:a link between excess adiposity and associated comorbidities? J Mol Med (Berl) 2002;80(11):696–702. doi: 10.1007/s00109-002-0378-7. [DOI] [PubMed] [Google Scholar]
- 26.RENALDI O, PRAMONO B, SINORITA H, et al. Hypoadiponectinemia:a risk factor for metabolic syndrome. Acta Med Indones. 2009;41(1):20–24. [PubMed] [Google Scholar]
- 27.YAMAUCHI T, KAMON J, WAKI H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med. 2001;7(8):941–946. doi: 10.1038/90984. [DOI] [PubMed] [Google Scholar]


