Abstract
目的
比较不同性别BALB/c小鼠采用高脂饮食建立肥胖模型的差异。
方法
32只4周龄无特定病原体级BALB/c小鼠(雌雄各半)随机分为雌性对照组、雌性高脂组、雄性对照组和雄性高脂组,每组8只。雌性对照组和雄性对照组采用普通饮食,雌性高脂组和雄性高脂组采用高脂饲料喂养,喂养12周后测量小鼠体重、内脏脂肪比、空腹血糖、葡萄糖耐量、血脂、代谢相关激素水平,并采用16S rRNA测序检测小鼠粪便菌群构成。
结果
高脂饮食干预导致雄性小鼠体重和内脏脂肪比明显增加,病理表现为单个脂肪面积明显增大,肝脏脂肪滴堆积,总胆固醇、空腹血糖、口服糖耐量试验时间-血糖曲线下面积以及血清胰岛素水平明显上升(均P<0.05),并出现明显胰岛素抵抗(P<0.01)。而雌性高脂组体重、内脏脂肪比、血清胰岛素和瘦素水平与雌性对照组差异均无统计学意义(均P>0.05)。高脂干预后小鼠肥胖相关肠道菌群相对丰度显著变化并存在性别差异,其中雄性高脂组肥胖相关菌属(如布劳特菌)相对丰度明显增加,菌群结构变化更明显。
结论
高脂饮食喂养12周4周龄BALB/c雄性小鼠可稳定建立以内脏脂肪堆积、代谢功能紊乱和肠道菌群变化为特点的内脏肥胖小鼠模型,而雌性小鼠高脂饮食诱导建立的肥胖模型这些特点不明显。
Keywords: 高脂饮食, 内脏肥胖, 性别, 糖脂代谢, 肠道菌群, 小鼠
Abstract
Objective
To establish a mouse visceral obesity model, and to investigate the effect of animal sex on this model.
Methods
Thirty-two 4-week-old BALB/c mice were randomly divided into female control group, female high-fat group, male control group and male high-fat group with 8 mice in each group.The control groups were given ordinary diet, and the high-fat groups were given high-fat diet. After 12 weeks of feeding, body weight, visceral fat, fasting blood glucose, glucose tolerance, blood lipid and metabolism-related hormone levels were measured, and the composition of gut microbiota of mice was analyzed by 16S rRNA sequencing.
Results
The high fat diet resulted in a significant increase of body weight and visceral fat content in male mice; the pathological results showed significantly increased fat area, accumulation of liver fat droplets, increased total cholesterol, fasting blood glucose, oral glucose tolerance and serum insulin levels (all P<0.05), as well as significant insulin resistance (P<0.01). However, the above changes were not significant in female mice. Compared with the control groups, there was an increase in the relative abundance of obesity-related gut microbiota in the model groups (such as Blautia), and the microbiota structure changed significantly, while the changes were less obvious in female mice.
Conclusion
A visceral obesity mouse model has been stably established by feeding high-fat diet in BALB/c male mice, showing visceral fat accumulation, metabolic dysfunction and gut microbiota changes; while female mice are not sensitive in this obesity model.
Keywords: High-fat diet, Visceral obesity, Gender, Glucolipid metabolism, Gut microbiota, Mice
肥胖是21世纪亟待解决的全球性公共卫生问题之一。随着我国国民经济水平与生活质量的提高,我国人群肥胖的患病率逐年攀升,成年人的超重率和肥胖率分别达到30.1%和11.9%,因此肥胖问题也将是未来我国公共卫生领域的一大挑战[1]。
近年来,肥胖等代谢性疾病的危险因素成为研究的热点[2]。其中肠道微生物群失调与代谢紊乱密切相关,是肥胖等代谢性疾病发展的重要因素[3-5]。随着对肥胖问题研究的深入,发现根据脂肪堆积特点肥胖可进一步分为全身性肥胖和内脏肥胖(visceral obesity)[6]。内脏肥胖又称为中心性肥胖(concentric obesity)或腹型肥胖,是指内脏脂肪组织异常堆积导致的肥胖。国内外研究提示,腰臀比等腹部脂肪相关指标相比体质指数更能准确预测代谢性疾病的发生与发展[7-8]。
不同人群肥胖发生率存在差异。我国人群虽然全身肥胖发生率在世界范围内较低,但相比欧洲人群存在更多内脏脂肪堆积[9],且呈现性别差异[10]。本研究通过建立内脏肥胖小鼠模型,观察相关代谢指标及肠道菌群丰度变化,探究内脏肥胖小鼠模型的性别差异,为实验建模提供参考,同时为进一步研究不同性别人群的肥胖特点提供思路。
1. 材料与方法
1.1. 实验动物、试剂及仪器
32只3周龄无特定病原体级BALB/c小鼠(雌雄各半)购自北京维通利华实验动物技术有限公司[生产许可证号:SCXK(浙)2019-0001],于四川大学华西公共卫生学院实验动物中心无特定病原体级动物房(实验许可证号:SYXK2018-011)适应性喂养1周后开始实验操作。本研究方案通过四川大学华西第四医院/华西公共卫生学院伦理委员会审查(Gwll2022059)。
全自动生化分析仪为雷杜生命科学股份有限公司产品;活力型手持式血糖仪(Accu-Chek)为上海罗氏制药有限公司产品。血清胰岛素ELISA试剂盒(EZRMI-13K)为Millipore中国公司产品;血清瘦素ELISA试剂盒(MOB00)为R&D Systems中国公司产品;高脂饲料D12492(三大营养素供能比分别为脂肪60%、碳水化合物20%、蛋白质20%)为美国Research Diets公司产品;脂肪专用固定液(HP192102)为武汉赛维尔生物科技有限公司产品;biosharp通用型组织固定液为北京兰杰柯科技有限公司产品;TIANamp Stool DNA kit为天根生化科技(北京)有限公司产品。
1.2. 动物分组及干预
雄性小鼠和雌性小鼠分别随机分两组,共四组,即雌性对照组、雌性高脂组、雄性对照组和雄性高脂组,每组8只。雌性对照组和雄性对照组均采用普通饮食,雌性高脂组和雄性高脂组均采用高脂饲料喂养,各组分笼饲养,自由饮食饮水。各组喂养12周后测定体重,眼球取血后处死并解剖,测量小鼠内脏脂肪(包括肠周脂肪、性腺周围脂肪和肾周脂肪)质量并计算内脏脂肪比。
1.3. HE染色和油红O染色观察性腺周围脂肪和肝脏组织病理学改变
取性腺周围脂肪和肝脏各1 cm×1 cm×1 cm,分别浸泡于脂肪专用固定液和通用型组织固定液中,经石蜡包埋、切片后,再分别进行HE染色和油红O染色。
1.4. 生化分析仪测定各组血脂水平
采用全自动生化分析仪测定各组血清高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆固醇和总三酰甘油。
1.5. 血糖仪测定各组空腹血糖及口服葡萄糖耐量试验
各组处死前1 d禁食不禁水8 h,采用活力型手持式血糖仪测定空腹血糖。各组按体重灌胃给予20%葡萄糖(2.0 g/kg),分别测定0、30、60、90和120 min后的血糖值。
1.6. ELISA法检测各组血清胰岛素及胰岛素抵抗指数
采用ELISA试剂盒测定各组血清瘦素和胰岛素水平,并计算胰岛素抵抗指数:胰岛素抵抗指数=空腹血糖(mmol/L)×空腹胰岛素水平(mIU/L)/22.5。
1.7. 16S rRNA测序检测各组粪便菌群DNA
使用TIANamp Stool DNA kit提取各组粪便中的DNA,选择V3~V4区进行PCR扩增。将获得的原始数据经过测序片段(Reads)拼接、序列标签(Tags)过滤,得到有效序列。筛选数据并去除嵌合体,将相似度为97%及以上的序列进行聚类,得到操作分类单元,并进一步得到物种丰度分布情况。选择门、属水平相对丰度前十和前二十五的菌属进行数据处理,并主要对肥胖代谢密切相关的菌属进行统计分析。将操作分类单元进行多序列对比,基于Bray-curtis计算样本间的距离进行主坐标分析。同时,使用BLASTN算法将有效序列与SILVA SSU Ref NR数据库和SILVA数据库进行对比,获得的注释结果以Tax4Fun功能预测热图的形式呈现。
1.8. 统计学方法
应用SPSS 26.0软件进行统计分析。满足正态分布且方差齐的资料采用均数±标准差()表示,两组间比较采用t检验;不满足正态分布或方差不齐的资料采用中位数(上下四分位数)[M(Q 1,Q 3)]表示,两组间比较采用t 检验或非参数检验。P<0.05为差异具有统计学意义。
2. 结果
2.1. 不同性别模型鼠体重及内脏脂肪比比较
高脂饮食喂养12周后,雄性高脂组体重及内脏脂肪比明显高于雄性对照组(均P<0.01),但雌性高脂组体重和内脏脂肪比与雌性对照组接近,见表1。结果提示,模型鼠体重和内脏脂肪堆积存在明显的性别差异。
表1.
各组体重和内脏脂肪比比较
| 组 别 | n | 体重(g) | 内脏脂肪比(mg/g) |
|---|---|---|---|
| 雌性对照组 | 8 | 25.2±1.7 | 0.75±0.23 |
| 雌性高脂组 | 8 | 26.6±3.2 | 0.92±0.49 |
| 雄性对照组 | 8 | 31.8±1.9 | 0.86±0.31 |
| 雄性高脂组 | 8 | 36.8±1.9** | 1.80±0.30** |
与雄性对照组比较,**P<0.01.
2.2. 不同性别模型鼠性腺周围脂肪和肝脏组织病理学检查结果比较
HE染色结果显示,雌性对照组和雄性对照组的脂肪细胞大小结构正常且两组间无明显差异;雌性高脂组与雌性对照组脂肪细胞无明显变化,而雄性高脂组相比雄性对照组单个脂肪面积明显增大,相同视野下脂肪细胞数更少。油红O染色结果显示,雌性对照组和雄性对照组肝脏脂肪细胞中染色较浅,未出现明显脂质沉积;雌性高脂组和雄性高脂组分别相比雌性对照组和雄性对照组油红O染色面积更广泛,脂肪滴堆积更多,其中雄性高脂组肝脏脂肪滴堆积明显多于雌性高脂组,脂质沉积更严重。见图1。结果提示,高脂饮食后雄性小鼠中性腺周围脂肪和肝脏脂滴堆积出现明显的病理变化,而雌性小鼠变化不如雄性小鼠明显。
图1. 各组性腺周围脂肪组织(苏木精-伊红染色)和肝脏组织(油红O染色)病理学检查结果.
雌性对照组和雄性对照组脂肪细胞大小结构正常且两组间无明显差异;与雌性对照组比较,雌性高脂组单个脂肪细胞面积未明显增大;而与雄性对照组比较,雄性高脂组单个脂肪细胞面积明显增大.雌性对照组和雄性对照组肝脏细胞中染色较浅,未出现明显脂质沉积;与雌性对照组比较,雌性高脂组肝脏中有少量脂滴堆积;与雄性对照组比较,雄性高脂组肝脏中脂滴堆积明显,脂质沉积.标尺=20 μm.
2.3. 不同性别模型鼠脂代谢指标比较
与雌性对照组和雄性对照组比较,雌性高脂组和雄性高脂组高脂饮食12周后总胆固醇均明显升高(均P<0.01),三酰甘油均明显降低(均P<0.01),而高密度脂蛋白胆固醇和低密度脂蛋白胆固醇水平均无明显变化(均P>0.05),见表2。结果提示,高脂饮食导致雄性和雌性小鼠脂代谢调节功能受损。
表2.
各组脂代谢指标检测结果比较
| 组 别 | n | 总胆固醇 | 三酰甘油 | 高密度脂蛋白胆固醇 | 低密度脂蛋白胆固醇 |
|---|---|---|---|---|---|
| 雌性对照组 | 8 | 3.89±0.20 | 2.80±0.79 | 0.55±0.11 | 1.81±0.24 |
| 雌性高脂组 | 8 | 5.02±0.29** | 1.77±0.32** | 0.50±0.09 | 1.85±0.14 |
| 雄性对照组 | 8 | 4.57±0.28 | 2.18±0.32 | 0.69±0.06 | 1.97±0.13 |
| 雄性高脂组 | 8 | 5.37±0.39## | 1.55±0.11## | 0.64±0.05 | 2.05±0.19 |
与雌性对照组比较,**P<0.01;与雄性对照组比较,##P<0.01.
,mmol/L
2.4. 不同性别模型鼠糖代谢指标比较
与雄性对照组比较,雄性高脂组的空腹血糖明显升高(P<0.01);而与雌性对照组比较,雌性高脂组的空腹血糖未见明显升高(P>0.05)。在口服葡萄糖耐量试验中,与雄性对照组和雌性对照组比较,雄性高脂组和雌性高脂组血糖值均升高,其中雄性高脂组血糖曲线面积升高更加明显(P<0.01)。见表3和图2。结果提示,高脂饮食引起小鼠糖代谢功能紊乱,对葡萄糖的耐受能力下降,并且雄性小鼠中糖代谢调节功能受损更加显著。
表3.
各组糖代谢指标检测结果比较
| 组 别 | n |
空腹血糖 (mmol/L) |
时间-血糖曲线下面积 (mmol·L-1·min-1) |
|---|---|---|---|
| 雌性对照组 | 8 | 4.97±0.67 | 753±75 |
| 雌性高脂组 | 8 | 5.46±0.73 | 865±139* |
| 雄性对照组 | 8 | 4.88±0.22 | 900±61 |
| 雄性高脂组 | 8 | 8.00±0.41## | 1240±81## |
与雌性对照组比较,*P<0.05;与雄性对照组比较,##P<0.01.
图2. 各组口服葡萄糖耐量试验结果.

2.5. 不同性别模型鼠血清瘦素、胰岛素水平及胰岛素抵抗指数比较
与雄性对照组比较,雄性高脂组血清瘦素、胰岛素水平和胰岛素抵抗指数均明显上升(P<0.05或P<0.01);而与雌性对照组比较,雌性高脂组血清瘦素水平未见明显上升,胰岛素水平和胰岛素抵抗指数虽有上升,但差异无统计学意义(均P>0.05)。见表4。结果提示,高脂饮食使雄性小鼠出现糖代谢紊乱的原因可能与瘦素、胰岛素水平升高以及出现胰岛素抵抗等有关,而雌性小鼠对高脂饮食具有更强的耐受性。
表4.
各组血清瘦素、胰岛素水平及胰岛素抵抗指数比较
| 组 别 | n | 瘦素(ng/mL) | 胰岛素(ng/mL) | 胰岛素抵抗指数 |
|---|---|---|---|---|
| 雌性对照组 | 8 | 342±113 | 1.43(0.80,3.20) | 6.61(3.96,15.71) |
| 雌性高脂组 | 8 | 358±225 | 3.93(2.07,4.95) | 18.14(11.52,28.15) |
| 雄性对照组 | 8 | 369±185 | 1.83(1.53,2.85) | 8.27(6.23,9.35) |
| 雄性高脂组 | 8 | 626±222# | 5.21(3.55,8.07)# | 29.41(22.98,39.75)## |
与雄性对照组比较,#P<0.05,##P<0.01.
2.6. 不同性别模型鼠肠道菌群构成比较
在门水平,与雄性对照组比较,雌性对照组厚壁菌门相对丰度明显升高,变形菌门相对丰度明显降低(均P<0.05),拟杆菌门相对丰度无明显差异(P>0.05);与雌性对照组比较,雌性高脂组厚壁菌门相对丰度明显升高,拟杆菌门相对丰度明显降低(P<0.05),变形菌门相对丰度无明显差异(P>0.05);与雄性对照组比较,雄性高脂组厚壁菌门和拟杆菌门相对丰度均无明显变化(均P>0.05),变形菌门相对丰度明显降低(P<0.05)。在属水平,与雄性对照组比较,雌性对照组另枝菌属和布劳特菌属相对丰度均明显升高(均P<0.05),乳杆菌属相对丰度无明显差异(P>0.05);与雌性对照组比较,雌性高脂组另枝菌属相对丰度明显降低,布劳特菌属相对丰度明显升高(均P<0.05),乳杆菌属相对丰度无明显变化(P>0.05);与雄性对照组比较,雄性高脂组布劳特菌属相对丰度明显升高,乳杆菌属相对丰度明显降低(均P<0.05),另枝菌属相对丰度无明显变化。见图3A、B。结果可见,高脂干预后小鼠粪便中肥胖相关肠道菌群相对丰度显著变化并存在性别差异,其中雄性小鼠代谢相关菌群组成和结构变化更明显。
图3. 各组粪便肠道菌群分析结果.
A:各组门水平的肠道菌群相对丰度;B:各组属水平的肠道菌群相对丰度;C:基于肠道菌群Bray-Curtis距离的主坐标分析.
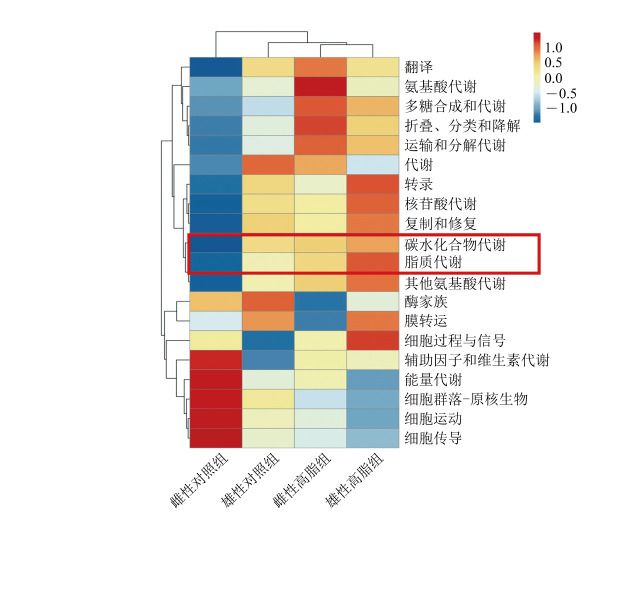
雄性对照组和雌性对照组的肠道菌群处于不同象限,彼此相互分开,提示菌群结构存在差异。高脂饮食12周后,雄性高脂组和雌性高脂组的肠道菌群仍处于不同象限,并分别与雄性对照组和雌性对照组相互分开。其中,雄性高脂组与雄性对照组的距离明显大于雌性高脂组与雌性对照组的距离,见图3C。肠道菌群Tax4Fun功能预测热图显示,雄性高脂组的肠道菌群在糖代谢、脂质代谢等功能中呈现出负相关趋势,见图4。结果提示,雄性小鼠高脂饮食后菌群结构变化更显著,对糖脂代谢功能影响更大。
图4. 肠道菌群的Tax4Fun功能预测热图.
3. 讨论
2017年以来全球每年都有超过400万人因超重和肥胖而死亡,导致极大的疾病负担[9]。越来越多的流行病学证据表明,内脏脂肪组织与糖尿病、高血压和部分心血管疾病等多种代谢性疾病显示出明显的关联性,其对代谢性疾病的预测准确度甚至高于传统的体质指数[10-11]。因此,内脏肥胖或许也能影响机体的糖脂代谢和激素水平。
本文资料显示,经过12周高脂饮食喂养,雌性小鼠的体重、内脏脂肪比和内脏脂肪(性腺周围脂肪和肝脏脂肪等)堆积并没有明显增加,然而雄性小鼠体重、内脏脂肪比和内脏脂肪堆积明显增加。多数研究认为,小鼠肥胖模型成功的标准是模型鼠平均体重超过对照鼠的1.2倍[12]。然而本研究中,虽然雌性高脂组与雌性对照组体重有差异,但雌性高脂组平均体重未达雌性对照组的1.2倍,而雄性高脂组平均内脏脂肪比约为雄性对照组的1.5倍且内脏脂肪明显堆积,符合内脏肥胖中体重变化小、腹部脂肪明显增多的特点。因此在此条件下BALB/C雄性小鼠表现为内脏肥胖而非单纯性肥胖。
与单纯性肥胖不同,内脏肥胖主要以腹部器官周围的白色脂肪堆积为主。与皮下脂肪相比,白色脂肪能产生更多甘油和脂肪酸等脂肪代谢产物[13],增加肝脏过度摄取游离脂肪酸合成极低密度脂蛋白和低密度脂蛋白的可能,从而升高血浆中总胆固醇、低密度脂蛋白胆固醇和极低密度脂蛋白胆固醇的浓度[14]。但本文资料显示,BALB/C小鼠经高脂饮食喂养12周后,雌性小鼠和雄性小鼠血清高密度脂蛋白胆固醇和低密度脂蛋白胆固醇水平并未出现显著改变,但雌性高脂组和雄性高脂组血清总胆固醇水平出现明显上升而血清三酰甘油水平出现明显下降。这些结果表明,内脏肥胖影响了模型鼠的脂代谢功能且不同性别之间影响趋势相似,其中总胆固醇水平上升与大部分研究结果相吻合,而血清三酰甘油水平下降可能是由于三酰甘油蓄积于肝脏,引起内脏脂肪积累,以致游离三酰甘油减少。截至目前,高脂饮食对小鼠血脂的影响并无一致报道,如一些研究认为高脂饮食会导致小鼠血清高密度脂蛋白胆固醇降低[15]。但在另一些研究中,同品系小鼠同样喂食高脂饮食后高密度脂蛋白胆固醇水平升高[16]。类似的,部分研究认为高脂饮食会导致小鼠血清三酰甘油水平升高,但也有研究表明高脂饮食不会导致小鼠血清三酰甘油水平改变[17]。因而还需要更多基础研究探索高脂饮食下小鼠血脂水平的变化。
内脏肥胖除了引起血脂水平变化以外,还会增加胰岛素抵抗、高胰岛素血症和葡萄糖耐受不良等风险,导致血糖水平异常[18],这可能与游离脂肪酸导致的氧化应激、内皮功能异常、胰岛素受体表达下降等有关[19-20]。有研究显示高脂饮食可导致小鼠血糖升高[21-22]。本研究采用空腹血糖、口服葡萄糖耐量试验时间-血糖曲线下面积评价小鼠对葡萄糖耐受量的变化,发现高脂饮食对小鼠糖代谢功能有明显影响,同时这种影响也出现了一定的性别差异。雄性高脂组的空腹血糖、时间-血糖曲线下面积上升相比雌性高脂组更加明显,可能是不同性别对高脂饮食的敏感性不同所致。这与以往报道的雄性小鼠对高脂饮食引起的代谢功能紊乱更加敏感基本吻合[23]。由此推测,内脏肥胖同样会导致小鼠糖代谢功能紊乱,对葡萄糖的耐受能力下降,同时这种现象在雄性小鼠中更加明显。
胰岛素和瘦素是调控机体能量代谢的重要激素,尤其对血浆葡萄糖的稳态起重要作用[24-25]。瘦素主要在白色脂肪组织中合成,与脂肪量成正比,肥胖患者中更易出现高瘦素水平,这可能与瘦素抵抗有关[26-27]。同样,高脂饮食引起的肥胖会伴随明显的胰岛素抵抗[28]。本文资料显示,雄性高脂组血清瘦素和胰岛素水平明显升高,同时还出现了明显的胰岛素抵抗,而雌性小鼠的相关指标仅出现了类似的变化趋势但与对照组差异无统计学意义,这可能也是由不同性别对高脂饮食的敏感性不同造成的。
肠道菌群与肥胖的研究已有许多报道,肠道菌群紊乱可能导致低度慢性炎症和代谢紊乱引起肥胖,还可能通过肠道屏障完整性、影响饱腹感和胰岛素抵抗的代谢物等途径影响宿主代谢和肥胖[29-31]。其中另枝菌属被认为是影响肥胖的重要菌种之一,近期研究发现另枝菌属相对丰度与血清三酰甘油浓度降低明显相关,进一步研究证明另枝菌属可代谢产生少量短链脂肪酸,在健康受试人群中丰度更高[32-33]。本文资料显示,另枝菌属的相对丰度呈现出性别差异。雌性对照组的另枝菌属相对丰度更高,虽然雌性高脂组已明显降低,但其并未形成预期的肥胖模型,故推测另枝菌属可以影响宿主的脂肪代谢过程,并在高脂小鼠造模过程中产生保护作用。布劳特菌属也是与肥胖相关的重要菌属,近年研究结果表明布劳特菌属的丰度与肥胖呈正相关[34-35],本研究结果与之相吻合,高脂饮食引起小鼠粪便中布劳特菌属的相对丰度升高并呈现性别差异。此外有研究提出,乳杆菌属相对丰度的升高可能存在潜在降低血糖水平的有益作用并且产生肠道代谢产物(如丁酸盐等)参与修复损伤[36-37]。本文资料显示,高脂饮食后小鼠粪便中乳杆菌属相对丰度显著降低,可能会加重高脂组的脂代谢损伤。基于Bray-Curtis距离的肠道菌群主坐标分析结果显示,各组肠道菌群结构有明显的区分与聚类,但相比雌性小鼠,高脂饮食对雄性小鼠肠道菌群结构改变的影响更加明显,这可能是雄性小鼠代谢功能更加紊乱的潜在原因之一。Tax4Fun功能预测热图也提示高脂饮食干预对雄性小鼠糖脂代谢的负面影响明显大于雌性小鼠。
综上所述,本研究利用高脂饮食喂养BALB/C小鼠所得内脏肥胖模型小鼠的特点为体重未达到肥胖标准,但伴随内脏脂肪堆积、代谢功能紊乱和激素水平异常。BALB/C小鼠虽然能够造成内脏肥胖模型小鼠,但雄性小鼠相较于雌性小鼠表现出更明显的糖脂代谢功能紊乱、胰岛素抵抗、激素水平异常以及肥胖相关肠道菌群改变,这可能是由于不同性别小鼠对高脂饮食敏感性不同以及摄食量不同两个因素导致。因此高脂饮食喂养BALB/C雄性小鼠可以造成明显的内脏肥胖而非单纯肥胖模型,而雌性小鼠的内脏肥胖造模还需要进一步研究。
Acknowledgments
研究得到国家自然科学基金(81973042)支持
Acknowledgments
This work was supported by National Natural Science Foundation of China (81973042)
[缩略语]
酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA);苏木精-伊红染色(hematoxylin and eosin staining,HE染色);聚合酶链反应(polymerase chain reaction,PCR)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献
- 1.顾景范. 《中国居民营养与慢性病状况报告(2015)》解读[J]. 营养学报, 2016, 38(6): 525-529. 10.3969/j.issn.0512-7955.2016.06.005 [DOI] [Google Scholar]; GU Jingfan. Interpretation of Report on nutrition and chronic diseases of Chinese residents (2015)[J]. Acta Nutrimenta Sinica, 2016, 38(6): 525-529. (in Chinese) 10.3969/j.issn.0512-7955.2016.06.005. 10.3969/j.issn.0512-7955.2016.06.005 [DOI] [Google Scholar]
- 2.BALA M, MEENAKSH I, AGGARWAL S. Correlation of body mass index and Waist/Hip ratio with glycated hemoglobin in prediabetes[J]. EJIFCC, 2019, 30(3): 317-324. [PMC free article] [PubMed] [Google Scholar]
- 3.GOMES A C, HOFFMANN C, MOTA J F. The human gut microbiota: metabolism and perspective in obesity[J]. Gut Microbes, 2018, 9(4): 308-325. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.ARON-WISNEWSKY J, WARMBRUNN M V, NIEUWDORP M, et al. Metabolism and metabolic disorders and the microbiome: the intestinal microbiota associated with obesity, lipid metabolism, and metabolic health-pathophysiology and therapeutic strategies[J]. Gastroenterology, 2021, 160(2): 573-599. 10.1053/j.gastro.2020.10.057 [DOI] [PubMed] [Google Scholar]
- 5.AMATO M C, GIORDANO C, GALIA M, et al. Visceral adiposity index: a reliable indicator of visceral fat function associated with cardiometabolic risk[J]. Diabetes Care, 2010, 33(4): 920-922. 10.2337/dc09-1825 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.秦叶叶, 李燕. 成人腹型肥胖测量相关简易方法[J]. 山西大同大学学报 (自然科学版), 2021, 37(4): 56-58, 76. [Google Scholar]; QIN Yeye, LI Yan. Simple method for measuring adult abdominal obesity[J]. Journal of Shanxi Datong University (Natural Science Edition), 2021, 37(4): 56-58, 76. (in Chinese) [Google Scholar]
- 7.杨波, 杨孟雪, 高琳, 等. 血清Chemerin水平与2型糖尿病合并大血管病变及腰身比的相关性研究[J]. 中国糖尿病杂志, 2016, 24(4): 304-308. 10.3969/j.issn.1006-6187.2016.04.004 [DOI] [Google Scholar]; YANG Bo, YANG Mengxue, GAO Lin, et al. Correlation between serum serumchemerin levels and waist-to-stature ratio in type 2 diabetes with macroangiopathy[J]. Chinese Journal of Diabetes, 2016, 24(4): 304-308. (in Chinese) 10.3969/j.issn.1006-6187.2016.04.004. 10.3969/j.issn.1006-6187.2016.04.004 [DOI] [Google Scholar]
- 8.KODAMA S, HORIKAWA C, FUJIHARA K, et al. Comparisons of the strength of associations with future type 2 diabetes risk among anthropometric obesity indicators, including waist-to-height ratio: a meta-analysis[J]. Am J Epidemiol, 2012, 176(11): 959-969. 10.1093/aje/kws172 [DOI] [PubMed] [Google Scholar]
- 9.LEAR S A, HUMPHRIES K H, KOHLI S, et al. Visceral adipose tissue accumulation differs according to ethnic background: results of the Multicultural Community Health Assessment Trial (M-CHAT)[J]. Am J Clin Nutr, 2007, 86(2): 353-359. 10.1093/ajcn/86.2.353 [DOI] [PubMed] [Google Scholar]
- 10.薛海峰. 中国成人腹型肥胖与糖尿病发病关系的前瞻性队列研究[D]. 北京: 北京协和医学院, 2014. [Google Scholar]; XUE Haifeng. A prospective cohort study of the association between abdominal obesity and diabetes in Chinese adults[D]. Beijing: Peking Union Medical College, 2014. (in Chinese) [Google Scholar]
- 11.LIU P J, MA F, LOU H P, et al. Visceral adiposity index is associated with pre-diabetes and type 2 diabetes mellitus in Chinese adults aged 20-50[J]. Ann NutrMetab, 2016, 68(4): 235-243. 10.1159/000446121 [DOI] [PubMed] [Google Scholar]
- 12.向玖琳, 王茹, 陈廷, 等. 肥胖小鼠良性前列腺增生模型的建立[J]. 中国老年学杂志, 2017, 37(19): 4700-4703. 10.3969/j.issn.1005-9202.2017.19.005 [DOI] [Google Scholar]; XIANG Jiulin, WANG Ru, CHEN Ting, et al. Establishment of benign prostatic hyperplasia model in obese mice[J]. Chinese Journal of Gerontology, 2017, 37(19): 4700-4703. (in Chinese) 10.3969/j.issn.1005-9202.2017.19.005. 10.3969/j.issn.1005-9202.2017.19.005 [DOI] [Google Scholar]
- 13.BÓDIS K, RODEN M. Energy metabolism of white adipose tissue and insulin resistance in humans[J/OL]. Eur J Clin Invest, 2018, 48(11): e13017. 10.1111/eci.13017 [DOI] [PubMed] [Google Scholar]
- 14.DHAWAN D, SHARMA S. Abdominal obesity, adipokines and non-communicable diseases[J]. J Steroid Biochem Mol Biol, 2020, 203: 105737. 10.1016/j.jsbmb.2020.105737 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.NI M, CHAI R, ZHANG P, et al. Toxicity test of different kinds of insecticides to Lymantria dispar and Apocheimacinerarius[J]. J Northeast For Univ, 2009, 37: 121-122. [Google Scholar]
- 16.LEE H S, NAM Y, CHUNG Y H, et al. Beneficial effects of phosphatidylcholine on high-fat diet-induced obesity, hyperlipidemia and fatty liver in mice[J]. Life Sci, 2014, 118(1): 7-14. 10.1016/j.lfs.2014.09.027 [DOI] [PubMed] [Google Scholar]
- 17.IVANOVIC N, MINIC R, DIMITRIJEVIC L, et al. Lactobacillus rhamnosus LA68 and Lactobacillus plantarum WCFS1 differently influence metabolic and immunological parameters in high fat diet-induced hypercholesterolemia and hepatic steatosis[J]. Food Funct, 2015, 6(2): 558-565. 10.1039/c4fo00843j [DOI] [PubMed] [Google Scholar]
- 18.KISSEBAH A H, PEIRIS A N. Biology of regional body fat distribution: relationship to non-insulin-dependent diabetes mellitus[J]. Diabetes Metab Rev, 1989, 5(2): 83-109. 10.1002/dmr.5610050202 [DOI] [PubMed] [Google Scholar]
- 19.STANDL E. Dysglycemia and abdominal obesity[J]. Curr Vasc Pharmacol, 2012, 10(6): 678-679. 10.2174/157016112803520936 [DOI] [PubMed] [Google Scholar]
- 20.PAPAETIS G S, PAPAKYRIAKOU P, PANAGIOTOU T N. Central obesity, type 2 diabetes and insulin: exploring a pathway full of thorns[J]. Arch Med Sci, 2015, 11(3): 463-482. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.LI J, WU H, LIU Y, et al. High fat diet induced obesity model using four strainsof mice: Kunming, C57BL/6, BALB/c and ICR[J]. Exp Anim, 2020, 69(3): 326-335. 10.1538/expanim.19-0148 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.ANDRIKOPOULOS S, BLAIR A R, DELUCA N, et al. Evaluating the glucose tolerance test in mice[J/OL]. Am J Physiol Endocrinol Metab, 2008, 295(6): E1323-1332. 10.1152/ajpendo.90617.2008 [DOI] [PubMed] [Google Scholar]
- 23.FREIRE-REGATILLO A, FERNÁNDEZ-GÓMEZ M J, DÍAZ F, et al. Sex differences in the peripubertal response to a short-term, high-fat diet intake[J/OL]. J Neuroendocrinol, 2020, 32(1): e12756. 10.1111/jne.12756 [DOI] [PubMed] [Google Scholar]
- 24.徐凯旋, 郁婷燕, 管磊剑, 等. 下丘脑中瘦素/瘦素受体的促发育作用被干扰引起成年期肥胖: 肥胖新机制[J]. 中华疾病控制杂志, 2015, 19(9): 6. [Google Scholar]; XU Kaixuan, YU Tingyan, GUAN Leijian, et al. Interference of leptin/leptin receptors in hypothalamus causes obesity in adulthood: a new mechanism for obesity[J]. Chinese Journal of Disease Control & Prevention, 2015, 19(9): 6. (in Chinese) [Google Scholar]
- 25.STERN J H, RUTKOWSKI J M, SCHERER P E. Adiponectin, leptin, and fatty acids in the maintenance of metabolic homeostasis through adipose tissue crosstalk[J]. Cell Metab, 2016, 23(5): 770-784. 10.1016/j.cmet.2016.04.011 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.VERDICH C, TOUBRO S, BUEMANN B, et al. Leptin levels are associated with fat oxidation and dietary-induced weight loss in obesity[J]. Obes Res, 2001, 9(8): 452-461. 10.1038/oby.2001.59 [DOI] [PubMed] [Google Scholar]
- 27.PEREIRA S, CLINE D L, GLAVAS M M, et al. Tissue-specific effects of leptin on glucose and lipid metabolism[J]. Endocr Rev, 2021, 42(1): 1-28. 10.1210/endrev/bnaa027 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.KUMAR A, SUNDARAM K, MU J, et al. High-fat diet-induced upregulation of exosomal phospha-tidylcholine contributes to insulin resistance[J]. Nat Commun, 2021, 12(1): 213. 10.1038/s41467-020-20500-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.THINGHOLM L B, RÜHLEMANN M C, KOCH M, et al. Obese individuals with and without type 2 diabetes show different gut microbial functional capacity and composition[J]. Cell Host Microbe, 2019, 26(2): 252-264.e10. 10.1016/j.chom.2019.07.004 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.GOMES A C, HOFFMANN C, MOTA J F. The human gut microbiota: metabolism and perspective in obesity[J]. Gut Microbes, 2018, 9(4): 308-325. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.LEE C J, SEARS C L, MARUTHUR N. Gut microbiome and its role in obesity and insulin resistance[J]. Ann N Y Acad Sci, 2020, 1461(1): 37-52. 10.1111/nyas.14107 [DOI] [PubMed] [Google Scholar]
- 32.XU Z, JIANG W, HUANG W, et al. Gut microbiota in patients with obesity and metabolic disorders — a systematic review[J]. Genes Nutr, 2022, 17(1): 2. 10.1186/s12263-021-00703-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.LIU X, TONG X, ZOU Y, et al. Mendelian randomization analyses support causal relationships between blood metabolites and the gut microbiome[J]. Nat Genet, 2022, 54(1): 52-61. 10.1038/s41588-021-00968-y [DOI] [PubMed] [Google Scholar]
- 34.JO J K, SEO S H, PARK S E, et al. Gut microbiome and metabolome profiles associated with high-fat diet in mice[J]. Metabolites, 2021, 11(8): 482. 10.3390/metabo11080482 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.KASHTANOVA D A, TKACHEVA O N, DOUDIN-SKAYA E N, et al. Gut microbiota in patients with different metabolic statuses: moscow study[J]. Microorganisms, 2018, 6(4): 98. 10.3390/microorganisms6040098 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.SERGEEV I N, ALJUTAILY T, WALTON G, et al. Effects of synbiotic supplement on human gut microbiota, body composition and weight loss in obesity[J]. Nutrients, 2020, 12(1): 222. 10.3390/nu12010222 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.ZHOU D, PAN Q, XIN F Z, et al. Sodium butyrate attenuates high-fat diet-induced steatohepatitis in mice by improving gut microbiota and gastrointestinal barrier[J]. World J Gastroenterol, 2017, 23(1): 60-75. 10.3748/wjg.v23.i1.60 [DOI] [PMC free article] [PubMed] [Google Scholar]