Abstract
目的
探讨玄胡索散抑制乳腺癌小鼠脾脏髓源抑制细胞(MDSC)分化的作用机制。
方法
4~5周龄BALB/c雌性小鼠48只,其中6只为正常对照组,其他42只采用小鼠左侧第二对乳腺皮下脂肪垫接种4T1细胞构建乳腺癌荷瘤小鼠模型,分为粒细胞集落刺激因子(G-CSF)对照组、G-CSF敲减组、模型对照组、玄胡索散小剂量组、玄胡索散中剂量组、玄胡索散大剂量组和环磷酰胺组,每组6只。其中G-CSF对照组和G-CSF敲减组分别采用shRNA慢病毒转染联合嘌呤霉素构建相应4T1稳转细胞模型。各组造模48 h后,玄胡索散小剂量组、玄胡索散中剂量组、玄胡索散大剂量组分别按2、4、8 g·kg-1·d-1玄胡索散灌胃,每天一次;环磷酰胺组按30 mg/kg腹腔注射环磷酰胺,隔天一次;其他组给予等体积0.5%羟甲基纤维素纳。各组连续给药25 d。苏木精-伊红染色观察脾脏组织病理学改变,流式细胞术测定脾脏MDSC亚群比例,免疫荧光法检测脾脏CD11b、Ly6G共表达,酶联免疫吸附测定外周血G-CSF浓度。在体外,建立荷瘤小鼠脾脏与4T1稳转株共培养体系,玄胡索散(30 μg/mL)处理24 h,免疫荧光检测脾脏CD11b、Ly6G共表达;不同浓度的玄胡索散(10、30、100 μg/mL)处理4T1细胞12 h,实时逆转录PCR检测G-CSF mRNA水平。
结果
与正常对照组比较,模型鼠脾脏红髓增宽伴巨核细胞浸润,脾脏多形核细胞样MDSC(PMN-MDSC)比例增加(P<0.01),脾脏CD11b、Ly6G共表达增多,外周血G-CSF浓度上升(P<0.01)。玄胡索散干预后脾脏PMN-MDSC比例减小(P<0.05),脾脏CD11b、Ly6G共表达减少,4T1细胞G-CSF mRNA水平下调(P<0.01),模型鼠外周血G-CSF浓度减少(P<0.05),肿瘤体积缩小,脾脏增大情况改善(均P<0.05)。
结论
玄胡索散可能通过下调G-CSF,阻碍MDSC向PMN-MDSC分化,重建脾脏髓系微环境,从而发挥抗乳腺癌作用。
Keywords: 玄胡索散, 乳腺癌, 脾脏, 髓源抑制细胞, 粒细胞集落刺激因子, 4T1细胞株, 小鼠
Abstract
Objective
To investigate the mechanism of Xuanhusuo powder (XHSP) inhibiting the differentiation of spleen myeloid-derived suppressor cells (MDSCs) in breast cancer mice.
Methods
Forty-eight BALB/c female mice aged 4-5 weeks were selected, 6 of them were in normal control group, while others were in tumor-bearing models established by orthotopic injection of 4T1 cells into the subcutaneous fat pad of the second pair of left mammary glands. The tumor-bearing mice were divided into granulocyte colony stimulating factor (G-CSF) control group, G-CSF knock-down group, model control group, XHSP small dose group, XHSP medium dose group, XHSP high dose group, and cyclophosphamide (CTX) group, with 6 mice in each group. G-CSF control group and G-CSF knock-down group were constructed by stably transfecting 4T1 cells established by shRNA lentivirus combined with puromycin selection. 48 h after the model was established, XHSP small, medium, high dose group were given 2, 4, 8 g·kg-1·d-1 intragastric administration once a day, respectively. CTX was given 30 mg/kg by intraperitoneal injection, once every other day. The other groups were given an equal volume of 0.5% hydroxymethylcellulose sodium. The drugs in each group were continuously administered for 25 d. Histological changes in spleen were observed by HE staining, the proportion of MDSCs subsets in the spleen were detected by flow cytometry, the co-expression of CD11b and Ly6G in the spleen was detected by immunofluorescence, and the concentration of G-CSF in peripheral blood was detected by ELISA. The spleen of tumor-bearing mice was co-cultured with 4T1 stably transfected cell lines in vitro, treated with XHSP (30 μg/mL) for 24 h, and the co-expression of CD11b and Ly6G in the spleen was detected by immunofluorescence. 4T1 cells were treated by XHSP (10, 30, 100 μg/mL) for 12 h. The mRNA level of G-CSF was detected by realtime RT-PCR.
Results
Compared with normal mice, the red pulp of the spleen in tumor-bearing mice was widened with megakaryocyte infiltration. The proportion of spleen polymorphonucleocyte-like MDSCs (PMN-MDSCs) was significantly increased (P<0.01) and the co-expression of CD11b and Ly6G was increased, and the concentration of G-CSF in peripheral blood was significantly increased (P<0.01). However, XHSP could significantly reduce the proportion of PMN-MDSCs (P<0.05) and the co-expression of CD11b and Ly6G in the spleen, down-regulate the mRNA level of G-CSF in 4T1 cells (P<0.01). The concentration of G-CSF in peripheral blood of tumor-bearing mice also decreased (P<0.05) and tumor volume was reduced and splenomegaly was improved (all P<0.05).
Conclusion
XHSP may play an anti-breast cancer role by down-regulating G-CSF, negatively regulating the differentiation of MDSCs, and reconstruct the spleen myeloid microenvironment.
Keywords: Xuanhusuo powder, Breast cancer, Spleen, Myeloid-derived suppressor cells, Granulocyte colony stimulating factor, 4T1 cells, Mice
乳腺癌是最常见的恶性肿瘤之一,也是20~59岁女性癌症患者死亡的主要原因之一[1]。乳腺癌被认为是一种具有高度免疫抑制肿瘤微环境特征的免疫冷肿瘤,包括MDSC在内的免疫抑制细胞群的显著浸润是乳腺癌肿瘤微环境的共同特征[2]。MDSC的免疫抑制活性已在体内和体外得到证实,其产生的精氨酸酶、活性氧和一氧化氮等活性物质抑制效应T细胞活化,从而使肿瘤获得免疫逃逸能力[3-4]。
G-CSF是调控粒细胞发育和功能的主要细胞因子。G-CSF在乳腺癌中高表达,以STAT3依赖的方式促进未成熟骨髓细胞向PMN-MDSC分化,促进肿瘤的发生和发展。脾脏作为髓外造血器官,是这些细胞的潜在储存库。先前研究表明,在小鼠肿瘤模型中,肿瘤衍生的G-CSF促进脾脏过度髓外造血,MDSC在脾脏中积累[5]。因此,抑制乳腺癌中脾脏过度髓外造血,减少MDSC的产生和浸润对于乳腺癌的免疫治疗具有重要意义。
玄胡索散由破血攻积的莪术与行气止痛的延胡索组成,首载于宋代《鸡峰普济方》,主治“妇人血气攻心,痛不可忍,并走注”。前期研究表明,玄胡索散能降低乳腺癌4T1细胞G-CSF mRNA表达,减小乳腺癌小鼠肿瘤体积,减轻脾大,下调MDSC比例[6-9],推测该方可能通过调控G-CSF抑制脾脏过度髓外造血及其相关的MDSC积累,进而发挥抗乳腺癌作用。基于此,本研究拟通过药理学方法探索玄胡索散是否通过调控G-CSF抑制乳腺癌脾脏MDSC的分化。
1. 材料与方法
1.1. 细胞、动物、试剂和仪器
乳腺癌4T1细胞株由美国芝加哥大学何通川教授惠赠,于含10%胎牛血清、1%青-链霉素的DMEM培养基中培养,每2~3天按1∶4传代一次。无特定病原体级BALB/c雌性小鼠,4~5周龄,体重(15±2)g,共54只,购于上海斯莱克实验动物有限责任公司[许可证号SCXK(沪)2017-0005]。本研究方案通过浙江中医药大学实验动物中心审查(IACΜC-20210517-07)。小鼠G-CSF ELISA试剂盒为武汉酶免生物科技有限公司产品;hU6-MCS-Ubiquitin-EGFP-IRES-puromycin对照慢病毒和LV-Csf3-RNAi(95623-1)慢病毒为上海吉凯基因医学科技股份有限公司产品;环磷酰胺为德国Baxter Oncology GmbH公司产品;Cy3-羊抗小鼠IgG为杭州达文生物有限公司产品;小鼠单克隆抗体CD11b、FITC-鼠抗兔IgG为美国Santa Cruz公司产品;FITC大鼠抗CD11b、PE大鼠抗Ly6G、APC大鼠抗Ly6C为美国BD公司产品;HRP-羊抗兔IgG、HRP-兔抗小鼠IgG;兔多克隆抗体Ly6G为杭州华安生物技术有限公司产品;引物为生工生物工程(上海)股份有限公司产品。所有中药材均购自浙江中医药大学滨江门诊部。荧光倒置显微镜为德国Zeiss公司产品;数字病理切片(荧光)扫描分析仪为日本Olympus公司产品;流式细胞仪为美国BD公司产品。
1.2. 玄胡索散的制备
按照饮片质量以醋莪术∶醋元胡=3∶2的比例配置中药材。将中药材打成粗粉,加入8倍体积的75%乙醇,保鲜膜封口,置于超声水浴锅内,室温,超声提取60 min,滤过药液,药渣重新加入8倍体积的75%乙醇,超声提取60 min,滤过药液,抽滤后将药液合并,倒入旋转蒸发瓶浓缩2 h,将所得浸膏均匀地平铺于冻干皿,进行冷冻干燥,得药率为8.45%。
1.3. G-CSF敲减4T1细胞株的建立及鉴定
取对数生长期的4T1细胞,以2×104个/孔接种于24孔板,待细胞贴壁且融合度达到30%时进行转染,按MOI=2加入对照慢病毒,按MOI=40加入敲减慢病毒,转染时间为12 h;将转染细胞于3 μg/mL嘌呤霉素的DMEM培养基中培养48 h,然后于1.5 μg/mL嘌呤霉素的DMEM培养基中继续维持14 d。
荧光显微镜下观察细胞荧光比例,待细胞荧光比例接近100%,收集细胞培养上清液,室温下1700×g离心20 min,收集上清液,按照ELISA试剂盒说明书进行点样、加酶、温育、洗涤、显色、终止,酶标仪450 nm处测定吸光度值。根据所测得标准品和样品的吸光度值,使用ELISACalc软件绘制标准曲线,然后计算样品的实际浓度,用于G-CSF敲减4T1稳转细胞株的鉴定。
1.4. 乳腺癌小鼠模型的建立及分组干预
将4T1细胞用预冷的磷酸盐缓冲液重悬,调整细胞密度为6×106个/mL。各组均提前1 d用脱毛膏进行左腹部脱毛,75%乙醇消毒皮肤,于左侧第二对乳腺皮下脂肪垫接种100 μL单细胞悬液,制备4T1乳腺癌荷瘤小鼠模型。造模48 h后,观察注射部位出现小点状突起视为造模成功。根据成瘤体积随机分为模型对照组、G-CSF对照组、G-CSF敲减组、玄胡索散小剂量组、玄胡索散中剂量组、玄胡索散大剂量组和环磷酰胺组。其中G-CSF对照组和G-CSF敲减组分别采用shRNA慢病毒转染联合嘌呤霉素构建相应4T1稳转细胞造模。本研究使用0.5%羟甲基纤维素钠溶解玄胡索散和环磷酰胺。各组造模48 h后,玄胡索散小剂量组、玄胡索散中剂量组、玄胡索散大剂量组分别按2、4、8 g·kg-1·d-1玄胡索散剂量灌胃,每天一次;环磷酰胺组按30 mg/kg环磷酰胺剂量腹腔注射,隔天一次;其他组给予等体积0.5%羟甲基纤维素纳。各组连续给药25 d,然后进行后续实验。其中小鼠玄胡索散中剂量按照人体用药量等效换算,换算系数为12.33[10]。
1.5. 测定肿瘤体积和脾脏质量
每5天观察并记录各组肿瘤体积。游标卡尺测量荷瘤小鼠瘤体长径(L)和短径(W),并计算肿瘤体积(V),即V(mm3)=(L+W)mm×(L)mm×(W)mm×0.2618。中药灌胃结束后,颈椎脱臼法处死小鼠,置于75%乙醇中浸泡5 min,然后剖取肿瘤和脾脏,称重后拍照,计算脾脏质量。
1.6. HE染色观察小鼠脾脏病理学变化
将脾脏固定在4%多聚甲醛中,流水冲洗2 h,逐步进行脱水、透明、浸蜡、包埋、切片(厚度约4 μm);置于60 ℃烘箱2 h后用二甲苯(各15 min)和不同浓度乙醇(无水乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇)(各2 min)脱腊至水;苏木精染色5 min,水洗1 min,1%盐酸乙醇中浸泡20 s,水洗1 min,稀氨水返蓝30 s,水洗1 min,伊红染色3 min,经不同浓度乙醇(95%乙醇、无水乙醇)、二甲苯脱水和透明,置于60 ℃烘箱约10 min,采用中性树胶封片,显微镜下观察。
1.7. 流式细胞术检测小鼠脾脏MDSC亚群的比例
颈椎脱臼法处死小鼠,75%乙醇中浸泡5 min,迅速分离脾脏,磷酸盐缓冲液漂洗,去除表面血液,用无菌剪取下一小块脾脏组织,置于过滤器中,加入1 mL含2%胎牛血清的RPMI-1640培养基,用5 mL注射器迅速研磨组织,将制备好的细胞悬液转移至离心管内,570×g离心5 min,弃上清液,加入2 mL红细胞裂解液,室温静置5 min,570×g离心5 min,弃上清液,磷酸盐缓冲液重悬,分装单细胞悬液至1.5 mL EP管。调节各上样管体积100 μL,细胞密度为1×106个/100μL。各样品管滴加0.5 μL流式抗体,4 ℃下避光孵育30 min,孵育结束后各管分别加入1 mL预冷磷酸盐缓冲液清洗,570×g离心5 min,弃上清液,加入500 μL磷酸盐缓冲液重悬,200目筛网过滤,上机检测。
1.8. 免疫荧光法检测CD11b、Ly6G表达
1.8.1. 动物实验
脾脏组织取材后固定、脱水、包埋,脱蜡步骤同HE染色。然后进行抗原修复、内源性过氧化物酶阻断、磷酸盐缓冲液漂洗三次,加入鼠抗CD11b(1∶200)、兔抗Ly6G(1∶200)孵育,4 ℃过夜。次日,37 ℃烘箱复温20 min,磷酸盐缓冲液泡洗三次,先滴加携带PE荧光基团的二抗(1∶200),37 ℃烘箱孵育40 min,磷酸盐缓冲液泡洗三次;再滴加携带FITC荧光基团的二抗(1∶200),37 ℃烘箱孵育40 min,磷酸盐缓冲液泡洗三次。滴加含4,6-二脒基-2-苯基吲哚的防荧光淬灭剂,置于暗盒孵育10 min,荧光显微镜下观察。
1.8.2. 细胞实验
取对数生长4T1细胞,以2×105个/孔接种于12孔板,每组三个复孔,设置G-CSF对照组、G-CSF对照+玄胡索散组(30 μg/mL)、G-CSF敲减组、G-CSF敲减+玄胡索散组(30 μg/mL),待细胞完全贴壁后,更换含药培养基继续培养24 h。4~5周龄BALB/c雌性小鼠6只,造模成功后10 d颈椎脱臼法处死小鼠,无菌分离荷瘤小鼠脾脏,对半纵切,取1/2体积的脾脏,与4T1细胞直接接触共培养24 h,然后将脾脏用10%甲醛溶液固定48 h,免疫荧光法检测脾脏CD11b、Ly6G共表达。
1.9. 实时逆转录PCR检测G-CSF mRNA表达
取对数生长期的4T1细胞,以3×105个/孔接种于六孔板,每组三个复孔,24 h待细胞贴壁后,更换含药培养基,设置4T1对照组、玄胡索散10 μg/mL组、玄胡索散30 μg/mL组、玄胡索散100 μg/mL组干预12 h后,按照试剂盒说明书进行RNA提取,逆转录成cDNA,再进行实时荧光定量PCR。具体引物序列如下:G-CSF:正向5'-GCACTATGGTCAGGACGAGAG-3',反向5'-GGGGAAATACCCGATAGAGCC-3';GAPDH:正向5'-GGCTGCCCAGAACATCAT-3',反向5'-CGGACACATTGGGGGTAG-3'。GAPDH为内参基因,目的基因的相对表达量采用2-ΔΔCt方法表示[11]。
1.10. ELASA法测定小鼠外周血G-CSF浓度
采集小鼠外周血至EP管(非抗凝),室温静置30 min,1700×g离心15 min,小心吸取上清液并转移至新EP管,按照试剂盒说明书操作。
1.11. 统计学方法
使用GraphPad Prism 8.0进行统计分析。符合正态分布的计量数据采用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法,P<0.05为差异具有统计学意义。
2. 结 果
2.1. G-CSF敲减4T1细胞株鉴定结果
4T1对照细胞株、G-CSF对照细胞株和G-CSF敲减细胞株培养上清液中G-CSF浓度分别为(490.8±28.3)、(485.1±21.3)和(379.1±48.6)pg/mL,其中G-CSF对照细胞株与4T1对照细胞株培养上清液中G-CSF浓度差异无统计学意义(P>0.05),而G-CSF敲减细胞株培养上清液中G-CSF浓度较4T1对照细胞株和G-CSF对照细胞株均明显下降(均P<0.01),提示G-CSF敲减细胞株构建成功。
2.2. 玄胡索散可减小荷瘤小鼠肿瘤体积
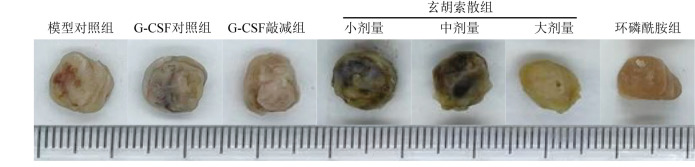
与模型对照组比较,G-CSF对照组、玄胡索散小、中剂量组肿瘤体积无显著差异(均P>0.05),而玄胡索散大剂量组、环磷酰胺组肿瘤体积均减小(均P<0.05);与G-CSF对照组比较,G-CSF敲减组肿瘤体积有缩小趋势,但差异无统计学意义(均P>0.05);与玄胡索散小剂量组比较,玄胡索散中剂量组肿瘤体积未见明显缩小(均P>0.05),而玄胡索散大剂量组在第25、30天肿瘤体积均减小(均P<0.05);与环磷酰胺组比较,玄胡索散小、中剂量组肿瘤体积差异具有统计学意义(P<0.05),而玄胡索散大剂量组肿瘤体积差异无统计学意义(均P>0.05),见图1和表1。结果表明,G-CSF对照组慢病毒转染对4T1细胞的成瘤能力未产生影响,可以排除慢病毒转染对实验结果的干扰;玄胡索散组肿瘤生长速度减慢,肿瘤体积减小,说明玄胡索散干预后能在一定程度上抑制肿瘤生长。
图1. 各组肿瘤大体观.
G-CSF:粒细胞集落刺激因子.
表1.
各组肿瘤体积随造模时间增加变化比较
| 组 别 | n | 10 d | 15 d | 20 d | 25 d | 30 d |
|---|---|---|---|---|---|---|
| 模型对照组 | 6 | 204.0±40.3 | 308.3±90.2 | 640.7±214.6 | 810.8±295.3 | 1020.0±148.8 |
| G-CSF对照组 | 6 | 175.9±43.8 | 346.7±132.5 | 644.8±226.8 | 855.5±320.4 | 1005.0±134.1 |
| G-CSF敲减组 | 6 | 152.8±32.4 | 272.0±51.7 | 565.2±108.9 | 666.1±85.7 | 825.4±245.7 |
| 玄胡索散小剂量组 | 6 | 166.7±32.8 | 303.3±97.2 | 613.6±103.0 | 778.8±272.3 | 923.1±129.5 |
| 玄胡索散中剂量组 | 6 | 159.2±36.0 | 262.7±88.9 | 492.1±166.2△ | 614.2±106.7 | 827.0±85.8△△ |
| 玄胡索散大剂量组 | 6 | 135.0±39.1 | 212.7±35.0* | 399.1±226.2 | 494.6±98.8*# | 666.1±136.4**## |
| 环磷酰胺组 | 6 | 134.4±30.4 | 204.1±32.2* | 237.6±51.7**## | 354.4±99.0**## | 508.3±93.8**## |
与模型对照组比较,*P<0.05,**P<0.01;与玄胡索散小剂量组比较,#P<0.05,##P<0.01;与环磷酰胺组比较,△P<0.05,△△P<0.01.G-CSF:粒细胞集落刺激因子.
,mm3
2.3. 玄胡索散能降低荷瘤小鼠脾脏质量、减轻脾脏组织病理改变
与正常对照组[(0.15±0.08)g]比较,模型对照组脾脏质量[(0.69±0.09)g]增加(P<0.01);与模型对照组比较,G-CSF对照组、玄胡索散小、中剂量组脾脏质量[分别为(0.69±0.06)、(0.66±0.08)、(0.63±0.11)g]未见明显减轻(均P>0.05);而玄胡索散大剂量组、G-CSF敲减组脾脏质量[分别为(0.56±0.06)、(0.44±0.19)g]较模型对照组和G-CSF对照组明显减轻(均P<0.05)。
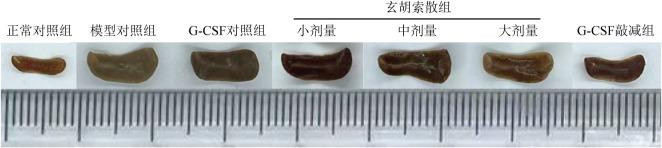
与正常对照组比较,模型对照组脾脏明显增大且脾脏组织红髓显著扩张,伴巨核细胞浸润,红、白髓界限不清;与模型对照组比较,G-CSF对照组、玄胡索散小、中剂量组脾脏体积未见明显减小,脾脏组织红、白髓界限不清,伴巨核细胞浸润;而玄胡索散大剂量组、G-CSF敲减组脾脏体积减小且脾脏组织红髓扩张面积减小,巨核细胞浸润减少,红、白髓界限尚清楚。见图2、3。
图2. 各组脾脏大体观.
G-CSF:粒细胞集落刺激因子.
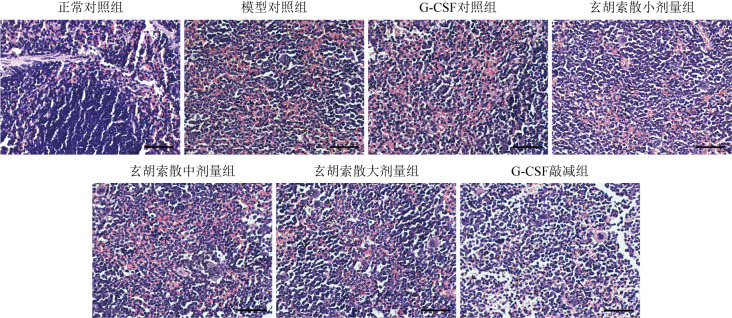
图3. 各组脾脏组织病理学变化(苏木精-伊红染色).
正常对照组脾脏白髓与红髓界限清楚;模型对照组脾脏组织红髓显著扩张,伴巨核细胞浸润,红、白髓界限不清;G-CSF对照组、玄胡索散小剂量组、中剂量组脾脏红髓显著扩张,红、白髓界限不清;玄胡索散大剂量组、G-CSF敲减组脾脏组织红髓扩张面积减小,巨核细胞浸润减少,红、白髓界限尚清. 标尺=20 μm. G-CSF:粒细胞集落刺激因子.
上述结果表明,荷瘤状态下,脾脏髓外造血过度亢进且脾脏体积增大;G-CSF敲减后荷瘤小鼠脾脏体积缩小,髓外造血减轻;玄胡索散可抑制荷瘤小鼠脾脏增大、减轻脾脏组织病理改变。
2.4. 玄胡索散下调荷瘤小鼠脾脏PMN-MDSC比例
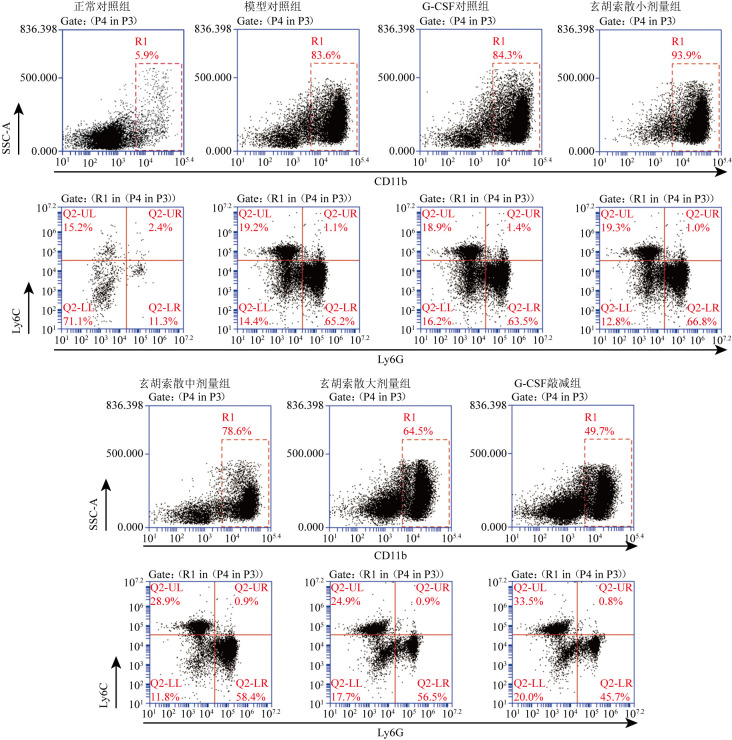
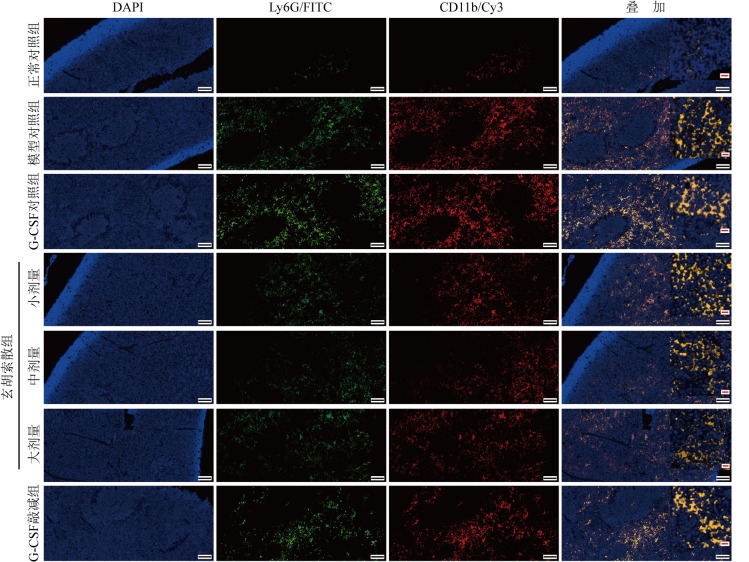
与正常对照组比较,模型对照组脾脏PMN-MDSC细胞比例增大(均P<0.01),M-MDSC细胞比例未见明显改变;与模型对照组比较,玄胡索散小剂量组PMN-MDSC细胞比例和M-MDSC细胞比例未见明显改善(均P>0.05),而玄胡索散中、大剂量组脾脏PMN-MDSC细胞比例减小,M-MDSC细胞比例增大(均P<0.05),随着玄胡索散剂量增加,脾脏PMN-MDSC细胞比例减小,M-MDSC细胞比例增大;与G-CSF对照组比较,G-CSF敲减组脾脏PMN-MDSC细胞比例减小,M-MDSC细胞比例增大(均P<0.01)。见表2和图4。免疫荧光结果显示,与正常对照组比较,模型对照组和G-CSF对照组脾脏CD11b+Ly6G+共表达(黄色区域)明显增加;与模型对照组和G-CSF对照组比较,玄胡索散小、中剂量组脾脏CD11b+Ly6G+共表达区域无显著差异,而玄胡索散大剂量组、G-CSF敲减组脾脏CD11b+Ly6G+共表达区域减少。见图5。
表2.
各组脾脏MDSC亚群比例比较
| 组 别 | n | PMN-MDSC | M-MDSC |
|---|---|---|---|
| 正常对照组 | 3 | 9.4±1.8 | 13.3±1.9 |
| 模型对照组 | 3 | 68.9±4.8** | 17.0±2.1 |
| G-CSF对照组 | 3 | 64.7±4.4 | 17.3±1.5 |
| G-CSF敲减组 | 3 | 49.9±4.2△△ | 28.5±4.4△△ |
| 玄胡索散小剂量组 | 3 | 68.4±1.8 | 16.7±2.6 |
| 玄胡索散中剂量组 | 3 | 61.8±3.3 | 25.1±3.4#▲ |
| 玄胡索散大剂量组 | 3 | 58.4±2.9#▲ | 23.7±2.1# |
与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05;与G-CSF对照组比较,△△P<0.01;与玄胡索散小剂量组比较,▲P<0.05. MDSC:髓源抑制细胞;G-CSF:粒细胞集落刺激因子;PMN-MDSC:多形核细胞样MDSC;M-MDSC:单核细胞样MDSC.
,%
图4. 各组脾脏MDSC亚群流式细胞术检测结果.
G-CSF:粒细胞集落刺激因子;MDSC:髓源抑制细胞.
图5. 各组脾脏CD11b与Ly6G共表达免疫荧光图.
正常对照组脾脏可见少量CD11b+Ly6G+的共表达(黄色区域);模型对照组、G-CSF对照组脾脏CD11b+Ly6G+共表达(黄色区域)较正常对照组明显增加;玄胡索散小、中剂量组小鼠脾脏CD11b+Ly6G+共表达区域较模型对照组和G-CSF对照组未见明显缩减;G-CSF敲减组、玄胡索散大剂量组小鼠脾脏CD11b+Ly6G+共表达区域较模型对照组和G-CSF对照组减少. G-CSF:粒细胞集落刺激因子.黑色标尺=100 μm;红色标尺=10 μm.
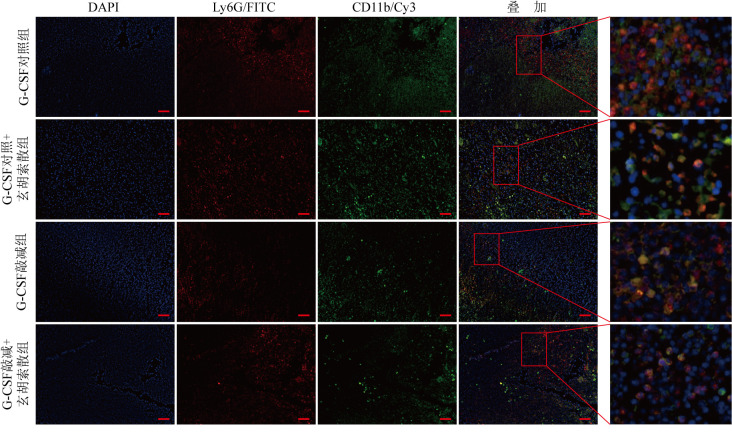
4T1细胞与荷瘤小鼠脾组织共培养体系中,与G-CSF对照组比较,玄胡索散处理或G-CSF敲减后均能减少CD11b与Ly6G在脾脏红髓和白髓交界处的共表达;在G-CSF敲减的基础上再采用玄胡索散干预,脾脏CD11b与Ly6G的共表达未见更大程度的减少,见图6。
图6. 乳腺癌细胞与荷瘤鼠脾脏组织共培养后CD11b与Ly6G共表达免疫荧光图.
与G-CSF对照组比较,G-CSF对照+玄胡索散组、G-CSF敲减组脾组织CD11b+Ly6G+共表达(橘黄色区域)显著减少;与G-CSF敲减组比较,G-CSF敲减+玄胡索散组脾组织CD11b+Ly6G+的共表达区域未进一步减少.标尺=50 μm.
上述结果表明,荷瘤状态下G-CSF促进MDSC优先向PMN-MDSC群分化,而玄胡索散干预后能下调脾脏PMN-MDSC比例。
2.5. 玄胡索散能降低4T1细胞G-CSF mRNA水平和荷瘤小鼠外周血G-CSF浓度
在体外采用不同浓度的玄胡索散提取物处理4T1细胞,然后测定G-CSF mRNA水平,与4T1对照细胞(1.00±0.07)比较,玄胡索散30、100 μg/mL处理后G-CSF mRNA水平(分别为0.39±0.21、0.27±0.25)均明显下降,且浓度越高,效果越明显(均P<0.01)。在动物实验中,与正常对照组[(289.90±50.38)pg/mL]比较,模型对照组、G-CSF对照组外周血G-CSF浓度[分别为(646.50±68.59)、(631.00±22.33)pg/mL]明显升高,差异有统计学意义(均P<0.01);与模型对照组、G-CSF对照组比较,玄胡索散小、中剂量组外周血G-CSF浓度[分别为(651.10±38.29)、(598.60±40.62)pg/mL,均P>0.05]均未见明显下降(均P>0.05);而玄胡索散大剂量组、G-CSF敲减组外周血G-CSF浓度[分别为(536.00±21.13)和(529.10±35.67)pg/mL]均下降(均P<0.05)。上述结果表明,G-CSF在乳腺癌荷瘤小鼠的外周血中浓度显著增加,而玄胡索散能降低4T1乳腺癌细胞的G-CSF mRNA水平,下调荷瘤小鼠外周血G-CSF浓度。
3. 讨论
玄胡索散是莪术和元胡组成的中药复方。现代药理学研究表明,莪术可用于血瘀腹痛、肝脾大[12],在治疗恶性肿瘤的肝脾大时,配伍莪术是临床常用策略。莪术及其活性化合物如β-榄香烯等对恶性肿瘤的治疗作用已得到药理和临床研究广泛证实[13-14]。玄胡及其活性成分小檗碱能抑制乳腺癌细胞的增殖和转移[8],延胡索丙素可通过降低整合素β1等黏附因子的表达,抑制肿瘤细胞与内皮细胞之间的异质黏附作用,从而抑制乳腺癌的转移[9]。本文资料证实,玄胡索散可通过下调G-CSF表达抑制乳腺癌脾脏MDSC分化,重建脾脏髓系微环境,从而发挥抗乳腺癌的作用。
肿瘤被视为一种生态性疾病,其中肿瘤细胞、基质细胞和浸润性免疫细胞之间的相互作用对于疾病的进展有重要作用。髓系细胞是这个生态系统的主要组成部分,肿瘤进展与髓系细胞的持续积累和扩张有关,包括肿瘤相关巨噬细胞、肿瘤相关中性粒细胞和MDSC[15]。MDSC是由大量不成熟的骨髓细胞组成的异质群体,其产生是由肿瘤衍生因子,如G-CSF、粒细胞-巨噬细胞集落刺激因子和白介素-6诱导的。MDSC通过产生VEGF及其类似物BV8、基质金属蛋白酶9、钙卫蛋白(S100A8/9)等肿瘤血管新生、肿瘤细胞迁移与浸润及转移前生态位形成所必需的介质参与肿瘤进展[16-17]。MDSC代表大量未成熟骨髓细胞的异质群体,其特征在于病理状态下的活化并显示出有效的免疫抑制活性[18],能保护肿瘤免受免疫系统和免疫治疗的影响,在黑色素瘤[19]、多发性骨髓瘤[20]、肝癌[21]、非小细胞肺癌[22]和结肠直肠癌[23]等各种肿瘤中起重要作用。研究表明,肿瘤来源的MDSC介导转移前生态位形成是恶性肿瘤高转移性的原因[24]。此外,浸润MDSC的肿瘤可以诱导不依赖VEGF的血管生成,从而对抗VEGF药物的治疗敏感性显著下降[25]。一项基于乳腺癌小鼠模型的研究表明,肿瘤衍生的G-CSF调节造血干祖细胞动员和分化,一方面使未成熟骨髓细胞大量扩增,这类细胞具有MDSC表型特征,自身虽然不具备免疫抑制能力,但能向肿瘤相关免疫抑制细胞群分化;另一方面使荷瘤机体的造血功能始终偏向骨髓谱系[26]。Strauss等[27]也发现骨髓中CD11b+Gr-1+细胞群受G-CSF依赖的维甲酸相关孤核受体与CCAAT/增强子结合蛋白β通路的激活而扩展。以上研究表明,髓系细胞能直接感知环境刺激和炎症细胞因子,可主动作为免疫反应的基础,但这种独特的感知作用却能被肿瘤细胞劫持。肿瘤细胞能通过持续性、渐进性地释放细胞因子、趋化因子以及代谢产物来影响髓系细胞的活动。
由于髓系细胞的寿命短暂,转换周期快,因此,肿瘤会干扰宿主的造血过程,使具有促进肿瘤特性的髓系细胞获得优势。脾脏作为机体最大的次级淋巴器官,同时也是髓外造血器官,被视为癌症中髓外造血的主要部位。肝癌模型中,脾脏髓外造血的消除减少了PMN-MDSC产生[28]。在4T1细胞株建立的小鼠乳腺癌模型中发现,PMN-MDSC大量产生,脾脏作为其主要存储库明显肿大[29]。有研究报道,在癌症患者的脾脏中发现了髓样前体细胞的大量扩增[30]。这些研究表明,脾脏是肿瘤浸润性骨髓细胞尤其是在肿瘤生长和扩散过程中起重要作用的MDSC及其亚群的生产和储存库,重建和修复脾脏髓系微环境对于肿瘤的免疫治疗具有重要意义。然而,玄胡索散是否能通过调控脾脏MDSC分化影响乳腺癌进展却鲜见报道。本文资料证实,玄胡索散能减小荷瘤小鼠的肿瘤体积,抑制乳腺癌小鼠脾脏MDSC分化,下调乳腺癌小鼠脾脏PMN-MDSC比例,减轻脾脏髓外造血,提示玄胡索散可能通过负向调控脾脏MDSC分化而发挥抗乳腺癌作用。本文资料还显示,G-CSF敲减组、玄胡索散组脾脏M-MDSC数增加,这可能缘于向PMN-MDSC的分化受到抑制而向M-MDSC的分化代偿性增加。
G-CSF是造血驱动因子之一,可在结肠癌、甲状腺癌、胰腺癌、膀胱癌、肺癌和肝癌等多种癌症中大量产生[31-36]。G-CSF在肿瘤微环境中能够促进肿瘤生长与转移,患者预后不良且总存活率降低可能与G-CSF促进血管生成和增强未成熟粒细胞动员的作用高度相关[37-38]。研究报道,乳腺癌患者的G-CSF血浆水平显著升高,其中三阴性乳腺癌患者表现出更高的G-CSF表达[39]。本文资料证实,乳腺癌荷瘤小鼠外周血中G-CSF浓度显著高于正常对照组,玄胡索散干预后能下调外周血G-CSF浓度,以大剂量组最明显。然而,G-CSF在调控乳腺癌脾脏MDSC分化过程中的作用尚不明确。研究表明,在宫颈癌中,G-CSF与增加的MDSC比例和对化疗的抵抗力有关[40]。除此之外,G-CSF已被证明可促进MDSC细胞活性,从而增强乳腺癌生长,并已被建议作为抑制MDSC活性的靶标[10]。由此推测,玄胡索散可能通过下调G-CSF表达,从而抑制脾脏MDSC分化和积累,发挥抗乳腺癌作用。本文资料证实,乳腺癌荷瘤小鼠G-CSF浓度显著升高并刺激脾脏MDSC分化为PMN-MDSC亚群,而玄胡索散干预能够下调G-CSF浓度并下调PMN-MDSC比例,从而发挥抗肿瘤作用。G-CSF是诱导脾脏中CD11b与Ly6G双阳性的MDSC细胞产生的主要诱导因子。为了进一步验证玄胡索散是否通过调控G-CSF从而抑制荷瘤小鼠脾脏CD11b与Ly6G共表达,本研究将荷瘤小鼠脾脏与4T1稳转细胞株进行共培养,发现玄胡索散能减少CD11b与Ly6G在脾脏红髓和白髓交界处的共表达。玄胡索散在体内、体外均能有效抑制MDSC的产生,这种作用很有可能通过调控G-CSF的水平发挥。
综上,玄胡索散可通过下调G-CSF发挥抗乳腺癌作用,其机制可能与G-CSF调控脾脏MDSC分化有关。
Acknowledgments
研究得到浙江省基础公益研究计划(LGC20B050010,LQ18H280002,LY19H280010,LY22H160007)支持. 《浙江大学学报(医学版)》编辑部余方等编辑在稿件修改中提供帮助
Acknowledgments
This work was supported by Zhejiang Provincial Basic Public Welfare Research Program (LGC20B050010, LQ18H280002, LY19H280010, LY22H160007). Editors including YU Fang from the editorial department of the Journal of Zhejiang University (Medical Sciences) provided assistance in the revision of the manuscript
[缩略语]
髓源抑制细胞(myeloid-derived suppressor cells,MDSC);粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF);信号传导与转录激活因子(signal transducer and activator of transcription,STAT);多形核细胞样MDSC(polymorphonuclear MDSC,PMN-MDSC);酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA);免疫球蛋白G(immunoglobulin G,IgG);异硫氰酸荧光素(fluorescein isothiocyanate,FITC);辣根过氧化物酶(horseradish peroxidase,HRP);病毒感染复数(multiplicity of infection,MOI);苏木精-伊红染色(hematoxylin and eosin staining,HE染色);聚合酶链反应(polymerase chain reaction,PCR);单核细胞样MDSC(monocyte MDSC,M-MDSC);血管内皮生长因子(vascular endothelial growth factor,VEGF)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献
- 1.SIEGEL R L, MILLER K D, FUCHS H E, et al. . Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. 10.3322/caac.21708 [DOI] [PubMed] [Google Scholar]
- 2.TUCCITTO A, SHAHAJ E, VERGANI E, et al. . Immunosuppressive circuits in tumor microenvironment and their influence on cancer treatment efficacy[J]. Virchows Arch, 2019, 474(4): 407-420. 10.1007/s00428-018-2477-z [DOI] [PubMed] [Google Scholar]
- 3.DUGAST A S, HAUDEBOURG T, COULON F, et al. . Myeloid-derived suppressor cells accumulate in kidney allograft tolerance and specifically suppress effector T cell expansion[J]. J Immunol, 2008, 180(12): 7898-7906. 10.4049/jimmunol.180.12.7898 [DOI] [PubMed] [Google Scholar]
- 4.MAZZONI A, BRONTE V, VISINTIN A, et al. . Myeloid suppressor lines inhibit T cell responses by an NO-dependent mechanism[J]. J Immunol, 2002, 168(2): 689-695. 10.4049/jimmunol.168.2.689 [DOI] [PubMed] [Google Scholar]
- 5.CLARK C E, HINGORANI S R, MICK R, et al. . Dynamics of the immune reaction to pancreatic cancer from inception to invasion[J]. Cancer Res, 2007, 67(19): 9518-9527. 10.1158/0008-5472.can-07-0175 [DOI] [PubMed] [Google Scholar]
- 6.GAO J L, HE T C, LI Y B, et al. . A traditional Chinese medicine formulation consisting of Rhizoma Corydalis and Rhizoma Curcumae exerts synergistic anti-tumor activity[J]. Oncol Rep, 2009, 22(5): 1077-1083. 10.3892/or_00000539 [DOI] [PubMed] [Google Scholar]
- 7.GAO J L, SHI J M, LEE S M, et al. . Angiogenic pathway inhibition of Corydalis yanhusuo and berberine in human umbilical vein endothelial cells[J]. Oncol Res, 2009, 17(11-12): 519-526. 10.3727/096504009789745575 [DOI] [PubMed] [Google Scholar]
- 8.GAO J L, SHI J M, HE K, et al. . Yanhusuo extract inhibits metastasis of breast cancer cells by modulating mitogen-activated protein kinase signaling pathways[J]. Oncol Rep, 2008, 20(4): 819-824. [PubMed] [Google Scholar]
- 9.HE K, GAO J L. Protopine inhibits heterotypic cell adhesion in MDA-MB-231 cells through down-regulation of multi-adhesive factors[J]. Afr J Tradit Complement Altern Med, 2014, 11(2): 415-424. 10.4314/ajtcam.v11i2.28 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 71. [Google Scholar]; WEI Wei, WU Ximei, LI Yuanjian. Pharmacological experimental methodology[M]. 4th edition. Beijing: People’s Health Publishing House, 2010: 71. (in Chinese) [Google Scholar]
- 11.SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101-1108. 10.1038/nprot.2008.73 [DOI] [PubMed] [Google Scholar]
- 12.陈家树. 董廷瑶教授运用三棱莪术配伍的经验[J]. 辽宁中医杂志, 1995, 22(10): 440-441. [Google Scholar]; CHEN Jiashu. Professor Dong Tingyao’s experience in using the compatibility of Sparganii Rhizoma and Curcumae Rhizoma[J]. Liaoning Journal of Traditional Chinese Medicine, 1995, 22(10): 440-441. (in Chinese) [Google Scholar]
- 13.LI X, LIN Z, ZHANG B, et al. . β-elemene sensitizes hepatocellular carcinoma cells to oxaliplatin by preventing oxaliplatin-induced degradation of copper transporter 1[J]. Sci Rep, 2016, 6: 21010. 10.1038/srep21010 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.倪雯婷, 潘燕红, 王爱云, 等. 破血消癥中药抗肿瘤转移研究进展[J]. 中草药, 2016, 47(24): 4472-4477. 10.7501/j.issn.0253-2670.2016.24.028 [DOI] [Google Scholar]; NI Wenting, PAN Yanhong, WANG Aiyun, et al. . Research progress in inhibition of Chinese materia medica with breaking blood stasis and resolving mass on tumor metastasis[J]. Chinese Traditional and Herbal Drugs, 2016, 47(24): 4472-4477. (in Chinese) 10.7501/j.issn.0253-2670.2016.24.028. 10.7501/j.issn.0253-2670.2016.24.028 [DOI] [Google Scholar]
- 15.WU C, HUA Q, ZHENG L. Generation of myeloid cells in cancer: the spleen matters[J]. Front Immunol, 2020, 11: 1126. 10.3389/fimmu.2020.01126 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.BRONTE V, BRANDAU S, CHEN S H, et al. . Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards[J]. Nat Commun, 2016, 7: 12150. 10.1038/ncomms12150 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.MEIROW Y, KANTERMAN J, BANIYASH M. Paving the road to tumor development and spreading: myeloid-derived suppressor cells are ruling the fate[J]. Front Immunol, 2015, 6: 523. 10.3389/fimmu.2015.00523 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.GABRILOVICH D I. Myeloid-derived suppressor cells[J]. Cancer Immunol Res, 2017, 5(1): 3-8. 10.1158/2326-6066.cir-16-0297 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.JIANG H, GEBHARDT C, UMANSKY L, et al. . Elevated chronic inflammatory factors and myeloid-derived suppressor cells indicate poor prognosis in advanced melanoma patients[J]. Int J Cancer, 2015, 136(10): 2352-2360. 10.1002/ijc.29297 [DOI] [PubMed] [Google Scholar]
- 20.BRIMNES M K, VANGSTED A J, KNUDSEN L M, et al. . Increased level of both CD4+FOXP3+ regulatory T cells and CD14+HLA-DR(-)/low myeloid-derived suppressor cells and decreased level of dendritic cells in patients with multiple myeloma[J]. Scand J Immunol, 2010, 72(6): 540-547. 10.1111/j.1365-3083.2010.02463.x [DOI] [PubMed] [Google Scholar]
- 21.HOECHST B, ORMANDY L A, BALLMAIER M, et al. . A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4(+)CD25(+)Foxp3(+) T cells[J]. Gastro-enterology, 2008, 135(1): 234-243. 10.1053/j.gastro.2008.03.020 [DOI] [PubMed] [Google Scholar]
- 22.LIU C Y, WANG Y M, WANG C L, et al. . Population alterations of L-arginase- and inducible nitric oxide synthase-expressed CD11b+/CD14(-)/CD15+/CD33+ myeloid-derived suppressor cells and CD8+ T lymphocytes in patients with advanced-stage non-small cell lung cancer[J]. J Cancer Res Clin Oncol, 2010, 136(1): 35-45. 10.1007/s00432-009-0634-0 [DOI] [PubMed] [Google Scholar]
- 23.CHUN E, LAVOIE S, MICHAUD M, et al. . CCL2 promotes colorectal carcinogenesis by enhancing polymorphonuclear myeloid-derived suppressor cell population and function[J]. Cell Rep, 2015, 12(2): 244-257. 10.1016/j.celrep.2015.06.024 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.SASANO T, MABUCHI S, KOZASA K, et al. . The highly metastatic nature of uterine cervical/endometrial cancer displaying tumor-related leukocytosis: clinical and preclinical investigations[J]. Clin Cancer Res, 2018, 24(16): 4018-4029. 10.1158/1078-0432.ccr-17-2472 [DOI] [PubMed] [Google Scholar]
- 25.PHAN V T, WU X, CHENG J H, et al. . Oncogenic RAS pathway activation promotes resistance to anti-VEGF therapy through G-CSF-induced neutrophil recruitment[J]. Proc Natl Acad Sci U S A, 2013, 110(15): 6079-6084. 10.1073/pnas.1303302110 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.CASBON A J, REYNAUD D, PARK C, et al. . Invasive breast cancer reprograms early myeloid differentiation in the bone marrow to generate immunosuppressive neutrophils[J/OL]. Proc Natl Acad Sci U S A, 2015, 112(6): E566- E575. 10.1073/pnas.1424927112 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.STRAUSS L, SANGALETTI S, CONSONNI F M, et al. . RORC1 regulates tumor-promoting “emergency” granulo-monocytopoiesis[J]. Cancer Cell, 2015, 28(2): 253-269. 10.1016/j.ccell.2015.07.006 [DOI] [PubMed] [Google Scholar]
- 28.WU C, NING H, LIU M, et al. . Spleen mediates a distinct hematopoietic progenitor response supporting tumor-promoting myelopoiesis[J]. J Clin Invest, 2018, 128(8): 3425-3438. 10.1172/jci97973 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.YAMAMOTO Y, ISHIGAKI H, ISHIDA H, et al. . Analysis of splenic Gr-1int immature myeloid cells in tumor-bearing mice[J]. Microbiol Immunol, 2008, 52(1): 47-53. 10.1111/j.1348-0421.2008.00009.x [DOI] [PubMed] [Google Scholar]
- 30.ALMAND B, CLARK J I, NIKITINA E, et al. . Increased production of immature myeloid cells in cancer patients: a mechanism of immunosuppression in cancer[J]. J Immunol, 2001, 166(1): 678-689. 10.4049/jimmunol.166.1.678 [DOI] [PubMed] [Google Scholar]
- 31.YANG X, LIU F, XU Z, et al. . Expression of granulocyte colony stimulating factor receptor in human colorectal cancer[J]. Postgrad Med J, 2005, 81(955): 333-337. 10.1136/pgmj.2004.024646 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.FUJITA T, OGASAWARA Y, NAITO M, et al. . Anaplastic thyroid carcinoma associated with granulocyte colony-stimulating factor: report of a case[J]. Surg Today, 2006, 36(1): 63-67. 10.1007/s00595-005-3100-x [DOI] [PubMed] [Google Scholar]
- 33.VINZENS S, ZINDEL J, ZWEIFEL M, et al. . Granulocyte colony-stimulating factor producing anaplastic carcinoma of the pancreas: case report and review of the literature[J]. Anticancer Res, 2017, 37(1): 223-228. 10.21873/anticanres.11310 [DOI] [PubMed] [Google Scholar]
- 34.NISHIMURA K, HIGASHINO M, HARA T, et al. . Bladder cancer producing granulocyte colony-stimulating factor: a case report[J]. Int J Urol, 1996, 3(2): 152-154. 10.1111/j.1442-2042.1996.tb00502.x [DOI] [PubMed] [Google Scholar]
- 35.SATO N, ASANO S, UEYAMA Y, et al. . Granulo-cytosis and colony-stimulating activity (CSA) produced by a human squamous cell carcinoma[J]. Cancer, 1979, 43(2): 605-610. [DOI] [PubMed] [Google Scholar]
- 36.KOHNO M, SHIRABE K, MANO Y, et al. . Granulocyte colony-stimulating-factor-producing hepatocellular carcinoma with extensive sarcomatous changes: report of a case[J]. Surg Today, 2013, 43(4): 439-445. 10.1007/s00595-012-0202-0 [DOI] [PubMed] [Google Scholar]
- 37.KOWANETZ M, WU X, LEE J, et al. . Granulocyte-colony stimulating factor promotes lung metastasis through mobilization of Ly6G+Ly6C+ granulocytes[J]. Proc Natl Acad Sci U S A, 2010, 107(50): 21248-21255. 10.1073/pnas.1015855107 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.SHOJAEI F, WU X, QU X, et al. . G-CSF-initiated myeloid cell mobilization and angiogenesis mediate tumor refractoriness to anti-VEGF therapy in mouse models[J]. Proc Natl Acad Sci U S A, 2009, 106(16): 6742-6747. 10.1073/pnas.0902280106 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.CAO Y, SLANEY C Y, BIDWELL B N, et al. . BMP4 inhibits breast cancer metastasis by blocking myeloid-derived suppressor cell activity[J]. Cancer Res, 2014, 74(18): 5091-5102. 10.1158/0008-5472.can-13-3171 [DOI] [PubMed] [Google Scholar]
- 40.KAWANO M, MABUCHI S, MATSUMOTO Y, et al. . The significance of G-CSF expression and myeloid-derived suppressor cells in the chemoresistance of uterine cervical cancer[J]. Sci Rep, 2015, 5: 18217. 10.1038/srep18217 [DOI] [PMC free article] [PubMed] [Google Scholar]