Abstract
目的
探讨硫化氢(H2S)对脓毒症心肌损伤中活性氧(ROS)介导的内质网应激的影响。
方法
采用盲肠结扎穿刺术(CLP)诱导SD大鼠脓毒症模型,将大鼠随机分成假手术(sham)组、脓毒症(CLP)组、脓毒症+硫氢化钠(NaHS)(CLP+NaHS)组。超声心动图观察各组大鼠左心室功能,检测大鼠血浆H2S的水平;通过乳酸脱氢酶(LDH)、丙二醛(MDA)、谷胱甘肽(GSH)水平检测以及ROS染色评估大鼠心肌氧化应激水平;HE染色观察大鼠心肌组织形态变化,透射电子显微镜观察心肌细胞线粒体超微结构;Western blot检测细胞内源性硫化氢合成酶半胱硫氨酸-γ-裂解酶(CSE)、3-巯基丙酮酸硫转移酶(3-MST)表达变化,内质网应激标志性蛋白:磷酸化(p)-激酶蛋白激酶R样内质网激酶(PERK)、p-细胞翻译启始因子2α(eIF2α)、p-肌醇需要酶1α(IRE1α)、活化转录因子(ATF)4和C/EBP同源蛋白(CHOP)的表达变化;TUNEL染色观察大鼠心肌细胞凋亡变化。
结果
脓毒症大鼠左室射血分数(LVEF)、左心室缩短分数(LVFS)降低(P<0.05),血浆H2S降低(P<0.05),血浆H2S与LVEF和LVFS呈线性相关(r2=0.62、r2=0.64,P均<0.05)。脓毒症组大鼠ROS水平明显增强,LDH水平增高(P<0.05),MDA表达增强(P<0.05),GSH表达下降(P<0.05);在HE染色中可见炎性细胞浸润,心肌细胞水肿,透射电子显微镜可观察到线粒体明显损伤,可见线粒体水肿,嵴结构溶解等情况;Western blot结果显示,CSE、3-MST表达水平有所下降(P<0.05),内质网应激标志性蛋白p-PERK、p-eIF2α、IRE1α、ATF4和CHOP蛋白表达水平升高(P<0.05);TUNEL染色结果显示心肌细胞凋亡水平明显增加(P<0.05)。NaHS处理后,LVEF和LVFS升高(P<0.05),血浆H2S升高(P<0.05)。心肌氧化应激水平降低,HE与透射电镜显示心肌形态学有改善,线粒体损伤减轻,CSE、3-MST水平升高(P<0.05),p-PERK、p-eIF2α、IRE1α、CHOP蛋白表达下降(P<0.05),心肌细胞凋亡水平有所下降(P<0.05)。
结论
H2S通过抑制ROS介导的内质网应激,减少脓毒症心肌细胞凋亡,从而改善脓毒症心肌功能障碍。
Keywords: 脓毒症, 心肌损伤, 凋亡, 内质网应激, 硫化氢
Abstract
Objective
To investigate the effect of hydrogen sulfide (H2S) on reactive oxygen species (ROS)-mediated endoplasmic reticulum stress in myocardial injury caused by sepsis.
Methods
A sepsis model was induced in Sprague-Dawley (SD) rats by cecal ligation and puncture (CLP). The rats were randomly divided into sham operation (sham) group, sepsis (CLP) group, and sepsis+sodium hydrosulfide (NaHS) (CLP+NaHS) group. The left ventricular function of the rats was observed with echocardiography and their plasma H2S levels were measured. Lactate dehydrogenase (LDH), malondialdehyde (MDA), glutathione (GSH) levels were measured and HE staining was done to evaluate the level of myocardial oxidative stress in rats. HE staining was done to observe the morphological changes of rat myocardium, and transmission electron microscope was used to observe the ultrastructure of myocardial mitochondria. Western blot was done to examine changes in the expression of two endogenous hydrogen sulfide synthases, cystathionine γ-lyase (CSE) and 3-mercaptopyruvate sulfur transferase (3-MST), and changes in the expression of endoplasmic reticulum stress (ERS) marker proteins, including phosphorylated (p) protein kinase R-like endoplasmic reticulum kinase (p-PERK), p-eukaryotic translation initiation factor 2α (p-eIF2α), p-inositol requires enzyme 1α (IRE1α), recombinant activating transcription factor 4 (ATF4), and C/EBP homologous protein (CHOP). TUNEL staining was performed to observe the changes of cardiomyocyte apoptosis in rats.
Results
Left ventricular ejection fraction (LVEF), left ventricular shortening fraction (LVFS) and plasma H2S decreased in septic rats (P<0.05). Plasma H2S exhibited linear correlation with LVEF and LVFS (r2=0.62 and r2=0.64, all P<0.05). The ROS levels were significantly elevated in rats of the CLP group. In addition, these rats showed increased level of LDH (P<0.05), increased expression of MDA (P<0.05), and decreased expression of GSH (P<0.05). Inflammatory cell infiltration and cardiomyocyte edema were observed in HE staining. Transmission electron microscopic observation revealed significant mitochondrial damage, observable mitochondrial edema, and cristae structure dissolution. The Western blot results showed that the expression levels of CSE and 3-MST decreased (P<0.05), while the ERS marker proteins, including p-PERK, p-eIF2, IRE1α, ATF4, and CHOP, were expressed at increased levels (P<0.05). TUNEL staining showed significant increase of apoptosis in cardiomyocytes (P<0.05). After NaHS treatment, LVEF and LVFS increased (P<0.05) and plasma H2S increased in septic rats (P<0.05). Myocardial oxidative stress levels decreased. HE staining and transmission electron microscopy showed improved myocardial morphology. Mitochondrial damage was reduced and CSE and 3-MST levels were significantly increased (P<0.05). The expression of p-PERK, p-eIF2α, p-IRE1α, and CHOP proteins decreased (P<0.05). A decrease in cardiomyocyte apoptosis levels was observed by TUNEL staining (P<0.05).
Conclusion
H2S reduces septic cardiomyocyte apoptosis by inhibiting ROS-mediated ERS, thereby improving myocardial dysfunction in sepsis.
Keywords: Sepsis, Myocardial injury, Apoptosis, Endoplasmic reticulum stress, Hydrogen sulfide
脓毒症是感染导致的机体反应失调,血流动力学不稳定加剧,甚至多器官衰竭的疾病[1-2],是院内死亡的主要原因[3]。在脓毒症的各种并发症中,脓毒症引起的心功能障碍虽然是可逆的,但这种并发症对机体的危害仍然不容小觑,患者通常表现为心室射血分数降低并伴有心室扩张[1]。
内质网为新生肽链的折叠提供了优化的环境,其对细胞内稳态的改变极其敏感。正常情况下,组织或细胞中的活性氧(reactive oxygen species, ROS)水平很低。当组织或细胞受到强应激时,ROS会急剧增加,当内质网受到ROS的持续刺激,将会触发内质网应激信号通路[4]。内质网应激由3种跨膜蛋白激活,包括肌醇需要酶1α(IRE1α)、激酶蛋白激酶R样内质网激酶(PERK)和活化转录因子(ATF)6。内质网应激的发生会触发未折叠蛋白的反应(UPR),并激活C/EBP同源蛋白(CHOP)介导的凋亡信号通路[5],导致心肌细胞的凋亡。因此抑制内质网应激反应,可能对脓毒症心肌病的改善有所帮助。
硫化氢(H2S)是在哺乳动物体内发现的第三种气体信号分子,承载许多生物信号的传递,内源性H2S的产生依赖3种关键酶——半胱硫氨酸-β-合成酶(CBS)、半胱硫氨酸-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶(3-MST),它们在不同器官中表达水平不同,比如CSE是心血管系统中产生内源性H2S的主要合成酶,而CBS在中枢神经系统、肾脏中大量表达,3-MST广泛表达于肺、肝和血管系统[6]。我们前期研究发现,H2S具有抗炎保护心血管系统的作用[7],本研究拟进一步通过构建脓毒症大鼠心肌损伤模型,分析H2S在脓毒症心肌病内质网应激中的作用。
1. 材料和方法
1.1. 实验动物及主要试剂
清洁级雄性SD大鼠72只,周龄7~8周,体质量为(270±25) g,购自中国山东济南朋悦实验动物繁育有限公司,动物许可编号SCXK(鲁)2019-0003。大鼠饲养在正常环境中,自由饮食、饮水。所涉及的动物实验按照石河子大学动物保护委员会的规定进行,所有实验方案均经石河子大学动物保护与使用委员会批准。
硫化氢检测试剂盒,乳酸脱氢酶(LDH)、丙二醛(MDA)、谷胱甘肽(GSH)试剂盒均购自中国南京建成生物研究所,ROS试剂盒、RIPA裂解液购自索莱宝公司, 兔抗PERK单克隆抗体、兔抗磷酸化(p)-PERK单克隆抗体、兔抗细胞翻译启始因子2α(eIF2α)单克隆抗体、兔抗p-eIF2α单克隆抗体、兔抗IRE1α单克隆抗体、兔抗ATF4单克隆抗体、兔抗CHOP单克隆抗体及内参兔抗β-actin、山羊抗兔的辣根过氧化物酶标记的IgG均购自英国Abcam公司,硫氢化钠(NaHS)粉剂购自美国Sigma公司,TUNEL凋亡检测试剂盒购自德国Mannheim公司。
1.2. 实验动物及细胞模型分组
将所有大鼠随机分为3组:sham组,盲肠结扎穿刺术(CLP)组,CLP+NaHS组,每组24只,采用CLP建立大鼠脓毒症实验模型。所有大鼠术前禁食12 h,饮水自由。首先,戊巴比妥钠45 mg/kg腹腔注射麻醉大鼠,随后进行手术。沿腹部中线切开,露出盲肠,细线结扎盲肠中部,用21号针穿刺盲肠末端。将少量胃内容物挤出,将盲肠归位,随后缝合腹部。假手术组不结扎、不穿刺,其余步骤相同。CLP+NaHS组在CLP术后将NaHS(8.9 μg/kg)进行腹腔注射。最后3组大鼠用2 mL 0.9%氯化钠生理盐水进行液体复苏。CLP建模后,脓毒症大鼠均出现呼吸频率增加、心率升高、抑郁、垂直毛发、蜷缩、饮食、活动减少等症状,与脓毒症大鼠模型的一般表现一致,说明成功造模。
1.3. 超声心动图检查
术后12 h用戊巴比妥麻醉大鼠,并剃去前胸毛。然后使用配备了10 mhz线性传感器的超高分辨率小动物超声系统进行评价。在M型超声模块下测量心率、计算左室射血分数(LVEF%)和左室缩短分数(LVFS%)。每只大鼠至少记录3个心脏周期,以反映大鼠心脏的舒张和收缩功能。
1.4. 大鼠血浆H2S水平的检测
术后12 h用戊巴比妥麻醉大鼠,超声心动图检查后,“V”字型剪开大鼠腹部皮肤,暴露内脏,将肠管及脂肪推向鼠左侧腹部,暴露腹主动脉。采用真空采血管沿腹主动脉向心性缓慢进针,每只大鼠取血3 mL,采足血样后,将针头退出血管。每组取0.6 mL血浆与1%醋酸锌充分混匀,再加入三氯乙酸0.6 mL终止反应,1 000 r/min,4 ℃,离心去上清,随后加入蒸馏水0.6 mL 10 000 ×g,4 ℃,离心去上清,随后加入对氨基二甲基苯胺盐酸盐0.3 mL与三氯化铁0.3 mL,室温静置10 min,在酶标仪670 nm下测量各管吸光度值,所有步骤按照硫化氢检测试剂盒说明书操作。
1.5. LDH、MDA、GSH水平检测
术后12 h用戊巴比妥麻醉大鼠,超声心动图检查后,取2 mL大鼠腹主动脉血离心血清,检测心肌酶LDH变化水平。取血后手术取出各组大鼠心肌组织,通过研磨取左心室心肌组织匀浆上清液检测GSH、MDA的变化水平。操作步骤均按照对应试剂盒说明书操作。
1.6. HE染色
洗净各组大鼠心肌组织的残余血液,置于体积分数为4%多聚甲醛缓冲液中固定保存48 h后行石蜡包埋切片(5 μm),60 ℃烤片30 min进行脱蜡,水洗后行HE染色,梯度酒精脱水,透明,滴加适量中性树胶后加盖玻片封片,待切片干燥后光学显微镜下观察心肌损伤并拍照保存。
1.7. 透射电镜检测
将各组大鼠心肌组织放入2%戊二醛固定,4 ℃,过夜。在乙醇系列中上升并嵌入环氧树脂中脱水后,切割超薄切片,用醋酸铀酰和柠檬酸铅染色,最后在透射电子显微镜下拍照,观察心肌纤维微结构和线粒体的变化。
1.8. 大鼠心肌细胞内ROS的测定
将各组大鼠新鲜心肌组织冰冻切片进行ROS染色。使用含乙醇-干冰的OCT化合物包埋心脏组织并切片(5 μm),置于载玻片上,储存于−80 ℃冰箱。在每张组织切片上滴加ROS检测液(10 mol/L),37 ℃避光湿盒中30 min,荧光显微镜观察和拍摄红色发射图像,ROS阳性细胞在整个核区被染成红色(激发波长为490 nm,发射波长为610 nm)。
1.9. Western blot检测内源性H2S合成酶与内质网应激相关蛋白
取各组大鼠适量心肌组织用组织裂解液提取总蛋白,分光光度计测定蛋白质浓度。随后,将10 μL总蛋白装入6%~12% SDS-PAGE凝胶上,转移到PVDF膜上,在5%BSA中室温封闭2 h。加入一抗兔抗CSE、兔抗3-MST、兔抗p-PERK、兔抗p-eIF2α、兔抗IRE1α、兔抗ATF4、兔抗CHOP,一抗滴度均为1∶1 000,4 ℃孵育过夜。TBST清洗3次,与辣根过氧化物酶偶联山羊抗兔IgG抗体(1∶10 000)室温孵育2 h,采用ECL信号法采集蛋白信号。Image J采集蛋白条带灰度值,用目的蛋白与内参蛋白条带灰度值的比值作为目的蛋白的相对表达量。
1.10. TUNEL法检测心肌细胞凋亡
将各组大鼠心肌组织以体积分数为4%多聚甲醛固定过夜,双蒸水冲洗、脱水、脱乙醇、透明、石蜡包埋,制备厚度为2~3 μm切片,使用TUNEL凋亡检测试剂盒进行TUNEL染色,于光学显微镜下观察凋亡阳性细胞。具体步骤按照试剂盒说明书操作。
1.11. 统计学方法
计量资料用 表示,组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异有统计学意义。血浆H2S与LVEF和LVFS的相关性采用线性分析,r2越接近于1,拟合优度越大。
表示,组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异有统计学意义。血浆H2S与LVEF和LVFS的相关性采用线性分析,r2越接近于1,拟合优度越大。
2. 结果
2.1. H2S可缓解脓毒症大鼠心功能障碍
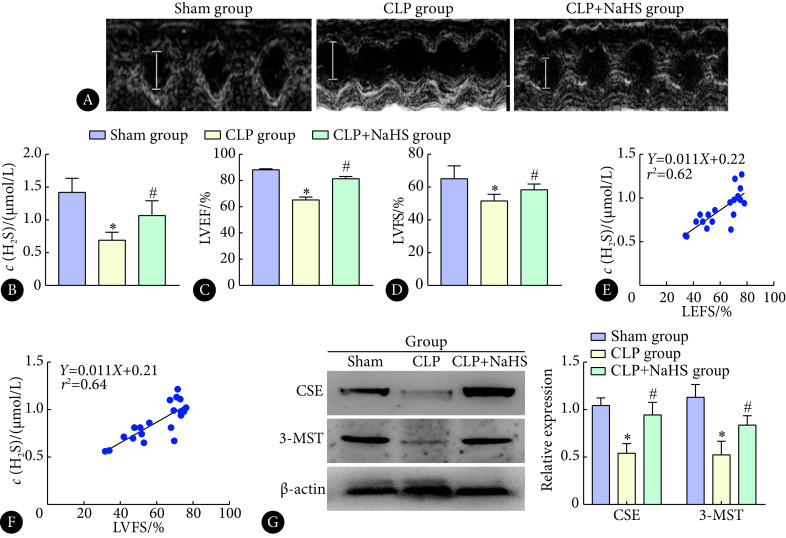
术后12 h,sham组、CLP组和CLP+NaHS组大鼠死亡数量分别为0、6和3只(大鼠死亡后补充新鼠继续造模,使每组样本量均一致)。超声心动图结果示,与sham组相比,CLP组大鼠左心室明显扩张(图1A),LVEF、LVFS水平下降(P<0.05);与CLP组相比,CLP+NaHS组大鼠心功能有所改善,LVEF、LVFS水平有所上升(P<0.05)(图1C、图1D)。内源性H2S水平结果示,与sham组相比,CLP组大鼠血浆H2S水平下降(P<0.05),与CLP组相比,CLP+NaHS组大鼠血浆H2S水平有所上升(P<0.05)(图1B)。大鼠LVEF、LVFS与血浆H2S水平呈线性相关(r2=0.62、r2=0.64,P均<0.05)(图1E、图1F)。Western blot结果示(图1G),与sham组相比,CLP组大鼠心肌中内源性H2S合成关键酶CSE、3-MST蛋白表达下降(P<0.05),与CLP组相比,CLP+NaHS组大鼠心肌中CSE、3-MST蛋白表达水平有所上升(P<0.05)。以上结果提示H2S参与了脓毒症心肌损伤的病理过程,外源性H2S干预后可减轻脓毒症大鼠心功能障碍。
图 1.
Cardiac function determination and plasma H2S expression of rats in each group (n=24)
各组大鼠心功能测定与血浆H2S的表达(n=24)
A: Echocardiography; B: The concentration of plasma H2S; C: LVEF; D: LVSF; E, F: Correlation analysis; G: Western blot. * P<0.05, vs. sham group; # P<0.05, vs. CLP group.
2.2. H2S可降低氧化应激水平,减轻脓毒症大鼠心肌损伤
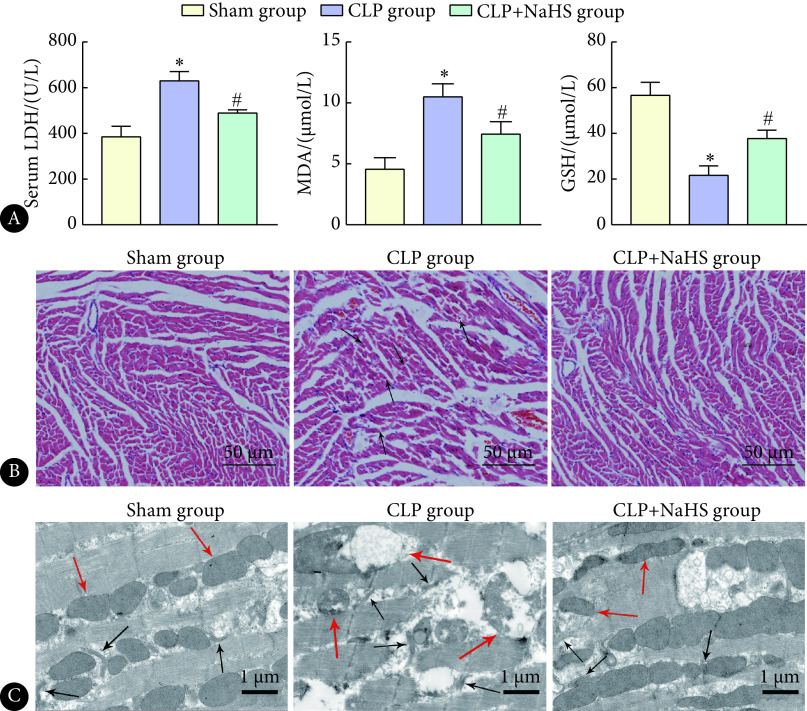
对各组大鼠心肌氧化应激指标进行检测,结果显示(图2A),与sham组相比,CLP组大鼠血清中LDH水平升高,心肌组织中MDA水平升高、GSH水平降低,差异均有统计学意义(P<0.05);与CLP组相比,CLP+NaHS组大鼠血清中LDH水平下降,心肌组织中MDA水平下降、GSH水平有所升高,差异均有统计学意义(P<0.05)。HE染色发现(图2B),sham组心肌纤维细胞完整,排列整齐,无坏死和炎症细胞浸润;CLP组心肌纤维断裂、心肌横纹模糊,间质水肿,有红细胞渗出,炎症浸润(黑色箭头处);CLP+NaHS组肌丝排列较整齐,炎性浸润和红细胞渗出减少。电镜下观察显示(图2C),sham组细胞内线粒体呈短棒状或椭圆状,形态规则无肿胀;而CLP组胞内线粒体出现了空泡样变化,嵴结构部分溶解 (红色箭头处),质网扁池结构水肿呈囊泡化 (黑色箭头处)在给予NaHS干预后,线粒体及内质网损伤有所减轻。以上结果提示H2S降低氧化应激水平,进而减轻脓毒症大鼠心肌损伤。
图 2.
Determination of myocardial injury and oxidative stress levels in rats of each group (n=24)
各组大鼠心肌损伤与氧化应激水平测定(n=24)
A: Serum LDH, MDA and GSH in rat myocardial tissue; B: HE staining (the black arrows indicate the site of obvious injury to the myocardial tissue); C: Transmission electron microscopy (black arrows indicate the endoplasmic reticulum, and red arrows indicate the mitochondria). * P<0.05, vs. sham group; # P<0.05, vs. CLP group.
2.3. H2S抑制ROS介导的内质网应激减轻脓毒症大鼠心肌损伤
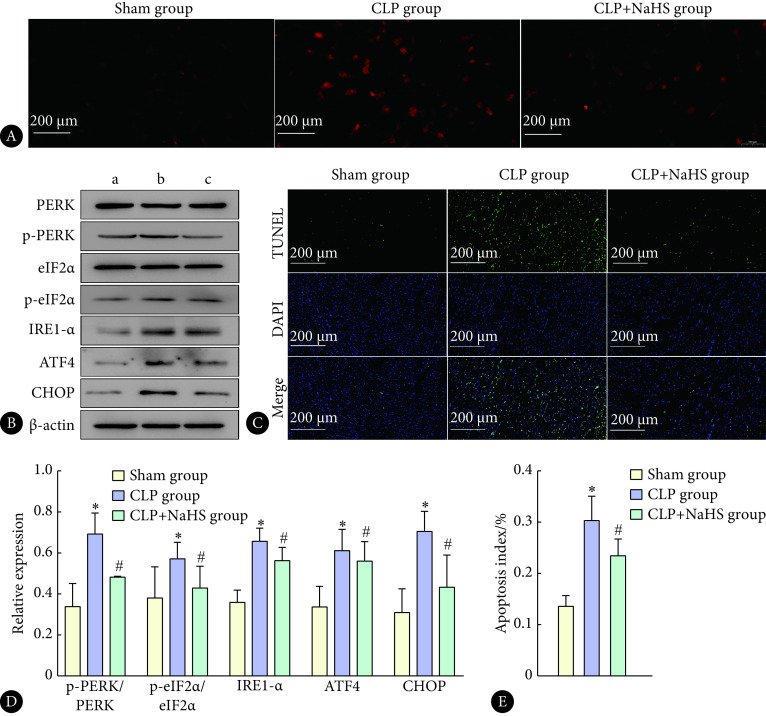
ROS检测结果显示(图3A),与sham组相比,CLP组大鼠心肌组织中红色荧光强度显著增强,ROS水平升高;与CLP组相比,CLP+NaHS组大鼠心肌组织中红色荧光强度有所减少,ROS水平降低。内质网应激标志性蛋白检测结果显示(图3B、图3D),与sham组相比,CLP组大鼠心肌组织中p-PERK/PERK、p-eIF2α/eIF2α、IRE1-α、ATF4蛋白表达上调,凋亡蛋白CHOP表达升高(P<0.05);与CLP组相比,CLP+NaHS组大鼠心肌组织中p-PERK/PERK、p-eIF2α/eIF2α、IRE1-α、ATF4蛋白表达有所下降,凋亡蛋白CHOP降低(P<0.05)。TUNEL检测结果显示(图3C、图3E),与sham组相比,CLP组大鼠心肌组织绿色荧光增强,凋亡指数增加(P<0.05),提示CLP诱导脓毒症大鼠心肌细胞凋亡增加;与CLP组相比,CLP+NaHS组大鼠心肌组织绿色荧光减弱,凋亡指数有所下降(P<0.05),提示NaHS可减轻CLP诱导的心肌细胞凋亡。以上结果表明,H2S可通过抑制ROS介导的内质网应激减轻脓毒症大鼠心肌凋亡,改善脓毒症大鼠心肌损伤。
图 3.
Determination of myocardial ROS, endoplasmic reticulum stress (ERS) marker proteins and apoptosis in rats in each group (n=24)
各组大鼠心肌ROS、内质网应激标志性蛋白与凋亡的测定(n=24)
A: ROS expression levels in rat myocardial tissue; B, D: ERS marker protein expression levels in rat myocardial tissue; C, E: Expression level of apoptosis in rat myocardial tissue; a: Sham group; b: CLP group; c: CLP+NaHS group. * P<0.05, vs. sham group; # P<0.05, vs. CLP group.
3. 讨论
脓毒症是一种由宿主对感染产生的免疫紊乱引起的危及生命的器官功能障碍[8-9]。其特征是炎症风暴和免疫失调,以及内环境失衡[10],脓毒症并发心功能障碍的患者死亡率高,迫切需要了解它的发生机制及潜在治疗靶点。已有研究表明内质网应激与脓毒症心肌病的发生密切相关[11-12],因此抑制内质网应激的发生可能有助于改善脓毒症心肌病。本研究结果显示,脓毒症组大鼠生存率显著降低,且内源性H2S水平降低;脓毒症会导致大鼠心肌组织细胞受损,出现心功能障碍,脓毒症心肌病可能是由ROS介导的内质网应激所致;在脓毒症心肌病中给予外源性H2S,可以降低ROS、内质网应激水平从而改善脓毒症心肌病。
H2S对于心血管疾病的保护作用已得到共识,例如,JIANG等[13]发现H2S参与抑制自噬通路来保护大鼠缺氧/复氧后心肌细胞,减轻细胞损伤。SU等[14]研究发现H2S可以抑制阿霉素诱导的心功能障碍,还有研究发现外源性H2S可以通过增加内源性H2S清除氧自由基、对抗氧化应激以抑制炎症[15]。并且内源性H2S可以抑制血管重构,内源性H2S的缺失可能是血管重构的重要因素[16],所以我们猜想内源性H2S的缺失可能会加重脓毒症的心肌损伤。本研究发现脓毒症大鼠内源性H2S水平显著降低,并且内源性H2S水平与LVEF、LVFS呈线性正相关。为了进一步证实该猜想,本研究检测了大鼠心肌组织中内源性H2S合成的关键酶CSE和3-MST的表达,发现脓毒症大鼠两种酶显著降低。同时,超声心动图检测发现,脓毒症大鼠左心室明显扩张,LVEF、LVFS水平下降,这与脓毒症心肌病的定义相符[17],心肌酶LDH在脓毒症大鼠出现了显著上升,给予NaSH后,心肌酶水平显著降低,心室射血功能也有所上升。
ROS可以在体内由线粒体电子传递链和NADPH氧化酶形成,正常体内ROS处于一个很低的水平,当ROS过量,可引发细胞凋亡、坏死、促炎等级联反应。近年来有研究表明,过度的ROS将损害内质网功能,引发UPR和内质网应激,这可能是导致细胞凋亡的重要机制[18]。因此本研究检测了代表氧化应激水平的大鼠血浆ROS以及心肌组织中的MDA、GSH水平,结果发现脓毒症大鼠心肌MDA、血浆ROS水平显著上升,心肌GSH则明显下降,同时还检测了内质网应激标志蛋白,由于ROS的急剧升高可直接导致细胞Ca2+稳态失衡,蛋白质合成、折叠和转运障碍,内质网功能紊乱,进一步引发内质网应激反应,结果显示内质网应激蛋白p-PERK、p-eIF2α、IRE1-α、ATF4、CHOP均显著上调,细胞凋亡增加,表明ROS水平增强干扰了心肌细胞内质网的功能,导致心功能障碍。给予NaHS后,内质网应激相关蛋白显著下调,ROS水平降低,细胞凋亡减少。
综上所述,本研究结果表明外源性H2S可以降低ROS介导的内质网应激,减少脓毒症心肌细胞凋亡,改善心肌功能。但随着内质网应激参与自噬和铁死亡等新型细胞死亡方式的发现[19-20],我们在后续还需进一步验证以及完善H2S保护脓毒症心肌损伤的多重调节通路,为H2S治疗脓毒症心肌损伤提供更全面的作用机制。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81860336)资助
Contributor Information
宇含 赵 (Yu-han ZHAO), Email: 1572621727@qq.com.
青虹 程 (Qing-hong CHENG), Email: xunfeicheng@aliyun.com.
References
- 1.BAKKER J, KATTAN E, ANNANE D, et al Current practice and evolving concepts in septic shock resuscitation. Intensive Care Med. 2022;48(2):148–163. doi: 10.1007/s00134-021-06595-9. [DOI] [PubMed] [Google Scholar]
- 2.WINTERBOTTOM F Treating sepsis in patients with heart failure. Crit Care Nurs Clin North Am. 2022;34(2):165–172. doi: 10.1016/j.cnc.2022.02.006. [DOI] [PubMed] [Google Scholar]
- 3.LIU V, ESCOBAR G J, GREENE J D, et al Hospital deaths in patients with sepsis from 2 independent cohorts. JAMA. 2014;312(1):90–92. doi: 10.1001/jama.2014.5804. [DOI] [PubMed] [Google Scholar]
- 4.MARCINIAK S J, CHAMBERS J E, RON D Pharmacological targeting of endoplasmic reticulum stress in disease. Nat Rev Drug Discov. 2022;21(2):115–140. doi: 10.1038/s41573-021-00320-3. [DOI] [PubMed] [Google Scholar]
- 5.REN J, BI Y, SOWERS J R, et al Endoplasmic reticulum stress and unfolded protein response in cardiovascular diseases. Nat Rev Cardiol. 2021;18(7):499–521. doi: 10.1038/s41569-021-00511-w. [DOI] [PubMed] [Google Scholar]
- 6.WANG Y Z, NGOWI E E, WANG D, et al The potential of hydrogen sulfide donors in treating cardiovascular diseases. Int J Mol Sci. 2021;22(4):2194. doi: 10.3390/ijms22042194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LI L, PENG X, GUO L, et al Sepsis causes heart injury through endoplasmic reticulum stress-mediated apoptosis signaling pathway. Int J Clin Exp Pathol. 2020;13(5):964–971. [PMC free article] [PubMed] [Google Scholar]
- 8.CHIU C, LEGRAND M Epidemiology of sepsis and septic shock. Curr Opin Anaesthesiol. 2021;34(2):71–76. doi: 10.1097/ACO.0000000000000958. [DOI] [PubMed] [Google Scholar]
- 9.SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al The third international consensus definitions for sepsis and septic shock (Sepsis-3) JAMA. 2016;315(8):801–810. doi: 10.1001/jama.2016.0287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.VAN DER POLL T, VAN DE VEERDONK F L, SCICLUNA B P, et al The immunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol. 2017;17(7):407–420. doi: 10.1038/nri.2017.36. [DOI] [PubMed] [Google Scholar]
- 11.PANG J, PENG H, WANG S, et al Mitochondrial ALDH2 protects against lipopolysaccharide-induced myocardial contractile dysfunction by suppression of ER stress and autophagy. Biochim Biophys Acta Mol Basis Dis. 2019;1865(6):1627–1641. doi: 10.1016/j.bbadis.2019.03.015. [DOI] [PubMed] [Google Scholar]
- 12.BHARDWAJ M, LELI N M, KOUMENIS C, et al Regulation of autophagy by canonical and non-canonical ER stress responses. Semin Cancer Biol. 2020;66:116–128. doi: 10.1016/j.semcancer.2019.11.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.JIANG H, XIAO J, KANG B, et al PI3K/SGK1/GSK3β signaling pathway is involved in inhibition of autophagy in neonatal rat cardiomyocytes exposed to hypoxia/reoxygenation by hydrogen sulfide. Exp Cell Res. 2016;345(2):134–140. doi: 10.1016/j.yexcr.2015.07.005. [DOI] [PubMed] [Google Scholar]
- 14.SU Y W, LIANG C, JIN H F, et al Hydrogen sulfide regulates cardiac function and structure in adriamycin induced cardiomyopathy. Circ J. 2009;73(4):741–749. doi: 10.1253/circj.CJ-08-0636. [DOI] [PubMed] [Google Scholar]
- 15.GENG B, CHANG L, PAN C, et al Endogenous hydrogen sulfide regulation of myocardial injury induced by iso-proterenol. Biochem Biophys Res Commun. 2004;318(3):756–763. doi: 10.1016/j.bbrc.2004.04.094. [DOI] [PubMed] [Google Scholar]
- 16.CALVERT J W, JHA S, GUNDEWAR S, et al Hydrogen sulfide mediates cardioprotection through Nrf2 signaling. Circ Res. 2009;105(4):365–374. doi: 10.1161/CIRCRESAHA.109.199919. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.PARKER M M, SHELHAMER J H, BACHARACH S L, et al Profound but reversible myocardial depression in patients with septic shock. Ann Intern Med. 1984;100(4):483–490. doi: 10.7326/0003-4819-100-4-483. [DOI] [PubMed] [Google Scholar]
- 18.LIU Z W, ZHU H T, CHEN K L, et al. Protein kinase RNA-like endoplasmic reticulum kinase (PERK) signaling pathway plays a major role in reactive oxygen species (ROS)-mediated endoplasmic reticulum stress-induced apoptosis in diabetic cardiomyopathy. Cardiovasc Diabetol, 2013, 12: 158[2021-12-29]. https://cardiab.biomedcentral.com/articles/10.1186/1475-2840-12-158. doi: 10.1186/1475-2840-12-158.
- 19.TIAN J, SHI H, WANG X, et al The cardiotoxicity of asthmatic rats after traffic-related PM2.5 and water-soluble components exposure mediated by endoplasmic reticulum stress and autophagy. Environ Sci Pollut Res Int. 2022;29(33):50704–50716. doi: 10.1007/s11356-022-19496-1. [DOI] [PubMed] [Google Scholar]
- 20.LI W, LI W, LENG Y, et al Ferroptosis is involved in diabetes myocardial ischemia/reperfusion injury through endoplasmic reticulum stress. DNA Cell Biol. 2020;39(2):210–225. doi: 10.1089/dna.2019.5097. [DOI] [PubMed] [Google Scholar]