Abstract
目的
分析四川地区初治HIV/AIDS患者的HIV基因亚型分布特点和传播性耐药现状。
方法
纳入四川地区住院且无抗反转录病毒治疗(ART)药物暴露史的成年HIV/AIDS患者,采用In-house测序法进行HIV基因测序,系统进化树判定HIV基因亚型,美国斯坦福大学HIV耐药数据库在线比对耐药突变位点并确定是否存在耐药及耐药种类、耐药水平。
结果
共纳入符合标准的120例患者,采集120份血液样本。87.5%样本HIV基因扩增成功(105/120),HIV基因亚型分布特点:CRF01_AE占比46.67%(49/105),CRF07_BC占比39.05%(41/105),其他占比14.28%(15/105)。不同性别、年龄、民族、感染途径、耐药、HIVRNA水平、CD4水平等基因亚型的差异均无统计学意义(P>0.05)。25份样本检测到耐药突变位点(20.83%),20份样本潜在耐药(16.67%),5份样本传播性耐药(4.17%)。24份样本对非核苷类反转录酶抑制剂(NNRTIs)耐药,V179D/E位点突变频率最高,1份样本对蛋白酶抑制剂耐药,突变位点M46I,未发现核苷类反转录酶抑制剂耐药及整合酶抑制剂耐药。
结论
四川地区初治住院成年HIV/AIDS患者HIV基因亚型分布特点以CRF01_AE和CRF07_BC为主,传播性耐药率较低,以NNRTIs耐药为主。进行HIV基线耐药检测对制定有效ART方案具有重要意义。
Keywords: HIV/AIDS患者, 抗病毒治疗, 基因亚型, 传播性耐药
Abstract
Objective
To investigate the distribution characteristics of the HIV genetic subtypes and the status quo of transmitted drug resistance among HIV/AIDS patients in Sichuan with no previous history of receiving antiretroviral therapy (ART).
Methods
Adult HIV/AIDS patients who were hospitalized in Sichuan and who had no previous history of exposure to ART drugs exposure were enrolled. In-house sequencing of the HIV gene was done and phylogenetic tree was constructed to analyze the HIV genetic subtypes. The Stanford HIV drug resistance database was used to make online comparison of the drug resistance mutation sites and to determine the presence or absence of drug resistance, and the type and level of drug resistance.
Results
A total of 120 patients were enrolled for the study, and 120 blood samples were collected. The genetic subtypes of 87.5% (105/120) of the samples were successfully amplified. The distribution characteristics of HIV genotype were as follows, CRF01_AE accounted for 46.67% (49/105), CRF07_BC accounted for 39.05% (41/105), and the others genetic subtypes, 14.28% (15/105). There were no significant differences between the different genetic subtypes in sex, age, ethnicity, HIV transmission route, drug resistance, baseline HIV RNA and baseline CD4 (P>0.05). Drug-resistant mutation sites were detected in 25 samples, accounting for 20.83% (25/120) of all samples, with 16.67% (20/120) being potential drug resistance and 4.17% (5/120) being transmitted drug resistance. For the 24 samples found to be resistant to non-nucleoside reverse transcriptase inhibitors (NNRTIs), the mutation frequency of V179D/E was the highest. One patient showed resistance to protease inhibitors (PI) and the mutation site was M46I. No nucleoside reverse transcriptase inhibitor (NRTI) or integrase inhibitors (INTI) resistance were found.
Conclusions
The main genetic subtypes of HIV/AIDS patients in Sichuan with no previous history of receiving ART were CRF01_AE and CRF07_BC. The incidence of transmitted drug resistance was low. The drug resistance detected in the study was predominantly resistance to NNRTIs. Baseline HIV drug resistance testing is of great significance for formulating effective ART regimens.
Keywords: HIV/AIDS patients, Antiretroviral therapy, Genotypes, Transmitted drug resistance
抗反转录病毒治疗(antiretroviral therapy, ART)是目前艾滋病的主要治疗方式[1]。目前国际上共有六大类ART药物:核苷类反转录酶抑制剂(NRTIs)、非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂(INSTIs)、融合抑制剂(FIs)及CCR5抑制剂[2-3]。虽然ART可显著降低HIV感染的发病率和病死率,延长患者预期寿命,提高患者生存质量,但同时也会导致HIV耐药。HIV耐药不仅增加ART治疗失败风险和患者死亡风险,还导致耐药病毒株的传播,对控制艾滋病流行构成重大挑战[4-5]。
HIV耐药包括传播性耐药(TDR)、获得性耐药(ADR)、治疗前耐药(PDR)。TDR是指无ART药物暴露史的HIV/AIDS患者感染耐药突变毒株,TDR会降低ART疗效,增加治疗难度[6]。进行基线耐药检测,制定个体化的ART方案,可更大程度地合理使用医疗资源,有助于提高ART成功率。目前多地开展的有关HIV基因亚型、TDR流行率的调查显示出较大的地区差异[7],尚无四川地区初治HIV/AIDS患者基因亚型及TDR报道。本研究分析四川地区初治HIV/AIDS患者HIV基因亚型分布特点及TDR现状,为四川地区有效开展艾滋病防治工作提供参考依据。
1. 材料与方法
1.1. 研究对象
前瞻性纳入120例住院且无ART药物暴露史的成年HIV/AIDS患者进行基因型耐药检测。收集患者的人口学资料、基因亚型、耐药突变位点、耐药水平、HIV RNA、T淋巴细胞亚群计数等,本研究为探索性研究,样本量的选择主要基于临床判断而非统计检验计算,120例受试者可以提供有临床意义的描述性试验结果。入选标准:①确诊为HIV/AIDS患者,HIV/AIDS诊断标准参考《中国艾滋病诊疗指南(2018版)》[8];②2019年7月–2020年12月期间在成都市公共卫生临床医疗中心感染一科住院并在启动ART前自愿进行HIV基因亚型及耐药检测;③年龄>18岁;④未接受过ART治疗患者;⑤未服用过HIV暴露前或暴露后预防药物;⑥若合并乙肝感染者未服用过核苷类似物;⑦基线HIV RNA>1000 copies/mL;⑧签署知情同意书,同意ART并能遵守研究要求接受随访和标本采集。排除标准:①妊娠期或哺乳期女性患者,②现吸毒或酗酒、依从性差的患者。本研究已经通过成都市公共卫生临床医疗中心伦理委员会审批。成都市公共卫生临床医疗中心作为四川省唯一一家三级甲等传染病专科医院,是国家感染性疾病临床医学研究中心四川分中心,四川地区艾滋病最大的收治中心, 其收治的患者来自四川整个地区。
1.2. 方法
1.2.1. 样本采集
患者启动ART前抽取 HIV/AIDS患者外周静脉血5 mL, 离心保留血浆。进行以下指标检测。
1.2.2. 指标检测
1.2.2.1. HIV RNA提取及测序
患者启动ART前抽取血样标本,采用中山大学达安基因股份有限公司生产的核酸提取试剂盒提取 HIV RNA,逆转录巢式聚合酶链反应(RT-nested-PCR)扩增 HIV基因序列,并对PCR产物进行纯化处理,In-house测序法进行HIV基因测序,ABI3730测序仪进行HIV基因测序,BioEdit进行对比处理和其他分析,Contig-分析序列,每轮34个循环,共2轮。
1.2.2.2. HIV基因亚型分型
MEGA 6.0系统进化分析软件构建 Neighbor-Joining 系统进化树,Distance Model 模型选择Kimura 2-parameter,Bootstrap Replicates设置1000,通过样本序列与参考序列的聚集情况判断HIV基因亚型。
1.2.2.3. HIV耐药分析
将测序结果导入 HIV药物检测系统进行评价,得到完整fasta格式序列,使用美国斯坦福大学HIV耐药数据库(http://hivdb.stanford.edu/)在线比对耐药突变位点并确定是否存在耐药及耐药种类、耐药水平。耐药水平标准:敏感S(0~9分);潜在低度耐药P(10~14分);低度耐药L(15~29分);中度耐药I(30~59分);高度耐药H(>60分)。
1.2.2.4. HIV RNA和T淋巴细胞亚群检测
采用美国雅培公司的Abbott Real Time M2000sp病毒定量检测仪及配套试剂检测血浆HIV RNA,HIV RNA<40 copies/mL为检测下限;美国BD公司流式细胞仪FACS Calibur及配套试剂盒检测T淋巴细胞亚群。
1.3. 统计学方法
计量资料进行正态分布检验,满足正态分布用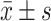 表示,对HIV RNA进行对数转换,广义估计方程进行ART前后HIV RNA、CD4+ T淋巴细胞(CD4)、CD8+ T淋巴细胞(CD8)变化分析,χ2检验或Fisher精确检验进行组间比较,P<0.05为差异有统计学意义。
表示,对HIV RNA进行对数转换,广义估计方程进行ART前后HIV RNA、CD4+ T淋巴细胞(CD4)、CD8+ T淋巴细胞(CD8)变化分析,χ2检验或Fisher精确检验进行组间比较,P<0.05为差异有统计学意义。
2. 结果
2.1. 基本情况
共纳入120例患者,年龄(44.97±15.63)岁;男性86.67%(104/120),女性13.33%(16/120);同性传播35.83%(43/120),异性传播64.17%(77/120);汉族95%(114/120),藏族5%(6/120);来源于成都市61.67%(74/120),38.33%(46/120)来自资阳市、宜宾市、凉山州、阿坝州、甘孜州等17个地级市、州;25%(30/120)合并乙肝、丙肝或梅毒等传染性疾病,14.17%(17/120)合并高血压、高血脂或糖尿病等老年性疾病,60.83%(73/120)无以上合并症;5.83%(7/120)无机会性感染,10.83%(13/120)合并1种机会性感染,83.33%(100/120)合并≥2种机会性感染。
2.2. ART情况
120例患者均使用含艾博韦泰(Albuvirtide, ABT)的方案进行初始ART,其中106例患者ART方案为ABT+多替拉韦钠,1例为ABT+拉替拉韦钾,13例为ABT+替诺福韦+拉米夫定。120例患者基线HIV RNA(5.43±0.06) lg copies/mL,基线CD4+ T淋巴细胞(CD4)(61.03±7.66) cells/μL,基线CD8+ T淋巴细胞(CD8)(503.91±44.74) cells/μL;ART 4周后HIV RNA较基线下降(2.87±0.13) lg copies/mL,CD4较基线上升(91.92±18.56) cells/μL,CD8较基线上升(342.71±68.55) cells/μL,差异均有统计学意义(P<0.001)。
2.3. HIV-1基因亚型分析
87.5%(105/120)样本HIV基因扩增成功。CRF01_AE占比46.67%(49/105),CRF07_BC占比39.05%(41/105),其他占比14.28%(15/105)。不同性别、年龄、民族、居住地、感染途径、耐药、基线HIV RNA水平、基线CD4水平、基线CD8水平等基因亚型的差异均无统计学意义(P>0.05),见表1。其他亚型为CRF67-01B 1例、CRF59-01B 1例、CRF55-01B 2例、CRF08-BC 5例、C 2例、B 3例、B+C 1例。
表 1. Characteristics of the genetic subtypes and clinical data of 105 HIV/AIDS patients.
105例HIV/AIDS患者基因亚型及临床信息特征
| Variable | Total (n=105) | HIV major genotype/case | χ 2 | P | ||
| CRF01_AE (n=49) | CRF07_BC (n=41) | Other genotype (n=15) | ||||
| Gender | − | 0.791 | ||||
| Male | 91 | 41 | 36 | 14 | ||
| Female | 14 | 8 | 5 | 1 | ||
| Age/yr. | − | 0.748 | ||||
| ≤40 | 48 | 19 | 18 | 7 | ||
| 41-59 | 51 | 23 | 14 | 6 | ||
| ≥60 | 21 | 7 | 9 | 2 | ||
| Ethnicity | − | 0.353 | ||||
| Han | 101 | 48 | 40 | 13 | ||
| Tibetan | 4 | 1 | 1 | 2 | ||
| Region | 4.42 | 0.113 | ||||
| Chengdu | 65 | 30 | 29 | 6 | ||
| Other parts of Sichuan | 40 | 19 | 12 | 9 | ||
| Comorbidity | − | 0.833 | ||||
| Infectious diseases | 15 | 11 | 12 | 4 | ||
| Senile diseases | 27 | 6 | 6 | 3 | ||
| No | 63 | 32 | 23 | 8 | ||
| Mode of HIV exposure | 0.87 | 0.667 | ||||
| Homosexual contact | 37 | 15 | 16 | 6 | ||
| Heterosexual contact | 68 | 34 | 25 | 9 | ||
| Resistance | 3.21 | 0.196 | ||||
| Yes | 25 | 12 | 7 | 6 | ||
| No | 80 | 37 | 34 | 9 | ||
| Baseline HIV RNA/(copies/mL) | − | 0.564 | ||||
| <100000 | 21 | 8 | 9 | 4 | ||
| ≥100000 | 84 | 41 | 32 | 11 | ||
| Baseline CD4/(cells/μL) | − | 0.460 | ||||
| <50 | 76 | 38 | 27 | 11 | ||
| ≥50 | 29 | 11 | 14 | 4 | ||
| Baseline CD8/(cells/μL) | − | 0.449 | ||||
| <500 | 74 | 37 | 26 | 11 | ||
| ≥500 | 31 | 12 | 15 | 4 | ||
| Baseline CD4/CD8 | − | 1.000 | ||||
| <0.2 | 87 | 40 | 34 | 13 | ||
| ≥0.2 | 18 | 9 | 7 | 2 | ||
2.4. 传播性耐药分析
25份样本检测到耐药突变位点(20.83%),20份样本潜在耐药(16.67%),3份样本低度耐药(2.50%),2份样本高度耐药(1.67%),5份样本传播性耐药(4.17%)。24份样本对NNRTIs耐药,V179D/E位点突变频率最高,对EFV、ETR、NVP、RPV潜在耐药19份、低度耐药3份,对EFV、RPV高度耐药2份;1份样本对PIs耐药,突变位点M46I,对ATV/r、LPV/r潜在耐药,未发现对NRTIs及INTIs耐药样本。复合突变样本3份,单突变样本22份,具体突变位点及耐药情况详见表2。基线存在耐药突变位点的患者与无耐药位点的患者在感染途径、基线及治疗4周HIV RNA、CD4水平、CD8水平的差异均无统计学意义(P>0.05)。
表 2. Transmitted drug resistance and mutation sites in 25 HIV/AIDS patients.
25例HIV/AIDS患者传播性耐药及突变位点
| Subject | Genotype | Protease inhibitor resistance mutations | ATV/r | DRV/r | LPV/r | NNRTI resistance mutations | EFV | ETR | NVP | RPV |
| S: Susceptible; P: Potential low-level resistance; L: Low-level resistance; I: Intermediate resistance; H: High-level resistance; PI: Protease inhibitor; ATV/r: Atazanavir/ritonavir; DRV/r: Darunavir/ritonavir; LPV/r: Lopinavir/ritonavir; NNRTI: Non-nucleoside reverse transcriptase inhibitors; EFV: Efavirenz; ETR: Etravirine; NVP: Nevirapine; RPV: Rilpivirine. | ||||||||||
| 1 | CRF01_AE | M46I | P | S | P | S | S | S | S | |
| 2 | CRF01_AE | S | S | S | G190A | I | P | H | L | |
| 3 | CRF01_AE | S | S | S | V106M, Y188D | H | S | H | S | |
| 4 | CRF01_AE | S | S | S | E138G, V179E | L | L | L | L | |
| 5 | CRF55_01B | S | S | S | E138G, V179E | L | L | L | L | |
| 6 | - | S | S | S | E138A | S | P | S | L | |
| 7 | CRF01_AE | S | S | S | V179D | P | P | P | P | |
| 8 | CRF01_AE | S | S | S | V179D | P | P | P | P | |
| 9 | CRF01_AE | S | S | S | V179VD | P | P | P | P | |
| 10 | CRF01_AE | S | S | S | V106M | S | P | P | P | |
| 11 | CRF01_AE | S | S | S | V179D | P | P | P | P | |
| 12 | CRF01_AE | S | S | S | V179D | P | P | P | P | |
| 13 | CRF01_AE | S | S | S | V179E | P | P | P | P | |
| 14 | CRF01_AE | S | S | S | V179E | P | P | P | P | |
| 15 | CRF07_BC | S | S | S | V106A | S | P | P | P | |
| 16 | CRF07_BC | S | S | S | V179D | P | P | P | P | |
| 17 | CRF07_BC | S | S | S | V179D | P | P | P | P | |
| 18 | CRF07_BC | S | S | S | V179E | P | P | P | P | |
| 19 | CRF07_BC | S | S | S | V179D | P | P | P | P | |
| 20 | CRF07_BC | S | S | S | V179D | P | P | P | P | |
| 21 | CRF08_BC | S | S | S | V179D | P | P | P | P | |
| 22 | CRF55_01B | S | S | S | V179E | P | P | P | P | |
| 23 | CRF67_01B | S | S | S | V179D | P | P | P | P | |
| 24 | B | S | S | S | V106A | S | P | P | P | |
| 25 | − | S | S | S | V179D | P | P | P | P | |
3. 讨论
TDR限制ART方案选择、影响ART疗效,最终将导致ART失败、耐药毒株传播,对控制艾滋病流行和传播造成巨大挑战和障碍,多个研究[9-10]显示HIV基因型、TDR流行率存在较大的地区差异,本研究分析了四川地区初治HIV/AIDS患者HIV基因亚型分布特点、TDR现状及临床ART疗效。
HIV基因亚型以全球多样性、地域分布不平衡为显著特点[9-12],亚洲国家以CRF01_AE为主,重组变异和C亚型日益增长[13],本研究中HIV基因亚型以CRF01_AE和CRF07_BC为主,与中国多个研究[11-12, 14]结果相似。有研究[11-12]报道,HIV基因亚型分布差异与感染途径、地区、种族差异相关及CRF_BC原发耐药率较高,而DONG等[15]的研究报道CRF01_AE发生耐药的可能性更高,但本研究中不同性别、年龄、民族、感染途径、耐药、HIV RNA水平、CD4水平等基因亚型的差异无统计学意义,可能原因为:①本研究中的感染途径均为性传播且以异性传播为主,感染途径单一,不能进一步探讨静脉吸毒及其他感染途径与基因亚型之间的关系;②本研究中仅有6例藏族,余均为汉族,不能进一步对比分析少数民族与基因亚型之间的关系;③本研究中的患者半数以上来源于成都市,来自四川省其他地区尤其是凉山州、阿坝等地患较少,不能进一步分析四川各地市州基因亚型的分布差异;④样本量较少并且耐药患者例数少,可能存在偏倚,目前尚无关于四川地区大样本的初治HIV/AIDS患者基因亚型与传播性耐药的报道,需进一步扩大样本量进行多中心研究。
本研究中20.83%患者有耐药突变位点,但以潜在耐药为主,传播性耐药4.17%,有研究[9]报道未接受ART的中国HIV/AIDS人群HIV原发整体耐药率4.7%,结合本研究提示四川地区低度以上耐药低于5%的中度耐药警戒线及其他地区的相关研究[16]。本研究结果显示四川地区初治HIV/AIDS患者以NNRTIs耐药为主,与多个地区研究[3, 5]结果一致,但本研究未发现NRTI耐药样本,与其他研究[17-18]结果不一致,可能提示NRTI耐药毒株在四川地区初治HIV/AIDS人群中传播率较低。本研究中V179D/E位点突变频率最高,与多个研究[3, 5]结果一致。有研究[19]报道V179D/E在初治HIV/AIDS患者中突变频率较高,并且会导致EFV、ETR、NVP、RPV的潜在耐药,但这种单基因突变是否会导致临床治疗失败,还需要进一步研究和证实。本研究中2例患者存在E138G、V179E复合突变,基因亚型分别为CRF01_AE、CRF55-01B,有研究[20]报道CRF55-01B初治HIV感染者E138G、V179E复合突变发生率为6.2%,但这种复合突变对NRTI药物敏感性和病毒学的影响及与基因亚型的关系尚不清楚,需进一步研究。结合以上研究结果提示,四川地区初治HIV/AIDS患者耐药水平以潜在耐药为主,传播性耐药率较低,耐药种类以NNRTIs耐药为主,需加强基线HIV耐药检测,以选择有效的ART方案。
本研究中潜在耐药16.66%,有研究[4]报道存在潜在耐药患者ART 6个月病毒学失败率显著高于药物均敏感患者,目前有关潜在耐药与ART失败的临床研究较少,本研究未发现基线存在耐药突变位点患者与无耐药突变位点患者在ART后HIV RNA、免疫功能等方面的差异有统计学意义,原因为:①本研究中ART方案为ABT+整合酶或ABT+两核苷,均为敏感药物;②ART观察时间较短,不能进一步探讨ART长期疗效差异,将进一步追踪这部分潜在耐药患者的长期ART疗效。结合本研究,建议选择敏感药物进行初始ART,含ABT方案可作为初治HIV/AIDS患者的选择方案。
本研究为单中心、小样本研究,研究对象为住院的初治HIV/AIDS患者,感染途径均为性传播、民族以汉族为主及居住地差异较大,可能对结果造成一定的偏倚,需扩大样本量进行多中心、更深入的探究。需加强基线HIV耐药检测,以更好地掌握HIV/AIDS患者基线耐药情况,选择敏感药物进行初始ART,提高ART成功率、预防耐药毒株的发生和传播。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省卫生和计划生育委员会科研课题(No. 18PJ341)资助
Contributor Information
欢霞 刘 (Huan-xia LIU), Email: 928574018@qq.com.
盛华 何 (Sheng-hua HE), Email: 13198552429@163.com.
References
- 1.PRABHU S, HARWELL J I, KUMARASAMY N. Advanced HIV: Diagnosis, treatment, and prevention. Lancet HIV, 2019, 6(8): e540−e551[2021-11-13]. https://doi.org/10.1016/S2352-3018(19)30189-4.
- 2.中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心 中国艾滋病诊疗指南(2021年版). 中华内科杂志. 2021;60(12):1106–1128. doi: 10.3760/cma.j.cn112138-20211006-00676. [DOI] [Google Scholar]
- 3.RYOM L, COTTER A, MIGUEL R D, et al 2019 update of the European AIDS Clinical Society Guidelines for treatment of people living with HIV version 10. 0. HIV Med. 2020;21(10):617–624. doi: 10.1111/hiv.12878. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.栗翠林, 肖静, 汪笛, 等 一线抗病毒治疗失败HIV/AIDS患者治疗前耐药特征分析. 中国艾滋病性病. 2021;27(5):453–456. doi: 10.13419/j.cnki.aids.2021.05.04. [DOI] [Google Scholar]
- 5.WANG Z, ZHANG M, ZHANG R, et al Diversity of HIV-1 genotypes and high prevalence of pretreatment drug resistance in newly diagnosed HIV-infected patients in Shanghai, China. BMC Infect Dis. 2019;19(1):313–322. doi: 10.1186/s12879-019-3927-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.CLUTTER D S, JORDAN M R, BERTAGNOLIO S, et al HIV-1 drug resistance and resistance testing. Infect Genet Evol. 2016;46:292–307. doi: 10.1016/j.meegid.2016.08.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.ZUO L, LIU K, LIU H, et al. Trend of HIV-1 drug resistance in China: A systematic review and meta-analysis of data accumulated over 17 years (2001-2017). eClin Med, 2020, 18: 100238[2021-11-13]. https://doi.org/10.1016/j.eclinm.2019.100238.
- 8.中华医学会感染病学分会艾滋病丙肝学组, 中国疾病预防与控制中心 中国艾滋病诊疗指南(2018版). 中国艾滋病性病. 2018;24(12):1266–1282. doi: 10.13419/j.cnki.aids.2018.12.26. [DOI] [Google Scholar]
- 9.MAZZUTI L, MELENGU T, FALASCA F, et al. Transmitted drug resistance mutations and trends of HIV-1 subtypes in treatment-naïve patients: A single-centre experience. J Glob Antimicrob Resist, 2020, 20: 298−303[2021-11-13]. https://doi.org/10.1016/j.jgar.2019.08.024.
- 10.MACDONALD V, MBUAGBAW L, JORDAN M R, et al. Prevalence of pretreatment HIV drug resistance in key populations: A systematic review and meta-analysis. J Int AIDS Soc, 2020, 23(12): e25656[2021-11-13]. https://doi.org/10.1002/jia2.25656.
- 11.吴楠楠, 殷明琪, 袁瑞, 等 我国HIV亚型与耐药性Meta分析. 中华流行病学杂志. 2016;37(11):1546–1554. doi: 10.3760/cma.j.issn.0254-6450.2016.11.022. [DOI] [PubMed] [Google Scholar]
- 12.苏迎盈, 刘慧鑫, 吴静, 等 中国HIV-1基因亚型分布及流行趋势. 中华流行病学杂志. 2014;35(10):1164–1168. [PubMed] [Google Scholar]
- 13.BBOSA N, KALEEBU P, SSEMWANGA D HIV subtype diversity worldwide. Curr Opin HIV AIDS. 2019;14(3):153–160. doi: 10.1097/COH.0000000000000534. [DOI] [PubMed] [Google Scholar]
- 14.孙伟东, 姜天俊, 黄辉煌, 等 北京地区HIV-1感染者治疗前耐药特征及2年抗病毒治疗效果研究. 国际病毒学杂志. 2020;27(3):224–227. doi: 10.3760/cma.j.issn.1673-4092.2020.03.011. [DOI] [Google Scholar]
- 15.DONG K, YE L, LENG Y, et al Prevalence of HIV-1 drug resistance among patients with antiretroviral therapy failure in Sichuan, China, 2010-2016. Tohoku J Exp Med. 2019;247(1):1–12. doi: 10.1620/tjem.247.1. [DOI] [PubMed] [Google Scholar]
- 16.LU X, CHEN S, ZHAO H, et al Baseline investigation of HIV-1 primary drug resistance among newly diagnosed treatment-naïve HIV-1 individuals in Hebei, China. AIDS Res Hum Retroviruses. 2018;34(12):1083–1089. doi: 10.1089/AID.2018.0142. [DOI] [PubMed] [Google Scholar]
- 17.YUAN H, LIU Z, WU X, et al Prevalence of transmitted HIV-1 drug resistance among treatment-naive individuals in China, 2000-2016. Arch Virol. 2021;166(9):2451–2460. doi: 10.1007/s00705-021-05140-9. [DOI] [PubMed] [Google Scholar]
- 18.GUO C, WU Y, ZHANG Y, et al. Transmitted drug resistance in antiretroviral therapy-naive persons with acute/early/primary HIV infection: A systematic review and meta-analysis. Front Pharmacol, 2021, 12: 718763[2021-11-13]. https://doi.org/10.3389/fphar.2021.718763.
- 19.龙茂娇, 李健健, 董兴齐 HIV基因型耐药检测在抗病毒治疗中的应用进展. 国际流行病学传染病学杂志. 2017;44(5):333–337. doi: 10.3760/cma.j.issn.1673-4149.2017.05.011. [DOI] [Google Scholar]
- 20.LIU Y, LI H, WANG X, et al. Natural presence of V179E and rising prevalence of E138G in HIV-1 reverse transcriptase in CRF55_01B viruses. Infect Genet Evol, 2020, 77: 104098[2021-11-13]. https://doi.org/10.1016/j.meegid.2019.104098.


