Abstract
目的
探讨普通白光内镜(white light image, WLI)、超声内镜(endoscopic ultrasonography, EUS)、放大内镜结合窄带显像(magnifying endoscopy with narrow band imaging, ME-NBI)技术在早期胃癌内镜治疗适应症中的应用价值,为临床诊疗决策提供依据。
方法
纳入2013年12月–2020年10月在四川大学华西医院行内镜下黏膜剥离术且术后病理证实为早期胃癌患者的临床资料,比较WLI和EUS判断早期胃癌浸润深度的准确性、敏感性、特异性、阳性预测值、阴性预测值;分析ME-NBI预测早期胃癌分化类型的作用。
结果
共纳入280例患者(291处病变),其中行EUS检查199例(207处病变),ME-NBI检查160例(168处病变)患者。结果显示WLI诊断早期胃癌浸润深度的准确率为87.0%,优于EUS(46.4%,P<0.001),即使两者联合诊断准确性(87.4%)相较于单独使用WLI(87.0%)也并无明显提高。ME-NBI判断早期胃癌分化程度的总体准确率为92.3%(155/168),未分化型早期胃癌ME-NBI判断准确率低于分化型早期胃癌(41.2% vs. 98.0%,P<0.001)。
结论
在早期胃癌内镜治疗适应症的评估中,WLI可较好的预测病变浸润深度,EUS价值有限;ME-NBI能较为准确地预测绝大部分早期胃癌的分化程度,尤其是分化型早期胃癌。
Keywords: 早期胃癌, 适应症, 普通白光内镜, 超声内镜, 放大内镜结合窄带显像技术
Abstract
Objective
To explore the application value of white light image (WLI), endoscopic ultrasonography (EUS) and magnifying endoscopy with narrow band imaging (ME-NBI) in the endoscopic treatment of early gastric cancer (EGC), and to provide basis for decision-making in clinical diagnosis and treatment.
Methods
The clinicopathological data of EGC patients who underwent endoscopic submucosal dissection (ESD) at West China Hospital, Sichuan University between December 2013 and October 2020 were included. The accuracy, sensitivity, specificity, positive predictive value and negative predictive value of EGC invasive depth were compared between WLI and EUS. The role of ME-NBI in predicting the differentiation types of EGC was analyzed.
Results
A total of 280 patients (291 lesions) were enrolled in the study. Among them, 199 patients (207 lesions) received EUS and 160 patients (168 lesions) received ME-NBI. The overall accuracy of WLI in diagnosing the invasive depth of EGC was 87.0%, significantly higher than that of EUS (46.4%, P<0.001). When WLI was combined with EUS, the diagnostic accuracy (87.4%) was not significantly improved. The overall accuracy of determining the differentiation degree of EGC with ME-NBI was 92.3% (155/168), and the accuracy of determining undifferentiated EGC with ME-NBI was significantly lower than that of differentiated EGC (41.2% vs. 98.0%,P<0.001).
Conclusion
In the evaluation of indications for endoscopic treatment of EGC, WLI showed better performance in predicting the invasive depth of EGC, while EUS demonstrated limited value. ME-NBI showed better accuracy for predicting the differentiation degree of most EGC, especially for differentiated EGC.
Keywords: Early gastric cancer, Indication, White light image, Endoscopic ultrasonography, Magnifying endoscopy with narrow band imaging
早期胃癌(early gastric cancer, EGC)是指癌组织仅局限于胃黏膜层或黏膜下层,无论有无淋巴结转移[1]。对于符合内镜治疗适应证的EGC患者,其行内镜下切除的远期生存率与外科手术治疗相当,且费用低,创伤及并发症少,可最大程度地保留胃大体解剖结构,具有更好的术后生活质量[2]。目前,内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)已成为EGC内镜治疗的标准技术。我国EGC内镜切除适应证分为:①绝对适应证:无合并溃疡的分化型黏膜内癌;病灶大小≤3 cm、有溃疡的分化型黏膜内癌;胃黏膜高级别上皮内瘤变。②扩大适应证:病灶大小≤2 cm、无溃疡的未分化型黏膜内癌[1]。评估内镜治疗适应症重点需要判断病变大小、有无溃疡、浸润深度及分化类型。病灶大小及是否合并溃疡可以通过普通白光内镜(white light image, WLI)进行直观判断,因此浸润深度及分化类型是早期胃癌ESD治疗适应症判断的重点和难点。实际临床工作中,WLI和超声内镜(endoscopic ultrasonography, EUS)是评估EGC浸润深度常见方法之一,但缺乏国际统一的标准,其准确性很大程度上依赖于操作内镜医师的个人经验。对于病灶分化类型的判断,主要取决于术前活检的病理结果,但既往研究发现EGC术前内镜评估与术后病理差异率达41.2%[3-4]。放大胃镜结合窄带显像技术(magnifying endoscopy with narrow band imaging, ME-NBI)是一种新的内镜图像增强技术与放大内镜的结合,可清晰的显示EGC微表面和微血管结构,有研究表明ME-NBI可观察到不同的微血管及微表面结构可以预测EGC的分化类型[5-6]。
本研究拟回顾性分析在我院内镜中心行ESD的EGC患者的临床及内镜资料,比较WLI及EUS判断EGC浸润深度的准确性,探究ME-NBI预测EGC分化类型的价值,为评估EGC内镜治疗适应证提供科学依据。
1. 资料与方法
1.1. 研究对象
回顾性收集2013年12月–2020年10月在四川大学华西医院行ESD治疗术后病理证实为EGC患者的临床病理资料及内镜资料,包括WLI、EUS和ME-NBI内镜图像。纳入标准:在我院消化内镜中心行ESD、术后病理结果证实为EGC且具有完整临床病理及内镜资料者;排除标准:①既往有胃部手术史者;②同时合并其他恶性肿瘤者;③CT、超声等影像学检查提示有淋巴结或远处脏器转移者;④术后病理结果证实为非癌性病变者。本研究获四川大学华西医院伦理委员会批准(2015年审63号)。
1.2. 主要器械
普通内镜(GIF-Q260; Olympus Medical, Tokyo, Japan);超声内镜(Pantax EG3830UT; Pantax EG3630UR);超声探头(UM-DP12-R25,频率12 MHz);放大内镜(GIFH260Z, Olympus, Tokyo, Japan)。
1.3. 研究方法
1.3.1. WLI检查及浸润深度判断
WLI发现EGC,确定具体部位及范围,观察病变的形态、色泽、表面胃小区结构、周围黏膜皱襞情况、是否合并溃疡,通过调节胃内空气量等方法判断肿瘤局限于黏膜层(M)或者累及黏膜下层(SM),具体判断深度的方法参考文献[7]。本研究将EGC中接受了EUS的患者进行病变浸润深度分析,比较WLI、EUS及联合诊断的准确性、敏感性、特异性、阳性预测值、阴性预测值。
1.3.2. EUS检查及浸润深度判断
EUS分期参考胃癌TNM分期标准[8]:正常胃壁在EUS下分为5层结构,若表现为第1~2层受累,第3层回声正常,则判断病变浸润层次为黏膜层;若表现为第1~3层受累,第4层回声正常,则判断病变浸润层次为黏膜下层。
1.3.3. WLI联合EUS判断EGC浸润深度的标准
根据TSUJII等[9]提出的WLI联合EUS共同诊断EGC的标准如下:若WLI判断为黏膜内癌,无论EUS判断为黏膜内癌或黏膜下癌,则联合诊断为黏膜内癌;若WLI判断为黏膜下癌,如果EUS结果显示为黏膜内癌,则联合诊断为黏膜内癌,如果EUS结果显示为黏膜下癌,则联合诊断为黏膜下癌。
1.3.4. ME-NBI检查及微血管分型标准
将EGC中接受了ME-NBI检查的患者进行病变性质分析,参考YOKOYAMA等[6]提出的ME-NBI分型分为(图1):①精细网格状(fine network pattern, FNP);②螺旋型(corkscrew pattern, CSP);③小叶内环形-1(intra-lobular loop pattern-1, ILL-1);④小叶内环形-2(intra-lobular loop pattern-2, ILL-2)。⑤另外我们将ME-NBI下表现为隐窝开口和隐窝边缘上皮扩张,没有明显边界的类型定义为未分类型,与既往研究所提出的分型均不同。⑥正常型。根据未分化型胃癌生长发育的特点,我们将早期胃癌ME-NBI下观察到CSP或者ILL-2型中若存在螺旋状血管结构时,判断为未分化型胃癌[6],余则为分化型胃癌。
图 1.
Microsurface structures and microvascular patterns under ME-NBI
ME-NBI下微表面结构和微血管分型
A: Fine network pattern (FNP); B: Corkscrew pattern (CSP); C: Intra-lobular loop pattern-1 (ILL-1); D: Intra-lobular loop pattern-2 (ILL-2); E: Unclassified; F: Normal type.
1.3.5. 图像分析
两名高年资内镜医师(15年以上的内镜操作经验)分别阅读WLI、EUS图片对病变深度作出诊断;分别阅读ME-NBI图片对病变进行ME-NBI分型,当判断结果不一致时,由两名内镜医师共同商议作出统一诊断。
1.3.6. 组织病理学诊断
根据2019年消化系统肿瘤WHO分类[10],分化型胃癌包括:高分化管状腺癌、中分化管状腺癌、乳头状腺癌;未分化型胃癌包括:低分化管状腺癌、低黏附型癌(印戒细胞癌和其它亚型)。若肿瘤同时包括分化型胃癌和未分化型胃癌两种成分,则按占主要成分的分类。病理标本均由一名10年以上消化道肿瘤亚专业的高年资病理医师进行读片和诊断。
1.4. 统计学方法
连续性变量符合正态分布的采用
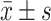 表示,非正态分布的采用中位数与四分位间距表示,组间比较采用两独立样本t检验;计数资料以例数(%)表示,组间比较采用卡方检验和McNemar检验,一致性比较采用Kappa检验。以术后病理结果为金标准,分析WLI和EUS判断EGC浸润深度的准确性及ME-NBI判断EGC分化类型的价值。P<0.05为差异有统计学意义。
表示,非正态分布的采用中位数与四分位间距表示,组间比较采用两独立样本t检验;计数资料以例数(%)表示,组间比较采用卡方检验和McNemar检验,一致性比较采用Kappa检验。以术后病理结果为金标准,分析WLI和EUS判断EGC浸润深度的准确性及ME-NBI判断EGC分化类型的价值。P<0.05为差异有统计学意义。
2. 结果
2.1. 患者的基线信息
2013年12月–2020年10月期间,有280例患者(291处病变)因拟诊胃癌前病变或EGC于我院消化内镜中心行ESD治疗。其中,199例(207处病变)患者接受了EUS检查,男性为主,男女比例为2.49:1,平均年龄(62.30±10.48)岁。病灶平均大小为(1.93±1.08) cm,≤2 cm的病变居多,占65.2%(135/198)。病变部位主要位于胃下1/3,共占38.6%(80/207),5.3%(11/207)合并溃疡。EGC患者中共有160例(168处病变)接受了ME-NBI检查,男女比例为3.1:1,平均年龄为(62.63±10.58)岁。全部病灶平均大小为(2.06±1.23) cm,直径2cm以内的占大部分(60.7%,102/168)。部位多位于胃下三分之一处,占41.7%(70/168)。4.8%(8/168)合并溃疡。具体信息见表1。
表 1. Baseline characteristics of patients underwent EUS or ME-NBI.
行EUS及ME-NBI患者的基线资料
| Characteristic | EUS (n=199) | ME-NBI (n=160) |
| Gender/case (%) | ||
| Male | 142 (71.4) | 121 (75.6) |
| Female | 57 (28.6) | 39 (24.4) |
Age/yr.,

|
62.30±10.48 | 62.63±10.58 |
| ≤60 yr./case (%) | 83 (40.1) | 67 (39.9) |
| >60 yr./case (%) | 124 (59.9) | 101 (60.1) |
Size/cm,

|
1.93±1.08 | 2.06±1.23 |
| ≤2 cm/case (%) | 135 (65.2) | 102 (60.7) |
| 2-3 cm/case (%) | 54 (26.1) | 47 (28.0) |
| >3 cm/case (%) | 18 (8.7) | 19 (11.3) |
| Location of lesions/case (%) | ||
| Upper | 58 (28.0) | 40 (23.8) |
| Middle | 69 (33.3) | 58 (34.5) |
| Lower | 80 (38.6) | 70 (41.7) |
| Paris classification/case (%) | ||
| 0-Ⅰ | 10 (4.8) | 5 (3.0) |
| 0-Ⅱa | 77 (37.2) | 66 (39.3) |
| 0-Ⅱb | 25 (12.1) | 20 (11.9) |
| 0-Ⅱc | 93 (44.9) | 75 (44.6) |
| 0-Ⅲ | 2 (1.0) | 2 (1.2) |
| Ulcer/case (%) | ||
| Present | 11 (5.3) | 8 (4.8) |
| Absent | 196 (94.7) | 160 (95.2) |
2.2. WLI、EUS单独及联合诊断评估EGC浸润深度准确性的比较
199例(207处病变)行EUS(包含有WLI检查)的EGC患者中,病理诊断结果显示黏膜内病变173处,黏膜下病变34处。WLI检查判断病变层次与病理诊断结果存在一致性(P=0.248,Kappa=0.482)。见表2。EUS对全部病变浸润层次的总体诊断准确率、低估率、敏感性和阴性预测值低于WLI及联合检查(P<0.05),过诊断率和特异性高于WLI及联合诊断(P<0.05)。WLI联合EUS检查在总体诊断准确率、过诊断率、低估率、敏感性、特异性、阳性预测值、阴性预测值方面与单独WLI检查相似(P>0.05)。见表3。
表 2. Diagnostic findings of WLI and EUS for the invasion depth of EGC (207 lesions).
WLI、EUS及联合检查诊断EGC结果(207处病变)
| Pathology depth | WLI | EUS | WLI+EUS | |||||
| M | SM | M | SM | M | SM | |||
| M: Mucosal invasion; SM: Submucosal invasion. | ||||||||
| M/lesion | 163 | 10 | 65 | 108 | 166 | 7 | ||
| SM/lesion | 17 | 17 | 3 | 31 | 19 | 15 | ||
| P(McNemer test) | 0.248 | <0.001 | 0.029 | |||||
| Kappa | 0.482 | 0.128 | 0.467 | |||||
表 3. Diagnostic value of WLI and EUS for the invasion depth of EGC.
WLI、EUS及联合检查对EGC的诊断价值分析
| Endoscopy | Accuracy/% | Overestimate/% | Underestimate/% | Sensitivity/% | Specificity/% | PPV/% | NPV/% |
| PPV: Positive predictive value; NPV: Negative predictive value. *P<0.05, vs. WLI and WLI+EUS. | |||||||
| WLI | 87.0 | 4.8 | 8.2 | 94.2 | 50.0 | 90.6 | 63.0 |
| EUS | 46.4* | 52.2* | 1.5* | 37.6* | 91.2* | 95.6 | 22.3* |
| WLI+EUS | 87.4 | 3.4 | 9.2 | 96.0 | 44.1 | 89.7 | 68.2 |
2.3. ME-NBI分型与EGC病理组织学的关系
见表4。根据本研究所采用的ME-NBI分型,95.4%(144处病变)的分化型EGC在ME-NBI下表现为FNP和ILL型,其中ILL型超过80%。在分化型EGC中,4例未分类型术后病理证实为胃底腺型胃癌,肿瘤性异型腺体均位于黏膜深层,而表面覆盖正常胃黏膜上皮;3例分化型EGC在ME-NBI下表现正常,术后标本未见肿瘤组织,所有术前活检均在普通WLI下完成,活检标本经病理复核证实为分化型胃癌,即为“一点癌”。17例未分化型EGC中,35.3%在ME-NBI下表现为CSP型,52.9%表现为ILL-2型,但表现为ILL-2型的未分化型EGC大多数可见螺旋型血管。有2例未分化型EGC在ME-NBI下表现为未分类型,病理复核后为局限于黏膜固有层的印戒细胞癌,黏膜表层覆盖正常胃黏膜上皮。由表5可见,ME-NBI判断EGC分化程度的总体准确率为92.3%(155/168),与术后病理判断基本一致(P=0.092,Kappa=0.480);未分化型早期胃癌ME-NBI下判断准确率低于分化型早期胃癌(41.2% vs. 98.0%,P<0.001)。
表 4. Associations between ME-NBI patterns and histopathological diagnosis of EGC (168 lesions).
ME-NBI分型与EGC病理组织学诊断的关系(168处病变)
| Pathology | n | ME-NBI/lesion (%) | |||||
| FNP
(n=19) |
ILL-1
(n=42) |
ILL-2
(n=92) |
CSP
(n=6) |
Unclassified (n=6) | Normal
(n=3) |
||
| FNP, ILL-1, ILL-2, CSP: Denotes the same as those in Fig 1. | |||||||
| Differentiated type | 151 | 19 (12.6) | 42 (27.8) | 83 (55.0) | 0 (0) | 4 (2.6) | 3 (2.0) |
| Undifferentiated type | 17 | 0 (0) | 0 (0) | 9 (52.9) | 6 (35.3) | 2 (11.8) | 0 (0) |
表 5. Comparison of differentiation types between ME-NBI and pathology findings (168 lesions).
ME-NBI与病理判断分化类型的比较(168处病变)
| Pathology | n | ME-NBI | Accuracy/% | P | |
| Differentiated
type (n=158) |
Undifferentiated
type (n=10) |
||||
| Differentiated
type |
151 | 148 | 3 | 98.0 | <0.001 |
| Undifferentiated
type |
17 | 10 | 7 | 41.2 | |
| P(McNemer test) | 0.092 | ||||
| Kappa | 0.480 | ||||
3. 讨论
3.1. WLI和EUS对EGC浸润深度的诊断价值
临床工作中,EGC浸润深度的评估一般采用WLI及EUS两种方式[11]。既往研究结果显示WLI可通过观察病变的大体形态、表面结构、颜色、僵硬度、周围黏膜皱襞形态等综合判断EGC的浸润深度[12],准确率在63%~98.2%之间[13-15]。正常胃壁在EUS下可分为5层结构,理论上讲,EUS可以准确地评估EGC的浸润深度,但既往研究显示不同中心对EUS评估EGC浸润深度的准确率介于41.4%~84.6%之间,差异较大[8,16-17]。本研究中,WLI诊断EGC浸润深度的准确率为87.0%,明显优于EUS(46.4%,P<0.01)。原因可能与EUS检查时是否合并溃疡、病变位于胃上1/3、病变较大、未分化型胃癌等影响因素相关[18]。大约10%~30%的EGC合并溃疡并伴有纤维化,在EUS下可表现为与肿瘤浸润类似的低回声改变;当病变位于胃上1/3部位时,EUS操作会更加困难,且不容易注满脱气水;未分化型胃癌表现为肿瘤细胞弥漫性生长或形成小的巢状时,EUS下也难以发现;对于较大病变,EUS扫查范围较小,很难对病灶全貌进行详尽检查,很可能忽略浸润较深部位[19]。相比之下,WLI是通过调节胃腔内空气量、观察病变大体形态、周围皱襞、表面结构、颜色等综合判断EGC深度,受因素影响较小。此外,EUS检查比WLI更加依赖操作者经验与水平[20]。
本研究中,EUS相比WLI过诊断率明显更高(52.2% vs. 4.8%,P<0.001),而对病变深度的低估率更低(1.5% vs. 8.2%,P=0.002)。若术前低估EGC浸润深度而超适应证行ESD,根据术后病理结果可选择追加外科手术达到治疗目的;但术前过诊断病变浸润深度,这部分患者则可能面临不必要的外科手术风险。
TSUJII等[9]的一项研究发现使用EUS可纠正61.9%被WLI过诊断的病例,因此提出了WLI和EUS联合诊断EGC浸润深度的标准。但本研究结果显示联合诊断的准确性为87.4%,相较于单独使用WLI(87.0%)并没有明显提高;过诊断率较WLI(3.4% vs. 4.8%)也无明显改善。
3.2. ME-NBI对EGC分化类型的诊断价值
胃底腺型胃癌是胃癌的一种新的组织学类型,起源于非萎缩正常胃底腺的深部,表面常常覆盖正常胃黏膜上皮[21],因此在ME-NBI下常常呈规则的微血管和微表面结构形态。未分化型胃癌起源于黏膜中间层,在肿瘤细胞完全在中间层侧向生长时,表面覆盖正常胃黏膜,ME-NBI下仅能观察到扩张的隐窝边缘结构和隐窝开口扩张;当肿瘤逐渐浸润黏膜表层时可观察到螺旋状血管和扩张的微表面结构;直至肿瘤浸润黏膜表层全层时ME-NBI下出现表面微结构消失,CSP型不规则微血管出现[22]。根据本研究结果,ME-NBI下观察到FNP和ILL-1型结构,是分化型EGC的特征,准确率达98.0%;ILL-2型结构大多情况是分化型EGC的特征,少数情况下是未分化型EGC的特征,需警惕是否同时含有螺旋状血管,这也解释了为何ME-NBI判断未分化型早期胃癌的准确性较低(41.2%);CSP结构则是未分化型EGC的特征。ME-NBI总体上与病理判断基本一致,与YOKOYAMA等[6]的研究结果相符。另外,当在ME-NBI下观察到未分类型结构时,应结合WLI的表现,考虑特殊组织类型的胃癌和其所对应的生长发育阶段。
综上,本研究推荐可单独使用WLI对病变浸润深度进行评估,在检查时需充分结合病变的大体形态、周围黏膜皱襞情况、表面结构、僵硬度、充吸气延展状态等综合判断;对于病变分化类型的判断,推荐使用ME-NBI进行评估。ME-NBI下表现为FNP和ILL-1型,判断为分化型胃癌;ME-NBI下表现为ILL-2型,一般来说判断为分化型胃癌,若存在螺旋型血管,则判断为未分化型胃癌;ME-NBI下表现为CSP型,判断为未分化型胃癌;若ME-NBI下表现为未分类型,应考虑特殊类型胃癌的可能,如胃底腺型胃癌和局限于黏膜中层的印戒细胞癌。但本研究为单中心、回顾性研究,所纳入的WLI和EUS图片为不同内镜医师摄取,图片质量参差不齐,对结果的判断影响较大,且内镜图片为静态图,而实时、动态的评估对EGC浸润深度和分化类型的评估非常重要。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
中国博士后科学基金(No. 2020M673260)资助
Contributor Information
波 林 (Bo LIN), Email: 792974705@qq.com.
锦林 杨 (Jin-lin YANG), Email: mouse-577@163.com.
References
- 1.北京市科委重大项目《早期胃癌治疗规范研究》专家组, 柴宁莉, 翟亚奇, 等 早期胃癌内镜下规范化切除的专家共识意见(2018, 北京). 中华胃肠内镜电子杂志. 2018;5(2):7–18. [Google Scholar]
- 2.LIU Q, DING L, QIU X, et al Updated evaluation of endoscopic submucosal dissection versus surgery for early gastric cancer: A systematic review and meta-analysis. Int J Surg. 2020;73:28–41. doi: 10.1016/j.ijsu.2019.11.027. [DOI] [PubMed] [Google Scholar]
- 3.KIM J M, SOHN J H, CHO M Y, et al Pre- and post-ESD discrepancies in clinicopathologic criteria in early gastric cancer: the NECA-Korea esd for early gastric cancer prospective study (N-Keep) Gastric Cancer. 2016;19(4):1104–1113. doi: 10.1007/s10120-015-0570-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.JEON S W, PARK H W, KWON Y H, et al Endoscopic indication of endoscopic submucosal dissection for early gastric cancer is not compatible with pathologic criteria in clinical practice. Dig Dis Sci. 2019;64(2):373–381. doi: 10.1007/s10620-018-5324-9. [DOI] [PubMed] [Google Scholar]
- 5.NAKAYOSHI T, TAJIRI H, MATSUDA K, et al Magnifying endoscopy combined with narrow band imaging system for early gastric cancer: Correlation of vascular pattern with histopathology (including video) Endoscopy. 2004;36(12):1080–1084. doi: 10.1055/s-2004-825961. [DOI] [PubMed] [Google Scholar]
- 6.YOKOYAMA A, INOUE H, MINAMI H, et al Novel narrow-band imaging magnifying endoscopic classification for early gastric cancer. Dig Liver Dis. 2010;42(10):704–708. doi: 10.1016/j.dld.2010.03.013. [DOI] [PubMed] [Google Scholar]
- 7.阮江, 殷云勤, 高宇辉, 等 早期胃癌浸润深度判断的研究进展. 中华消化病与影像杂志(电子版) 2018;8(6):267–270. [Google Scholar]
- 8.KIM J, KIM S G, CHUNG H, et al Clinical efficacy of endoscopic ultrasonography for decision of treatment strategy of gastric cancer. Surg Endosc. 2018;32(9):3789–3797. doi: 10.1007/s00464-018-6104-5. [DOI] [PubMed] [Google Scholar]
- 9.TSUJII Y, KATO M, INOUE T, et al Integrated diagnostic strategy for the invasion depth of early gastric cancer by conventional endoscopy and EUS. Gastrointest Endosc. 2015;82(3):452–459. doi: 10.1016/j.gie.2015.01.022. [DOI] [PubMed] [Google Scholar]
- 10.黄丹, 朱雄增, 盛伟琪 2019版《WHO消化系统肿瘤分类》胃肠上皮性肿瘤部分解读. 中华病理学杂志. 2020;49(3):209–213. [Google Scholar]
- 11.SUMIYAMA K Past and current trends in endoscopic diagnosis for early stage gastric cancer in Japan. Gastric Cancer. 2017;20(Suppl 1):20–27. doi: 10.1007/s10120-016-0659-4. [DOI] [PubMed] [Google Scholar]
- 12.廖专, 孙涛, 吴浩, 等 中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙). 胃肠病学. 2014;19(7):408–427. doi: 10.3969/j.issn.1008-7125.2014.07.006. [DOI] [Google Scholar]
- 13.KIM S J, CHOI C W, KANG D H, et al Factors associated with the efficacy of miniprobe endoscopic ultrasonography after conventional endoscopy for the prediction of invasion depth of early gastric cancer. Scand J Gastroenterol. 2017;52(8):864–869. doi: 10.1080/00365521.2017.1315167. [DOI] [PubMed] [Google Scholar]
- 14.NAGAHAMA T, YAO K, IMAMURA K, et al Diagnostic performance of conventional endoscopy in the identification of submucosal invasion by early gastric cancer: the “non-extension sign” as a simple diagnostic marker. Gastric Cancer. 2017;20(2):304–313. doi: 10.1007/s10120-016-0612-6. [DOI] [PubMed] [Google Scholar]
- 15.SALAS F P, BACA E L Endoscopic prediction of tumor invasion depth in early gastric neoplasia: a prospective study in Peru. Rev Gastroenterol Peru. 2017;37(2):120–128. [PubMed] [Google Scholar]
- 16.PARK J S, KIM H, BANG B, et al. Accuracy of endoscopic ultrasonography for diagnosing ulcerative early gastric cancers. Medicine (Baltimore), 2016, 95(30): e3955[2021-01-21]. https://journals.lww.com/md-journal/Fulltext/2016/07260/Accuracy_of_endoscopic_ultrasonography_for.8.aspx. doi: 10.1097/MD.0000000000003955.
- 17.PARK J M, AHN C W, YI X, et al Efficacy of endoscopic ultrasonography for prediction of tumor depth in gastric cancer. J Gastric Cancer. 2011;11(2):109–115. doi: 10.5230/jgc.2011.11.2.109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.KIM J, CHUNG H, KIM J L, et al Hierarchical analysis of factors associated with T staging of gastric cancer by endoscopic ultrasound. Dig Dis Sci. 2021;66(2):612–618. doi: 10.1007/s10620-020-06194-6. [DOI] [PubMed] [Google Scholar]
- 19.王警, 吴齐, 孙利, 等 术前小探头超声内镜检查在早期胃癌治疗方式选择中的作用. 中国内镜杂志. 2016;22(2):15–21. [Google Scholar]
- 20.PARK C H, PARK J C, KIM E H, et al. Learning curve for EUS in gastric cancer T staging by using cumulative sum analysis. Gastrointest Endosc, 2015, 81(4): 898−905. e1[2021-01-21]. https://doi.org/10.1016/j.gie.2014.08.024.
- 21.IWAMURO M, KUSUMOTO C, NAKAGAWA M, et al. Endoscopic resection is a suitable initial treatment strategy for oxyntic gland adenoma or gastric adenocarcinoma of the fundic gland type. Sci Rep, 2021, 11: 7375[2021-01-21].https://doi.org/10.1038/s41598-021-86893-w.
- 22.OKADA K, FUJISAKI J, KASUGA A, et al Diagnosis of undifferentiated type early gastric cancers by magnification endoscopy with narrow-band imaging. J Gastroenterol Hepatol. 2011;26(8):1262–1269. doi: 10.1111/j.1440-1746.2011.06730.x. [DOI] [PubMed] [Google Scholar]



