Abstract
目的
探索血浆D-二聚体水平与儿童肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)疾病严重度及预后的相关性。
方法
回顾性分析我院2016年1月–2018年12月收治的MPP患儿的临床资料,根据D-二聚体峰值分为正常组(D-二聚体<0.55 mg/L)和升高组(D-二聚体≥0.55 mg/L),比较两组患儿一般资料、临床表现、辅助检查及治疗情况。
结果
入组的231例MPP患儿中,D-二聚体正常组70例,D-二聚体升高组161例。升高组患儿年龄大于正常组(P<0.01)。与D-二聚体正常组比较,升高组发热时间、住院时间、抗生素使用时间更长,影像学表现更重(P均<0.01)。同时升高组患儿肺外并发症、难治性MPP、重症MPP的发生率均高于正常组(P<0.01)。实验室检查发现,升高组患儿的中性粒细胞、超敏C反应蛋白、乳酸脱氢酶、白细胞介素6、白细胞介素10、γ干扰素均较正常组升高(P<0.05)。经治疗所有患儿均好转出院,但升高组使用激素、支气管镜、胸腔穿刺的比例均高于正常组(P<0.05)。入组患儿中有123例进行了长期随访,其中正常组43例,升高组80例。随访结果发现,正常组患儿入院后4周肺部病灶基本吸收比例高于升高组,肺部病灶吸收所需时间短于升高组,而出现肺部后遗症比例低于升高组(P均<0.05)。相关性分析显示D-二聚体水平与肺炎严重程度(r=0.272,P=0.000)、肺部后遗症(r=0.235,P=0.000)的发生呈正相关。
结论
血浆D-二聚体升高的MPP患儿临床表现更重,治疗时间更长,肺部病灶恢复所需时间更久,更易出现肺部后遗症。
Keywords: 儿童, 肺炎支原体, 肺炎, D-二聚体
Abstract
Objective
To explore the association between the levels of plasma D-dimer and the disease severity and prognosis of Mycoplasma pneumoniae pneumonia (MPP) in children
Methods
We retrospectively analyzed the clinical data of pediatric MPP patients who were admitted in our hospital between January 1, 2016 and December 31, 2018. According to the peak value of D-dimer, patients were divided into the normal group (D-dimer<0.55 mg/L) and the elevated group (D-dimer≥0.55 mg/L). Information regarding the demographics, clinical manifestations, auxiliary examinations and treatments of patients in the two groups was compared.
Results
Of the 231 MPP patients included in the study, 70 were in the normal group and 161 were in the elevated group. The age of patients in the D-dimer elevated group was significantly higher than that of the normal group (P<0.01). Compared with the normal group, the elevated group had longer lengths of fever, hospital stay and antibiotic therapy, and more severe radiographic manifestations (allP<0.01). In addition, the incidence of extrapulmonary complications, refractory MPP and severe MPP in the elevated group were significantly higher than those in the normal group (P<0.01). As for the laboratory data, we found that neutrophils, C-reactive protein, lactate dehydrogenase, interleukin-6, interleukin-10 and interferon-γ were significantly higher in the elevated group than those in the normal group (P<0.05). After treatments, all patients showed improvement and were discharged, but the proportions of patients requiring glucocorticoids, bronchoscopy, thoracentesis were significantly higher in the elevated group than those in the normal group (P<0.05). Follow-up findings showed that the absorption rate of lung lesions 4 weeks after admission was significantly higher, the time needed for lung lesions absorption was significantly shorter, and the incidence of pulmonary sequelae was significantly lower in the normal group than those in the elevated group (allP<0.05). Correlation analysis showed that D-dimer level was positively correlated with the severity of pneumonia (r=0.272, P=0.000) and the incidence of pulmonary sequelae (r=0.235, P=0.000).
Conclusion
Pediatric patients of MPP who had elevated plasma D-dimer had clinical manifestations that were more severe, required longer duration of treatment and longer recovery time for lung lesions, and were more likely to have pulmonary sequelae.
Keywords: Children, Mycoplasma pneumoniae, Pneumonia, D-dimer
肺炎支原体(Mycoplasma pneumonia, MP)是引起学龄期和学龄前期儿童社区获得性肺炎(community-acquired pneumonia, CAP)最常见的病原菌之一[1]。近年来越来越多的临床研究发现,肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)并不是一种自限性疾病,它能引起一系列的肺内肺外并发症,如坏死性肺炎、闭塞性细支气管炎、心肌炎、脑炎、溶血性贫血等[1-5]。此外,还有研究报道MPP患儿可并发脾梗死、脑梗塞、肺栓塞等血栓性疾病[6-8]。
D-二聚体是一种可溶性纤维蛋白降解产物,许多研究报道其升高与血栓性疾病相关,目前也被广泛用于静脉血栓栓塞的诊断[9-10]。近期亦有研究报道D-二聚体水平与新型冠状病毒肺炎患者的病情有关[11]。然而,D-二聚体水平对MPP患儿的病情及预后的影响目前鲜有研究。因此,本研究回顾性分析了231例MPP患儿的临床资料,以期探索D-二聚体水平与MPP患儿病情及预后的相关性。
1. 对象和方法
1.1. 研究对象
入组2016年1月–2018年12月因MPP在浙江大学医学院附属儿童医院呼吸科住院的患儿。肺炎诊断标准依据第7版《诸福棠实用儿科学》[12];MP感染诊断依据为咽拭子或鼻咽吸出物MP-RNA阳性且MP-IgM阳性。排除标准:①有合并其他病原菌感染的实验室依据者;②有免疫缺陷、慢性心肺疾病、凝血功能异常等基础疾病者;③病程中应用抗凝药物治疗者;④病历资料不完整者。肺炎严重程度的评估依据《儿童社区获得性肺炎管理指南(2013修订)(下)》[13]。难治性肺炎支原体肺炎(refractory Mycoplasma pneumoniae pneumonia, RMPP)采用第9版《儿科学》标准[14]。本研究经浙江大学医学院附属儿童医院伦理委员会批准(2019-IRB-058)。
1.2. 临床资料收集
采集研究对象的临床资料,包括一般资料、临床表现、影像学资料和治疗情况。实验室结果主要包括血常规、超敏C反应蛋白(C-reactive protein, CRP)、乳酸脱氢酶(lactic dehydrogenase, LDH)、细胞因子等。部分患儿有出院后门诊定期随访的资料,主要包括胸部影像学资料。
1.3. 血浆D-二聚体测定
所有患儿入院当天采集3 mL静脉血,EDTA-K2抗凝,3 000 r/min离心10 min,分离血浆,免疫比浊法检测血浆D-二聚体水平。采用D-二聚体测定试剂盒(西门子,汉堡,德国)进行检测,正常值为<0.55 mg/L,所有操作严格按照说明书进行。对于D-二聚体异常的患儿,根据病情每3~5 d复查,记录峰值。
1.4. 统计学方法
符合正态分布的计量资料用
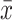 ±s表示,组间比较采用t检验;非正态分布的计量资料用中位数(最小值~最大值)表示,组间比较采用Mann-Whitney U非参数检验;计数资料用例数(%)表示,组间比较应用χ2检验。用Spearman相关检验来描述不同变量与D-二聚体之间的相关性。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;非正态分布的计量资料用中位数(最小值~最大值)表示,组间比较采用Mann-Whitney U非参数检验;计数资料用例数(%)表示,组间比较应用χ2检验。用Spearman相关检验来描述不同变量与D-二聚体之间的相关性。P<0.05为差异有统计学意义。
2. 结果
2.1. 一般资料
共有231例MPP患儿入选,患儿的中位年龄为5.7(0.4~14.1)岁。根据入院后D-二聚体的检测峰值,把入组患儿分成正常组(<0.55 mg/L)和升高组(≥0.55 mg/L)。其中正常组患儿70例,中位年龄4.3(0.4~14.1)岁,男33例,女37例;升高组患儿161例,中位年龄6.0(0.9~12.3)岁,男76例,女85例。升高组年龄大于正常组(P=0.004),而性别构成比两组间差异无统计学意义。
2.2. 临床症状
231例患儿均有咳嗽,225例有发热,44例伴有喘息,82例存在一侧呼吸音减低,74例存在肺外并发症。肺外并发症大多累及一个系统,但有9例累及两个系统,1例累及三个系统,其中消化系统受累50例(肝功能异常、肝脾肿大)、心血管系统受累24例(心肌炎、心包积液)、神经系统受累6例(脑炎)、血液系统受累1例(贫血)及皮疹4例等。如表1所示,升高组患儿肺外并发症发生率高于正常组(P<0.01);同时RMPP和重症MPP(severeMycoplasma pneumoniae pneumonia, SMPP)的发生率升高组也高于正常组(P<0.01);在总发热天数上,升高组患儿大于正常组患儿(P<0.01)。我们还对MPP严重程度与D-二聚体水平进行了Spearman相关检验,结果发现MPP严重程度与D-二聚体水平呈轻度正相关(r=0.272,P=0.000)。
表 1. Clinical characteristics of MMP patients with different levels of D-dimer.
不同D-二聚体水平的肺炎支原体肺炎患儿临床症状的区别
| Clinical characteristic | Normal group
(n=70) |
Elevated group
(n=161) |
χ2/Z | P |
| RMPP: Refractory Mycoplasma pneumoniae pneumonia; SMPP: Severe Mycoplasma pneumoniae pneumonia. | ||||
| Extrapulmonary complications/case (%) | 10 (14.3) | 64 (39.8) | 14.532 | 0.000 |
| RMPP/case (%) | 5 (7.1) | 72 (44.7) | 31.002 | 0.000 |
| SMPP/case (%) | 48 (68.6) | 139 (86.3) | 9.984 | 0.002 |
| Total length of fever/d, median (Min-Max) | 8.5 (0.0-15.0) | 10.0 (1.0-30.0) | −4.922 | 0.000 |
2.3. 辅助检查
2.3.1. 外周血检查
比较正常组和升高组患儿的外周血检查结果,发现升高组患儿的中性粒细胞、CRP、LDH、白细胞介素(interleukin, IL)-6、IL-10、γ干扰素(interferon-γ, IFN-γ)较正常组升高(P<0.05)。见图1。
图 1.
Peripheral blood examinations of MMP patients with different levels of D-dimer
不同D-二聚体水平的肺炎支原体肺炎患儿外周血检查结果
*P<0.05, **P<0.01.

2.3.2. 胸部影像学
入组的MPP患儿肺部出现不同程度的影像学改变。如表2所示,升高组患儿肺部胸腔积液、大叶性肺不张、大叶性肺实变和胸膜增厚的发生率均高于正常组患儿,两组间差异有统计学意义(P<0.001)。
表 2. Radiographic features of MMP patients with different levels of D-dimer.
不同D-二聚体水平的肺炎支原体肺炎患儿胸部影像学检查结果
| Radiographic feature | Normal group (n=70) | Elevated group (n=161) | χ 2 | P |
| Pleural effusion/case (%) | 21 (30.0) | 110 (68.3) | 29.187 | 0.000 |
| Lobar atelectasis/case (%) | 3 (4.3) | 64 (39.8) | 29.801 | 0.000 |
| Pulmonary consolidation/case (%) | 23 (32.9) | 105 (65.2) | 20.678 | 0.000 |
| Pleural thickening/case (%) | 12 (17.1) | 68 (42.2) | 13.570 | 0.000 |
2.4. 治疗、转归和预后
2.4.1. 治疗
入组患儿均予以阿奇霉素10 mg/(kg·d)序贯疗法(用药5~7 d,间隔4 d),疗程一般10~14 d,辅以雾化、补液等对症支持治疗。此外,根据病情的严重程度,给予患儿吸氧、纤维支气管镜下支气管肺泡灌洗、胸腔穿刺、联合应用β内酰胺类抗生素等治疗。升高组应用激素、纤维支气管镜下支气管肺泡灌洗、胸腔穿刺的比例均高于正常组(P<0.05),而吸氧、静脉用丙种球蛋白和联合应用β内酰胺类抗生素比例两组间差异无统计学意义。总抗生素使用天数上升高组长于正常组(P<0.05)。见表3。
表 3. Treatments of MMP patients with different levels of D-dimer.
不同D-二聚体水平的肺炎支原体肺炎患儿的治疗情况
| Treatment | Normal group
(n=70) |
Elevated group
(n=161) |
χ 2 | P |
| Oxygen therapy/case (%) | 22 (31.4) | 39 (24.2) | 1.303 | 0.254 |
| Glucocorticoid/case (%) | 37 (52.9) | 125 (77.6) | 14.304 | 0.000 |
| Bronchoalveolar lavage/case (%) | 16 (22.9) | 93 (57.8) | 23.855 | 0.000 |
| Immunoglobulin/case (%) | 3 (4.3) | 9 (5.6) | 0.008 | 0.930 |
| Thoracentesis/case (%) | 0 (0.0) | 15 (9.3) | 5.525 | 0.019 |
| Combined application with β-lactam antibiotics/case (%) | 31 (44.3) | 89 (55.3) | 2.362 | 0.124 |
2.4.2. 转归
所有患儿均好转出院,均未行肺切除术,无1例死亡。升高组住院天数为8.0(3.0~26.0) d,较正常组的6.0(1.0~18.0) d延长(Z=−4.120,P=0.000)。出院时患儿均行胸部影像学恢复情况的评估,结果发现两组患儿出院时肺部病灶吸收>1/2的比例无明显差异〔正常组91.4%(64/70) vs. 升高组82.6%(133/161),χ2=3.024,P>0.05 〕。
2.4.3. 预后
入组患儿中有108例失访,123例进行了长期随访,其中正常组43例,升高组80例。随访结果如表4所示,正常组患儿入院后4周肺部病灶基本吸收比例高于升高组(P=0.047),肺部病灶吸收所需时间短于升高组(P=0.047)。随访1年左右发现正常组患儿无肺部后遗症,升高组患儿有11例存在肺部后遗症,主要表现为闭塞性细支气管炎、支气管扩张、局限性肺气肿等,有肺部后遗症的比例在两组间的差异有统计学意义(P=0.027)。D-二聚体水平与肺部后遗症的Spearman相关检验显示,两者间呈轻度正相关(r=0.235,P=0.000)。
表 4. Prognosis of MMP patients with different levels of D-dimer.
不同D-二聚体水平的肺炎支原体肺炎患儿的预后情况
| Prognosis | Normal group
(n=43) |
Elevated group (n=80) | Z/χ2 | P |
| The absorption rate of lung lesions at 4 weeks after admission/case (%) | 32 (74.4) | 45 (56.3) | 3.943 | 0.047 |
| The time for lung lesions absorption/d, median (Min, Max) | 17.0 (4.0-134.0) | 24.0 (3.0-374.0) | -1.982 | 0.047 |
| Pulmonary sequelae/case (%) | 0 (0.0) | 11 (13.8) | 4.914 | 0.027 |
根据随访1年患儿有无肺部后遗症重新分组,分为有后遗症组(n=11)和无后遗症组(n=112),比较两组患儿D-二聚体的差异。结果发现,有后遗症组患儿的D-二聚体为2.51(0.82~7.29) mg/L,无后遗症组患儿的D-二聚体为0.77(0.11~7.00) mg/L,两组间差异有统计学意义(Z=−3.907,P=0.000)。
3. 讨论
MPP是儿童CAP的常见类型,约占儿童CAP的10%~40%[15]。近年来RMPP、SMPP的报道明显增多,治疗效果欠佳,常引起一系列肺内肺外并发症[16]。最近也有一些研究者报道,MPP患者可合并血栓性疾病,并且认为可能与D-二聚体水平升高有关[17-18]。然而,目前国内外鲜有研究关注D-二聚体升高在MPP患儿中的临床意义。因此,本研究回顾性纳入了231例伴/不伴有D-二聚体升高的MPP患儿,分析了血浆D-二聚体水平与儿童MPP疾病严重程度及预后的相关性。
D-二聚体是一种特定的纤维蛋白降解产物,是纤维蛋白溶解系统的特异性标志物,D-二聚体水平升高说明体内存在高凝状态和继发纤维蛋白溶解亢进,因此,D-二聚体水平对血栓性疾病的诊断、疗效评估和预后判断具有重要的意义[19]。近来有研究发现D-二聚体还可以作为评价CAP严重程度的一个指标[20]。本研究结果显示,与正常组相比,升高组患儿肺外并发症的发生率更高,发生RMPP、SMPP的比例更高,发热天数和住院天数更长;同时升高组患儿肺部病变更重,更容易出现胸腔积液、大叶性肺不张、大叶性肺实变和胸膜增厚;治疗上升高组患儿抗生素使用天数更长,更需要使用激素、支气管镜下支气管肺泡灌洗和胸腔穿刺。Spearman相关分析显示,MPP严重程度与D-二聚体水平呈一定程度正相关。以上结果提示合并D-二聚体升高的MPP患儿临床表现可能更严重,进一步提示D-二聚体可能可以作为评估疾病严重程度的指标。
众所周知MP可通过直接或间接作用损伤血管壁,导致局部血管炎或微血栓形成,从而激活凝血系统和补体系统[1]。此外,随着MPP的进展,发热、脱水、缺氧等因素可刺激免疫细胞释放不同类型的炎症介质,从而加剧血管内皮细胞的损伤,导致D-二聚体升高[17, 21-22]。因此,发热持续时间越长,血管内皮损伤越严重,D-二聚体水平越高,本研究结果与之一致。此外本研究还发现,升高组患儿的中位年龄大于正常组,考虑可能与年长儿免疫系统发育较完善,易产生较强的免疫反应、易激活凝血系统有关。
细胞介导的免疫反应在MPP的疾病进程中起着至关重要的作用[1]。本课题组前期研究和其他研究均发现,在机体炎症反应强烈的RMPP患儿中细胞因子和其他一些炎症指标(如IL-6、IL-10、CRP、LDH等)明显升高[23-24]。在本研究中,升高组患儿的CRP、LDH、细胞因子(如IL-6、IL-10及IFN-γ)均较正常组升高。以上结果表明MPP患儿中的D-二聚体水平与各类炎症介质水平相关,临床上可能可以通过检测血浆D-二聚体水平来评估MPP患儿机体的炎症反应情况。
本研究还评估了D-二聚体升高对MPP患儿预后的影响。对123例MPP患儿的随访结果显示,与正常组患儿相比,升高组入院后4周肺部病灶基本吸收的患儿比例下降,肺部病灶吸收所需时间延长,肺部出现后遗症的比例升高。同时D-二聚体水平与肺部后遗症之间呈一定程度的正相关。以上结果提示血浆D-二聚体水平可能对肺部病灶的恢复、后遗症的发生具有一定的提示意义。
本研究尚存不足之处:①本研究中正常组和升高组患儿病例数相差较大,在一定程度上可能会造成统计结果的偏倚。②对于入院后初测D-二聚体正常的病例我们没有动态监测其变化,可能会导致部分病例分组的偏倚。③本研究为单中心回顾性研究,选择病例时排除了D-二聚体升高但接受抗凝治疗的病例,在一定程度上可能影响研究结果。因此需开展多中心、前瞻性、大样本研究来进一步验证本研究结果。
综上所述,血浆D-二聚体升高的MPP患儿更容易出现临床表现重、治疗时间长、肺部病灶恢复所需时间久,以及出现肺部后遗症的可能。临床医生应对合并D-二聚体升高的MPP患儿引起重视,把握治疗时机及早进行合理的治疗,避免肺部后遗症的发生。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81871264)资助
Contributor Information
美霞 黄 (Mei-xia HUANG), Email: huangmeixia9937@126.com.
园园 张 (Yuan-yuan ZHANG), Email: chzyy@zju.edu.cn.
References
- 1.WAITES K B, XIAO L, LIU Y, et al Mycoplasma pneumoniae from the respiratory tract and beyond . Clin Microbiol Rev. 2017;30(3):747–809. doi: 10.1128/CMR.00114-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.WANG X, ZHONG L J, CHEN Z M, et al Necrotizing pneumonia caused by refractory Mycoplasma pneumonia pneumonia in children . World J Pediatr. 2018;14(4):344–349. doi: 10.1007/s12519-018-0162-6. [DOI] [PubMed] [Google Scholar]
- 3.XU W, YANG H, LIU H, et al Bronchoalveolar lavage T cell cytokine profiles and their association with lung function in children with Mycoplasma pneumoniae-associated bronchiolitis obliterans. Pediatr Pulmonol. 2020;55(8):2033–2040. doi: 10.1002/ppul.24882. [DOI] [PubMed] [Google Scholar]
- 4.DABA M, KANG P B, SLADKY J, et al Intravenous immunoglobulin as a therapeutic option for Mycoplasma pneumoniae encephalitis . J Child Neurol. 2019;34(11):687–691. doi: 10.1177/0883073819854854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.CARRARA C, ABBATE M, SABADINI E, et al Acute kidney injury and hemolytic anemia secondary to Mycoplasma pneumoniae infection . Nephron. 2017;137(2):148–154. doi: 10.1159/000478991. [DOI] [PubMed] [Google Scholar]
- 6.求伟玲, 王颖硕, 陈志敏 肺炎支原体肺炎合并脾梗死一例. 中华儿科杂志. 2017;55(9):705–706. doi: 10.3760/cma.j.issn.0578-1310.2017.09.016. [DOI] [Google Scholar]
- 7.BAO Y, LI X, WANG K, et al Central retinal artery occlusion and cerebral infarction associated with Mycoplasma pneumonia infection in children . BMC Pediatr. 2016;16(1):210. doi: 10.1186/s12887-016-0750-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.CHEN S, DING Y, VINTURACHE A, et al Pulmonary embolism associated with mycoplasma in a child. Lancet Infect Dis. 2020;20(11):1347. doi: 10.1016/S1473-3099(20)30253-X. [DOI] [PubMed] [Google Scholar]
- 9.WEITZ J I, FREDENBURGH J C, EIKELBOOM J W A test in context: D-dimer. J Am Coll Cardiol. 2017;70(19):2411–2420. doi: 10.1016/j.jacc.2017.09.024. [DOI] [PubMed] [Google Scholar]
- 10.TRITSCHLER T, KRAAIJPOEL N, LE GAL G, et al Venous thromboembolism: Advances in diagnosis and treatment. JAMA. 2018;320(15):1583–1594. doi: 10.1001/jama.2018.14346. [DOI] [PubMed] [Google Scholar]
- 11.GUNGOR B, ATICI A, BAYCAN O F, et al Elevated D-dimer levels on admission are associated with severity and increased risk of mortality in COVID-19: A systematic review and meta-analysis. Am J Emerg Med. 2021;39:173–179. doi: 10.1016/j.ajem.2020.09.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.胡亚美, 江载芳主编 诸福棠实用儿科学. 第7版. 北京: 北京人民卫生出版社. 2011:1204–1205. [Google Scholar]
- 13.中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会 儿童社区获得性肺炎管理指南(2013修订)(下). 中华儿科杂志. 2013;51(11):856–862. doi: 10.3760/cma.j.issn.0578-1310.2013.11.012. [DOI] [Google Scholar]
- 14.王卫平, 孙锟, 常立文主编 儿科学. 第9版. 北京: 北京人民卫生出版社. 2018:262. [Google Scholar]
- 15.JAIN S, WILLIAMS D J, ARNOLD S R, et al Community-acquired pneumonia requiring hospitalization among U. S. children. N Engl J Med. 2015;372(9):835–845. doi: 10.1056/NEJMoa1405870. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.PODDIGHE D Extra-pulmonary diseases related to Mycoplasma pneumoniae in children: recent insights into the pathogenesis . Curr Opin Rheumatol. 2018;30(4):380–387. doi: 10.1097/BOR.0000000000000494. [DOI] [PubMed] [Google Scholar]
- 17.LIU J, HE R, WU R, et al Mycoplasma pneumoniae pneumonia associated thrombosis at Beijing Children’s hospital . BMC Infect Dis. 2020;20(1):51. doi: 10.1186/s12879-020-4774-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.LI T, YU H, HOU W, et al Evaluation of variation in coagulation among children with Mycoplasma pneumoniae pneumonia: a case-control study . J Int Med Res. 2017;45(6):2110–2118. doi: 10.1177/0300060517709613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.FAVRESSE J, LIPPI G, ROY P M, et al D-dimer: Preanalytical, analytical, postanalytical variables, and clinical applications. Crit Rev Clin Lab Sci. 2018;55(8):548–577. doi: 10.1080/10408363.2018.1529734. [DOI] [PubMed] [Google Scholar]
- 20.CERDA-MANCILLAS M C, SANTIAGO-GERMÁN D, ANDRADE-BRAVO B, et al D-dimer as a biomarker of severity and adverse outcomes in patients with community acquired pneumonia. Arch Med Res. 2020;51(5):429–435. doi: 10.1016/j.arcmed.2020.04.014. [DOI] [PubMed] [Google Scholar]
- 21.MISHRA K P, GANJU L, SINGH S B Hypoxia modulates innate immune factors: A review. Int Immunopharmacol. 2015;28(1):425–428. doi: 10.1016/j.intimp.2015.07.008. [DOI] [PubMed] [Google Scholar]
- 22.ITURRIAGA R, MOYA E A, DEL RIO R Inflammation and oxidative stress during intermittent hypoxia: The impact on chemoreception. Exp Physiol. 2015;100(2):149–155. doi: 10.1113/expphysiol.2014.079525. [DOI] [PubMed] [Google Scholar]
- 23.CHOI Y J, JEON J H, OH J W Critical combination of initial markers for predicting refractory Mycoplasma pneumoniae pneumonia in children: A case control study . Respir Res. 2019;20(1):193. doi: 10.1186/s12931-019-1152-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.ZHANG Y, MEI S, ZHOU Y, et al. Cytokines as the good predictors of refractory Mycoplasma pneumoniae pneumonia in school-aged children. Sci Rep, 2016, 6: 37037[2021-04-30]. https://dx.doi.org/10.1038/srep37037.


