Abstract
目的
比较基于深度学习(deep learning, DL)的重建算法、滤波反投影(filtered back projection filtering, FBP)重建算法和迭代重建(iterative reconstruction, IR)算法,探讨DL重建算法在健康志愿者肝脏低剂量薄层CT检查中临床应用的可行性。
方法
采用联影160层CT对直径180 mm的标准水模进行扫描,比较DL、FBP和IR算法的噪声功率谱。前瞻性纳入健康志愿者100例,其中常规剂量组(normal dose, ND)50例、低剂量组(low dose, LD)50例。ND组采用IR算法;LD组分别采用DL、FBP和IR算法。使用单因素方差分析比较ND-IR、LD-FBP、LD-IR和LD-DL 4组的肝CT值、肝噪声、肝信噪比(signal-to-noise ratio, SNR)、对比噪声比(contrast noise ratio, CNR)和质量因数(figure of merit, FOM)。采用Kruskal-Wallis检验比较4组图像的解剖结构主观评分。
结果
DL噪声功率谱平均峰值最低,形态与中等迭代等级IR算法相似。ND-IR、LD-FBP、LD-IR和LD-DL的肝CT值差异无统计学意义,LD-DL的噪声低于LD-FBP、LD-IR和ND-IR(P<0.05),LD-DL的SNR、CNR和FOM均高于LD-FBP、LD-IR和ND-IR(P<0.05)。LD-DL解剖结构的主观评分均与ND-IR无明显差异(P>0.05),且均高于LD-FBP和LD-IR(P<0.05)。LD组相对于ND组减少约50.2%辐射剂量。
结论
噪声形态与临床常用的中等迭代等级IR相近的DL算法降噪能力高于IR,与FBP相比噪声形态较平滑但降噪能力大幅提高,在健康志愿者肝脏低剂量薄层CT检查中可获得肝脏常规剂量厚层CT的图像质量。
Keywords: 肝脏计算机断层扫描, 深度学习, 图像重建
Abstract
Objective
To explore the clinical feasibility of applying deep learning (DL) reconstruction algorithm in low-dose thin-slice liver CT examination of healthy volunteers by comparing the reconstruction algorithm based on DL, filtered back projection (FBP) reconstruction algorithm and iterative reconstruction (IR) algorithm.
Methods
A standard water phantom with a diameter of 180 mm was scanned, using the 160 slice multi-detector CT scanning of United Imaging Healthcare, to compare the noise power spectrums of DL, FBP and IR algorithms. 100 healthy volunteers were prospectively enrolled, with 50 assigned to the normal dose group (ND) and 50 to the low dose group (LD). IR algorithm was used in the ND group to reconstruct images, while DL, FBP and IR algorithms were used in the LD group to reconstruct images. One-way analysis of variance was used to compare the liver CT values, the liver noise, liver signal-to-noise ratio (SNR), contrast noise ratio (CNR) and figure of merit (FOM) of the images of ND-IR, LD-FBP, LD-IR and LD-DL. The Kruskal-Wallis test was used to analyse subjective scores of anatomical structures.
Results
The DL algorithm had the lowest average peak value of noise power spectrum, and its shape was similar to that of medium-level IR algorithm. Liver CT values of ND-IR, LD-FBP, LD-IR and LD-DL did not show statistically significant difference. The noise of LD-DL was lower than that of LD-FBP, LD-IR and ND-IR (P<0.05), and the SNR, CNR and FOM of LD-DL were higher than those of LD-FBP, LD-IR and ND-IR (P<0.05). The subjective scores of anatomical structures of LD-DL did not show significant difference compared to those of ND-IR (P>0.05), and were higher than those of LD-FBP and LD-IR. The radiation dose of the LD group was reduced by about 50.2% compared with that of the ND group.
Conclusion
The DL algorithm with noise shape similar to the medium iterative grade IR commonly used in clinical practice showed higher noise reduction ability than IR did. Compared with FBP, the DL algorithm had smoother noise shape, but much better noise reduction ability. The application of DL algorithm in low-dose thin-slice liver CT of healthy volunteers can help achieve the standard image quality of liver CT.
Keywords: Liver computed tomography, Deep learning, Image reconstruction
增强CT具有较高的空间分辨率与时间分辨率,临床上广泛应用于显示肝脏解剖以及评价多种肝脏疾病[1-3]。近年来,随着多层螺旋CT技术的快速发展,使CT具备了更快的采集速度和更薄的图像层厚,从而提高图像分辨率,更好地评估体积较小的病灶[4-5]。与薄层CT相比,厚层CT图像提供了更好的细节,但噪声也随之增加。肝脏CT常采用2~3 mm层厚来避免噪声掩盖肝脏细微的低对比度病变,降低诊断特异性[6]。同时,CT的广泛应用大大增加人口相关辐射暴露,为平衡使用辐射诊断的风险和收益,国际放射防护委员会提出了放射防护最优化(as low as reasonably achievable, ALARA)原则[7],保持CT图像质量的同时降低辐射剂量至关重要。CT辐射剂量降低导致噪声增加,临床中广泛使用的是迭代重建(iterative reconstruction, IR)算法。与传统的滤波反投影(filtered back projection, FBP)CT重建算法相比,IR降低图像噪声的能力更强,但过高的IR等级会改变噪声纹理,剂量较低时会极大地降低诊断低对比度细小病变的能力[8]。目前,国外已有多种基于深度学习(deep learning, DL)的重建算法被应用到CT图像并初步展现出了较强的图像降噪能力[9-11],使进一步降低肝脏CT辐射剂量和图像层厚的同时保持图像质量成为可能。本研究将DL算法与FBP和IR算法相比较,探讨DL算法在健康志愿者肝脏低剂量薄层CT检查中应用的可行性。
1. 对象与方法
1.1. 研究对象
2019年7月−2019年9月,前瞻性纳入健康志愿者100例。纳入标准:男性及非妊娠女性;年龄≥18岁。排除标准:有肝脏疾病;有碘对比剂过敏史;无法配合闭气;心、肾功能不全。随机分配至常规剂量(normal dose, ND)组和低剂量(low dose, LD)组各50例,ND组志愿者(男性21例,女性29例)平均年龄(57.46±12.42)岁,体质量指数(body mass index, BMI)(23.36±3.14) kg/m2。LD组志愿者(男性22例,女性28例)平均年龄(56.1±13.39)岁,BMI(23.18±3.28) kg/m2。两组志愿者性别、年龄和BMI差异均无统计学意义。本研究经我院医学伦理委员会审查通过(2019年审742号),所有试验对象均签署知情同意书。
1.2. DL重建算法
本研究使用的DL算法(DELTA;上海联影公司)[12]训练数据集由大量正常图像和异常病例图像组成,其中腹部病例包括活性占位性病变、脂肪肝、肝硬化、肾结石、胃癌等。基于临床图像的多样性,训练后的算法能够很好地学习正常组织和常见疾病的结构。正常剂量的图像使用FBP重建,而每一幅相对应的低剂量图像通过在原始数据中插入泊松噪声以及高斯噪声模拟低剂量CT的噪声分布生成。为了训练能够处理不同噪声水平图像的算法,模拟生成了不同剂量水平的低剂量图像。通过改变图像厚度、卷积核等重建参数增加数据量,最终训练数据集共包含约100 000对图像。由两名经验丰富的放射科医生对所有配对图像进行审核,确保CT图像无伪影且具有临床意义。
使用3D残余卷积网络[13]学习低剂量图像和正常剂量图像的差异,虽然不同患者的CT图像具有不同的组织特征,但相同剂量下的图像具有相似的噪声特征。网络学习噪声特征后在低剂量图像中减去噪声输出降噪后的图像,在每个训练周期内,所有模拟的低剂量图像都被随机输入网络中,经过运算后将网络输出的图像与正常剂量的图像进行比较,通过不断缩小两者差异来优化模型。
1.3. 模体CT扫描及图像重建方案
标准水模(圆柱体,直径180 mm)由联影公司提供。采用联影160层CT扫描仪(uCT 780; United Imaging Healthcare, Shanghai, China)扫描水模体。扫描参数:管电压120 kVp,管电流100 mAs,转速0.5 s/rot,螺距0.9875,准直160 mm×0.5 mm。分别采用FBP、IR(KARL 3D,迭代等级为5)和DL 3种重建方式重建,1 mm层厚及层间距。
1.4. 健康志愿者CT扫描及图像重建方案
采用联影160层CT扫描仪(uCT 780;上海联影公司)进行腹部增强CT扫描,使用高压注射器经肘正中静脉以流速2.5 mL/s、1.5 mL/kg体质量注入对比剂(碘克沙醇注射液,320 mgI/mL),采集门脉期图像用于本研究。ND组扫描参数:管电压120 kVp,自适应管电流调节,剂量等级设置为2级,转速0.5 s/rot,螺距0.9875,准直160 mm×0.5 mm。ND组图像采用IR(KARL 3D,迭代等级为5)重建(ND-IR),2 mm层厚及层间距。LD组扫描参数除剂量等级设置为1级外其余与ND组相同(联影uCT780自动管电流调制技术的剂量等级从低到高有1到4级,腹部常规剂量等级为2级,1级的管电流约为2级的50%)。LD组分别采用FBP(LD-FBP)、IR(LD-IR)和DL(LD-DL)3种重建方式重建,1 mm层厚及层间距。其中IR算法与ND组图像重建算法一致(KARL 3D,迭代等级为5),DL算法为联影公司的DELTA算法。以ND-IR的图像质量作为金标准,比较各组图像质量。
1.5. 图像质量评价指标
模体CT使用噪声功率谱(noise power spectrum, NPS)进行图像质量评价。NPS曲线可反映CT图像噪声的大小和形态,用于比较DL和IR相对于传统FBP算法的噪声幅值和噪声纹理的变化。健康志愿者CT图像质量评价指标包括肝CT值、肝噪声、肝信噪比(signal-to-noise ratio, SNR)、对比噪声比(contrast-to-noise ratio, CNR)和质量因数(figure of merit, FOM)。分别于肝门平面肝左内叶、左外叶、右前叶和右后叶各放置一个大小为2 mm2的圆形兴趣区(region-of-interest, ROI),肝CT值、噪声取各ROI的均数。分别于左、右竖脊肌内放置大小为1 mm2的圆形ROI,竖脊肌CT值取两个ROI的均数。于前腹壁脂肪内放置大小为1 mm2的圆形ROI。SNR为肝CT值与肝噪声的比值,CNR为CT值肝−竖脊肌与前腹壁脂肪噪声的比值,FOM为SNR2与有效剂量(effective dose, ED)的比值。
两位经验丰富的腹部放射科医生采用盲法对各组图像的5个解剖结构(门静脉、肝静脉、肝总管、胆总管、胆囊壁)进行评分:1分,完全不能诊断;2分,结构模糊,不确定性强;3分,满足诊断;4分,结构锐利,图像质量优秀。两名医师可自己调整窗宽、窗位和角度,意见不一致时经过讨论得出一致性评分。
1.6. 辐射剂量
扫描结束后记录所有志愿者的剂量-长度乘积(dose-length product, DLP)和容积CT剂量指数(volume CT dose index, CTDIVOL),DLP乘以组织权重因子(腹部取k=0.015)计算ED。
1.7. 统计学方法
选择两独立样本t检验比较ND组和LD组志愿者的性别、年龄、BMI、DLP、CTDIVOL和ED。使用单因素方差分析比较ND-IR、LD-FBP、LD-IR和LD-DL 4组的肝CT值、肝噪声、SNR、CNR和FOM。采用Kruskal-Wallis检验比较4组图像的解剖结构评分。α双侧=0.05。
2. 结果
2.1. 模体CT图像噪声功率谱
3种CT图像重建方式的NPS如图1所示,单张模体CT图像的NPS显示DL图像噪声形态与IR(KARL 3D,迭代等级为5)相似。水模CT图像共重建50张,平均NPS显示DL图像所有频率的噪声均低于IR和FBP(曲线幅值更低)。DL的NPS平均峰值最低,平均空间频率较IR偏移约10%,较FBP偏移约16%(表1)。
图 1.

Noise power spectrum of single phantom CT image (A) and the average noise power spectrum of 50 phantom CT images (B)
单张模体CT图像的噪声功率谱(A)和50张模体CT图像的平均噪声功率谱(B)
表 1. Noise power spectrum average peaks and average spatial frequencies obtained for three reconstruction types (n=50) .
3种重建方式的噪声功率谱平均峰值和平均空间频率(n=50)
| Item | FBP | IR | DL |
| NPS: Noise power spectrum; FBP: Filtered back projection; IR: Iterative reconstruction; DL: Deep learning. | |||
| NPS average peak/HU2·mm2 | 147.70 | 90.68 | 65.25 |
| NPS average spatial frequency/mm−1 | 2.93 | 2.73 | 2.45 |
2.2. 健康志愿者CT图像质量评价
ND组和LD组图像的肝CT值、肝噪声、SNR、CNR和FOM如表2所示。ND-IR、LD-FBP、LD-IR和LD-DL 4组图像的肝CT值差异无统计学意义;LD-DL组图像的噪声低于LD-FBP、LD-IR和ND-IR图像(P<0.05);LD-DL组图像的SNR、CNR和FOM均高于LD-FBP、LD-IR和ND-IR图像(P<0.05)。由表3可见,LD-DL图像5个解剖结构的主观评分与ND-IR差异均无统计学意义(P>0.05),且均高于LD-FBP和LD-IR(P<0.05)。4组图像中,LD-DL图像质量最高(图2)。
表 2. Comparison of the image quality of the normal-dose images and low-dose images (n=100) .
常规剂量和低剂量图像质量比较(n=100)
| Variable | ND-IR | LD-FBP | LD-IR | LD-DL |
| ND: Normal dose; LD: Low dose; IR: Iterative reconstruction; FBP: Filtered back projection; DL: Deep learning; SNR: Signal-to-noise ratio; CNR: Contrast-to-noise ratio; FOM: Figure of merit. *P<0.05, vs. LD-DL. | ||||
| CT value/HU | 108.9±8.59 | 108.89±10.91 | 108.98±10.83 | 109.13±10.55 |
| Noise/HU | 9.71±1.19* | 20.36±1.49* | 15.26±1.19* | 9.10±1.26 |
| SNR | 11.41±1.77* | 5.39±0.72* | 7.19±0.97* | 12.22±2.07 |
| CNR | 4.51±1.28* | 2.22±0.61* | 2.95±0.8* | 5.11±1.31 |
| FOM | 25.99±12.97* | 11.85±6.21* | 21.08±10.95* | 62.45±35.5 |
表 3. Comparison of subjective scores of anatomical structures (n=100) .
解剖结构主观评分比较(n=100)
| Variable | ND-IR | LD-FBP | LD-IR | LD-DL |
| ND: Normal dose; LD: Low dose; IR: Iterative reconstruction; FBP: Filtered back projection; DL: Deep learning. *P<0.001, vs. LD-DL. | ||||
| Intrahepatic portal veins | 3.48±0.58 | 2.36±0.66* | 2.46±0.61* | 3.36±0.56 |
| Hepatic veins | 3.78±0.42 | 2.48±0.68* | 2.56±0.70* | 3.86±0.35 |
| Common hepatic duct | 2.92±0.57 | 2.06±0.77* | 2.20±0.69* | 2.81±0.53 |
| Common bile duct | 2.64±0.53 | 1.90±0.76* | 2.08±0.78* | 2.72±0.54 |
| Gallbladder wall | 3.10±0.54 | 2.22±0.76* | 2.38±0.88* | 3.01±0.64 |
图 2.
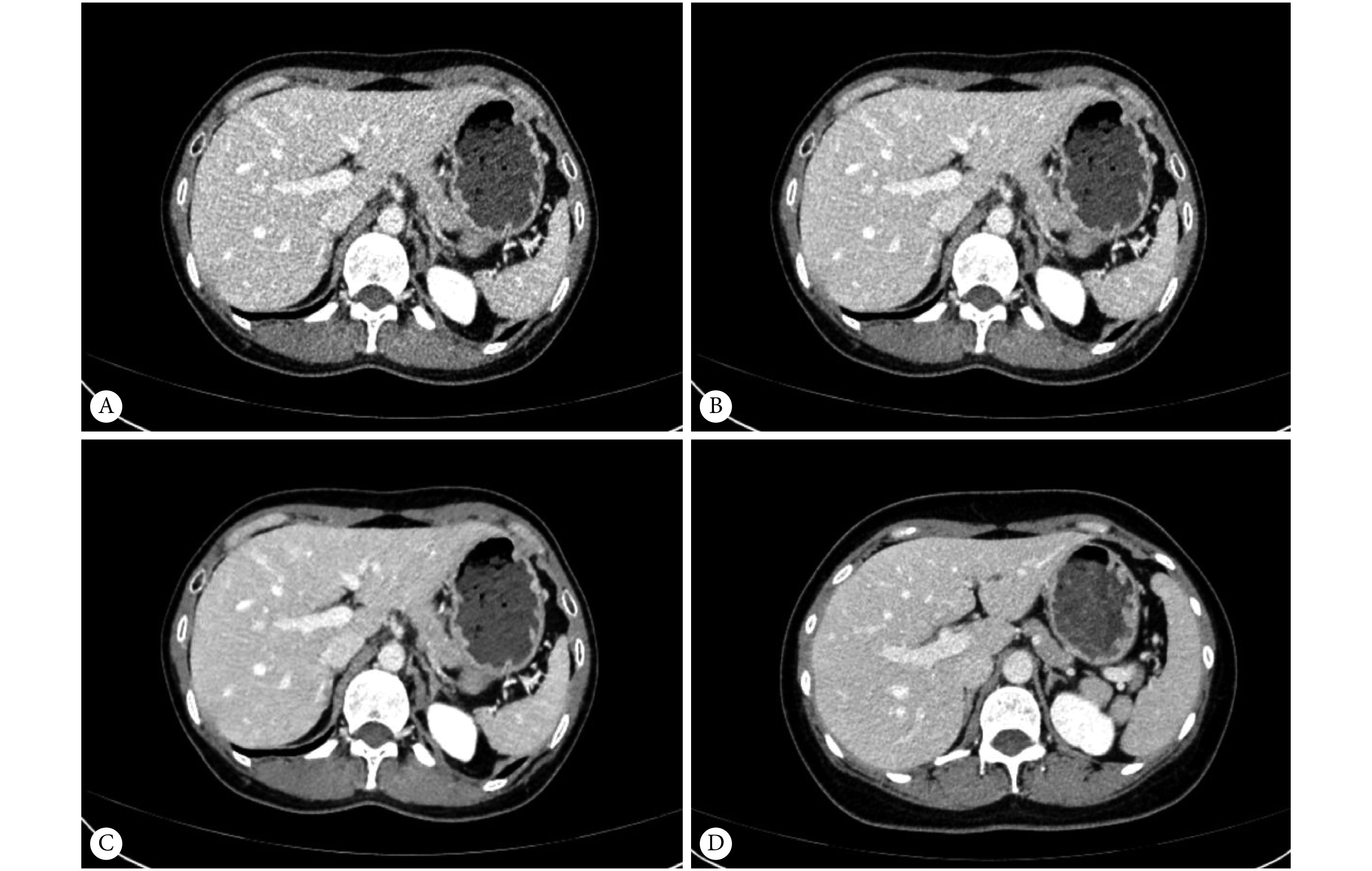
Low-dose CT in a 49-year-old woman was reconstructed using filtered back projection (A), iterative reconstruction (B), and deep learning algorithm (C), respectively (body mass index, 19.3 kg/m2; volume CT dose index, 3.4 mGy; dose-length product, 92.13 mGy∙cm; estimated effective dose, 1.38 mSv). A normal-dose CT image of a 56-year-old woman was reconstructed with iterative reconstruction of a 56-year-old woman (D) (body mass index, 19.1 kg/m2; volume CT dose index, 7.76 mGy; dose-length product, 237.14 mGy∙cm; estimated effective dose, 3.56 mSv)
49岁女性低剂量CT分别使用滤波反投影(A)、迭代重建(B)和基于深度学习的算法(C)重建(体质量指数:19.3 kg/m2;容积CT剂量指数:3.4 mGy;剂量-长度乘积:92.13 mGy∙cm;有效剂量:1.38 mSv)。56岁女性常规剂量CT使用迭代重建算法(D)重建(体质量指数:19.1 kg/m2;容积CT剂量指数:7.76 mGy;剂量-长度乘积:237.14 mGy∙cm;有效剂量:3.56 mSv)
2.3. 辐射剂量
由表4可见,ND组和LD组DLP、CTDIVOL和ED差异均有统计学意义(P<0.001),LD组相对于ND组约减少了50.2%辐射剂量。
表 4. Radiation dose in the two groups (n=100) .
两组辐射剂量比较(n=100)
| Group | CTDIVOL/mGy | DLP/mGy∙cm | ED/mSv |
| ND: Normal dose; LD: Low dose; CTDIVOL: Volume CT dose index; DLP: Dose-length product; ED: Effective dose. | |||
| ND | 9.09±1.24 | 390.71±138.02 | 5.86±2.07 |
| LD | 4.41±0.67 | 194.68±62.46 | 2.92±0.94 |
| t | 23.409 | 9.15 | 9.15 |
| P | <0.001 | <0.001 | <0.001 |
3. 讨论
目前,薄层高分辨CT主要在胸部广泛应用,大量研究表明,薄层CT有助于提高检测病变的能力[14-16]。美国国立综合癌症网络胰腺癌和胆管癌指南也建议采用增强薄层CT检测肿瘤[17]。但是由于肝脏增强CT采用薄层重建时会造成图像噪声大量增加,同等辐射剂量的条件下图像质量会大幅度下降。增加辐射剂量可以实现保证图像质量的同时采用薄层重建,但这违背了ALARA原则。随着电离辐射生物学效应的逐渐阐明,降低CT辐射剂量以减小辐射损伤越来越被重视。虽然CT具有显著的临床效益,但电离辐射已被证实有致癌的风险,一项研究表明,2015年法国因诊断性医疗辐射暴露造成2 300人患癌症[18]。我国人口众多,每年医疗放射检查基数更大,对于降低辐射剂量的探索至关重要。
鉴于目前临床常用的IR算法会改变噪声纹理及其有限的降噪能力,已有一些使用基于DL的算法降低低剂量CT图像噪声的尝试,LIU等[19]使用基于DL的方法在高噪声水平的低剂量冠状动脉CT血管造影图像中显示出良好的降噪能力。YIN等[20]提出了一种3D残差卷积网络的DL算法应用于低剂量CT,在模体研究中展示了较强的降噪性能。ZHAO等[21]在肺气肿的超低剂量CT中应用基于DL的降噪算法取得了较好的效果。目前,还未有基于DL的重建算法在肝脏低剂量薄层CT检查中的应用研究。本研究采用联影DELTA深度学习算法优化健康志愿者肝脏低剂量薄层CT的图像质量,与常规剂量2 mm层厚IR肝脏CT相比,图像噪声更低,SNR更高,展现出更好的图像质量。DELTA算法的降噪能力远高于目前临床常用的IR算法,同等剂量条件下,与FBP算法相比,DELTA算法约降低55.3%的噪声(IR约降低25%)。且与ND-IR相比,LD-DL图像更高的CNR表示其拥有更强的低对比度病变检测能力。FOM是同时评价图像质量及辐射剂量的综合指标,可比较不同CT扫描方案间图像质量与潜在的辐射损伤风险的综合“性价比”[22]。LD-DL的FOM远高于其余3组(约为LD-FBP的5.27倍,LD-IR的2.96倍,ND-IR的2.4倍),DELTA算法展现出优秀的降低CT电离辐射损伤的潜能。在提升图像质量的同时,DELTA算法没有改变肝脏组织CT值(P>0.05),这对于肝脏病变的定量检测十分重要[23-24],表示其未改变图像外观。而对细小解剖结构的主观评价表明LD-DL图像质量达到了正常剂量的图像质量,没有明显的解剖结构锐利度损失。此外,模体研究表明DELTA算法重建图像的噪声纹理与现临床常用的中等迭代等级的IR图像噪声纹理极其相近,在噪声更大幅度降低的同时避免出现高迭代等级的IR图像过于平滑使图像外观变化、失真的现象。虽DL平均空间频率较中等迭代等级的IR约低10%,但更高的CNR表明稍平滑的噪声形态并未影响低对比度病变的检测能力。
本研究存在的不足:①为了防止志愿者辐射剂量过高,常规剂量和低剂量CT两套扫描方案并未在同一志愿者中实施,虽然两组志愿者基本情况差异无统计学意义,但仍可能导致一定程度的误差。②并未对病变显示情况进行研究。
综上所述,DELTA DL重建算法具有比IR算法更强的CT图像降噪能力,并且未改变图像外观,噪声形态与现临床常用的中等等级IR算法相近,在健康志愿者肝脏低剂量薄层CT检查中应用可获得肝脏常规剂量厚层CT的图像质量,减少约50.2%辐射剂量的同时采用薄层重建提高图像分辨率,具备良好的可行性及临床应用价值。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科技计划项目(No. 2019YFS0522)和四川大学华西医院学科卓越发展1·3·5工程项目(No. ZYGD18019)资助
Contributor Information
令明 曾 (Ling-ming ZENG), Email: zenghouzi@163.com.
真林 李 (Zhen-lin LI), Email: HX_lizhenlin@126.com.
References
- 1.ALABOUSI M, MCINNES M D, SALAMEH J P, et al MRI vs. CT for the detection of liver metastases in patients with pancreatic carcinoma: A comparative diagnostic test accuracy systematic review and meta-analysis. J Magn Reson Imaging. 2021;53(1):38–48. doi: 10.1002/jmri.27056. [DOI] [PubMed] [Google Scholar]
- 2.RONOT M, LEPORQ B, VAN BEERS B E, et al CT and MR perfusion techniques to assess diffuse liver disease. Abdom Radiol (NY) 2020;45(11):3496–3506. doi: 10.1007/s00261-019-02338-z. [DOI] [PubMed] [Google Scholar]
- 3.HAN Y, LI L, SUN H CT and MRI imaging in the diagnosis of primary neuroendocrine tumors of the liver. World Neurosurg. 2020;138:723–731. doi: 10.1016/j.wneu.2020.01.169. [DOI] [PubMed] [Google Scholar]
- 4.SILVA T K B D, ZANON M, ALTMAYER S, et al High-resolution CT pulmonary findings in children with severe asthma. J Pediatr (Rio J) 2021;97(1):37–43. doi: 10.1016/j.jped.2019.10.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.OOSTVEEN L J, BOEDEKER K L, BRINK M, et al Physical evaluation of an ultra-high-resolution CT scanner. Eur Radiol. 2020;30(5):2552–2560. doi: 10.1007/s00330-019-06635-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.SCHIMA W, KOH D M, BARON R. Focal liver lesions//HODLER J. Diseases of the abdomen and pelvis 2018-2021: Diagnostic imaging-idkd book. Cham (CH): Springer; 2018: 173-196.
- 7.YEUNG A The “As Low As Reasonably Achievable” (ALARA) principle: A brief historical overview and a bibliometric analysis of the most cited publications. Radioprotection. 2019;54(2):103–109. doi: 10.1051/radiopro/2019016. [DOI] [Google Scholar]
- 8.MILETO A, GUIMARAES L S, MCCOLLOUGH C H, et al State of the art in abdominal CT: The limits of iterative reconstruction algorithms. Radiology. 2019;293(3):491–503. doi: 10.1148/radiol.2019191422. [DOI] [PubMed] [Google Scholar]
- 9.GREFFIER J, HAMARD A, PEREIRA F, et al Image quality and dose reduction opportunity of deep learning image reconstruction algorithm for CT: A phantom study. Eur Radiol. 2020;30(7):3951–3959. doi: 10.1007/s00330-020-06724-w. [DOI] [PubMed] [Google Scholar]
- 10.AKAGI M, NAKAMURA Y, HIGAKI T, et al Deep learning reconstruction improves image quality of abdominal ultra-high-resolution CT. Eur Radiol. 2019;29(11):6163–6171. doi: 10.1007/s00330-019-06170-3. [DOI] [PubMed] [Google Scholar]
- 11.SHAN H, PADOLE A, HOMAYOUNIEH F, et al Competitive performance of a modularized deep neural network compared to commercial algorithms for low-dose CT image reconstruction. Nature Machine Intelligence. 2019;1(6):269–276. doi: 10.1038/s42256-019-0057-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.ZENG L, XU X, ZENG W, et al. Deep learning trained algorithm maintains the quality of half-dose contrast-enhanced liver computed tomography images: Comparison with hybrid iterative reconstruction: Study for the application of deep learning noise reduction technology in low dose. Eur J Radiol, 2021, 135: 109487[2020-10-13]. https://doi.org/10.1016/j.ejrad.2020.109487.
- 13.LIU J, ZHANG Y, ZHAO Q, et al Deep iterative reconstruction estimation (DIRE): Approximate iterative reconstruction estimation for low dose CT imaging. Phys Med Biol. 2019;64(13):135007. doi: 10.1088/1361-6560/ab18db. [DOI] [PubMed] [Google Scholar]
- 14.周清华, 范亚光, 王颖, 等 中国肺部结节分类、诊断与治疗指南(2016年版) 中国肺癌杂志. 2016;19(12):793–798. doi: 10.3779/j.issn.1009-3419.2016.12.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.张蕾, 高亭, 于小多, 等 薄层CT导航联合细胞学在周围型肺癌术前常规支气管镜检查中的价值. 中华肿瘤杂志. 2019;41(2):86–90. doi: 10.3760/cma.j.issn.0253-3766.2019.02.002. [DOI] [Google Scholar]
- 16.ZHAN Y, PENG X, SHAN F, et al Attenuation and morphologic characteristics distinguishing a ground-glass nodule measuring 5-10 mm in diameter as invasive lung adenocarcinoma on thin-slice CT. AJR Am J Roentgenol. 2019;213(4):W162–W170. doi: 10.2214/AJR.18.21008. [DOI] [PubMed] [Google Scholar]
- 17.TAMURA A, NAKAYAMA M, OTA Y, et al. Feasibility of thin-slice abdominal CT in overweight patients using a vendor neutral image-based denoising algorithm: Assessment of image noise, contrast, and quality. PLoS One, 2019, 14(12): e0226521[2020-10-13]. https://doi.org/10.1371/journal.pone.0226521.
- 18.MARANT-MICALLEF C, SHIELD K D, VIGNAT J, et al The risk of cancer attributable to diagnostic medical radiation: Estimation for France in 2015. Int J Cancer. 2019;144(12):2954–2963. doi: 10.1002/ijc.32048. [DOI] [PubMed] [Google Scholar]
- 19.LIU P, WANG M, WANG Y, et al Impact of deep learning-based optimization algorithm on image quality of low-dose coronary CT angiography with noise reduction: A prospective study. Acad Radiol. 2020;27(9):1241–1248. doi: 10.1016/j.acra.2019.11.010. [DOI] [PubMed] [Google Scholar]
- 20.YIN X, COATRIEUX J L, ZHAO Q, et al Domain progressive 3D residual convolution network to improve low-dose CT imaging. IEEE Trans Med Imaging. 2019;38(12):2903–2913. doi: 10.1109/TMI.2019.2917258. [DOI] [PubMed] [Google Scholar]
- 21.ZHAO T, MCNITT-GRAY M, RUAN D A convolutional neural network for ultra-low-dose CT denoising and emphysema screening. Med Phys. 2019;46(9):3941–3950. doi: 10.1002/mp.13666. [DOI] [PubMed] [Google Scholar]
- 22.梁子威, 耿建华, 王奕斌, 等 PET/CT中CT仿真人体模型的图像质量与辐射剂量关系的研究. 中华放射医学与防护杂志. 2016;36(7):524–529. doi: 10.3760/cma.j.issn.0254-5098.2016.07.010. [DOI] [Google Scholar]
- 23.WASHIO H, OHIRA S, KARINO T, et al Accuracy of quantification of iodine and hounsfield unit values on virtual monochromatic imaging using dual-energy computed tomography: Comparison of dual-layer computed tomography with fast kilovolt-switching computed tomography. J Comput Assist Tomogr. 2018;42(6):965–971. doi: 10.1097/RCT.0000000000000798. [DOI] [PubMed] [Google Scholar]
- 24.TISCH C, BRENCICOVA E, SCHWENDENER N, et al Hounsfield unit values of liver pathologies in unenhanced post-mortem computed tomography. Int J Legal Med. 2019;133(6):1861–1867. doi: 10.1007/s00414-019-02016-1. [DOI] [PubMed] [Google Scholar]


