Abstract
目的
探讨定坤丹联合戊酸雌二醇对肾阳虚薄型子宫内膜大鼠Wnt/β-连环蛋白(β-catenin)信号通路的影响。
方法
选取处于动情期的雌性SD大鼠40只,随机分为空白组、模型组、定坤丹组、戊酸雌二醇组、联合用药组,每组8只。除空白组外,其余各组大鼠建立肾阳虚薄型子宫内膜模型。空白组自由饮食,模型组给予蒸馏水灌胃,定坤丹组灌服定坤丹2.26 g/(kg·d),戊酸雌二醇组灌服戊酸雌二醇0.3 mg/(kg·d),联合用药组在戊酸雌二醇0.3 mg/(kg·d)基础上同时给予定坤丹2.26 g/(kg·d)。经过3个动情周期后,处死大鼠,取材。HE染色观察大鼠子宫内膜组织形态学变化。免疫组织化学染色检测血管内皮生长因子(VEGF)的表达,Western blot法检测大鼠子宫内膜中β-catenin、E钙粘蛋白(E-cadherin)、基质金属蛋白酶-9(MMP-9)蛋白的表达。
结果
与空白组比较,模型组大鼠子宫腔狭窄或增大,内膜层腺体、血管稀疏,子宫内膜变薄(P<0.01),VEGF表达降低(P<0.01),β-catenin、E-cadherin、MMP-9蛋白表达升高(P<0.01)。与模型组比较,各治疗组内膜腺体较多,分布均匀,内膜层血管丰富,内膜增厚(P<0.01或P<0.05),VEGF表达呈不同程度升高,β-catenin、E-cadherin蛋白表达水平降低(P<0.01),定坤丹组与联合用药组MMP-9蛋白表达水平降低(P<0.01)。与戊酸雌二醇组比较,定坤丹组β-catenin蛋白水平更高(P<0.05),MMP-9蛋白水平更低(P<0.01);联合用药组β-catenin、MMP-9蛋白表达水平均降低(P<0.01)。与联合用药组比较,定坤丹组β-catenin蛋白水平更高,E-cadherin蛋白水平更低(P<0.01或P<0.05)。
结论
定坤丹联合戊酸雌二醇通过上调肾阳虚薄型子宫内膜大鼠子宫内膜VEGF表达,下调β-catenin、E-cadherin和MMP-9蛋白水平,增厚大鼠子宫内膜。
Keywords: 定坤丹, 薄型子宫内膜, 血管内皮生长因子, β-连环蛋白
Abstract
Objective
To explore the influence for combination of Dingkun Dan with estradiol valerateon in treating rats with thin endometrium with Kidney-Yang deficiency based on Wnt/β-catenin signaling pathway.
Methods
The estrous period 40 rats were randomly divided into the normal control group, the model group, the Dingkun Dan group, the estradiol valerateon group and the combination group, with 8 rats in each group. In addition to the normal control group, the rat model of thin endometrium with Kidney-Yang deficiency was established in other groups. The control group used free diet, the model group was given distilled water, the estradiol valerateon group was treated with progynova by gavage at 0.3 mg/(kg·d) , Dingkun Dan group was treated with Dingkun Dan by gavage at 2.26 g/(kg·d), and the combined group was given Dingkun Dan at 2.26 g/(kg·d) on the basis of progynova at 0.3 mg/(kg·d). After 3 estrous cycles, the rats were killed and harvested. HE staining was used to observe histopathologic changes in endometrium. The expression of VEGF in rats endometrium were detected by immunohistochemistry. The expression of β-catenin, E-cadherin and MMP-9 protein in rat endometrium was detected by Western blot.
Results
Compared with the control group, the uterine cavity was narrowed or enlarged, the endometrium glands and blood vessels were sparse, and the endometrium was thinner significantly in the model group (P<0.01); the levels of VEGF was decreased significantly (P<0.01), while β-catenin, E-cadherin and MMP-9 were increased significantly (P<0.01). Compared with the model group, more endometrial glands, rich intimal vessels, the endometrium were thickened significantly in the 3 treatment groups (P<0.01 orP<0.05); the levels of VEGF was increased differently. The protein levels of β-catenin and E-cadherin were significantly decreased in each treatment group (P<0.01), and MMP-9 were significantly decreased in the Dingkun Dan group and in the combination group (P<0.01). Compared with the estradiol valerateon group, the level of β-catenin in Dingkun Dan group was higher, and MMP-9 was lower (P<0.05 orP<0.01). The levels of β-catenin and MMP-9 in the combination group were significantly decreased (P<0.01). Compared with the combination group, the levels of β-catenin was increased significantly, while decreased signicantly in Dingkun Dan group (P<0.01 orP<0.05).
Conclusion
Dingkun Dan combined with estradiol valerateon can increase the thicken of the endometrium by up-regulation of VEGF, while down-regulate of β-catenin, E-cadherin and MMP-9 in rats with Shen-Yang deficiency and thin endometrium.
Keywords: Dingkun Dan, Thin endometrium, VEGF, β-catenin
不孕症以育龄期女子婚后或末次妊娠后,夫妇同居2年以上,配偶生殖功能正常,未避孕而不受孕为主要表现。据报道,全球约有8%~12%的夫妇受到不孕症或低生育能力的影响[1]。薄型子宫内膜的病因多样、发病机制复杂,是不孕的常见病因, 60%的胚胎种植失败与子宫内膜过薄密切相关[2]。近年来研究表明,Wnt信号通路可能也在子宫内膜修复中扮演重要角色,但相关研究甚少,作用机制尚未阐明[3]。Wnt/β-连环蛋白(Wnt/β-catenin) 是一个在进化上高度保守的细胞信号系统,在胚胎发育、维持器官及组织稳态方面,发挥了至关重要的作用,并且与薄型子宫内膜的发病机制相关[4]。定坤丹 为妇科常用的中成药,是由中药“补经汤”加减制成。有研究发现[5]定坤丹通过使基质细胞血管内皮细胞生长因子受体 2(vascular endothelial growth factor receptor 2,VEGF-R2)的表达广泛上调,促进内膜的发育。雌激素能促进间质细胞和子宫内膜细胞有丝分裂,引起血管、间质、腺体和子宫内膜基底层等增厚和增生,同时可加速裸露区上皮化,修复创面,促进子宫内膜增生[6]。戊酸雌二醇片是子宫内膜创伤性手术后促进子宫内膜修复与生长的一种较为广泛应用的雌激素制剂[7]。本实验通过检测Wnt/β-catenin信号通路上关键因子β-连环蛋白(β-catenin)以及下游因子E钙粘蛋白(E-cadherin)、基质金属蛋白酶-9(MMP-9)蛋白在肾阳虚薄型子宫内膜模型大鼠子宫内膜中治疗前后的表达变化,研究定坤丹对薄型子宫内膜的修复机制,以期为定坤丹的临床应用提供实验室依据。
1. 材料与方法
1.1. 实验动物
SPF级性周期规律的未交配SD雌性大鼠40只,体质量(230±20) g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)20160006,喂养于南京中医药大学动物实验中心。实验期间大鼠自由饮水、摄食,光照与黑暗周期各12 h。室温(24±3) ℃,湿度55%~65%。动物实验按照我国《实验动物福利伦理审查指南(GB/T 35892-2018)》要求,规范符合实验动物福利伦理。
1.2. 药物
定坤丹:山西广誉远国药有限公司生产,批准文号: 国药准字 Z14020656,10.8 g/丸;补佳乐(戊酸雌二醇片):拜耳医药保健有限公司广州分公司,批准文号:国药准字J20130009,1 mg/片。
1.3. 主要试剂及仪器
SP免疫组织化学试剂及Western blot检测实验试剂主要来自武汉谷歌生物科技有限公司,血管内皮生长因子(VEGF)一抗(武汉赛维尔生物科技有限公司),蛋白Marker(Therm,美国),Tris、甘氨酸及SDS(北京索莱宝科技有限公司),PVDF膜(Millipore,美国),BSA(Roche,瑞士)。脱水机、包埋机(武汉俊杰电子有限公司),显微镜及成像系统(尼康,日本),冷冻离心机〔力新仪器(上海)有限公司〕;电泳仪(北京六一仪器厂);感光胶片(柯达,美国);灰度分析软件(Alpha innotech,美国);图像分析软件(Adobe,美国)。
1.4. 实验方法
1.4.1. 分组及模型建立
实验大鼠适应性饲养后,随机分为5组,分别为空白组、模型组、定坤丹组、戊酸雌二醇组及联合用药组,每组8只。除空白组外,其余4组均建立肾阳虚薄型子宫内膜大鼠模型。参照ZHAO等[8]方法通过体积分数为95%乙醇化学损伤及羟基脲灌胃建模。术后次日,参照林继红等[9]方法,除空白组外,其余各组采用羟基脲悬浮液450 mg/(kg·d)给大鼠灌胃。术后连续3 d肌注青霉素(104U/d)预防感染,术口每日使用1%碘伏消毒。羟基脲灌胃8 d后,发现大鼠少饮少食,体质量增长缓慢,缩肩拱背,反应迟钝,自主活动明显减少,毛松无光泽,大便稀溏,提示成功建立肾阳虚薄型子宫内膜模型。
1.4.2. 给药方法
成药均用双蒸水溶解配制成悬浊液,根据人和动物体表面积折算的等效剂量灌胃。空白组不予处理,自由饮水摄食;其余各组均于薄型子宫内膜造模术后次日开始连续灌胃:模型组给予蒸馏水,按0.1 mL/(kg·d)灌胃;戊酸雌二醇组予补佳乐悬浊液,按0.3 mg/(kg·d)灌胃;定坤丹组给予定坤丹悬浊液,按2.26 g/(kg·d)灌胃;联合用药组予补佳乐悬浊液0.3 mg/(kg·d),同时给予定坤丹悬浮液2.26 g/(kg·d)灌胃。
1.4.3. 取材
用药3个动情周期后于动情期取材。采用2%戊巴比妥钠(0.2 mL/100 g)腹腔麻醉后打开腹腔,腹主动脉采血后,迅速取出子宫,去除周边多余组织。无菌PBS液清洗后,一侧子宫中1/3浸渍于体积分数为4%多聚甲醛溶液中固定。剩余2/3子宫及另一侧子宫浸泡在预冷的PBS溶液中在显微镜下取子宫内膜组织后,置入−80 ℃冰箱保存。
1.4.4. 检测方法
1.4.4.1. HE染色
取出固定在体积分数4%多聚甲醛溶液中的子宫组织,通过酒精梯度脱水,透明剂透明,透蜡浸蜡,包埋切片,脱蜡至水,HE染色,中性树胶封片。在光镜下观察 HE 染色后大鼠子宫内膜腺体和血管分布情况。子宫内膜厚度采用Image J图像处理软件测定子宫内膜肌层交界处至宫腔的垂直距离。
1.4.4.2. 免疫组织化学染色检测大鼠子宫内膜组织中VEGF的表达
自体积分数4%多聚甲醛溶液中取出实验大鼠子宫,石蜡包埋切片步骤同HE染色。采用免疫组化SP三步法检测子宫内膜组织中VEGF表达(一抗 VEGF滴度1:800 )。每张切片选择5个高倍镜视野,利用Image-pro plus图像分析软件测定实验各组平均光密度(average optical density, AOD)值。
1.4.4.3. Western blot法检测
提取大鼠子宫内膜组织总蛋白,BCA法测蛋白浓度后,SDS-PAGF电泳,转膜,免疫反应,最后用 ECLA和ECLB化学发光法显色,以 β-actin作为对照,检测β-catenin、E钙粘蛋白(E-cadherin)、基质金属蛋白酶-9(MMP-9)蛋白的表达。将胶片进行扫描存档,PhotoShop整理去色,Image J软件处理系统分析目的条带灰度值。
1.5. 统计学方法
数据采用
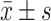 表示。多组间比较采用单因素方差分析(One-Way ANOVA),使用 LSD 法进行两两比较,P<0.05 为差异有统计学意义。
表示。多组间比较采用单因素方差分析(One-Way ANOVA),使用 LSD 法进行两两比较,P<0.05 为差异有统计学意义。
2. 结果
2.1. 大鼠子宫内膜HE染色结果
空白组大鼠子宫内膜结构完整,内膜表面被覆腔上皮完整,腺体和血管分布均匀、量多。与空白组比较,模型组子宫腔增大或狭窄,被覆腔上皮缺失,腺体、血管稀疏,子宫内膜变薄(P<0.01);与模型组比较,各治疗组腺体及血管均有所增加,其中定坤丹组及联合用药组内膜腺体较多,分布均匀,内膜层血管丰富,定坤丹组与联合用药组子宫内膜增厚 (P<0.01),戊酸雌二醇组子宫内膜增厚(P<0.05)。联合用药组与单用药组大鼠子宫内膜厚度及组织形态学变化无明显差异。见图1、表1。
图 1.
HE staining showed the uterus of each group of rats. ×40
HE染色显示各组大鼠子宫。 ×40
A: Control group; B: Model group; C: Dingkun Dan group; D: Estradiol valerateon group; E: Combination group.
表 1. Comparison of endometrial thickness and the expression VEGF in the endometrial tissues of rats in different groups (
 )
.
)
.
各组大鼠子宫内膜厚度和子宫内膜组织VEGF表达(
 )
)
| Group | n | Endometrial thickness/μm | VEGF |
| *P<0.01, vs. control group; #P<0.05, △P<0.01, vs. model group. | |||
| Control | 8 | 272.945±99.796 | 0.299±0.038 |
| Model | 8 | 120.884±80.119* | 0.208±0.031* |
| Dingkun Dan | 8 | 268.840±74.573△ | 0.256±0.035# |
| Estradiol valerateon | 8 | 259.004±77.761# | 0.252±0.049 |
| Combination | 8 | 305.207±114.361△ | 0.293±0.036△ |
2.2. 对大鼠子宫内膜组织VEGF表达的影响
VEGF主要表达于子宫内膜腔上皮和子宫腺上皮,子宫内膜基质细胞中的大多数细胞也有表达,免疫组化染色可见棕黄色颗粒沉淀,颜色深浅不一。与空白组比较,模型组子宫内膜VEGF表达降低(P<0.01);与模型组比较,定坤丹组、联合用药组子宫内膜VEGF表达呈不同程度的升高(P<0.05,P<0.01)。联合用药组与单用药组子宫内膜VEGF表达差异无统计学意义(P>0.05)。见图2、表1。
图 2.
Immunohistochemistry showing the expressions of VEGF in the endometrial tissues of different groups of rats. ×200
免疫组化显示各组大鼠子宫内膜VEGF的表达。×200
A: Control group; B: Model group; C: Dingkun Dan group; D: Estradiol valerateon group; E: Combination group.
2.3. 对大鼠子宫内膜组织β-catenin、E-cadherin和MMP-9表达的影响
见图3、表2。与空白组比较,模型组β-catenin、E-cadherin和MMP-9蛋白表达水平均升高(P<0.01),定坤丹组及联合用药组MMP-9的表达水平与空白组接近,其中,联合用药组β-catenin、E-cadherin、MMP-9蛋白水平与空白组比较,差异均无统计学意义。与模型组比较,各治疗组β-catenin、E-cadherin蛋白表达水平降低(P<0.01);定坤丹组与联合用药组MMP-9蛋白表达水平降低(P<0.01)。与戊酸雌二醇组比较,定坤丹组β-catenin蛋白水平更高(P<0.05),MMP-9蛋白水平更低(P<0.01);联合用药组β-catenin、MMP-9蛋白表达水平均降低(P<0.01)。与联合用药组比较,定坤丹组β-catenin蛋白水平更高(P<0.01),E-cadherin蛋白水平更低(P<0.05)。
图 3.
Western blot showing the expressions of β-catenin, E-cadherin and MMP-9 in the endometrial tissues of different groups of rats
Western blot示各组大鼠子宫内膜组织β-catenin、E-cadherin和MMP-9的表达
A: Control group; B: Model group; C: Dingkun Dan group; D: Estradiol valerateon group; E: Combination group.
表 2. Comparison of protein expressions of β-catenin, E-cadherin and MMP-9 in the endometrial tissues of different groups of rats (
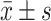 )
.
)
.
各组大鼠子宫内膜组织蛋白表达的比较(
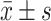 )
)
| Group | n | β-catenin | E-cadherin | MMP-9 |
| * P<0.05, **P<0.01, vs. control group; ##P<0.01, vs. model group; ★P<0.05, ★★P<0.01, vs. estradiol valerateon group ; △P<0.05, △△P<0.01,vs. combination group. | ||||
| Control | 8 | 0.09±0.02 | 0.52±0.06 | 0.37±0.07 |
| Model | 8 | 0.95±0.16** | 1.14±0.14** | 0.90±0.17** |
| Dingkun Dan | 8 | 0.67±0.05**, ##, ★, △△ | 0.45±0.03*, ##, △ | 0.42±0.07##, ★★ |
| Estradiol valerateon | 8 | 0.55±0.12**, ## | 0.46±0.04## | 0.80±0.13** |
| Combination | 8 | 0.10±0.02##, ★★ | 0.50±0.04## | 0.45±0.06##, ★★ |
3. 讨论
薄型子宫内膜往往不能充分地增殖与分泌,致使内膜结构、生化物质分泌等方面异常而不能形成有利于胚胎着床的微环境,从而导致子宫内膜容受性降低[10]。
MIWA等[11]认为,薄型内膜的主要病理生理为腺上皮生长缓慢、子宫动脉血流高阻力,抑制VEGF的过表达,导致血管发育不良,减少子宫内膜血供,导致薄型子宫内膜形成。理想有效的薄型子宫内膜动物模型,对于防治薄型子宫内膜的发生至关重要。探索薄型子宫内膜模型较多,各有优缺点。本研究参照文献方法[8-9]建立肾阳虚薄型子宫内膜大鼠模型,与人类肾阳虚薄型子宫内膜的致病途径及病理改变相似。本研究结果发现:模型组子宫内膜明显变薄,子宫腔增大或狭窄,被覆腔上皮缺失,腺体及血管稀疏,提示成功复制肾阳虚薄型子宫内膜模型。
VEGF是一种有高度特异性的促血管生成因子,对血管生成有极强的诱导性,与血管内皮表面的特异性受体结合后可促进血管内皮细胞的有丝分裂、增殖分化,改善细胞外基质,促进内皮细胞基因表达,同时还可阻止内皮细胞凋亡及宫腔网状结构的退化而增加血管通透性[12],从而促进大分子运转,造成纤维蛋白凝结、血浆蛋白溢出,形成血管基质物质,从而促进诱发新生血管形成和修复受损血管[13-15]。本研究发现,给药后大鼠子宫内膜VEGF 表达增加,可能有利于促进子宫内膜内皮细胞增殖、腺体的重塑、血管的新生、血管密度的增加等,可能对维持子宫内膜微循环系统的功能及内膜组织血流灌注有重要作用,从而改变子宫内膜细胞外基质的成分和结构,促进子宫内膜的生长。
β-catenin 是Wnt 经典信号通路的关键调节因子,当β-catenin 水平低下时,Wnt信号通路关闭,反之,Wnt 通路开启。本研究发现,在空白组大鼠子宫内膜组织中β-catenin低表达,E-cadherin、MMP-9的表达水平和活性相对较低,可能与Wnt经典信号通路处于关闭状态有关;而在模型组E-cadherin、MMP-9表达水平明显升高,可能与子宫内膜病理性损伤后,激活β-catenin的表达,Wnt经典信号通路开启相关。本研究结果表明,Wnt/β-catenin信号通路上的关键因子β-catenin及下游靶基因MMP-9可能参与了薄型子宫内膜的发生机制。β-catenin 是黏附分子复合体结构中的重要组成部分,在介导细胞间黏附、维持血管通透性方面有着不可忽视的作用[16]。E-cadherin是一种分布在上皮组织中的典型钙依赖型细胞表面跨膜糖蛋白[17],是以同种分子间“拉链”式结合的形式介导细胞黏附,主要分布在细胞周边尤其是细胞与细胞的连接处,维持上皮组织正常的形态[18],并通过与联蛋白相互作用,调节细胞的分化、增殖、凋亡以及信号转导[19]。MMP-9是MMPs家族中相对分子质量最大的一种明胶酶,可通过调节细胞外基质的合成和分解而影响细胞与基质之间、细胞与细胞之间的生物信号传递,参与降解细胞外基质成分的降解,进而调节细胞生长增殖、损伤修复、组织重塑,并能促进血管内皮细胞出芽,诱发新生血管形成[20-21]。
本研究选择肾阳虚薄型子宫内膜模型术后次日即给予药物进行预防性薄型子宫内膜形成的处理,这与人体子宫腔内子宫内膜创伤性手术后预防性给予雌激素促进子宫内膜的修复与生长,预防薄型子宫内膜形成及宫腔粘连发生机理极为相似。雌激素与子宫内膜细胞内特异性雌激素受体(ER)在细胞核内结合, 形成ER复合物, 激活转录通路, 增强内膜细胞内的DNA和蛋白质合成, 促进子宫内膜上皮细胞的增生[22],而高剂量雌激素的效果则相反[7]。本研究还发现,各治疗组β-catenin、E-cadherin蛋白水平与模型组比较,均明显降低,定坤丹组与联合用药组MMP-9的表达水平和空白组接近,其中,联合用药组β-catenin、E-cadherin、MMP-9蛋白水平与空白组比较,差异均无统计学意义。该结果提示,各治疗组均可不同程度修复肾阳虚薄型子宫内膜受损状况,而定坤丹与戊酸雌二醇联合用药组子宫内膜与空白对照组无差异,效果更为显著。根据本研究结果可以推测,定坤丹可能通过Wnt/β-catenin信号传导途径参与大鼠肾阳虚薄型子宫内膜的修复机制。
综上所述,本研究发现定坤丹联合戊酸雌二醇能明显促进大鼠子宫内膜损伤后子宫内膜间质、腺体的分化增殖,促进新生血管的出芽与生成,增厚子宫内膜,降低β-catenin、E-cadherin、MMP-9的表达,由此可以推测定坤丹通过Wnt/β-catenin信号传导途径来预防术后薄型子宫内膜的发生,但其具体机制还有待于进一步深入研究与验证。
Funding Statement
南京中医药大学横向课题(No. 012009023024)资助
Contributor Information
娟 郑 (Juan ZHENG), Email: zjruwu2010@qq.com.
勇 谈 (Yong TAN), Email: 1516584093@qq.com.
References
- 1.WADHWA L, FAUZDAR A, WADHWA S N An intrauterine insemination audit at tertiary care hospital: a 4½ years’ retrospective analysis of 800 intrauterine insemination cycles. J Hum Reprod Sci. 2018;11(3):279–285. doi: 10.4103/jhrs.JHRS_34_18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.ACHACHE H, REVEL A Endometrial receptivity markers, the journey to successful embryo implantation. Hum Reprod Update. 2006;12(6):731–746. doi: 10.1093/humupd/dml004. [DOI] [PubMed] [Google Scholar]
- 3.魏玉珍, 张艺宏, 杨信志, 等 小鼠子宫内膜修复模型中β-catenin、CD146的表达. 解剖学杂志. 2018;41(2):143–146. doi: 10.3969/j.issn.1001-1633.2018.02.004. [DOI] [Google Scholar]
- 4.陈镘如, 廖治 Wnt/β-catenin 信号通路对子宫内膜间质细胞的调节机制. 中国组织工程研究. 2016;20(7):1013–1018. doi: 10.3969/j.issn.2095-4344.2016.07.014. [DOI] [Google Scholar]
- 5.郁琳, 石燕, 庄梦斐, 等 定坤丹治疗子宫内膜异位症的药理作用与机制. 生殖与避孕. 2016;36(12):963–970. doi: 10.7669/j.issn.0253-357X.2016.12.0963. [DOI] [Google Scholar]
- 6.施勇, 彭丹红, 高永星, 等 补佳乐联合芬吗通及阿司匹林预防中-重度宫腔粘连HEOS冷刀术后复发的效果评价. 东南大学学报(医学版) 2019;38(5):873–876. [Google Scholar]
- 7.MALHOTRA N, BAHADUR A, KALAIVANI M, et al Changes in endometrial receptivity in women with receptivity Asherman's syndrome undergoing hysteroscopic adhesiolysis. Arch Gynecol Obstet. 2012;286(2):525–530. doi: 10.1007/s00404-012-2336-0. [DOI] [PubMed] [Google Scholar]
- 8.ZHAO J, GAO H, LI Y P Development of an animal model for thin endometrium using 95% ethanol. J Fertil in Vitro. 2012;2(4):1–3. [Google Scholar]
- 9.林继红, 杨海英 雌性大鼠肾虚模型初探. 中国比较医学杂志. 2010;20(10):78. [Google Scholar]
- 10.凌丹丹, 施晓波 17β-雌二醇及生长激素在薄型子宫内膜患者冷冻胚胎移植内膜准备中的作用. 生殖医学杂志. 2016;25(1):72–76. [Google Scholar]
- 11.MIWA I, TAMURA H, TAKASAKI A, et al Pathophysiologic features of “thin” endometrium. Fertil Steril. 2009;91(4):998–1004. doi: 10.1016/j.fertnstert.2008.01.029. [DOI] [PubMed] [Google Scholar]
- 12.CHAKRABORTY C, MITRA S, ROYCHOWDHURY A, et al Deregulation of LIMD1-VHL-HIF-1α-VEGF pathway is associated with different stages of cervical cancer. Biochem J. 2018;475(10):1793–1806. doi: 10.1042/BCJ20170649. [DOI] [PubMed] [Google Scholar]
- 13.PARIDA S, PAL I, PAREKH A, et al. GW627368X inhibits proliferation and induces apoptosis in cervical cancer by interfering with EP4/EGFR interactive signaling. Cell Death Dis, 2016, 7: e2154[2020-09-18]. https://www.nature.com/articles/cddis201661. doi: 10.1038/cddis.2016.61.
- 14.郭玉生, 冯若琳, 翁亚菡, 等 不同临床分期的子宫内膜癌患者血清VEGF、CRP水平变化情况及相关性研究. 成都医学院学报. 2018;13(1):68–70. doi: 10.3969/j.issn.1674-2257.2018.01.015. [DOI] [Google Scholar]
- 15.OLIVEIRA S L, PILLAT M M, CHEFFER A, et al Functions of neurotrophins and grown factors in neurogenesis and brain repair. Cytometry A. 2013;83(1):76–89. doi: 10.1002/cyto.a.22161. [DOI] [PubMed] [Google Scholar]
- 16.赵岚, 季洲 β-联蛋白促进大鼠外周血间充质干细胞存活及扩增. 中国生物化学与分子生物学报. 2019;35(8):880–887. [Google Scholar]
- 17.邓秀文, 邹文 E-cadherin 和 Vimentin 表达与早期宫颈癌临床病理特征及预后的关系. 临床肿瘤学杂志. 2016;21(2):160–165. [Google Scholar]
- 18.陈怡, 许红英, 王艳, 等 基质金属蛋白酶-7 和上皮钙粘素-E 在子宫腺肌症病灶及内膜的表达及意义. 临床和实验医学杂志. 2018;17(12):1289–1292. doi: 10.3969/j.issn.1671-4695.2018.12.017. [DOI] [Google Scholar]
- 19.HOFMANN G, BALIC M, DANDACHI N, et al The predictive value of serum soluble E-cadherin levels in breast cancer patients undergoing preoperative systemic chemotherapy. Clin Biochem. 2013;46(15):1585–1589. doi: 10.1016/j.clinbiochem.2013.06.010. [DOI] [PubMed] [Google Scholar]
- 20.LEE M J, YUN B S, SEONG S J, et al Uterine fibroid shrinkage after short-term use of selective progesterone receptor modulator or gonadotropin-releasing hormone agonist. Obstet Gynecol Sci. 2017;60(1):69–73. doi: 10.5468/ogs.2017.60.1.69. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.CHITTAWAR P B, KAMATH M S Review of nonsurgical/minimally invasive treatments and open myomectomy for uterine fibroids. Curr Opin Obstet Gynecol. 2015;27(6):391–397. doi: 10.1097/GCO.0000000000000223. [DOI] [PubMed] [Google Scholar]
- 22.CAI H, LI H, HE Y Interceed and estrogen reduce uterine adhesions and fibrosis and improve endometrial receptivity in a rabbit model of intrauterine adhesions. Reprod Sci. 2016;23(9):1208–1216. doi: 10.1177/1933719116632923. [DOI] [PubMed] [Google Scholar]





