Abstract
细胞衰老是细胞永久性周期阻滞,伴有多种分泌表型的发生。除促进细胞凋亡外,诱导细胞衰老是放化疗以及某些靶向药物抑制肿瘤的重要作用机制,然而细胞衰老作为细胞的自我保护性机制,在肿瘤治疗中的作用有利有弊。如何利用细胞衰老的抑瘤效应,并有效避免其可能产生的促瘤效应,提高肿瘤治疗的敏感性,防止肿瘤的复发和转移,是细胞衰老研究的重要瓶颈问题。本文旨在综述细胞衰老在肿瘤治疗中的“双刃剑”效应,对衰老细胞通过其自主性与非自主性机制影响肿瘤治疗效果的具体机制进行归纳和讨论,为提高肿瘤治疗效果提供指导,推动细胞衰老在肿瘤治疗的基础与临床应用研究。
Keywords: 肿瘤治疗, 细胞衰老, 衰老相关分泌表型, 细胞自主性机制, 细胞非自主性机制, 肿瘤微环境
Abstract
Cellular senescence is a permanent state of cell cycle arrest, combined with the acquisition of a variety of secretory phenotypes. In addition to apoptosis, the induction of cellular senescence is an important mechanism that chemo- and radiotherapies and some targeted therapies rely on to produce an anti-tumor effect. However, being a self-protective mechanism of cells, cellular senescence can produce both positive and negative effects in tumor treatment. It remains a challenge to effectively utilize the anti-tumor effect of cellular senescence while averting the pro-tumor effect. How to improve the sensitivity of tumor treatment and to prevent tumor recurrence and metastasis has become the bottleneck in cellular senescence research. We summarize in this review the “double-edged-sword” effect of cellular senescence in tumor treatment. We summarize and discuss the cell autonomous and non-autonomous mechanisms that senescent cells use to affect tumor treatment, hoping to provide information that will help improve the outcome of tumor treatment and promote further research in basic and clinical application of cellular senescence in tumor treatment.
Keywords: Tumor treatment, Cellular senescence, Senescence-associated, Secretory phenotype autonomous mechanisms, Non-autonomous mechanisms, Tumor microenvironment
细胞衰老是指细胞失去分裂能力而处于永久性的细胞周期阻滞状态;常伴有多种细胞因子表达的上调和细胞分泌能力的增强,即衰老相关分泌表型(senescence-associated secretory phenotype,SASP)[1]。与机体衰老不同,细胞衰老可以发生在发育和生长的各个阶段,是维持组织稳态、阻止损伤细胞扩增的重要机制[2]。基于其细胞周期阻滞特性,细胞衰老被认为是机体抑制肿瘤发生的重要机制。另外,凋亡和衰老同为化疗药物抑制肿瘤的重要机制,且衰老效应是凋亡效应的有益补充,是抑制凋亡耐受细胞的重要途径[3]。然而,也有数据表明,衰老是肿瘤细胞在应激条件下的适应性反应,长期存活的衰老细胞是肿瘤发生进展和转移的潜在危险因素。本文对细胞衰老的研究进展及其对肿瘤治疗的“双刃剑”效应(图1)进行系统综述,以期为改善肿瘤治疗效果提供线索和指导。
图 1.
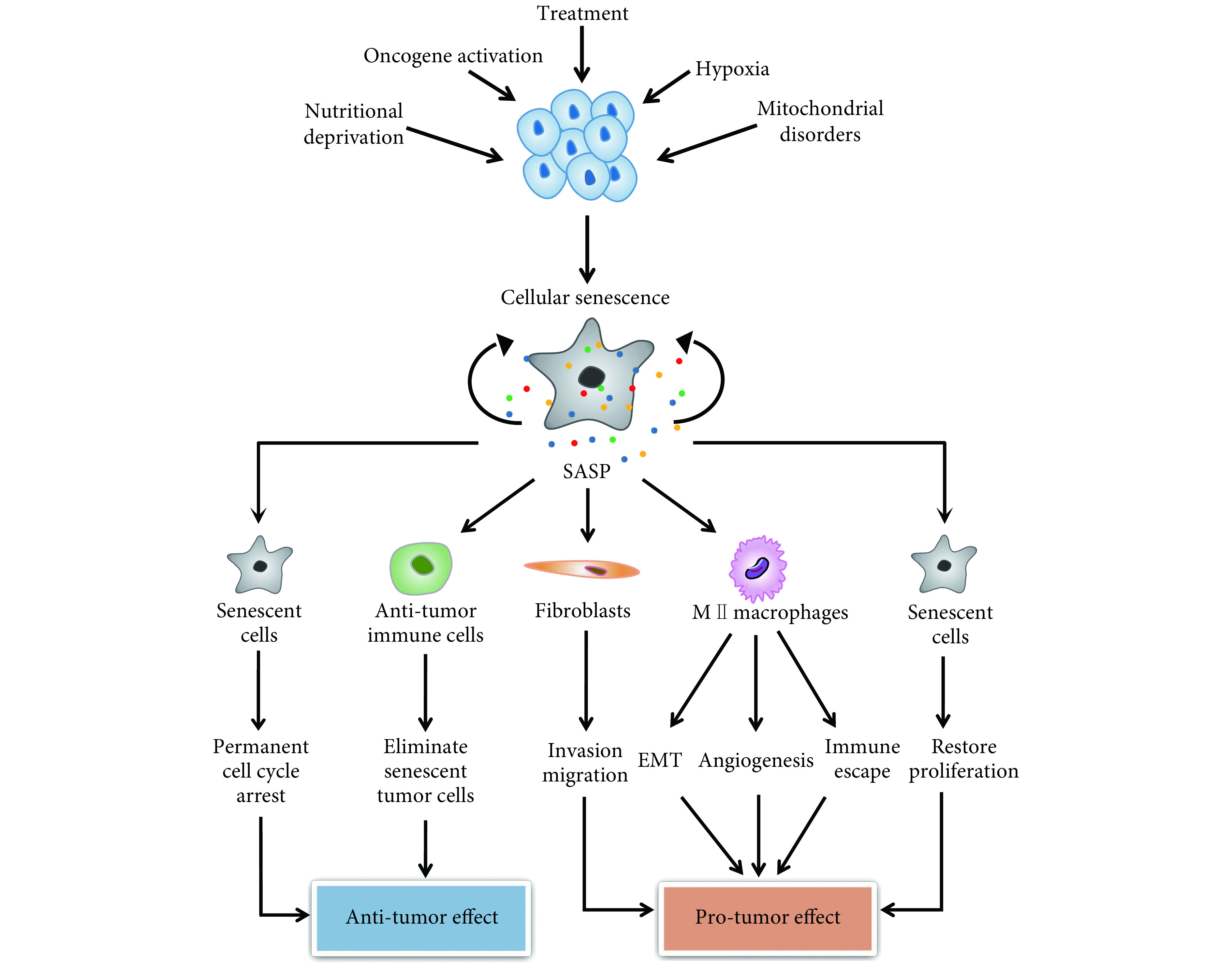
The “double-edged sword effect” of cellular senescence
细胞衰老的“双刃剑效应”
SASP: Senescence-associated secretory phenotype; EMT: Epithelial-mesenchymal transition.
1. 细胞衰老的特征和发生机制
“细胞衰老”一词最早在20世纪60年代被提出。HAYFLFLICK和MOORHEAD在培养人胚胎肺成纤维细胞时发现体外培养原代细胞经过有限次的分裂后进入永久性停滞的状态,即为“Hayflflick”极限[4],其原因是染色体末端的端粒DNA随着细胞分裂逐渐缩短[5],这种衰老也称为复制性衰老。除复制性衰老外,非端粒信号导致的早熟性衰老则可由癌基因的活化所致,即基因引起的细胞衰老(oncogene-induced senescence,OIS)[6]。一般认为,细胞内Ras、RAF或MYC等原癌基因的激活或PTEN等抑癌基因的缺失是促进细胞异常增殖、导致肿瘤发生的重要驱动因素。近年来的研究数据则显示,癌基因的异常活化以及抑癌基因的失活可诱导细胞衰老,产生抑制细胞增殖的效应。此OIS是细胞启动自我防御的重要机制[7],是抑制肿瘤发生的重要途径。其次,在临床治疗过程中,细胞处于化疗药物、氧化应激等不良环境条件刺激时,可发生基因组DNA损伤,进而造成细胞周期阻滞和衰老,称为治疗引起的细胞衰老(therapy-induced senescence,TIS)[8-9]。此外,营养剥夺、缺氧以及线粒体失调等因素也是导致早熟性衰老的重要原因。
衰老一旦发生,细胞将发生形态学和生物化学的特征性改变,如由于细胞骨架的重排而造成细胞形态扁平、体积增大;β-半乳糖苷酶活性上调;细胞周期阻滞于G1期;细胞周期相关调控基因,如p53、p21以及p16等表达升高等[10]。最近研究还显示,核纤层蛋白B1(Lamin B1)在细胞衰老过程中表达量下降也是细胞衰老重要的特异性分子标志[2]。此外,细胞代谢和表观遗传重编程也是衰老细胞的重要生化特征[11]。
2. 细胞衰老:肿瘤治疗中的“双刃剑”
细胞衰老可通过细胞自主性(cell autonomous)和细胞非自主性(cell non-autonomous)机制影响肿瘤治疗效果[12]。细胞内癌基因的过表达及抑癌基因的失活或衰老细胞合成并分泌的多种SASP因子以自分泌方式作用于肿瘤细胞自身,影响细胞衰老进程,即为细胞自主性机制[12]。而衰老细胞以旁分泌来调节周围其他细胞组分的方式则是细胞非自主性机制[13-14]。值得注意的是,由于肿瘤细胞所处生理环境的特殊性及机体环境的复杂性,肿瘤细胞自主性和非自主性机制对细胞衰老的调控表现出多种生物学效应,对肿瘤的发生和化疗效果产生综合性影响[15],可导致促瘤或抑瘤两种截然相反的效应[16]。因此,我们将从肿瘤细胞自主性和非自主性机制两方面对细胞衰老影响肿瘤治疗的“双刃剑”效应进行综述。
2.1. 细胞自主性机制及效应
2.1.1. 细胞自主性机制导致的抑瘤效应
单就衰老的肿瘤细胞不再增殖分裂的特性而言,细胞衰老是放化疗发挥抑瘤效应的重要机制。BIAN等[17]研究发现,通过转化生长因子-β(TGF-β)可诱导头颈部鳞状肿瘤细胞衰老,进而抑制肿瘤的进展。此外,传统放化疗以及部分分子靶向治疗也可导致细胞衰老,并可对肿瘤发挥重要的抑制效应。例如,泛素样蛋白NEDD8激活酶的小分子抑制剂MLN4924(pevonedistat)在肺癌、结肠癌等多种恶性肿瘤中通过诱导细胞衰老抑制肿瘤[18]。还有研究显示细胞衰老可抵抗癌基因过表达或抑癌基因失活诱导的细胞损伤,是一种强大的抗肿瘤生理机能[19-20]。可见,虽然诱导细胞衰老是一种细胞自我保护反应,但基于其永久性周期阻滞特性,其对于肿瘤的发生与发展却可发挥重要的自主性抑制作用。
除此之外,SASP是衰老细胞的重要特征,也是影响肿瘤治疗效果的重要因素。SASP成份复杂,包括炎性细胞因子、蛋白酶、生长因子等多种分泌性因子。SASP的组分因衰老诱导因素、衰老刺激强度和刺激时间,以及细胞种类不同而异。SASP因子既可反作用肿瘤细胞自身(自分泌效应),又可作用于肿瘤微环境(tumor microenvironment,TME)(旁分泌效应),引起多种、甚至相反的生物学效应[3]。有研究表明SASP可通过自分泌扩大和加强细胞衰老信号,对肿瘤的治疗发挥正反馈衰老促进作用。例如,我们最近研究发现,在化疗诱导的细胞衰老过程中,NF-κB激活肿瘤细胞中SASP核心因子,白细胞介素-6(IL-6)及白细胞介素-8(IL-8)的表达,这些因子可以反作用于肿瘤细胞,促进p21的表达,进而促进肿瘤细胞衰老进程,提高化疗药物的抑瘤效应[21]。与我们的研究结果一致,多个独立研究先后揭示了IL-6和IL-8通过自分泌机制促进细胞衰老的作用[22-24]。也有研究发现纤溶酶原激活抑制剂-1(PAI-1)可通过抑制生长因子介导的有丝分裂信号,引起肿瘤细胞周期阻滞的作用[25]。
2.1.2. 细胞自主性机制导致的促瘤效应
然而,基于其成份的复杂性,SASP所产生的自分泌效应也可导致化疗耐受[26]。例如,LOUISE等[27]研究发现,乳腺癌细胞向胞外分泌的丛生蛋白(clusterin,CLU),该蛋白通过自分泌的方式作用于肿瘤细胞自身,发挥促进肿瘤细胞化疗耐药和转移的作用。又有研究表明,衰老的肿瘤细胞分泌IL-6,其以自分泌的方式激活肿瘤细胞内Akt信号通路,进而促进肿瘤细胞化疗耐药[28]。促凝乳酶D也可通过自分泌的方式影响细胞内PI3/Akt信号通路,促进肿瘤细胞化疗耐药和抗凋亡,进而促进肿瘤细胞生长[29]。且长期培养的衰老细胞,由于其周围微环境的高度复杂性,可成为肿瘤复发和转移的潜在危险因素。的确,研究发现,有少部分衰老细胞在长期培养过程中有可能恢复其增殖特性,进而促进肿瘤进展[30]。SASP因子组分复杂性是导致SASP “双刃剑”作用重要原因,而同一细胞因子对肿瘤细胞衰老的不同调控作用则体现了细胞来源及衰老诱导条件对其最终效应的影响。如何利用SASP的抑瘤效应,避免其可能的促瘤效应是目前该领域尚未解决的重要难题。
2.2. 细胞非自主性机制及效应
SASP除了具有自分泌效应外,也可通过旁分泌效应影响肿瘤微环境。肿瘤微环境是由肿瘤细胞、成纤维细胞、免疫细胞、细胞外基质、细胞外蛋白因子、血管、内皮细胞等多种组分组成[31]。这些组分在肿瘤细胞发生、转移、化疗耐药及肿瘤的抑制等多种过程具有重要的调节作用[32]。近年来,肿瘤微环境的重要性及在肿瘤治疗中的作用备受关注,肿瘤与其生存微环境之间既相互促进,相互依存,又相互抑制,相互拮抗。随着肿瘤分子与细胞生物学的不断发展,肿瘤与其微环境互作研究不断深入,肿瘤微环境已经成为当今肿瘤生物学研究的热点领域。
2.2.1. 非细胞自主性机制导致的抑瘤效应
已经有研究结果表明,肿瘤微环境中SASP因子能招募多种免疫细胞,清除发生衰老的肿瘤细胞,进而抑制肿瘤细胞的生长。
衰老的肿瘤细胞会向微环境中分泌IL-6、IL-8和胰岛素样生长因子结合蛋白7( IGFBP7),驱动促炎反应的发生。这些因子可招募T淋巴细胞等免疫细胞到肿瘤发生部位,免疫细胞进一步识别并清除衰老细胞和肿瘤细胞,抑制肿瘤生长,防止发生肿瘤进展[33]。另有研究发现,在小鼠肝细胞中表达突变的RAS基因,可导致细胞衰老,相关SASP因子招募免疫细胞,发挥抑瘤效应。在CD4+T细胞缺失的小鼠体内,RAS基因的异常激活则可加速肝细胞癌的发生[34]。
肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs)是大量存在于肿瘤微环境中的一类免疫细胞,约占肿瘤微环境中免疫细胞的50%[35]。研究发现,衰老的肿瘤细胞可分泌集落刺激因子-1(CSF-1)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等SASP因子,这些因子具有招募单核细胞至肿瘤微环境,并促进其分化为巨噬细胞的作用[36]。肿瘤微环境中的巨噬细胞可大体分为:MⅠ型巨噬细胞和MⅡ型巨噬细胞[37]。其中MⅠ型巨噬细胞可以分泌大量蛋白酶等SASP因子,进而发挥抗肿瘤的特性。因此,GM-CSF等多种SASP因子可通过招募并促进巨噬细胞分化的作用抗肿瘤。
总之,肿瘤微环境中的SASP因子有望成为特异性抗肿瘤的“天然靶向药物”,这些“药物”在肿瘤微环境中与免疫细胞相互作用,抑制肿瘤细胞的增殖,防止化疗耐药,起到“抗肿瘤”的作用。
2.2.2. 非细胞自主性机制导致的促瘤效应
衰老细胞释放的SASP因子,亦能发挥促肿瘤的作用,且参与肿瘤细胞侵袭、转移、化疗耐药及免疫逃逸等多种过程。首先,SASP因子可通过促进上皮-间质转化(EMT)促进肿瘤的迁徙和转移。EMT是一个进化上极其保守特征,在机体中参与组织重塑、伤口愈合及调控胚胎发育等重要生命过程[38]。而在肿瘤治疗的过程中,EMT可赋予肿瘤细胞更强的侵袭性,促进肿瘤的不良进展。研究发现,衰老细胞向肿瘤微环境中释放IL-6和IL-8等SASP因子,可诱导上皮-间质转化的发生,进而发挥促进转移和侵袭的作用[39-40]。MⅠ型巨噬细胞具有抑瘤的活性,MⅡ型巨噬细胞的作用与MⅠ型巨噬细胞截然相反,具有重要的促瘤效应,且肿瘤微环境中的巨噬细胞多为MⅡ型巨噬细胞,因而也被称为肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs)。研究发现,衰老的肿瘤细胞通过SASP招募肿瘤微环境中的TAMs,TAMs分泌的趋化因子-18(CCL-18)进一步促进乳腺癌细胞的侵袭和转移[41];也有研究表明衰老的肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)可合成并分泌大量的IL-6等SASP因子,进而促进胰腺癌的侵袭和转移[42],提示衰老的CAFs也通过SASP参与调控肿瘤的侵袭和转移。
实体瘤内部的氧气含量低于机体正常组织,且常常处于营养缺乏状态,而肿瘤微环境中的SASP因子可通过促进血管和淋巴管的生成,为肿瘤细胞提供生存所需的氧气和营养物质,进而促进肿瘤的生长和转移。在缺氧肿瘤部位,TAMs产生血管内皮生成因子(VEGF)等因子,促进血管或者淋巴管的生成,保证氧气和营养物质的运输,进而促进肿瘤的生长[43-44]。
机体内免疫系统是抵御肿瘤细胞生长的重要屏障,利用自身的免疫系统,通过调整免疫功能,改善免疫应答,可以控制肿瘤的生长。然而肿瘤微环境中的部分SASP因子可促进肿瘤细胞逃避免疫监视。研究发现衰老肿瘤细胞招募的TAMs可分泌TGF-β,降低细胞毒性T细胞杀伤肿瘤细胞的能力,促进免疫抑制和免疫逃逸的发生[45]。TAMs也可以产生白介素-10(IL-10)等SASP因子,刺激程序性细胞死亡配体1(PD-L1)的表达,抑制细胞毒性T淋巴细胞的抗肿瘤活性,从而发生免疫抑制效应[46]。
3. 细胞衰老与临床治疗
值得关注的是,化疗后的肿瘤患者,其瘤内可检测到大量衰老细胞,并且细胞衰老的发生与患者良好预后相关[47-48]。动物实验结果也显示,p53依赖性细胞衰老功能的缺陷可导致肿瘤的发生和化疗耐受[49]。可见,细胞衰老是肿瘤发生和化疗耐受的天然生理屏障。近年来,美国食品和药品管理局(Food and Drug Administration,FDA)批准上市的Abemaciclib及Palbociclib等多种CDK4/6抑制剂,作为衰老诱导化合物可用于乳腺癌和非小细胞肺癌等多种恶性肿瘤的临床化疗,且展现出较好的治疗效果[50]。因此,细胞衰老是抑制肿瘤发生与发展的重要屏障,“促衰老”疗法也是颇具前景的抑瘤治疗方案。
近年来也有大量的研究致力于新提出的“衰老疗法”(Senotherapies)[51],该疗法首先通过放、化疗快速诱导肿瘤细胞发生衰老发挥抑瘤效应,再通过辅助药物清除衰老的细胞,抑制衰老细胞释放SASP因子,有效避免衰老细胞可能产生的促瘤效应[52]。进一步通过动物实验研究发现,清除小鼠体内衰老细胞能明显抑制肿瘤的形成。另有研究表明,酪氨酸激酶抑制剂达沙替尼(Dasatinib)联合植物中提取的类黄酮化合物槲皮素能有效清除衰老的细胞,且该方法在体外实验和小鼠实验中均取得了较好的结果,目前已经进入Ⅱ期临床研究阶段,被认为是最具前景的干预衰老疗法[53- 54]。目前大量已研发的药物在临床前试验阶段表现出了良好的疗效,相信随着对细胞衰老研究的深入,干预肿瘤细胞衰老疗法有望成为肿瘤治疗的重要手段。
4. 总结
综上所述,诱导肿瘤细胞衰老对肿瘤的治疗具有重要意义,并同时具有促进肿瘤转移和耐药的不良作用,因此细胞衰老是一把“双刃剑”,对肿瘤治疗效果有利有弊。在今后的研究中,以细胞衰老、SASP及肿瘤微环境的相互作用机制为靶点,扬长避短,进一步深入探究不同的肿瘤细胞衰老的类型、具体的分子机制以及与免疫微环境的关系,将对精确治疗肿瘤,抵御化疗耐药性、降低化疗药物对机体的毒副作用、提高肿瘤治疗效果具有重要的意义。随着大数据研究、生物信息学、各种组学研究及高通量测序等相关技术学科的不断完善与发展,可使我们更加充分地了解肿瘤细胞衰老的分子特征,为肿瘤治疗寻找新的靶点,进一步创新多种方法靶向治疗肿瘤,开发更多科学化的肿瘤治疗方案,使肿瘤的治疗更加精准。
Funding Statement
国家自然科学基金(No. 31301131)资助
Contributor Information
皓 刘 (Hao LIU), Email: 2315487514@qq.com.
颖 胡 (Ying HU), Email: huying@hit.edu.cn.
References
- 1.KUILAMN T, PEEPER D S Senescence-messaging secretome: SMS-ing cellular stress. Nat Rev Cancer. 2009;9(2):81–94. doi: 10.1038/nrc2560. [DOI] [PubMed] [Google Scholar]
- 2.HERNANDEZ-SEGURA A, NEHME J, DEMARIA M Hallmarks of cellular senescence. Trends Cell Biol. 2018;28(6):436–453. doi: 10.1016/j.tcb.2018.02.001. [DOI] [PubMed] [Google Scholar]
- 3.ACOSTA J C, GIL J Senescence: a new weapon for cancer therapy. Trends Cell Biol. 2012;22(4):211–219. doi: 10.1016/j.tcb.2011.11.006. [DOI] [PubMed] [Google Scholar]
- 4.HAYFLFLICK L, MOORHEAD P S The serial cultivation of human diploid cell strains. Exp Cell Res. 1961;25:585–621. doi: 10.1016/0014-4827(61)90192-6. [DOI] [PubMed] [Google Scholar]
- 5.HARLEY C B, FUTCHER A B, GREIDER C W Telomeres shorten during ageing of human fibroblasts. Nature. 1990;345(6274):458–460. doi: 10.1038/345458a0. [DOI] [PubMed] [Google Scholar]
- 6.SHARPLESS N E, SHERR C J Forging a signature of in vivo senescence . Nat Rev Cancer. 2015;15(7):397–408. doi: 10.1038/nrc3960. [DOI] [PubMed] [Google Scholar]
- 7.LEE S, LEE J S Cellular senescence: a promising strategy for cancer therapy. BMB Rep. 2019;52(1):35–41. doi: 10.5483/BMBRep.2019.52.1.294. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.JUSTYNA M P, ARKADIUSZ N, PAWEL U, et al. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cell Mol Life Sci, 2020, 77(2): 213-229[2020-11-14]. https://pubmed.ncbi.nlm.nih.gov/31414165. doi: 10.1007/s00018-019-03261-8.
- 9.TAREQ S, SARAH B, VALERIE J C, et al Therapy-induced senescence: an “old” friend becomes the enemy. Cancers (Basel) 2020;12(4):822[2020-11-14]. https://doi.org/10.3390/cancers12040822. doi: 10.3390/cancers12040822. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.HE S, SHARPLESS N E Senescence in health and disease. Cell. 2017;169(6):1000–1011. doi: 10.1016/j.cell.2017.05.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.NAKAO M, TANAKA H , KOGA T Cellular senescence variation by metabolic and epigenomic remodeling. Trends Cell Biol. 2020;30(12):919–922. doi: 10.1016/j.tcb.2020.08.009. [DOI] [PubMed] [Google Scholar]
- 12.DI MITRI D, ALIIMONTI A Non-cell-autonomous regulation of cellular senescence in cancer. Trends Cell Biol. 2016;26(3):215–226. doi: 10.1016/j.tcb.2015.10.005. [DOI] [PubMed] [Google Scholar]
- 13.SALEH T, TYUTYNUK-MASSEY L, CUDJOE E K, Jr, et al. Non-cell autonomous effects of the senescence-associated secretory phenotype in cancer therapy. Front Oncol, 2018, 8: 164[2020-11-15]. https://www.frontiersin.org/articles/10.3389/fonc.2018.00164/full.
- 14.HERRANZ N, GIL J Mechanisms and functions of cellular senescence. J Clin Invest. 2018;128(4):1238–1246. doi: 10.1172/JCI95148. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.PÉREZ-MANCERA P A, YOUNG A R J, NARITA M Inside and out: the activities of senescence in cancer. Nat Rev Cancer. 2014;14(8):547–558. doi: 10.1038/nrc3773. [DOI] [PubMed] [Google Scholar]
- 16.RAO S G, JACKSON J G. SASP: tumor suppressor or promoter? Yes! Trends Cancer, 2016, 2(11): 676–687.
- 17.BIAN Y, HALL B, SUN Z J, et al Loss of TGF‐beta signaling and PTEN promotes head and neck squamous cell carcinoma through cellular senescence evasion and cancer‐related inflammation. Oncogene. 2012;31(28):3322–3332. doi: 10.1038/onc.2011.494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.ZHOU L S, ZHANG W J, SUN Y, et al Protein neddylation and its alterations in human cancers for targeted therapy. Cell Signal. 2018;44:92–102. doi: 10.1016/j.cellsig.2018.01.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.COLLADO M Exploring a ‘pro-senescence’ approach for prostate cancer therapy by targeting PTEN. Future Oncol. 2010;6(5):687–689. doi: 10.2217/fon.10.39. [DOI] [PubMed] [Google Scholar]
- 20.NARDELLA C, CLOHESSY J G, ALIMONTI A, et al Pro-senescence therapy for cancer treatment. Nat Rev Cancer. 2011;11(7):503–511. doi: 10.1038/nrc3057. [DOI] [PubMed] [Google Scholar]
- 21.LI H Y, ZHANG W X, ZHAO K M, et al A previously identified apoptosis inhibitor iASPP confers resistance to chemotherapeutic drugs by suppressing senescence in cancer cells. J Biol Chem. 2020;295(12):4049–4063. doi: 10.1074/jbc.RA119.011411. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.KANSARA M, LEONG H S, LIN D M, et al Immune response to RB1-regulated senescence limits radiation-induced osteosarcoma formation. J Clin Invest. 2013;123(12):5351–5360. doi: 10.1172/JCI70559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.ACOSTA J C, O’LOGHLEN A, BANITO A, et al Chemokine signaling via the CXCR2 receptor reinforces senescence. Cell. 2008;133(6):1006–1018. doi: 10.1016/j.cell.2008.03.038. [DOI] [PubMed] [Google Scholar]
- 24.KUILMAN T, MICHALOGLOU C, VREDEVELD L C W, et al Oncogene-induced senescence relayed by an interleukin-dependent inflammatory network. Cell. 2008;133(6):1019–1031. doi: 10.1016/j.cell.2008.03.039. [DOI] [PubMed] [Google Scholar]
- 25.ELZI D J, LAI Y, SONG M, et al Plasminogen activator inhibitor 1-insulin-like growth factor binding protein 3 cascade regulates stress-induced senescence. Proc Natl Acad Sci U S A. 2012;109:12052–12057. doi: 10.1073/pnas.1120437109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.GIOVANNA B, RAFFAELLA P, MASSIMO D Autocrine mechanisms of cancer chemoresistance. Semin Cell Dev Biol. 2018;78:3–12. doi: 10.1016/j.semcdb.2017.07.019. [DOI] [PubMed] [Google Scholar]
- 27.FLANAGAN L, WHYTE L,CHATTERJEE N, et al Effects of clusterin over-expression on metastatic progression and therapy in breast cancer. BMC Cancer. 2010;10:107[2020-11-15]. https://doi.org/10.1186/1471-2407-10-107. doi: 10.1186/1471-2407-10-107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.CHEN H Y, LIN L T, WANG M L, et al Musashi-1 regulates AKT-derived IL-6 autocrinal/paracrinal malignancy and chemoresistance in glioblastoma. Oncotarget. 2016;7(27):42485–42501. doi: 10.18632/oncotarget.9890. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.VETVICK V, FUSEK M , VASHISHTA A Procathepsin D involvement in chemoresistance of cancer cells. North Am J Med Sci. 2012;4(4):174–179. doi: 10.4103/1947-2714.94943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.LEE S, SCHMITT C A The dynamic nature of senescence in cancer. Nat Cell Biol. 2019;21(1):94–101. doi: 10.1038/s41556-018-0249-2. [DOI] [PubMed] [Google Scholar]
- 31.DOUGLAS H, ROBERT A W Hallmarks of cancer: the next generation. Cell. 2011;144:646–674. doi: 10.1016/j.cell.2011.02.013. [DOI] [PubMed] [Google Scholar]
- 32.YANG L V Tumor microenvironment and metabolism. Int J Mol Sci. 2017;18(12):2729[2020-11-15]. https://doi.org/10.3390/ijms18122729. doi: 10.3390/ijms18122729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.TERLECKI Z L, LAMMERMANN I, LATREILLE J, et al Small extracellular vesicles and their miRNA cargo are anti-apoptotic members of the senescence-associated secretory phenotype. Aging. 2018;10:1103–1132. doi: 10.18632/aging.101452. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.KANG T W, YEVSA T, WOLLER N, et al Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 2011;479:547–551. doi: 10.1038/nature10599. [DOI] [PubMed] [Google Scholar]
- 35.CHANMEE T, ONTONG P, KONNO K, et al Tumor-associated macrophages as major players in the tumor microenvironment. Cancers (Basel) 2014;6(3):1670–1690. doi: 10.3390/cancers6031670. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.WANG H, SHAO Q, SUN J, et al Interactions between colon cancer cells and tumor-infiltrated macrophages depending on cancer cell-derived colony stimulating factor 1. Oncoimmunology. 2016;5:e1122157[2020-11-15]. https://doi.org/10.1080/2162402X.2015.1122157. doi: 10.1080/2162402X.2015.1122157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.HUME D A The many alternative faces of macrophage activation. Front Immunol. 2015;6:370[2020-11-15]. https://doi.org/10.3389/fimmu.2015.00370. doi: 10.3389/fimmu.2015.00370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.MIR M F, NATHAN D S, SYED M A, et al Convergence of therapy-induced senescence (TIS) and EMT in multistep carcinogenesis: current opinions and emerging perspectives. Cell Death Discov. 2020;6:51[2020-11-15]. https://doi.org/10.1038/s41420-020-0286-z. doi: 10.1038/s41420-020-0286-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.COPPE J P, PATIL C K, RODIER F, et al Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 2008;6(12):2853–2868. doi: 10.1371/journal.pbio.0060301. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.ORTIZ-MONTERO P, LONDOÑO-VALLEJO A, VERONT J P Senescence-associated IL-6 and IL-8 cytokines induce a self- and cross-reinforced senescence/inflammatory milieu strengthening tumorigenic capabilities in the MCF-7 breast cancer cell line. Cell Commun Signal. 2017;15(1):17[2020-11-15]. https://doi.org/10.1186/s12964-017-0172-3. doi: 10.1186/s12964-017-0172-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.CHEN J, YAO Y, GONG C, et al CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3. Cancer Cell. 2011;19:541–555. doi: 10.1016/j.ccr.2011.02.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.YAMAO T, YAMASHITA Y I, YAMAMURA K, et al Cellular senescence, represented by expression of caveolin-1, in cancer-associated fibroblasts promotes tumor invasion in pancreatic cancer. Ann Surg Oncol. 2019;26(5):1552–1559. doi: 10.1245/s10434-019-07266-2. [DOI] [PubMed] [Google Scholar]
- 43.QIAN B Z, POLLARD J W Macrophage diversity enhances tumor progression and metastasis. Cell. 2010;141:39–51. doi: 10.1016/j.cell.2010.03.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.YANG H, KIM C, KIM M J, et al Soluble vascular endothelial growth factor recepter-3 surpresses lymphangiogenesis and lymphatic metastasis in bladder cancer. Mol Cancer. 2011;10:36[2020-11-15]. https://doi.org/10.1186/1476-4598-10-36. doi: 10.1186/1476-4598-10-36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.LI L, YANG L, WANG L, et al Impaired T cell function in malignant pleural effusion is caused by TGF-β derived predominantly from macrophages. Int J Cancer. 2016;139(10):2261–2269. doi: 10.1002/ijc.30289. [DOI] [PubMed] [Google Scholar]
- 46.KUANG D M, ZHAO Q, PENG C, et al Activated monocytes in peritumoralstroma of hepatocellular carcinoma foster immune privilege and disease progression through PD-L1. J Exp Med. 2009;206:1327–1337. doi: 10.1084/jem.20082173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.SARETZKI G Cellular senescence in the development and treatment of cancer. Curr Pharm Des. 2010;16(1):79–100. doi: 10.2174/138161210789941874. [DOI] [PubMed] [Google Scholar]
- 48.CHILDS B G, BAKER D J, KIRKLAND J L, et al Senescence and apoptosis: dueling or complementary cell fates? EMBO Rep. 2014;15(11):1139–1153. doi: 10.15252/embr.201439245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.SCHMITT C A, FRIDMAN J S, YANG M, et al A senescence program controlled by p53 and p16INK4a contributes to the outcome of cancer therapy. Cell. 2002;109(3):335–346. doi: 10.1016/S0092-8674(02)00734-1. [DOI] [PubMed] [Google Scholar]
- 50.SIEBEN C J, STURMLECHNER I, VAN DE SLUIS B, et al Two-step senescence-focused cancer therapies. Trends Cell Biol. 2018;28(9):723–737. doi: 10.1016/j.tcb.2018.04.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.VAN DEURSEN J M Senolytic therapies for healthy longevity. Science. 2019;364(6441):636–637. doi: 10.1126/science.aaw1299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.WYLD L, BELLANTUONO I, TCHKONIA T, et al Senescence and cancer: a review of clinical implications of senescence and senotherapies. Cancers (Basel) 2020;12(8):2134[2020-11-15]. https://doi.org/10.3390/cancers12082134. doi: 10.3390/cancers12082134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.XU M, PIRTSKHALAVA T, FARR J N, et al Senolytics improve physical function and increase lifespan in old age. Nat. Med. 2018;24:1246–1256. doi: 10.1038/s41591-018-0092-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.ZHU Y, TCHKONIA T, PIRTSKHALAVA T, et al The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015;14:644–658. doi: 10.1111/acel.12344. [DOI] [PMC free article] [PubMed] [Google Scholar]


