Abstract
目的
明确腺病毒55型(HAdV-55)对人肠道细胞的感染性。
方法
体外培养人结直肠腺癌细胞Caco-2,以HAdV-3、7、14和55感染,免疫荧光法检测感染细胞内病毒蛋白的表达,荧光定量PCR方法检测不同时间点细胞内和上清中病毒DNA水平,采用腺病毒敏感细胞株HEp-2感染实验检测Caco-2细胞上清中感染性病毒颗粒水平。
结果
免疫荧光检测结果显示,感染48 h后,Caco-2细胞内HAdV-55病毒蛋白表达为阳性。HAdV-3、7、14、55在Caco-2细胞内均能持续复制和增殖,感染细胞内和上清中病毒DNA水平随感染时间的增加而升高,并且HAdV-55病毒DNA水平明显高于HAdV-3、7和14型。Caco-2上清中HAdV-55感染性病毒颗粒高于HAdV-3、7和14,差异有统计学意义(P<0.05)。采用低剂量病毒〔1×半数组织培养感染剂量(TCID50)〕感染Caco-2细胞,HAdV-55感染孔细胞病变效应(CPE)比HAdV-3、7和14感染孔细胞显著。
结论
人呼吸道病毒HAdV-55对肠道细胞易感,感染水平高于其他常见的呼吸道感染腺病毒3、7和14型。
Keywords: 呼吸道病毒, 腺病毒55型, 肠道细胞, 感染性, 致细胞病变效应
Abstract
Objective
To examine the infectivity of human adenovirus type 55 (HAdV-55) in human intestinal cells.
Methods
Caco-2 cells were cultured in vitro, and infected with HAdV-3, 7, 14 and 55. The expression of viral proteins in infected cells was detected with immunofluorescence method. The intracellular and supernatant viral DNA levels were determined with fluorescent quantitative PCR at different points of time. The level of infectious virus particles in the supernatant of Caco-2 cells was determined with adenovirus sensitive HEp-2 infection assay.
Results
Immunofluorescence assay showed positive result for the expression of HAdV-55 virus protein in Caco-2 cells 48 h post infection. HAdV-3, 7, 14, and 55 showed sustained replication and proliferation in Caco-2 cells. The level of viral DNA in infected cells and the supernatant increased with the infection time, and the viral DNA level of HAdV-55 was significantly higher than those of HAdV-3, 7 and 14. The infectious virus particles of HAdV-55 in Caco-2 supernatant were more than those of HAdV-3, 7 and 14, showing statistically significant difference (P<0.05). Caco-2 cells were infected with low doses of virus (1×TCID50), and the cytopathic effect (CPE) of HAdV-55 infection wells was more significant than that of HAdV-3, 7 and 14 infection wells.
Conclusion
This study found that human intestinal cells were susceptible to HAdV-55, and the infection level was higher than that of other common respiratory infections caused by adenovirus types 3, 7 and 14.
Keywords: Adenovirus, Type 55, Intestinal cell, Infectivity, Cytopathic effect
腺病毒是引起人呼吸道感染的主要病原体之一,感染人的腺病毒分为A~G 7个血清学组。人腺病毒(HAdV)目前已发现有100多个亚型别( http://hadvwg.gmu.edu/),HAdV感染的临床表现主要包括发烧、呼吸系统疾病、肠胃炎和结膜炎,在免疫功能低下的患者中,可能导致呼吸衰竭、弥漫性感染、出血性膀胱炎、神经系统疾病以及死亡[1-2]。在我国引起呼吸系统感染的腺病毒主要有3、7、11、14、55型等,引起肠道感染的主要有40和41型,但也有HAdV-3、7等其他型别腺病毒引起腹泻的报道[3-4]。
腺病毒55型(HAdV-55)由HAdV-11和14型重组而来[5]。自2006年首次报道以来,HAdV-55感染在我国时有发生,目前已有15个省(市、自治区和直辖市)分离出HAdV-55病毒[6]。2016−2019年,在西藏、云南和四川等地区的军营中每年都有HAdV-55感染病例的发生,规模较大时可引起数百名士兵的感染[7-8]。最近流行的HAdV-55毒株具有高度的基因组同源性,但也发现了一些可能影响感染性和传播性的基因突变[9]。我们前期对四川、西藏等地分离培养的毒株基因序列进行了分子进化分析,发现HAdV-55基因序列相对稳定,在十几年的流行期间仅发生了个别位点的基因突变[8,10]。HAdV-55主要引起呼吸系统感染,典型症状为发热、咳嗽、咽痛,约半数患者可发展为肺炎[11],2019年报道了中国安徽一宗HAdV-55引起的致命性急性呼吸道家庭聚集感染病例,其中一位55岁的感染者死亡[12]。目前尚未见HAdV-55引起腹泻的临床报道,也未见HAdV-55对肠道细胞感染性的相关研究报道。本研究主要以人结直肠腺癌细胞Caco-2为模型,探讨HAdV-55对肠道细胞的感染性,分析HAdV-55的感染特性,并为开发口服疫苗提供参考。
1. 材料与方法
1.1. 实验材料
人喉癌上皮细胞HEp-2、人结直肠腺癌细胞Caco-2购自中国科学院典型培养物保藏委员会细胞库。GIBCO胎牛血清(FBS)、DMEM、1640培养基、青/链霉素、AP标记山羊抗小鼠IgG购自赛默飞世尔科技(中国)有限公司;Alexa Fluor 488标记山羊抗小鼠IgG购自上海碧云天生物技术有限公司;病毒RNA/DNA提取试剂盒、One Step qRT-PCR Kit (Probe)购自天根生化科技(北京)有限公司;引物和探针由上海生工生物工程有限公司合成。
腺病毒毒株HAdV-3、7、14、55均分离自感染者咽拭子标本,咽拭子标本均采集自部队上呼吸道感染病例,采用细胞分离培养法在生物安全2级实验室进行毒株分离培养,具体方法为:接种HEp-2细胞于24孔板,待细胞密度达到70%,弃去细胞培养基,以PBS洗涤细胞3次,加入含2%FBS的DMEM培养基300 μL及咽拭子标本150 μL,37 ℃、体积分数为5%CO2饱和湿度培养箱中孵育6 h,更换为500 μL含2%FBS的DMEM培养基,逐日观察细胞病变情况。当75%以上的细胞出现病变时,收集上清,利用型特异性引物通过荧光定量PCR方法进行病毒鉴定,连续培养3代后分装保存,以Reed-Muench法计算病毒对HEp-2细胞的半数组织培养感染剂量(TCID50),以荧光定量PCR方法定量病毒拷贝数。所用引物和探针如下(5′-3′),HAdV-3F:GGGAGACAATATTACTAAAGAAGGTTTGC;HAdV-3R:CAACTTGAGGCTCTGGCTGATA;HAdV-3P:FAM-CACTAC“T*”GAAGGAGAAGAAAAGCCCATTTATGCC(T*处标记BHQ1,3′末端磷酸化修饰);HAdV-7F:GAGGAGCCAGATATTGATATGGAATT;HAdV-7R:AATTGACATTTTCCGTGTAAAGCA;HAdV-7P:FAM-AAGCTGCTGACGCTTTTTCGCCTGA-BHQ1;HAdV-14F:GAAAATCATGGTGTGGAAGATGAA;HAdV-14R:CAAGCTTGGTCTCCATTTAACTGA;HAdV-14P:FAM-ACGGCATCGGTCCGCGAACA-BHQ1;HAdV-55F:CGGAGCAGCCAAATCAGAA;HAdV-55R:CATGAGTGTCTGGAGTTTCCAAAT;HAdV-55P:FAM-TGCGGCATCACAGAAAACAAACTTAAGTC-BHQ1。
1.2. 免疫荧光检测(immunofluorescent assay, IFA)抗HAdV-55小鼠血清孵育的Caco-2细胞内HAdV-55病毒蛋白的表达
抗HAdV-55小鼠血清由前期实验获取[13],简要程序为:HAdV-55在0.1%甲醛、60 ℃条件下热灭活12 h,将灭活后的腺病毒毒液与弗氏完全佐剂按体积比1∶1混合,充分乳化,皮下注射BABL/c小鼠,免疫3次,每次间隔2周,末次免疫1周后采集小鼠血清。
接种Caco-2细胞于96孔板内,接种密度1×104/孔,培养24 h后,每孔加入含HAdV-55的培养基,病毒感染量为1 MOI,6 h后,更换为不含病毒的新鲜培养液。以不感染病毒的细胞培养孔作为对照。48 h后弃去培养上清,PBS洗涤2次,加入甲醇100 μL/孔,−20 ℃固定20 min,PBS洗涤1次,加入3%BSA 100 μL/孔,室温封闭2 h;PBS洗涤1次,加入抗HAdV-55小鼠血清或对照小鼠血清(1∶200稀释)100 μL/孔,室温孵育2 h;PBS洗涤3次,加入Alexa Fluor 488标记山羊抗小鼠IgG(1∶500稀释)100 μL/孔,室温避光孵育1 h;PBS洗涤3次,荧光显微镜下观察拍照,定性观察Caco-2细胞内病毒蛋白的表达(绿色荧光为阳性)。
1.3. 细胞培养与感染
Caco-2细胞培养于含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的1640培养液,于37 ℃、体积分数为5%CO2饱和湿度培养箱中培养。
接种Caco-2细胞于48孔板内,接种密度0.5×105/孔,于37 ℃、体积分数为5%CO2饱和湿度培养箱中培养24 h,弃去培养孔内培养基,PBS洗涤细胞3次。每孔加入500 μL 含不同病毒株HAdV-3、7、14、55的2%FBS 1640培养基,用感染复数(multiplicity of infection, MOI)为1的病毒量(即1 MOI)感染细胞,感染后6 h,更换为不含病毒的新鲜培养液,感染后不同时间点(1 d、3 d、5 d)收集细胞和上清,通过荧光定量PCR检测病毒DNA水平。
1.4. 荧光定量PCR检测HAdV-55 DNA在细胞内的表达
采用Tiangen病毒RNA/DNA提取试剂盒提取细胞或上清液中的腺病毒DNA,具体操作参照说明书进行。建立HAdV-55 DNA检测的标准曲线,对提取的腺病毒DNA水平进行定量检测。以提取的病毒DNA为模板,采用Tiangen One Step qRT-PCR Kit (Probe)进行病毒DNA检测,反应体系为:模板5 μL、2×RT-qPCR mix 12.5 μL、Taq酶 0.5 μL、上游引物Adv-F 0.5 μL、下游引物Adv-R 0.5 μL、探针Adv-probe 0.5 μL、ddH2O 5.5 μL;反应程序为:预变性 95 ℃ 1 min,变性94 ℃ 5 s、退火55 ℃ 10 s、延伸72 ℃ 15 s,循环40次。所用引物和探针序列如下(5′-3′),Adv-F:CGGAGCAGCCAAATCAGAA;Adv-R:CATGAGTGTCTGGAGTTTCCAAAT;Adv-probe:TGCGGCATCACAGAAAACAAACTTAAGTC。
1.5. 病毒感染致细胞病变效应(cytopathic effect, CPE)检测
接种Caco-2细胞于48孔板内,接种密度0.5×105/孔,于37 ℃、体积分数为5%CO2饱和湿度培养箱中培养24 h,弃去培养孔内培养基,PBS洗涤细胞3次。每孔加入500 μL含不同病毒株的2%FBS 1640培养基,病毒感染滴度为100×TCID50和1×TCID50,感染后6 h,更换为不含病毒的新鲜培养液,持续观察细胞生长情况,72 h后倒置显微镜下观察并拍照。
1.6. 细胞上清的感染性检测
按照1.3的方法感染Caco-2细胞,感染后5 d收集细胞上清。接种腺病毒敏感细胞系HEp-2细胞于48孔板内,接种密度0.5×105/孔,于37 ℃、体积分数为5%CO2饱和湿度培养箱中培养24 h。弃去培养孔内培养基,PBS洗涤细胞1次,更换为新鲜培养基,每孔加入20 μL Caco-2细胞上清,6 h后,更换为不含病毒的新鲜培养液,感染48 h收集HEp-2细胞,提取HEp-2细胞内病毒DNA,通过荧光定量PCR检测病毒DNA水平。
1.7. 统计学方法
计量数据以
 表示。多组间差异采用单因素方差分析,两组间比较采用Tukey检验,α=0.05。
表示。多组间差异采用单因素方差分析,两组间比较采用Tukey检验,α=0.05。
2. 结果
2.1. HAdV-55感染Caco-2细胞内病毒蛋白的表达
如图1所示,HAdV-55感染48 h后Caco-2细胞,经抗HAdV-55小鼠血清孵育后,细胞内病毒蛋白表达为阳性,经对照小鼠血清孵育后,细胞内病毒蛋白表达为阴性。未感染HAdV-55的对照组Caco-2细胞,两种小鼠血清孵育后,细胞内病毒蛋白表达均为阴性。结果提示,HAdV-55成功入侵Caco-2细胞,细胞内有HAdV-55病毒蛋白的表达。
图 1.
Detection of viral protein in infected cells by immunofluorescence. ×100
免疫荧光检测感染细胞内病毒蛋白的表达。 ×100
2.2. 腺病毒在细胞内的复制增殖
由图2A可见,HAdV-3、7、14、55在Caco-2细胞内均能持续复制和增殖,细胞内病毒DNA水平随感染时间的增加而升高。由图2B所示,感染的Caco-2细胞上清中,病毒DNA水平持续增长。另外,感染细胞内各检测时间点HAdV-55 DNA水平明显高于HAdV-3和HAdV-7,上清中HAdV-55病毒DNA水平在感染后3d和5d明显高于HAdV-3、7和14型。
图 2.

Detection of viral DNA levels via qPCR (n=3)
荧光定量PCR检测病毒DNA水平(n=3)
A: Viral DNA level in the cell; B: Viral DNA level in the supernatant.
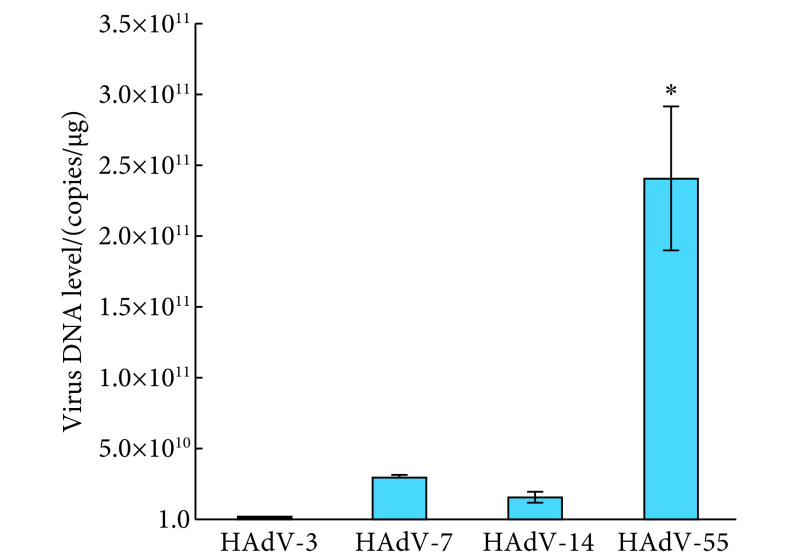
2.3. 感染细胞上清中感染性病毒颗粒检测
荧光定量PCR结果显示,Caco-2感染后5 d的上清感染的HEp-2细胞内可以检测到腺病毒DNA,说明Caco-2细胞上清中含有感染性病毒颗粒,能够成功感染HEp-2细胞。图3示,Caco-2上清中HAdV-55感染性病毒颗粒高于HAdV-3、7和14,差异有统计学意义(P<0.05)。
图 3.
Infectivity of Caco-2 supernatant to HEp-2 cells (n=3)
Caco-2上清对HEp-2细胞的感染性 (n=3)
*P<0.05, vs. HAdV-3, HAdV-7, and HAdV-14.
为进一步明确HAdV-55对Caco-2的感染性是否高于另外三者,我们采用小剂量病毒感染Caco-2,72 h后观察细胞CPE情况。采用100×TCID50的病毒感染Caco-2细胞,HAdV-3、7、14和55均能引起明显的CPE(结果未示)。而采用1×TCID50的病毒感染Caco-2细胞,感染72 h后细胞CPE情况见图4,HAdV-55感染孔出现典型CPE和病毒空斑,HAdV-3、7和14感染孔细胞与对照组差异不明显。
图 4.
CPE effect of different types of 1×TCID50 adenovirus on Caco-2 cells. ×100
1×TCID50腺病毒感染Caco-2细胞72 h后的CPE效应。 ×100
3. 讨论
目前腺病毒感染没有特效药物及疗效显著的治疗方法,主要依靠机体自身免疫系统消灭病毒而痊愈。腺病毒疫苗是预防腺病毒感染的有效方法,目前中国的一些学者也开始进行腺病毒疫苗的相关基础研究[14-15],包括重组多价疫苗的开发,但尚未见临床前研究,说明短时期内国内没有可用的人腺病毒疫苗上市。世界上经批准的腺病毒疫苗只有仅限美军内部使用的口服HAdV-4/HAdV-7疫苗,通过口服途径减毒,能够有效降低部队腺病毒引起的呼吸道感染疾病的发生率[16]。口服疫苗主要通过诱导肠道黏膜免疫反应,保护机体抵抗病原体的攻击。探讨病毒对肠道细胞的感染性,对其开发为口服疫苗具有指导作用。我们前期对HAdV-55的免疫原性进行了相关研究,发现灭活的HAdV-55病毒通过皮下注射免疫小鼠能够诱导较高的中和抗体[13],我们也对HAdV-55病毒口服免疫小鼠进行了初步探讨,口服免疫能够诱导小鼠产生体液免疫反应,利用免疫小鼠血清进行体外中和实验,对HAdV-55感染HEp-2细胞具有阻断作用。
另一方面,一些感染呼吸道的腺病毒可引起肠道系统感染。陈银桥等[17]调查武汉地区2015年5−8月腺病毒引起的急性腹泻的情况,发现腺病毒阳性率为15.90%(14/88),其病毒株主要为HAdV-41型,占75.14%,此外也有HAdV-7(21.43%)、HAdV-31(14.29%)以及HAdV-3(7.14%)。孙灵利等[3]调查了北京市朝阳区2011−2017年5岁以下腹泻患儿腺病毒分子流行病学特征,64例腺病毒阳性标本中,HAdV-41型为最主要的型别,占70.31%。其次依次为HAdV-31型(6.25%)、HAdV-40型(4.69%)、HAdV-1型(3.13%)、HAdV-5型(3.13%)、HAdV-6型(3.13%)、HAdV-7型(3.13%)、HAdV-2型(1.56%)、HAdV-3型(1.56%)、HAdV-4型(1.56%)和HAdV-61型(1.56%)。陈惠芳在其硕士学位论文中,调查了引起婴幼儿腹泻的主要病毒,发现25例腺病毒阳性中,HAdV-41占80%(20/25),为主要流行株,其余为非肠道腺病毒HAdV-7(16%,4/25)和HAdV-5(4%,1/25)[4]。国外也有这方面的相关报道,ÇOLAK等[18]对土耳其5岁以下儿童腺病毒腹泻调查发现,HAdV-41为主要毒株,占64%(16/25),其次分别为HAdV-40(24%,6/25)、HAdV-31(8%,2/25)以及HAdV-7(4%,1/25)。由上述这些研究可以看出,我国引起腹泻的腺病毒最主要的是HAdV-41型,其他非肠型的呼吸道感染腺病毒,如HAdV-7、HAdV-3等也可引起肠道感染,但尚未见腹泻标本中检测到HAdV-55的报道。
本实验主要观察了HAdV-55对肠道细胞的感染性,结果提示HAdV-55对肠道细胞具有较高的感染性,并且高于HAdV-3、7和14型,但综合国内的研究可以看出,尚未见病毒性腹泻中HAdV-55的报道,其原因一方面可能与HAdV-55在我国的总体流行率低有关。另一方面也可能是由于所用检测引物的局限性,而将其误归于HAdV-11或14型。但近几年我们通过监测呼吸道病原体感染情况发现,我国西部地区,尤其是四川省,HAdV-55感染每年均有发生,而且阳性率高于其他引起呼吸道感染的腺病毒亚型(HAdV-3、7型等),因此今后仍需加强西部地区病毒性腹泻腺病毒的监测和病毒分型。
另外本研究结果明确了HAdV-55对肠道细胞的易感性,提示其能够诱导肠道黏膜免疫应答,可制作成口服疫苗。但其对肠道细胞的感染性高于HAdV-3、7型等,利用野生型HAdV-55毒株进行口服免疫是否会产生较高的肠道感染副反应等,也是今后研究需要明确的重点问题之一。
Funding Statement
四川省科技计划重点研发项目(No. 2019YFS0367)和中国博士后科学基金(No. 2018T111157)资助
Contributor Information
怡蓓 何 (Yi-bei HE), Email: 604281719@qq.com.
媛 刘 (Yuan LIU), Email: liuyuan198231@163.com.
References
- 1.LION T Adenovirus infections in immunocompetent and immunocompromised patients. Clin Microbiol Rev. 2014;27(3):441–462. doi: 10.1128/CMR.00116-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.LYNCH J, KAJON A Adenovirus: epidemiology, global spread of novel serotypes, and advances in treatment and prevention. Semin Respir Crit Care Med. 2016;37(4):586–602. doi: 10.1055/s-0036-1584923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.孙灵利, 焦洋, 高艳, 等 北京市朝阳区2011−2017年5岁以下腹泻患儿腺病毒分子流行病学特征. 中华实验和临床病毒学杂志. 2018;32(5):492–495. doi: 10.3760/cma.j.issn.1003-9279.2018.05.009. [DOI] [Google Scholar]
- 4.陈惠芳. 2012−2013年广州市哨点医院婴幼儿病毒性腹泻的分子流行病学研究. 广州: 南方医科大学, 2014: 25-27.
- 5.WALSH M, SETO J, JONES M, et al Computational analysis identifies human adenovirus type 55 as a re-emergent acute respiratory disease pathogen. J Clin Microbiol. 2010;48(3):991–993. doi: 10.1128/JCM.01694-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.毛乃颖, 朱贞, 雷振强, 等 新型人腺病毒55型在中国10年的持续流行及其基因进化分析. 中华实验和临床病毒学杂志. 2018;32(2):124–129. doi: 10.3760/cma.j.issn.1003-9279.2018.02.004. [DOI] [Google Scholar]
- 7.赵瑞臣, 高文文 高原92例成人B组55型腺病毒感染治疗浅析. 华南国防医学杂志. 2016;30(7):470–471. [Google Scholar]
- 8.WANG W, LIU Y, ZHOU Y, et al Whole-genome analyses of human adenovirus type 55 emerged in Tibet, Sichuan and Yunnan in China, in 2016. PLoS One. 2017;12:e0189625[2020-01-05]. https://doi.org/10.1371/journal.pone.0189625. doi: 10.1371/journal.pone.0189625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.HANG J, KAJON A E, GRAF P C F, et al Human adenovirus type 55 distribution, regional persistence, and genetic variability. Emerg Infect Dis. 2020;26(7):1497–1505. doi: 10.3201/eid2607.191707. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.王文博, 古良琪, 刘媛, 等 2018年成都周边部队感染55型腺病毒分子流行病学溯源. 第三军医大学学报. 2018;40(24):2211–2216. [Google Scholar]
- 11.李文刚, 方瑶, 涂波, 等 群体性人55型腺病毒感染的临床特征分析. 内科理论与实践. 2019;14(2):65–70. [Google Scholar]
- 12.JING S, ZHANG J, CAO M, et al Household transmission of human adenovirus type 55 in case of fatal acute respiratory disease. Emerg Infect Dis. 2019;25(9):1756–1758. doi: 10.3201/eid2509.181937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.刘媛, 王文博, 邹自英, 等 灭活人55型腺病毒在小鼠体内免疫原性的评价. 中国生物制品学杂志. 2020;33(2):131–135. [Google Scholar]
- 14.LIU T, ZHOU Z, TIAN X, et al A recombinant trivalent vaccine candidate against human adenovirus types 3, 7, and 55. Vaccine. 2018;36(16):2199–2206. doi: 10.1016/j.vaccine.2018.02.050. [DOI] [PubMed] [Google Scholar]
- 15.TIAN X, JIANG Z, FAN Y, et al A tetravalent vaccine comprising hexon-chimeric adenoviruses elicits balanced protective immunity against human adenovirus types 3, 7, 14 and 55. Antiviral Res. 2018;154:17–25. doi: 10.1016/j.antiviral.2018.04.001. [DOI] [PubMed] [Google Scholar]
- 16.CHOUDHRY A, MATHENA J, ALBANO J, et al Safety evaluation of adenovirus type 4 and type 7 vaccine live, oral in military recruits. Vaccine. 2016;34(38):4558–4564. doi: 10.1016/j.vaccine.2016.07.033. [DOI] [PubMed] [Google Scholar]
- 17.陈银桥, 向赟, 艾洪武, 等 武汉地区2015年5月至8月腺病毒腹泻婴幼患儿病原学监测及流行特征调查. 医药卫生(全文版) 2016;5:174–175. [Google Scholar]
- 18.ÇOLAK M, BOZDAYI G, ALTAY A, et al Detection and molecular characterisation of adenovirus in children under 5 years old with diarrhoea. Turk J Med Sci. 2017;47(5):1463–1471. doi: 10.3906/sag-1510-94. [DOI] [PubMed] [Google Scholar]