Abstract
目的
探讨青蒿琥酯(artesunate, ART)对甲型流感病毒肺炎的治疗作用。
方法
将36只小鼠随机分为6组:正常对照组(C组)、溶剂对照组(M组,10%DMSO)、阳性药物组(P组,奥司他韦1.25 mg/kg)、ART高剂量组(ART-G组,ART 120 mg/kg)、ART中剂量组(ART-Z组,ART 60 mg/kg)和ART低剂量组(ART-D组,ART 30 mg/kg),每组6只。除C组不进行病毒干预和腹腔注射外,其余5组小鼠鼻腔滴入感染甲型流感病毒(influenza A virus, IAV),12 h后按分组剂量进行每日一次腹腔注射;治疗过程中观察小鼠体征、体质量和存活情况;治疗7 d后,取小鼠肺组织,计算肺指数,HE染色观察小鼠肺组织病理变化,RT-qPCR和Western blot分别检测肺组织中Toll 样受体 4(Toll-like receptor 4, TLR4)、核因子κB(nuclear factor kappa-B, NF-κB)(p65)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)和白细胞介素-1β(interleukin-1, IL-1β)mRNA和蛋白表达水平。
结果
与C组比较,M组小鼠体征变差、体质量和存活率降低,肺指数增加,肺组织出现严重病理变化,肺组织中TLR4、NF-κB (p65)、TNF-α、IL-6和IL-1β mRNA和蛋白表达水平升高(P<0.05);与M组比较,ART各组小鼠体征明显改善、体质量和存活率升高,肺指数降低,肺组织病理变化得到改善,肺组织中TLR4、NF-κB (p65)、TNF-α、IL-6和IL-1β mRNA和蛋白表达水平降低(P<0.05),且上述指标变化以ART-G组最显著。
结论
ART对甲型流感病毒肺炎具有治疗作用,其机制与抑制TLR4/NF-κB (p65)信号通路活化和抗炎相关。
Keywords: 青蒿琥酯, 甲型流感病毒, 肺炎
Abstract
Objective
To investigate the therapeutic effect of artesunate (ART) on influenza A viral pneumonia.
Methods
A total of 36 mice were evenly and randomly assigned to six groups, a normal control group (C group), a solvent control group (M group, 10% DMSO), a positive drug group (P group, oseltamivir, 1.25 mg/kg/day), ART high-dose group (ART-G group, 120 mg/kg/day), ART medium-dose group (ART-Z group, 60 mg/kg/day), and ART low-dose group (ART-D group, 30 mg/kg/day). Except for group C, which did not receive any influenza A virus intervention or intraperitoneal injection, mice in the five other groups were infected with influenza A virus through intranasal drip. Then, after 12 hours, mice in the five other groups received intraperitoneal injection of the assigned drugs and dosage once a day. The signs, body weight, and survival of the mice were observed over the course of treatment. After 7 days of treatment, the lung tissue of the mice was collected and weighed, and the lung index was calculated accordingly. HE staining was performed to observe the pathological changes in the lung tissue. The mRNA and protein expression levels of Toll-like receptor 4 (TLR4), nuclear factor kappa-B (NF-κB [p65]), tumor necrosis factor α (TNF-α), interleukin-6 (IL-6), and IL-1β were examined with RT-qPCR and Western blot, respectively.
Results
Compared with those in C group, mice in the M group had worse physical signs and lower body mass and survival, increased lung index, severe pathological changes in lung tissue, and increased levels of TLR4, NF-κB (p65), TNF-α, IL-6 and IL-1β mRNA and protein expression in their lung tissue (P<0.05). Compared with those in M group, the mice in the ART groups had better physical signs, higher body mass and survival rate, decreased lung index, improvement of pathological changes in the lung tissue, and decreased levels of level of TLR4, NF-κB (p65), TNF-α, IL-6 and IL-1β mRNA and protein expression in the lung tissue (P<0.05). Furthermore, the most prominent changes in these indexes were observed in the ART-G group.
Conclusion
ART has therapeutic effects on influenza A viral pneumonia, and the mechanisms are related to the inhibition of TLR4/p65 signaling pathway activation and anti-inflammation.
Keywords: Artesunate, Influenza A virus, Pneumonia
甲型流感病毒(influenza A virus, IAV)是流行性感冒的主要病原体,每年感染约7亿人,导致近60万人死亡,是人类面临的重大公共卫生问题[1-2]。IAV感染后可引发患者诸多并发症,其中病毒性肺炎是主要并发症之一,也是患者死亡的一大诱因[3]。虽然临床上已有相关治疗IAV的药物,但现阶段的药物还不能有效改善IAV肺炎所引起的急性肺损伤(acute lung injury, ALI)和急性呼吸窘迫综合征(acute respiratry distress syndrme, ARDS),因此急需开发相关针对性的药物[3-4]。Toll 样受体 4(Toll-like receptor 4, TLR4)和核因子κB(nuclear factor kappa-B, NF-κB)(p65)是IAV诱导肺炎的关键信号通路,IAV感染后通过激活TLR4/NF-κB(p65)信号通路诱导炎症因子过度分泌,加速肺炎的进展[5]。
青蒿琥酯(artesunate, ART)是青蒿素的衍生物之一,因其安全、生物利用度高,被临床用于危重疟疾的抢救治疗[6]。此外,ART还具有抗病毒[7]、抗炎[8]和抗肿瘤[9]的作用。我们前期研究发现双氢青蒿素在体外可抑制IAV H1N1诱导炎症因子TNF-α和IL-6的表达[10]。此外,ART还可通过抑制TLR-4、NF-κB、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)和白细胞介素-6 (interleukin-6, IL-6)的表达,改善炎症因子诱导的缺血再灌注脑损伤[11]。然而ART对IAV肺炎的治疗作用及相关机制现阶段还不明确;因此,在本研究中通过建立IAV肺炎小鼠模型,探讨ART对IAV肺炎的治疗效果和部分相关机制。
1. 材料与方法
1.1. 实验动物与病毒毒株
SPF级ICR小鼠,18~20 g,4~6周龄,购自成都达硕实验动物有限公司,动物许可证编号:SCXK(川)2020-030。动物实验过程遵循我国《实验动物福利伦理审查指南(GB/T 358922018)》提出的原则与要求;甲型流感病毒A/PR/8/34(H1N1)由中国疾病预防控制中心病毒病预防控制所国家流感中心提供。病毒实验操作在病原微生物二级生物安全实验室进行:川卫BSL-2-A备(2020)第0639号。
1.2. 实验试剂与设备
青蒿琥酯(artesunate, ART),纯度98%,购自成都植标化纯生物技术有限公司;兔抗TLR4抗体、兔抗NFκB(p65)抗体,兔抗TNF-α抗体,兔抗IL-1β抗体,兔抗IL-6抗体,均购自武汉爱博泰克生物科技有限公司;HRP-羊抗兔IgG,购自北京中杉金桥生物技术有限公司;一抗稀释液,二抗稀释液,封闭液,均购武汉赛维尔生物科技有限公司;ECL发光液和PVDF膜,购置美国BIO-RAD公司;总RNA提取试剂盒,购自北京天根生化科技有限公司;PrimeScriptTM RT reagent Kit withgDNAEraser试剂盒,TB Green® Premix Ex TaqTM (TliRNaseH Plus)均购自宝日医生物技术(北京)有限公司;苏木素染液购自武汉塞维尔生物科技有限公司;组织标本固定液购自福晨(天津)化学试剂有限公司;实时荧光定量PCR仪,购自德国耶拿分析仪器股份公司;凝胶成像系统,购自美国BIO-RAD公司;蛋白电泳仪,购自北京八一实验仪器厂;转轮式切片机,购自德国徕卡公司。
1.3. 方法
1.3.1. 肺炎模型建立及分组干预
实验前测定IAV的半数致死剂量(LD50),然后解剖小鼠,观察死亡和未死亡的小鼠肺部是否出现炎症,然后采用该剂量(LD50=10−2.3)进行正式实验,确保模型成功。小鼠腹腔注射10%戊巴比妥钠,0.1 mL/只,待小鼠进入麻醉状态后,鼻腔滴入1×LD50 IAV A/PR/8/34 H1N1,40 μL/只,建立肺炎模型。随机将模型鼠分为5组,每组6只:溶剂对照组(M组)、阳性药物组(P组)、ART高剂量组(ART-G组)、ART中剂量组(ART-Z组)和ART低剂量组(ART-D组)。将ART溶于含10%DMSO的注射用水中,小鼠感染后12 h,按ART高(ART-G)、中(ART-Z)、低剂量(ART-D)组,分别给予小鼠每日1次腹腔注射ART120、60、30 mg/kg,200 μL/只,治疗7 d。M组、P组则于小鼠感染后12 h,给予每日1次腹腔注射等体积10%DMSO、奥司他韦1.25 mg/kg,治疗7 d。取6只正常小鼠建立正常对照组(C组),麻醉后鼻腔滴入PBS,然后常规饲养,不进行腹腔注射。
1.3.2. 小鼠体征、体质量、存活率和肺指数观察
7 d治疗过程中观察小鼠的体征,在每天固定时间对小鼠进行称重,记录小鼠的存活情况。在实验过程死亡的小鼠,称重后解剖取全肺称取质量,并留样做后续检测,其余存活小鼠在末次给药后12 h,麻醉处死,取全肺称取质量,计算肺指数,然后留取肺组织进行后续检测。肺指数(%)=肺湿质量/体质量×100%。上式质量单位均为g。
1.3.3. 小鼠肺组织HE染色
处死小鼠后,取100 mg小鼠肺组织,经4%多聚甲醛固定过夜,按常规HE染色步骤进行染色,染色后于光学显微镜下采集图片,观察肺组织的病理变化。
1.3.4. qRT-PCR检测肺组织中TLR4、NF-κB(p65)、TNF-α、IL-6和IL-1β mRNA水平
取100 mg小鼠肺组织,用RNA提取试剂盒提取总RNA,总RNA经PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒逆转录为cDNA,cDNA在实时荧光定量PCR仪上按95.0 ℃预变性30 s,95.0 ℃变性10 s,60.0 ℃退火延伸30 s,扩增40循环。引物由苏州金唯智生物科技有限公司合成。引物序列如下:TLR4:Forward 5′-TCCCTGCATAGAGGTAGTTCC-3′,Reverse 5′-TCAAGGGGTTGAAGCTCAGA-3′,扩增产物长度119 bp;NF-κB(p65):Forward 5′-ACTGCCGGGATGGCTACTAT-3′,Reverse 5′-TCTGGATTCGCTGGCTAATGG -3′,扩增产物长度126 bp;TNF-α:Forward 5′-ACCCTCACACTCACAAACC-3′,Reverse 5′-ACAAGGTACAACCCATCGG-3′,扩增产物长度134 bp;IL-6:Forward 5′-GAGACTTCCATCCAGTTGCCT-3′,Reverse 5′-TGGGAGTGGTATCCTCTGTGA-3′,扩增产物长度105 bp;IL-1β:Forward 5′-GTTGACGGACCCCAAAAGAT-3′,Reverse 5′-TGATACTGCCTGCCTGAAGC-3′,扩增产物长度123 bp。内参基因β-actin:Forward 5′-CGTTGACATCCGTAAAGACC-3′,Reverse 5′-AACAGTCCGCCTAGAAGCAC -3′,扩增产物长度281 bp。扩增后根据2−ΔΔCt计算目的基因的相对表达量。
1.3.5. Western blot检测小鼠肺组织中TLR4、NF-κB(p65)、TNF-α、IL-6和IL-1β 蛋白水平
取50 mg小鼠肺组织,用RPIA裂解液裂解并经BCA试剂盒定量,制备成Western blot上样样品。样品经SDS-PAGE凝胶电泳后,转至聚偏二氟乙烯膜(PVDF)模上;PVDF膜经TBST洗涤及封闭液封闭,然后对应加入1∶1000稀释的TLR4、NF-κB(p65)、TNF-α、IL-6和IL-1β抗体,4 ℃孵育过夜;PVDF膜经TBST漂洗后加入HRP-羊抗兔IgG(1∶8000),室温孵育60 min;PVDF膜经TBST漂洗后,加入ECL发光液于凝胶成像系统中采集图像;使用Image J软件分析蛋白条带灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/内参蛋白β-actin灰度值。
1.3.6. 统计学方法
计量数据以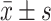 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。存活率采用卡方检验,P<0.05为差异有统计学意义。
表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。存活率采用卡方检验,P<0.05为差异有统计学意义。
2. 结果
2.1. ART对IAV肺炎小鼠体征的影响
C组小鼠在整个实验期间精神状态良好,行为活动和饮食正常,背毛光滑。M组小鼠在实验前3天一切正常,从第4天起出现精神萎靡,背毛耸立,行为活动迟缓,卷缩颤抖等变化。ART治疗组小鼠体征变化较M组明显改善,以ART-G组改善效果最明显。
2.2. ART对IAV肺炎小鼠体质量、存活率和肺指数的影响
如表1和图1所示:与C组比较,M组小鼠体质量和存活率均下降,肺指数升高(P<0.05)。与M组比较,ART各组小鼠体质量和存活率升高,肺指数降低(P<0.05),其中存活率与肺指数以ART-G组变化最显著(P<0.05);ART-G组与ART-D组相比,存活率与肺指数差异均有统计学意义(P<0.05)。表明ART可降低IAV肺炎小鼠的肺指数,提高小鼠的体质量和存活率。
表 1. The survival rate and lung index of mice in each group.
各组小鼠存活率和肺指数
| Group | n | Survival rate/% | Lung index/% |
| * P<0.05, vs. C group; # P<0.05, vs. M group; △ P<0.05, vs. ART-G group. C group: Normal control group; M group: Solvent control group; P group: Positive drug group (oseltamivir, 1.25 mg/kg per day); ART-G group: ART high dose group (ART 120 mg/kg per day); ART-Z group: ART medium dose group (ART 60 mg/kg per day); ART-D group: ART low dose group (ART 30 mg/kg per day). | |||
| C | 6 | 100 | 0.74±0.02 |
| M | 6 | 50* | 2.06±0.42* |
| P | 6 | 83.3# | 1.09±0.36# |
| ART-G | 6 | 100# | 1.02±0.37# |
| ART-Z | 6 | 83.3△,# | 1.04±0.26# |
| ART-D | 6 | 66.7△,# | 1.25±0.76△,# |
图 1.
The body mass changes of mice in each group
各组小鼠体质量变化
* P<0.05, M group vs. C group; # P<0.05, ART groups vs. M group. n=6.
2.3. ART对IAV肺炎小鼠肺组织病理损伤的影响
C组小鼠肺组织支气管结构清晰,上皮细胞排列整齐、形态正常,肺泡结构完整,未见病理损伤;M组小鼠肺组织结构明显受损,肺泡结构模糊,局部实质化,肺泡隔增厚,肺泡上皮细胞及纤维组织增生,上皮细胞变性坏死,大量淋巴细胞、中性粒细胞、巨噬细胞及细胞碎片聚集;ART-G组小鼠组织支气管结构清晰,上皮细胞排列整齐、形态正常,肺泡结构完整,仅少量炎细胞浸润;ART-Z组小鼠组织支气管结构清晰,少量上皮细胞坏死及少量炎细胞浸润;ART-D组小鼠肺组织结构受损,上皮细胞坏死及炎细胞浸润。表明ART可改善IAV肺炎导致的肺组织病理损伤。见图2。
图 2.

The pathological changes of lung tissue of mice in each group observed with HE staining. ×100
HE染色观察各组小鼠肺组织病理变化。×100
A: C group; B: M group; C: P group; D: ART-G group; E: ART-Z group; F: ART-D group. The arrows are pointed at the lesions.
2.4. ART对IAV肺炎小鼠肺组织中促炎症因子TNF-α、IL-6和IL-1β的mRNA和蛋白表达的影响
与C组比较,M组小鼠肺组织中TNF-α、IL-6和IL-1β mRNA和蛋白表达水平升高(P<0.05);与M组比较,ART组小鼠肺组织中TNF-α、IL-6和IL-1β mRNA和蛋白表达水平降低(P<0.05);ART-G组下降最显著,与ART-D组相比,差异均有统计学意义(P<0.05)。表明ART可降低IAV肺炎小鼠肺组中TNF-α、IL-6和IL-1β等促炎症因子的表达水平。见图3。
图 3.
The expression levels of TNF-α, IL-6 and IL-1β mRNA and proteins in the lung tissue of mice in each group
各组小鼠肺组织中TNF-α、IL-6和IL-1β的mRNA及蛋白表达水平
* P<0.05, vs. C group; # P<0.05, vs. M group; △ P<0.05, vs. ART-G group. n=6.
2.5. ART对IAV肺炎小鼠肺组织中TLR4和NF-κB(p65)的mRNA及其蛋白表达的影响
与C组比较,M组小鼠肺组织中TLR4和NF-κB(p65) mRNA及蛋白表达水平升高(P<0.05);与M组比较,ART组小鼠肺组织中TLR4和NF-κB(p65)mRNA及蛋白表达水平降低(P<0.05);ART-G组下降最显著,与ART-D组相比,差异均有统计学意义(P<0.05)。表明ART可抑制IAV肺炎小鼠肺组织中TLR4和NF-κB(p65)的表达,进而抑制TLR4/NF-κB(p65)信号通路活化,发挥抗炎效果。见图4。
图 4.

The expression levels of TLR4 and NF-κB(p65) mRNA and proteins in the lung tissue of mice in each group
各组小鼠肺组织中TLR4和NF-κB(p65)的mRNA及蛋白表达水平
* P<0.05, vs. C group; # P<0.05, vs. M group; △ P<0.05, vs. ART-G group. n=6.
3. 讨论
病毒性肺炎是IAV感染的主要并发症,在此过程中宿主会分泌大量的炎症因子,造成组织器官病理损伤,使患者病情加重,甚至死亡[12]。尽管临床上已有多种药物被用于IAV的治疗,但这些药物对IAV肺炎的治疗效果有限,因此急需探索针对IAV肺炎的治疗药物[4]。近年来,中药在抗IAV和治疗IAV肺炎上均有报道,并显示出较好的治疗效果[13]。ART是我国传统中药青蒿素的衍生物之一,在临床上主要用于危重疟疾的抢救治疗。研究发现ART还具有抗病毒[7]、抗炎[8]、抗肿瘤[9]和免疫调节[14]等生物活性。然而ART对IAV肺炎的治疗作用和机制现阶段还未阐明。在本研究中我们发现ART可通过抑制小鼠肺组织中TLR4、NF-κB (p65)、TNF-α、IL-6和IL-1β 的表达,降低肺组织的炎症反应,改善IAV肺炎小鼠的体征和肺组织病理损伤,降低小鼠肺指数,提高小鼠的存活率和体质量。证实ART对IAV肺炎具有治疗作用,其机制与抑制TLR4/NF-κB (p65)信号通路活化和抗炎相关。
IAV感染诱导ALI和ARDS与TLR4/NF-κB (p65)信号通路密切相关。研究表明IAV感染后可激活TLR4/NF-κB (p65)信号通路,进而诱导促炎因子分泌,诱导肺炎发生发展[5]。NOVAK等[15]发现重症流感肺炎小孩的预后情况与体内TLR4的抑制呈正相关,同时TLR4的抑制情况与患者器官衰竭持续时间和患者死亡率增加也存在关联。DAI等[16]研究表明大黄素通过抑制TLR4/NF-κB通路治疗流感病毒肺炎。在本研究中我们发现ART可抑制IAV肺炎小鼠肺组织中TLR4和NF-κB (p65) mRNA及蛋白的表达水平,抑制TLR4/NF-κB (p65)信号通路。TLR4/NF-κB (p65)信号通路活化后通过直接或间接途径诱导促炎症因子TNF-α、IL-6和IL-1β 等的表达,当TNF-α、IL-6和IL-1β等促炎因子过度分泌后会诱导炎症细胞进一步活化,增殖和迁移,加重感染部位的炎症反应,诱发炎症因子风暴[17-19]。在IAV肺炎中大量炎症因子分泌和炎症细胞浸润会导致肺充血水肿,肺指数升高,上皮细胞增生、坏死和脱落,诱发ALI和ARDS,加重病情并导致患者死亡[3]。ZHAO等[20]发现柴芩清宁可通过抑制IL-6和TNF-α的表达,改善IAV肺炎小鼠的肺病理损伤,降低肺指数,提高小鼠存活率。同样YU等[21]也证实通过抑制TNF-α、IL-6和IL-1β等促炎因子的表达可改善IAV肺炎小鼠组织病理损伤,提高存活率。我们实验结果显示ART可抑制IAV肺炎小鼠肺组织中TNF-α、IL-6和IL-1β mRNA和蛋白的表达水平,同时改善IAV肺炎小鼠的体征、肺组织病理变化,降低肺指数,提高IAV肺炎小鼠存活率。
综上所述:在研究中我们证实ART对IAV肺炎具有治疗作用,发现ART是通过抑制TLR4、NF-κB (p65)、TNF-α、IL-6和IL-1β的表达发挥效果,得出了ART治疗IAV肺炎的部分机制和分子靶点。但本研究仅使用一种毒株进行实验,此外ART治疗IAV肺炎的其它调控靶点和机制需进一步研究论证。在接下来的实验中我们将采用不同亚型毒株和通过蛋白组学法进一步完善ART治疗流感病毒肺炎的作用和机制,为ART在IAV肺炎上的应用和开发针对IAV肺炎小分子药物提供理论依据。虽然本研究存在以上不足,但证实ART具有治疗IAV肺炎的潜力,其部分机制是抑制TLR4、NF-κB (p65)、TNF-α、IL-6和IL-1β的表达,为ART治疗IAV肺炎的深入研究提供了理论基础。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
深地医学高温模拟创新交叉研究平台(No. 2020CDYB-35)资助
Contributor Information
永君 周 (Yong-jun ZHOU), Email: 821079676@qq.com.
明江 别 (Ming-jiang BIE), Email: 13941057@qq.com.
References
- 1.LEE V J, HO Z J M, GOH E H, et al Advances in measuring influenza burden of disease. Influenza Other Respi Viruses. 2018;12(1):3–9. doi: 10.1111/irv.12533. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.GORAYA M U, WANG S, MUNIR M, et al Induction of innate immunity and itsperturbation by influenza viruses. Protein Cell. 2015;6(10):712–721. doi: 10.1007/s13238-015-0191-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.张雨茜, 王荣花, 陈祥, 等 TLR4信号通路介导病毒性急性肺损伤与ARDS的研究进展. 病毒学报. 2021;37(5):1235–1243. doi: 10.13242/j.cnki.bingduxuebao.003887. [DOI] [Google Scholar]
- 4.MATTIL J M, VUORINEN T, WARIS M, et al Oseltamivir treatment of influenza A and B infections in infants. Influenza Other Respir Viruses. 2021;15(5):618–624. doi: 10.1111/irv.12862. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.LING L J, LU Y, ZHANGY Y, et al. Flavonoids from Houttuyniacordata attenuate H1N1-induced acute lung injury in mice via inhibition of influenza virus and Toll-like receptor signaling. Phytomedicine, 2020, 67: 153150[2022-01-21]. https//doi:10.1016/j.phymed.2019.153150.
- 6.NEWTON P, SUPUTTAMONGKOL Y, TEJA-ISAVADHARM Y, et al Antimalarial bioavailability and disposition of artesunate in acute falciparum malaria. Antimicrob Agents Chemother. 2000;44(4):972–977. doi: 10.1128/AAC.44.4.972-977.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.CAO R, HU H, LI Y, et al Anti-SARS-CoV-2 potential of artemisinins in vitro. ACS Infect Dis. 2020;6(9):2524–2531. doi: 10.1021/acsinfecdis.0c00522. [DOI] [PubMed] [Google Scholar]
- 8.LEI X Y, TAN R Z, JIA J, et al Artesunate relieves acute kidney injury through inhibiting macrophagic mincle-mediated necroptosis and inflammation to tubular epithelial cell. J Cell Mol Med. 2021;25(18):8775–8788. doi: 10.1111/jcmm.16833. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.XU Z W, LIU X J, ZHUANG D P Artesunate inhibits proliferation, migration, and invasion of thyroid cancer cells by regulating the PI3K/AKT/FKHR pathway. Biochem Cell Biol. 2022;100(1):85–92. doi: 10.1139/bcb-2021-0275. [DOI] [PubMed] [Google Scholar]
- 10.欧利, 秦克, 杨子宵, 等 双氢青蒿素对甲型流感病毒H1N1诱导人支气管上皮细胞TNF-α和IL-6表达的影响及机制研究. 四川大学学报(医学版) 2020;51(2):171–177. [Google Scholar]
- 11.CHEN Y, WU J, ZHU J, etal Artesunate provides neuroprotection against cerebral ischemia-reperfusion injury via the TLR-4/NF-κB pathway in rats. Biol Pharm Bull. 2021;44(3):350–356. doi: 10.1248/bpb.b20-00604. [DOI] [PubMed] [Google Scholar]
- 12.CHEUNG C Y, POON L L, LAU A S, et al. Induction of pro-inflammatory cytokines in human macrophages by influenza A (H5N1) viruses: A mechanism for the unusual severity of human disease? Lancet, 2002, 360(9348): 1831−1837.
- 13.周沁阳, 蔡文涛, 陈勇 中药抗流感病毒活性及作用机制研究新进展. 中草药. 2019;5(7):1719–1726. doi: 10.7501/j.issn.0253-2670.2019.07.034. [DOI] [Google Scholar]
- 14.CHEN S, XU Q, WANG J, Effects of artesunate tablet on immune activation and reconstitution among highly active antiretroviral therapy-treated patients with incomplete immune responses. AIDS Res Hum Retroviruses, 2022, 38(2): 100−110.
- 15.NOVAK T, HALL M W, MCDONALD D R, et al RIG-I and TLR4 responses and adverse outcomes in pediatric influenza-related critical illness. J Allergy ClinImmunol. 2020;145(6):1673–1680. doi: 10.1016/j.jaci.2020.01.040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.DAI J P, WANG Q W, YUN S, et al Emodin inhibition of influenza A virus replication and influenza viral pneumonia via the Nrf2, TLR4, p38/JNK and NF-kappaB pathways. Molecules. 2017;18, 22(10):1754–1770. doi: 10.3390/molecules22101754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.PAUL A T, GOHIL V M, BHUTANI K K Modulating TNF-α signaling with natural products. Drug Disco Today. 2006;11(15-16):725–732. doi: 10.1016/j.drudis.2006.06.002. [DOI] [PubMed] [Google Scholar]
- 18.ZHANG F, YAO S, ZHANG M, et al Roles of circulating soluble interleukin (IL)-6 receptor and IL-6 receptor expression on CD4+ T cellsin patients with chronic hepatitis B. Int J Infect Dis. 2011;15(4):267–271. doi: 10.1016/j.ijid.2010.12.008. [DOI] [PubMed] [Google Scholar]
- 19.JONG M D D, SIMMONS C P, THANH T T, et al Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. Nat Med. 2006;12(10):1203–1207. doi: 10.1038/nm1477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.ZHAO J, HAO Y B, XIA X Z, et al. Chaiqin Qingning capsule inhibits influenza virus infection and inflammation in vitro and in vivo. Evid Based Complement Alternat Med, 2021, 2021: 6640731[2022-02-18]. https//doi:10.1155/2021/6640731.
- 21.YU X H, CAI T T, FAN L, et al The traditional herbal formulation, Jianpiyifei Ⅱ, reduces pulmonary inflammation induced by influenza A virus and cigarette smoke in mice. Clin Sci. 2021;135(14):1733–1750. doi: 10.1042/CS20210050. [DOI] [PubMed] [Google Scholar]




