Abstract
目的
研究酪氨酸激酶受体2(tyrosine kinase receptor 2, Tie2)在口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)中的表达情况及其对细胞增殖、迁移及上皮-间充质转化(epithelial-mesenchymal transition, EMT)过程的影响。
方法
采用免疫组织化学(immunohistochemistry, IHC)检测Tie2在OSCC组织与正常口腔黏膜组织中的表达。Western blot检测DOK细胞及OSCC细胞株中Tie2的表达,选取Tie2高表达细胞株作为实验株。将沉默Tie2的慢病毒载体成功转染至实验株用于后续实验。CCK-8及克隆形成实验检测细胞增殖、克隆能力;细胞划痕和Transwell实验检测细胞迁移能力;激光共聚焦显微镜检测细胞骨架纤丝状肌动蛋白(F-actin)重塑能力及上皮钙黏素(E-cadherin)、神经钙黏素(N-cadherin)的表达;Western blot检测EMT相关标志性蛋白E-cadherin、N-cadherin、波形蛋白(vimentin)的表达以及蛋白激酶B(protein kinase B, AKT)、胞外信号调节激酶(extracellular signal-regulated kinase, ERK)的表达。
结果
IHC结果显示:OSCC组Tie2阳性率(74.5%)高于对照组(19.4%)(P<0.0001)。与DOK细胞相比,Tie2在HSC-4及SCC-9细胞株呈现高表达,慢病毒shRNA-162组沉默效果最好,作为实验组并应用于后续实验。与对照组相比,实验组细胞的增殖、克隆及迁移能力明显降低,细胞骨架F-actin绿色荧光强度降低,细胞前缘丝状伪足数量减少、长度变短;E-cadherin的表达明显增加,N-cadherin、vimentin的表达明显降低。p-AKT及p-ERK蛋白表达降低,AKT及ERK蛋白的表达增加。
结论
Tie2在大多数OSCC中呈高表达,沉默Tie2能通过调控AKT及ERK信号通路抑制OSCC细胞增殖克隆迁移能力,抑制F-actin重塑,改变其EMT相关标志性蛋白的表达,提示Tie2可能参与了OSCC的生长、转移及EMT过程。
Keywords: Tie2, 口腔鳞状细胞癌, ERK, AKT, 增殖, 迁移, 上皮-间充质转化
Abstract
Objective
To study the expression of tyrosine kinase receptor 2 (Tie2) in oral squamous cell carcinoma (OSCC) and its effect on cell proliferation and migration and the epithelial-mesenchymal transition (EMT) process.
Methods
Immunohistochemistry (IHC) tests were conducted to examine the expression of Tie2 in OSCC tissues and normal oral mucosa tissues. Western blot was performed to examine the expression of Tie2 in dysplastic oral keratinocyte (DOK) cell line and OSCC cell lines, and the cell line with high Tie2 expression was selected as the experimental cell line. The Tie2-silenced lentiviral vector was successfully transfected onto the experimental cell line for subsequent experiments. Cell proliferation and cloning abilities were examined with CCK-8 and clone formation assays. Cell migration ability was examined with scratch and Transwell assays. The remodeling ability of cytoskeletal F-actin and the expressions of E-cadherin and N-cadherin were examined with confocal laser scanning microscope. Western blot was performed to examine the expression of EMT-related signature proteins, including E-cadherin, N-cadherin, and vimentin, and the expression of the protein kinase B (AKT) and extracellular signal-regulated kinase (ERK).
Results
IHC results showed that the Tie2-positive rate of the OSCC group (74.5%) was significantly higher than that of the control group (19.4%) (P<0.0001). The expression of Tie2 was higher in HSC-4 and SCC-9 cell lines compared to that in DOK cells. The lentiviral shRNA-162 group showed the best silencing effect, which was used as the experimental group and applied in subsequent experiments. Compared with those of the control group, the proliferation, cloning and migration capacities of the cells of the experimental group were significantly reduced. Furthermore, the green fluorescence intensity of the cytoskeleton F-actin was reduced, the number of filamentous pseudopods at the leading edge of the cells decreased and their length was shortened, and the expression of E-cadherin was significantly increased, while the expression of N-cadherin and vimentin was significantly reduced in the experimental group in comparison with those of the control group. The expression of p-AKT and p-ERK proteins decreased, while AKT and ERK protein expression increased.
Conclusion
Tie2 was highly expressed in most OSCC cells. Silencing Tie2 can inhibit the proliferation, cloning, and migration ability of OSCC cells, inhibit F-actin remodeling, and alter the expression of its EMT-related signature proteins by regulating AKT and ERK signaling pathway, which suggests that Tie2 may be involved in the growth, metastasis and EMT process of OSCC.
Keywords: Tie2, Oralsquamouscell carcinoma, ERK, AKT, Proliferation, Migration, Epithelial mesenchymal transition
口腔鳞状细胞癌(oral squamonus cell carcinoma, OSCC)是口腔颌面部最为常见的恶性肿瘤之一。国外最新研究发现口腔癌死亡率每年递增0.4%[1-2],特别是有转移的晚期患者死亡率明显增加。癌症转移复发是患者死亡的主要原因,而上皮-间充质转化(epithelial-mesenchymal transition, EMT)是肿瘤发生转移的重要过程[3]。尽管目前的治疗手段不断趋于成熟,但由于肿瘤的局部侵袭及复发转移仍会造成其患者生存率降低,因此对OSCC生长转移的相关分子机制的研究是广大研究者亟需攻克的难题。
酪氨酸激酶受体2(tyrosine kinase receptor 2, Tie2)是受体酪氨酸激酶家族中的一员。作为一种促血管生成因子,Tie2在调节炎症、肿瘤的血管生成中均发挥重要作用;研究表明Tie2在多数实体肿瘤中如乳腺癌[4]、卵巢癌[5]、肝癌[6]等都存在异常高表达,Tie2的表达能促进肿瘤的血管生成,加速肿瘤的生长转移;目前,Tie2在OSCC生长转移中的作用研究较少。本实验研究了OSCC中Tie2的表达水平,并利用RNA干扰技术研究沉默Tie2对OSCC细胞增殖、克隆、迁移能力及EMT过程的影响,为后期进行靶向药物治疗、提高患者生存率提供新思路。
1. 材料与方法
1.1. 临床标本和细胞株
选取2019年1月–2021年6月在四川省医学科学院·四川省人民医院口腔颌面外科接受手术且临床资料完整的OSCC患者。其中男性95例,女性62例,年龄28~81岁,中位年龄56岁。术前未行放化疗,术后病理学检查结果均为OSCC。本研究经四川省医学科学院·四川省人民医院医学伦理委员会批准(批准号2019年第328号),所有患者均知情同意。人口腔黏膜癌前病变细胞(DOK)及口腔鳞癌细胞株HSC-4、SCC-9、Cal-27、HSC-3由四川大学口腔疾病研究国家重点实验室馈赠。
1.2. 主要材料和试剂
兔抗人Tie-2单克隆抗体(亲科生物研究中心有限公司,江苏),山羊抗兔/鼠HRP标记聚合物(三鹰生物技术有限公司,武汉),纤丝状肌动蛋白(F-actin)(Abcam,美国),ProLong Gold Antifade Reagent with DAPI,蛋白激酶B(protein kinase B, AKT)抗体,p-AKT抗体,胞外信号调节激酶(extracellular signal-regulated kinase, ERK)抗体,p-ERK抗体(Cell Signaling Technology,美国),全蛋白提取试剂盒(索莱宝科技有限公司,北京),Cell Counting Kit-8试剂盒(白鲨生物科技有限公司,上海),Transwell小室(Coring,美国),神经钙黏素(N-cadherin)抗体(Affinity,中国),上皮钙黏素(E-cadherin)抗体(Affinity,中国),波形蛋白(vimentin)抗体(Affinity,中国)。
1.3. 实验方法
1.3.1. 免疫组织化学(IHC)检测OSCC和正常口腔黏膜组织中Tie2的表达
取组织标本蜡块连续切片,脱蜡水化,抗原修复,3%过氧化氢阻断,山羊血清封闭,加一抗(1∶100),4 ℃冰箱过夜。PBS冲洗,加入二抗,作用1 h,PBS冲洗,DAB显色,苏木精衬染,盐酸酒精分化,脱水,中性树胶封片,观察。根据染色强度和阳性细胞比例判定结果[7]。
1.3.2. shRNA慢病毒载体的合成
根据NCBI人源Tie2基因序列,设计合成针对Tie2的3条重组慢病毒干扰序列:Tie2-shRNA-161、162、163;同时设计合成1条不针对任何靶基因的阴性对照序列:shRNA-429。由成都豪乙生物科技有限公司合成并进行序列测序鉴定,见表1。
表 1. Four double-stranded shRNA sequences.
四种双链shRNA序列
| Gene | Sequence |
| Tie2-shRNA-161 | 5′-TGGGTGACATTTGGGAGACAT-3′ |
| Tie2-shRNA-162 | 5′-GCTACCTACTAATGAAGAAAT-3′ |
| Tie2-shRNA-163 | 5′-CCCACTCCAATTTGACCCATA-3′ |
| Negative-shRNA-429 | 5′-TTCTCCGAACGTGTCACGTTT-3' |
1.3.3. 慢病毒转染
将HSC-4和SCC-9细胞(Tie2高表达细胞株)以密度为4×104 mL−1接种于6孔板中,通过预实验,确定转染最适条件为MOI=60。加入所需病毒量及助染剂,感染约72 h后荧光显微镜下观察荧光表达情况,加入质量浓度为2.5 μg/mL的嘌呤霉素筛选细胞株,直到在荧光显微镜的白光与绿色荧光下细胞形态基本一致约80%左右,确定感染成功。
1.3.4. CCK-8检测细胞增殖能力
HSC-4和SCC-9细胞各分为实验组shRNA-162和对照组shRNA-429。调整细胞悬液浓度为2×103 mL−1,加入96孔板(100 μL/孔)中培养,在不同时间点(1、2、3、4、5 d)加入10 μL CCK8溶液于每孔内,培养2 h,酶标仪测定492 nm处的光密度(optical density, OD)值,绘制增殖曲线。
1.3.5. 克隆形成实验检测细胞克隆形成能力
细胞分组同1.3.4。按800细胞/皿的细胞数接种到5 cm皿中,培养2周,每2~3 d更换培养基,待细胞出现克隆团时,去除培养液,体积分数为4%多聚甲醛固定20 min,0.2%结晶紫染色15 min。洗去染色液,干燥,拍摄细胞克隆形成情况,以肉眼计数克隆形成数量,取平均值。
1.3.6. 单细胞培养检测细胞克隆形态
细胞分组同1.3.4。提取细胞悬液,采取有限稀释法将细胞连续数倍稀释到极低密度,将稀释好的细胞悬液接种于96孔板,每孔加0.1 mL培养基。选取只含1个细胞的孔,划好标记,补加0.1 mL培养基,继续培养2周,观察细胞克隆情况。拍照并计算每孔中的细胞群落数,克隆形成率=克隆数÷接种细胞数×100%。
1.3.7. 细胞划痕实验检测细胞运动能力
细胞分组同1.3.4。将密度为3×105 mL−1细胞悬液接种于6孔板中,培养24 h,以垂直于水平线方向作一宽度均匀的划痕,PBS清洗3次,显微镜下定点拍照(0 h、48 h),采集图像。结果用Image J软件计算细胞迁移的距离进行统计学分析。
1.3.8. Transwell检测细胞迁移能力
细胞分组同1.3.4。将细胞密度为1.0×105 mL−1的100 μL细胞悬液加入预冷的Transwell上室中,下室加入600 μL完全培养基,孵育48 h。吸净上室、下室液体,PBS洗3次。用棉签将上室细胞擦净,下室加入甲醇固定20 min,0.1%结晶紫染色15~20 min。PBS清净染料,显微镜下观察。计数显微镜下每个视野中迁移细胞数,共计数9个视野,取均值。
1.3.9. 激光共聚焦显微镜检测细胞E-cadherin、N-cadherin和骨架F-actin重塑
细胞分组同1.3.4。检测E-cadherin和N-cadherin表达:①固定。用镊子小心取出盖玻片放入孔板中(注意区分细胞面与非细胞面),用预热的PBS轻轻洗涤2次,加入体积分数为4%多聚甲醛避光固定20 min。②封闭。弃去多聚甲醛,加入PBS清洗3×5 min,用含1%Triton-100的5%BSA(用PBS溶解)溶液室温封闭30 min。③一抗孵育。弃去封闭液,取载玻片加入用含1%Triton X-100的1%BSA(用PBS溶解)溶液稀释的一抗(E-cadherin、N-cadherin)(1∶100),放入湿盒4 ℃过夜。④二抗孵育。取载玻片用PBS清洗3×5 min,加入用1%BSA(含1%Triton X-100)溶液稀释的荧光二抗(1∶100),避光37 ℃孵育1 h。
检测骨架F-actin重塑:①细胞骨架染色。取载玻片避光条件下用PBS清洗3×5 min,加入30 μL已稀释的F-actin(浓度:100 nmol/L),放入湿盒室温孵育30 min。②DAPI染色。取载玻片避光条件下用PBS清洗3×5 min,取30 μL DAPI于干净载玻片上,吸干四周水分倒置于载玻片上,避光室温静置15 min。③封片。在盖玻片四周刷一层指甲油封片。激光共聚焦显微镜观察染色结果,计数显微镜下每个细胞中丝状伪足数,共计数约30个细胞,取均值。
1.3.10. Western blot
采用Western blot检测Tie2高表达细胞株,同时检测沉默Tie2基因后EMT相关标志性蛋白和AKT、ERK蛋白的表达(细胞分组同1.3.4)。收集不同处理的细胞,加入提前配置好的细胞裂解混合液〔含0.1%的蛋白酶抑制剂,0.5%苯甲基磺酰氟(PMSF),1%磷酸酶抑制剂 〕放置于冰上充分裂解,4 ℃下12 000 r/min离心10 min,小心吸取上清至新的EP管中,使用BCA试剂盒测定蛋白浓度并处理蛋白制备样本。配置SDS-PAGE电泳,聚偏氟乙烯(PVDF)膜转膜,5%脱脂牛奶(TBST溶解)室温封闭1 h。封闭结束后取出膜,用TBST洗3×5 min(90 r/min)分别加入1∶1000稀释的抗Tie2、抗E-cadherin、抗N-cadherin、抗vimentin、抗AKT、抗p-AKT、抗ERK、抗p-ERK、抗β-actin抗体,4 ℃摇床过夜孵育(90 r/min)。取出孵育过夜的膜,TBST清洗3×10 min(90 r/min)后,加入5%脱脂牛奶稀释的山羊抗兔二抗(1∶2 000)、羊抗鼠二抗(1∶2 000),室温孵育2 h。孵育结束后,取出膜用TBST清洗3×10 min(90 r/min)。用ECL发光显影液显色,Chemidoc XRS采集图像。Image G软件分析条带灰度值,以目的条带灰度值与内参(β-actin)条带灰度值的比值作为目的蛋白相对表达量。
1.4. 统计学方法
数据均以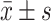 表示。采用χ2检验或t检验, α=0.05。
表示。采用χ2检验或t检验, α=0.05。
2. 结果
2.1. Tie-2在OSCC及正常口腔黏膜组织中的表达情况
IHC结果(图1)显示:在157例OSCC标本中,Tie2阳性率约74.5%(117/157)。而正常黏膜组阳性表达率为19.4%(6/31)。OSCC组Tie-2的阳性率高于正常黏膜组(P<0.0001)。
图 1.
Immunohistochemical staining results for Tie2 in OSCC tissues (A) and normal mucosal tissues (B). ×100
OSCC组织(A)和正常口腔黏膜组织(B)中 Tie2的免疫组化染色结果。 ×100
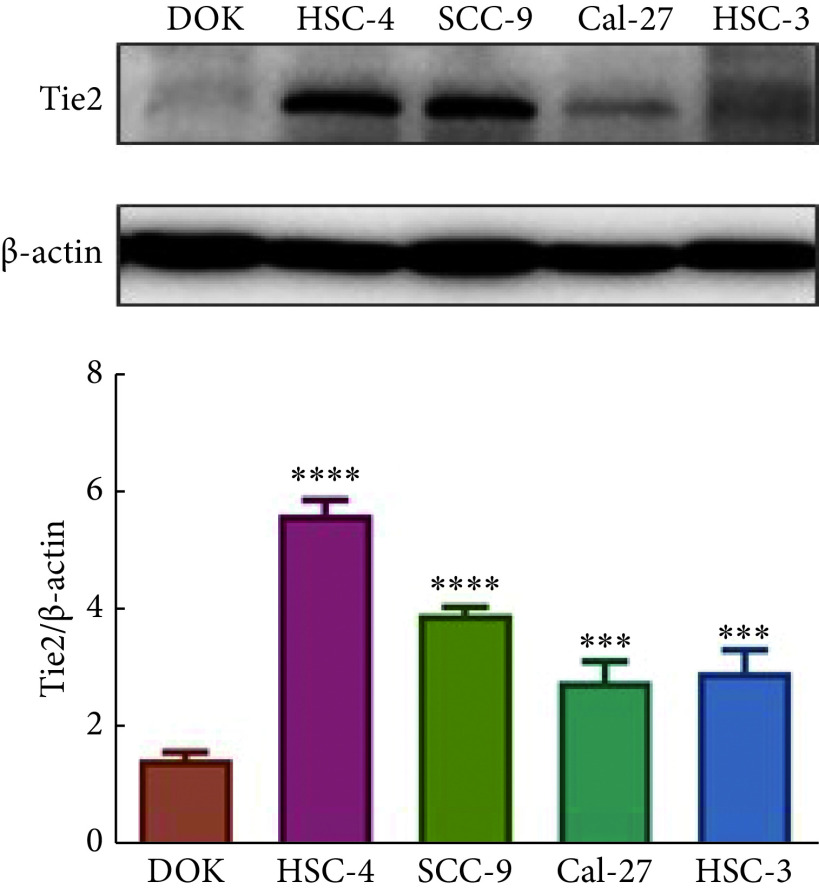
2.2. DOK细胞及4种口腔鳞癌细胞株中Tie2的表达情况
Western blot结果显示(图2):Tie2在DOK细胞及4种OSCC细胞株中均有所表达,相比DOK细胞,HSC-4中Tie2的表达水平最高(5.608±0.246),其次是SCC-9,Tie2 的表达量为3.901±0.123。因此,选择HSC-4、SCC-9作为实验细胞株以供后续实验。
图 2.
Expression of Tie2 in different cell lines
Tie2在不同细胞株中的表达情况
*** P<0.001, **** P<0.0001, vs. DOK cells.
2.3. 慢病毒转染情况及沉默Tie2效果
将3条慢病毒干扰序列(shRNA-161,shRNA-162,shRNA-163)成功转染至HSC-4、SCC-9后,Western blot检测HSC-4、SCC-9细胞株中Tie2蛋白敲减效率,结果显示:shRNA-162组中Tie2的表达最低(HSC-4中为0.652±0.003;SCC-9中为0.716±0.042),低于shRNA-429对照组(HSC-4中为1.000±0.050;SCC-9中为1.000±0.042)(P<0.0001)(图3)。筛选沉默效果最好的shRNA-162组作为实验组,供后续实验。
图 3.
Expression of Tie2 in HSC-4 (A) and SCC-9 (B) cell lines after stable transfection with virus
HSC-4(A)、SCC-9(B)细胞株稳定转染病毒后Tie2的表达
a: shRNA-429; b: shRNA-161; c: shRNA-163; d: shRNA-162. * P<0.05, **** P<0.0001, vs. a.
2.4. 沉默Tie2后对细胞增殖能力的影响
CCK-8检测结果显示:shRNA-162实验组的细胞增殖能力弱于shRNA-429对照组(P<0.05)(图4A)。说明沉默Tie2的表达能抑制HSC-4、SCC-9细胞增殖能力。
图 4.

Effect of Tie2 on the proliferation ability of HSC-4 and SCC-9 cells
Tie2对HSC-4、SCC-9细胞增殖能力的影响
A: the CCK-8 assay; B: the clone formation assay; C: the single-cell clonal culture. * P<0.05, *** P<0.001, **** P<0.0001, vs. shRNA-429 cells.
克隆形成实验结果显示:两组细胞中,shRNA-162实验组的克隆数量较shRNA-429对照组下降,克隆形成能力降低(HSC-4中shRNA-162实验组为121.000±28.350,shRNA-429对照组为391.000±46.800;SCC-9中shRNA-162实验组为37.000±8.869,shRNA-429对照组为128.000±8.641)(P<0.0001)(图4B)。说明沉默Tie2的表达能抑制HSC-4、SCC-9细胞的克隆形成能力。
单细胞培养结果显示:培养2周后HSC-4、SCC-9细胞均可见3种不同的克隆形态:全克隆(holoclone)、部分克隆(meroclone)、亚克隆(paraclone);其中全克隆细胞呈圆形或卵圆形,形态规则,排列整齐,边缘光滑,具有很高的增殖能力;亚克隆细胞形态不规则,边界不清晰,细胞较为松散;部分克隆介于全克隆和亚克隆之间。与shRNA-429对照组相比,shRNA-162实验组全克隆形成率下降,亚克隆形成率增加(P<0.05,P<0.001)(图4C)。说明沉默Tie2能抑制细胞的克隆增殖能力。
2.5. 沉默Tie2后对细胞迁移能力的影响
细胞划痕实验结果显示:在HSC-4、SCC-9细胞划痕48 h后,与shRNA-429对照组相比,shRNA-162实验组划痕愈合率降低(HSC-4细胞划痕愈合率由59.260%±3.704%降至15.480%±2.728%;SCC-9细胞划痕愈合率由35.220%±2.882%降至24.360%±5.875%)(P<0.05,P<0.0001)(图5A)。说明沉默Tie2能抑制HSC-4、SCC-9细胞的运动能力,其运动能力减弱。
图 5.
Effect of Tie2 on the migratory ability of HSC-4 and SCC-9 cells
Tie2对HSC-4、SCC-9细胞迁移能力的影响
A: cell scratch assay; B: Transwell assay; a: HSC-4; b: SCC-9.
Transwell实验结果显示:两组细胞中,shRNA-162实验组较shRNA-429对照组细胞迁移能力减弱〔细胞迁移数量HSC-4由(198.300±42.360)/field降至(77.750±10.050)/field;SCC-9由(78.600±8.735)/field降至(42.600±3.050)/field〕(P<0.01,P<0.0001)(图5B)。说明沉默Tie2能抑制HSC-4、SCC-9细胞迁移能力。
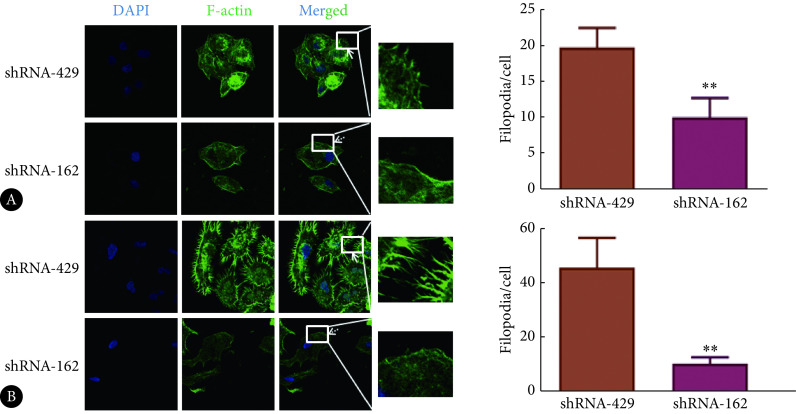
2.6. 沉默Tie2对细胞骨架F-actin重塑的影响
激光共聚焦显微镜检测结果显示:与shRNA-429对照组相比,shRNA-162实验组细胞骨架F-actin绿色荧光强度降低,细胞表面光滑,放大处可见细胞前缘丝状伪足数量减少(P<0.01)、长度变短,同时细胞质中应力纤维未能清晰可辨(图6)。这表明沉默Tie2的表达可以降低HSC-4、SCC-9细胞骨架F-actin荧光强度,减少细胞前缘丝状伪足数量,降低其运动迁移能力,明显抑制细胞骨架F-actin重塑。
图 6.
Cytoskeletal F-actin expression and the number of filamentous pseudopods in HSC-4 (A) and SCC-9 (B) cells were determined by confocal laser scanning microscope (Confocal). ×100
激光共聚焦显微镜检测HSC-4(A)、SCC-9(B)中细胞骨架F-actin表达情况和丝状伪足的数量。 ×100
** P<0.01, vs. shRNA-429.
2.7. 沉默Tie2对细胞E-cadherin、N-cadherin、vimentin蛋白表达的影响
Wetern blot结果显示:与shRNA-429对照组比较,shRNA-162实验组E-cadherin的蛋白表达水平增加,N-cadherin、vimentin的蛋白表达水平降低(P<0.0001)。表明沉默Tie2可能对EMT的进展具有抑制作用(图7A),提示Tie2可能参与了OSCC的EMT过程。
图 7.
The expression of E-cadherin, N-cadherin, and vimentin proteins in HSC-4 and SCC-9 cells
HSC-4、SCC-9细胞E-cadherin、N-cadherin和vimentin蛋白的表达
A: Western blot; B: confocal laser scanning microscope (×200); a: shRNA-429; b: shRNA-162. **** P<0.0001, vs. a.
激光共聚焦显微镜检测结果显示:与shRNA-429对照组相比,shRNA-162实验组细胞E-cadherin的表达明显增加,荧光强度明显增强,而N-cadherin的表达明显降低,荧光强度明显减弱(图7B)。表明沉默Tie2可能对EMT的进展具有抑制作用,进一步验证了上述结果。
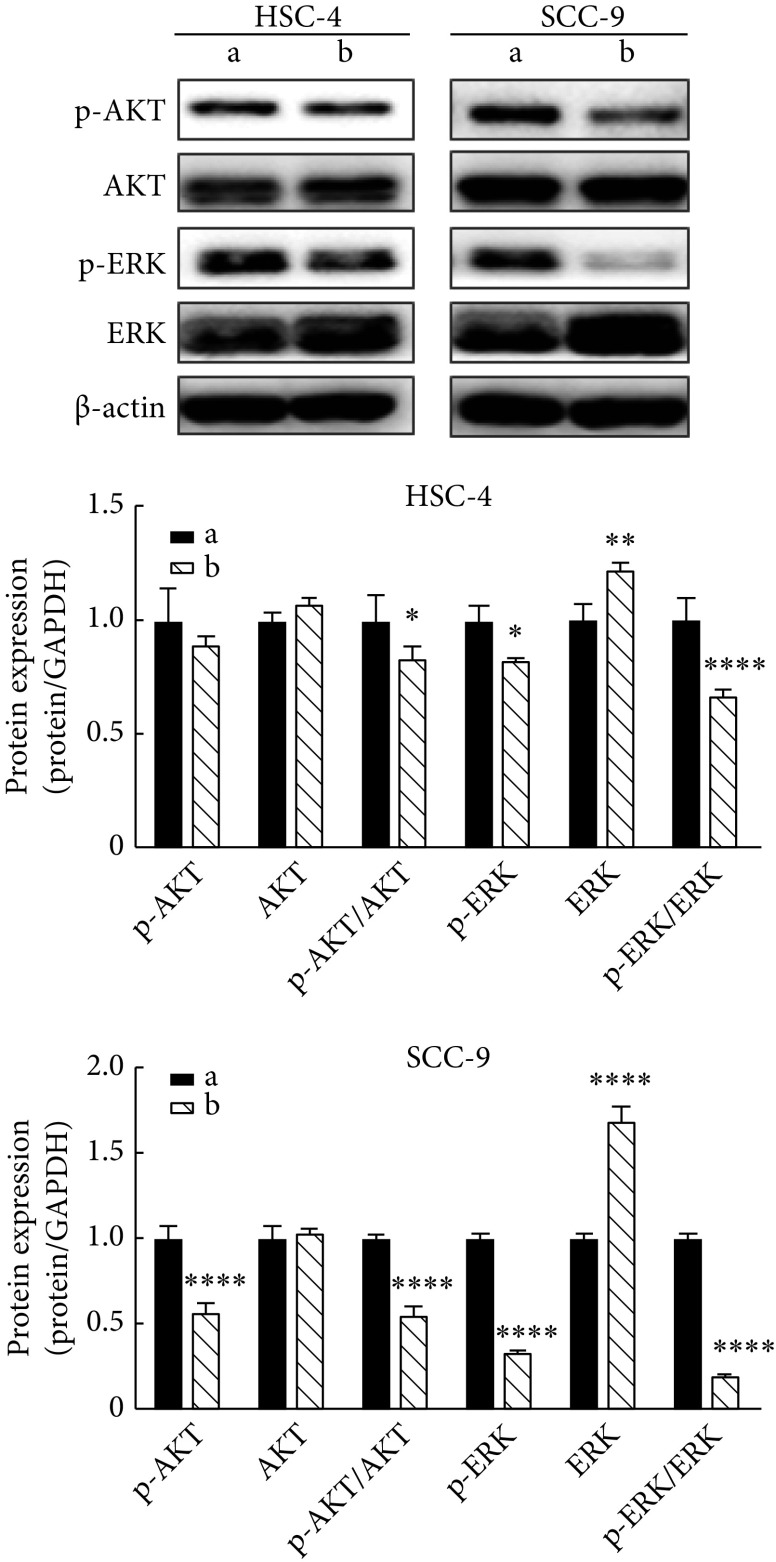
2.8. 沉默Tie2对细胞中AKT、p-AKT、ERK、p-ERK蛋白表达的影响
结果显示:与shRNA-429对照组相比,shRNA-162实验组p-AKT(SCC-9细胞)、p-AKT/AKT、p-ERK、p-ERK/ERK的表达降低(P<0.05),ERK的表达增加(P<0.01)(图8)。表明沉默Tie2对AKT及ERK信号通路具有抑制作用。
图 8.
Western blot was performed to determine the expression of AKT, p-AKT, ERK, and p-ERK proteins in HSC-4 and SCC-9 cells
Western blot检测HSC-4、SCC-9细胞中AKT、p-AKT、ERK、p-ERK蛋白的表达
a: shRNA-429; b: shRNA-162. * P<0.05, ** P<0.01, **** P<0.0001, vs. a.
3. 讨论
Tie2最早于1992年由ZIEGLER等[8]从人的胎盘中克隆发现,该基因位于9p21染色体上,共编码约1124 个氨基酸。Tie2主要表达于血管内皮细胞表面,随着研究的深入发现其在单核巨噬细胞、周细胞、肿瘤细胞表面均有所表达[9],Tie2不仅在正常组织如胚胎发育中的血管分化发挥作用,在病理状态下如炎症、肿瘤中的血管生成中也扮演重要的角色。
肿瘤的增殖、迁移与肿瘤的血管生成密切相关,而Tie2作为一种内皮细胞特异性受体,在肿瘤的血管生成中发挥着重要作用,大量研究[6, 10-12]证实在肝癌、胶质母细胞瘤和宫颈癌等多种肿瘤中,Tie2充当着促癌基因的角色,Tie2高表达对肿瘤的血管生成具有促进作用,阻断Tie2信号可以减少肿瘤相关内皮细胞的血管生成,对抑制肿瘤细胞的增殖、转移十分重要[13]。有学者[14]曾利用IHC检测发现Tie2在OSCC组织中的阳性表达率明显高于正常组织,且与病理分级成正相关,这与本实验的结果相一致。同时,本实验结果显示,沉默Tie2的表达能抑制OSCC细胞的增殖克隆以及迁移能力,并且利用激光共聚焦显微镜检测了Tie2对细胞骨架F-actin表达的影响,结果显示:沉默Tie2后,细胞骨架F-actin绿色荧光强度减弱,丝状伪足明显减少,细胞的运动、迁移能力减弱。这也进一步验证了沉默Tie2能抑制OSCC细胞的迁移能力,说明Tie2在肿瘤的转移过程中发挥重要作用。
EMT被认为是癌症转移的重要过程;由于上皮细胞间极性消失,黏附能力下降,逐渐向间充质型转化,获得其结构和功能特征,细胞的运动性及迁移能力增强,最终导致肿瘤细胞的转移扩散[3, 15];主要特征表现为上皮标志物表达减少, 间质标志物表达增加[16]。在此过程中,大量信号分子如转化生长因子β、血管内皮生长因子等刺激多种信号通路,激活部分EMT转录因子如ZEB家族、Snail和Twist的表达,促进EMT的发生[17]。研究发现OSCC的生长转移伴随有EMT的发生,如在OSCC患者中发现E-cadherin的mRNA及蛋白表达水平显著降低,且在低分化及有淋巴结转移的OSCC患者中更为明显,这提示E-cadherin与OSCC生长转移及病理分级密切相关,被认为是OSCC的高危标志物[18-19]。本实验通过沉默Tie2的表达对EMT相关蛋白进行检测,结果显示沉默Tie2的表达可以改变OSCC中EMT相关标志性蛋白的表达,如上皮标志物E-cadherin表达的增加,间质标志物如N-cadherin、vimentin表达的降低,提示沉默Tie2对OSCC的EMT进展具有抑制作用,从而抑制OSCC的生长转移。
ERK及AKT都是十分经典的信号传导途径,由于各种因素的刺激,ERK及AKT发生磷酸化而得以激活,从而对细胞的增殖分化迁移发挥调控作用[20];研究发现,Tie2可通过刺激ERK、AKT等下游信号通路对肿瘤细胞的增殖转移发挥重要作用[21]。在口腔癌细胞中,miR-1179表达的下降能抑制ERK及AKT的磷酸化水平,进而使口腔癌的生长与增殖得到抑制[22]。这提示ERK及AKT信号均参与肿瘤细胞的增殖迁移等过程,并发现其与肿瘤化疗过程中的耐药也存在密切关系[23];为进一步阐明Tie2在OSCC增殖转移过程中的分子机制,本研究对Tie2的下游信号ERK及AKT的表达进行了检测,结果显示在口腔鳞癌细胞株中,沉默Tie2后,p-AKT、p-AKT/AKT、p-ERK、p-ERK/ERK的表达降低,ERK的表达增加;这表明沉默Tie2能通过抑制AKT及ERK的磷酸化,从而调控OSCC细胞的生长增殖。这与前期的学者研究一致。
综上所述,Tie2在OSCC组织中的表达明显高于正常黏膜组织,沉默Tie2可通过调控AKT及ERK信号通路,抑制OSCC细胞增殖克隆迁移能力,抑制OSCC细胞骨架F-actin的重塑,改变OSCC细胞EMT相关标志性蛋白的表达,提示Tie2可能参与了OSCC的生长、转移及EMT过程;后续课题组将研究Tie2的配体血管生成素(angiopoietin, Ang)在OSCC中的作用,并进行体内动物实验进一步验证Tie2及其配体Ang对OSCC增殖转移能力以及其对口腔癌颌骨侵犯的影响,为治疗晚期及复发转移的口腔鳞癌患者提供一种新的治疗靶点,从而为提高其生存率提供可能。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省卫健委项目(No. 30305031136)资助
Contributor Information
珉 郑 (Min ZHENG), Email: 26642352@qq.com.
怡 黄 (Yi HUANG), Email: maohuangyi@163.com.
雄 聂 (Xiong NIE), Email: 823972788@qq.com.
References
- 1.SIEGEL R L, MILLER K D, FUCHS H E, et al Cancer statistics, 2022. CA Cancer J Clin. 2022;72(1):7–33. doi: 10.3322/caac.21708. [DOI] [PubMed] [Google Scholar]
- 2.DHANUTHAI K, ROJANAWATSIRIVEJ S, THOSAPORN W, et al Oral cancer: a multicenter study. Med Oral Patol Oral Cir Bucal. 2018;23(1):e23–e29. doi: 10.4317/medoral.21999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.YANG J, ANTIN P, BERX G, et al Guidelines and definitions for research on epithelial-mesenchymal transition. Nat Rev Mol Cell Biol. 2020;21(6):341–352. doi: 10.1038/s41580-020-0237-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SONG Q, ZHANG F, YUAN T, et al Upregulated Tie2 expression in plasma: a potential non-invasive biomarker for the diagnosis of breast cancer. Euro Cytokine Netw. 2021;32(2):39–47. doi: 10.1684/ecn.2021.0468. [DOI] [PubMed] [Google Scholar]
- 5.SOPO M, SALLINEN H, HÄMÄLÄINEN K, et al High expression of Tie-2 predicts poor prognosis in primary high grade serous ovarian cancer. PLoS One. 2020;15(11):e0241484. doi: 10.1371/journal.pone.0241484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.VANDERBORGHT B, LEFERE S, VLIERBERGHE H V, et al The Angiopoietin/Tie2 pathway in hepatocellular carcinoma. Cells. 2020;9(11):2382. doi: 10.3390/cells9112382. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.赵开, 袁文红, 李文健, 等 RhoE在舌鳞状细胞癌中的表达及其对细胞迁移和侵袭的影响. 华西口腔医学杂志. 2021;39(5):510–517. doi: 10.7518/hxkq.2021.05.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.ZIEGLER S F, BIRD T A, SCHNERINGER J A, et al Molecular cloning and characterization of a novel receptor protein tyrosine kinase from human placenta. Oncogene. 1993;8(3):663–670. [PubMed] [Google Scholar]
- 9.TEICHERT M, MILDE L, HOLM A, et al Pericyte-expressed Tie2 controls angiogenesis and vessel maturation. Nat Commun. 2017;8:16106. doi: 10.1038/ncomms16106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.DESHORS P, TOULAS C, ARNAUDUC F, et al Ionizing radiation induces endothelial transdifferentiation of glioblastoma stem-like cells through the Tie2 signaling pathway. Cell Death Dis. 2019;10(11):816. doi: 10.1038/s41419-019-2055-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.DU S, QIAN J, TAN S, et al Tumor cell-derived exosomes deliver TIE2 protein to macrophages to promote angiogenesis in cervical cancer. Cancer Lett. 2022;529:168–179. doi: 10.1016/j.canlet.2022.01.005. [DOI] [PubMed] [Google Scholar]
- 12.TAN S, CHEN Y, DU S, et al TIE2-high cervical cancer cells promote tumor angiogenesisby upregulating TIE2 and VEGFR2 in endothelial cells. Transl Oncol. 2022;26:101539. doi: 10.1016/j.tranon.2022.101539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.PAYTON M, JUN T, WAYNE W, et al Antagonism of Ang-Tie2 and Dll4-Notch signaling has opposing effects on tumor endothelial cell proliferation, evidenced by a new flow cytometry method. Lab Invest. 2014;94(11):1296–1308. doi: 10.1038/labinvest.2014.116. [DOI] [PubMed] [Google Scholar]
- 14.冀洪海, 杨勇, 胥欣, 等 Tie2受体在口腔鳞癌中的表达. 口腔颌面外科杂志. 2008;18(6):386–389. doi: 10.3969/j.issn.1005-4979.2008.06.002. [DOI] [Google Scholar]
- 15.DEBNATH P, HUIREM R S, DUTTA P, et al Epithelial-mesenchymal transition and its transcription factors. Biosci Rep. 2022;42(1):BSR20211754. doi: 10.1042/BSR20211754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.司书遥,李春鸣,姚娜 KLF4与上皮间质转化的关系在肿瘤中的研究进展. 遵义医科大学学报. 2022;45(2):266–269. doi: 10.14169/j.cnki.zunyixuebao.2022.0041. [DOI] [Google Scholar]
- 17.DONGRE A, WEINBERG R A New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer. Nat Rev Mol Cell Biol. 2019;20(2):69–84. doi: 10.1038/s41580-018-0080-4. [DOI] [PubMed] [Google Scholar]
- 18.LÓPEZ-VERDÍN S, MARTÍNEZ-FIERRO M L, GARZA-VELOZ I, et al E-Cadherin gene expression in oral cancer: clinical and prospective data. Med Oral Patol Oral Cir Bucal. 2019;24(4):e444–e451. doi: 10.4317/medoral.23029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.KAR D, BANERJEE S Epithelial expression of epithelia-cadherin in different grades of oral squamous cell carcinoma. J Oral Maxillofac Pathol. 2021;25(2):253–257. doi: 10.4103/0973-029X.325123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.SAKO K, SAKAI D, NAKAMURA Y, et al Effect of whole tissue culture and basic fibroblast growth factor on maintenance of Tie2 molecule expression in human nucleus pulposus cells. Int J Mol Sci. 2021;22(9):4723. doi: 10.3390/ijms22094723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.QI S, DENG S, LIAN Z, et al Novel drugs with high efficacy against tumor angiogenesis. Int J Mol Sci. 2022;23(13):6934. doi: 10.3390/ijms23136934. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.GAO Y, XU H, PU T MicroRNA-1179 suppresses the proliferation and enhances vincristine sensitivity of oral cancer cells via induction of apoptosis and modulation of MEK/ERK and PI3K/AKT signalling pathways. AMB Express. 2020;10(1):149. doi: 10.1186/s13568-020-01082-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.LIU R, CHEN Y W, LIU G Z, et al PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers. Cell Death Dis. 2020;11(9):797. doi: 10.1038/s41419-020-02998-6. [DOI] [PMC free article] [PubMed] [Google Scholar]