Abstract
目的
探讨首发重度抑郁症(major depressive disorder, MDD)青少年患者药物治疗后的血清炎症因子变化以及舍曲林疗效的预测因素。
方法
本研究纳入61例首发未用药的MDD青少年患者(MDD组)和55例健康青少年(HC组)。MDD组患者在入组后予盐酸舍曲林片治疗8周,健康对照组不予任何治疗。MDD组分别在基线和治疗后8周进行采集血样检测血清中炎症因子水平和临床资料评定〔17项汉密尔顿抑郁量表(17-items Hamilton Depression Scale, HAMD-17)和心理弹性量表(Connor-Davidson Resilience Scale, CD-RISC)〕,HC组仅在基线期采血检测和临床资料采集。分析MDD组炎症因子水平与抑郁严重程度的相关性,并进行MDD组HAMD-17的逐步线性回归,寻找能预测舍曲林疗效的血清学指标。
结果
基线时MDD组的IL-1β和IL-6水平高于HC组(P均<0.0001),TNF-α水平低于HC组(P=0.006)。经过8周用药后,MDD组IL-1β、IL-6均下降,TNF-α水平较治疗前升高,HAMD-17、CD-RISC总分、坚韧、相信直觉及控制得分均升高。应答组和无应答组的基线期血清炎症因子水平无明显差异。治疗前后的IL-6水平与治疗前后的CD-RISC及其相信直觉因子评分弱相关。基线期间IL-1β、TNF-α水平对治疗后的HAMD-17评分影响无统计学意义。
结论
青少年MDD患者血清炎症因子与健康青少年存在明显差异,IL-6与抑郁症严重程度相关,但尚不足以支持其作为预测舍曲林抗抑郁疗效的指标。
Keywords: 细胞因子, 重度抑郁症, 青少年, 首发
Abstract
Objective
To investigate the changes in serum inflammatory cytokines and the predictive factors for the efficacy of sertraline following medication therapy in adolescents with first-episode major depressive disorder (MDD).
Methods
A total of 61 adolescent patients with first-episode drug-naïve MDD were enrolled for the MDD group and 55 healthy adolescents were enrolled for the healthy control (HC) group. Sertraline tablets were administered to the MDD group for 8 weeks after enrollment, while no medication was given to the HC group. In the MDD group, blood samples were collected to measure the cytokine levels and clinical data, including scores for the 17-item Hamilton Depression Scale (HAMD-17) and the Connor-Davidson Resilience Scale (CD-RISC), were assessed at baseline and at the end of the 8-week medication, whereas in the HC group, blood samples and clinical data were collected only at baseline. The correlation between the levels of serum inflammatory cytokines and depression severity in the MDD group was analyzed and stepwise linear regression of HAMD-17 in the MDD group was performed to find serologic indicators that could be used to predict the efficacy of sertraline.
Results
At baseline, the levels of interleukin (IL)-1β and IL-6 in the MDD group were significantly higher than those in the HC group (all P<0.0001), while the tumor necrosis factor (TNF)-α level in the MDD group was significantly lower than that in the HC group (P=0.006). After 8 weeks of medication treatment, the MDD group showed decreased levels of IL-1β and IL-6 and increased level of TNF-α compared to the pre-treatment levels. In addition, the HAMD-17 score, CD-RISC total score, and scores for perceived competence, trust and tolerance, and control, three factors of CD-RISC, all improved after treatment. There was no significant difference in serum cytokine levels at baseline between the subgroup showing response to the treatment and the non-responding subgroup. There was a weak correlation between IL-6 levels before and after treatment and CD-RISC scores and the scores for the trust and tolerance factor of CD-RISC before and after treatment. The baseline IL-1β and TNF-α levels did not show significant effect on posttreatment HAMD-17 scores.
Conclusions
Serum cytokine levels of adolescents with first-episode MDD differ significantly from those of healthy adolescents. Although IL-6 was found to be correlated with depression severity, there was not enough support for it to be used as a predictor of the antidepression efficacy of sertraline.
Keywords: Cytokine, Major depressive disorder, Adolescents, First-episode
重度抑郁症(major depressive disorder, MDD)是一种常见且严重的精神疾病,具有高发病率和高死亡率[1]。近年来抑郁症呈现年轻化趋势,而青少年MDD好发于12~17 岁[2]。
研究发现,炎症因子参与抑郁症的发病机制已经成为抑郁症研究的热点之一[3-5]。重度抑郁症与炎症系统失衡相关,抗抑郁药物可以降低外周血清炎症因子水平[6-10]。然而,这些研究主要基于成人MDD的研究,抗抑郁药与青少年MDD血清炎症因子的研究较少,血清炎症因子是否能够成为青少年MDD抗抑郁药物疗效预测的生物标志尚缺乏可靠证据。我们假设,血清炎症水平与青少年MDD及抗抑郁药治疗反应密切相关,可能是预测青少年MDD治疗反应的潜在生物标志物。众所周知,SSRI类药物作为青少年抑郁症患者的首选用药,而其中舍曲林相较于其他SSRI类药物具有良好的耐受性以及缺乏药代动力学相互作用的特点,被推荐作为青少年抑郁症的一线用药[11]。本研究为一项开放标签、为期8周的临床研究,采用舍曲林对青少年MDD患者进行治疗,检测其血清IL-1β、IL-6、TNF-α是否发生变化,以了解青少年MDD在治疗过程中血清炎症因子水平的变化,并探索治疗前的血清炎症因子是否可以预测舍曲林的治疗反应。
1. 对象与方法
1.1. 研究对象
本研究在2021年7月–2022年3月,从重庆医科大学附属第一医院共招募61例青少年重度抑郁症患者(MDD组)。所有纳入的青少年均符合《精神疾病诊断与统计手册(第5版)》(DSM-5)中关于重性抑郁发作的诊断标准,且至少在1个月内没有接受过抗抑郁治疗,诊断由精神科医生采用简明儿童少年国际神经精神访谈(Mini-International Neuropsychiatric Interview for Children and Adolescents, MINI Kid)[12]进行结构化的精神访谈,纳入标准为:①年龄12~17岁,汉族;②17项汉密尔顿抑郁症量表(17-item Hamilton Depression Scale, HAMD-17)得分大于17分。
健康对照组(HC组)包括55例健康青少年,均通过海报招募。对照组目前及既往没有抑郁症或任何其他精神疾病的历史,且与MDD组在年龄、性别和教育方面匹配。患者和健康对照组的排除标准:①有其他影响情绪的躯体合并症;②有免疫系统和内分泌系统疾病;③有急性或近期感染、传染病;④有慢性身体疾病或慢性炎症;⑤研究前一个月使用抗炎药物或免疫调节剂或激素制剂;⑥拒绝签署知情同意书。
1.2. 研究设计
本研究是一个为期8周的试验,分别在基线(0)和试验结束(8 w)时评估访问。患者在入组后予盐酸舍曲林片治疗8周,初始剂量25 mg/d,第 1 周加量至100 mg/d,根据患者病情变化增加到 150~200 mg/d。健康对照组不予任何治疗。
该研究得到了重庆医科大学附属第一医院伦理委员会的批准(2021-546)。所有受试者及监护人均签署了知情同意书。
1.3. 采集血样和实验室检测
在药物治疗前一天早上和治疗后8周分别采集MDD组患者的血液样本,健康对照组于基线期在空腹状态下采集血液样本。用不含抗凝剂的试管抽取5 mL血液,在室温下自然凝固20 min,然后在3000 r/min下离心分离血清,分离的血清在−80 ℃下保存,直到分析细胞因子时取出。采用酶联免疫吸附试验检测血清中的IL-1β、IL-6、TNF-α。
1.4. HAMD-17[13]
HAMD-17用于评估抑郁症患者的症状,共17个条目,其中8个条目设置为0~2三级评分,9个条目设置为0~4五级评分,总分越高表示抑郁症状程度越重,在临床上作为判定抑郁症严重程度的金标准。HAMD-17降低50%或以上的患者被认为是有应答者,否则为无应答者[14]。
1.5. 心理弹性量表(Connor-Davidson Resilience Scale, CD-RISC)[15]
CD-RISC包含25个条目,每个条目均为0~4五级评分。该量表包含五个维度:坚韧、相信直觉、积极接受、控制、精神影响。CD-RISC用于描述个体过去1个月内的心理感受,总分范围在0~100分,分数越高,心理弹性和应激应对能力越好,个体的心理弹性水平可以预测个体的抑郁、焦虑、压力水平。
1.6. 统计学方法
计量资料以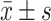 表示,采用夏皮罗-威尔克检验进行正态性检验,对于正态分布的连续变量,采用独立t检验进行统计学比较,对于非正态分布的连续变量,采用Mann-Whitney U检验来评估。计数资料以频数和百分比表示,采用皮尔逊卡方检验或Fisher精确检验来评估统计学差异。根据数据是否为正态分布,采用皮尔逊相关检验或斯皮尔曼相关检验来探讨参数之间的相关性。应用逐步线性回归分析HAMD-17的预测因素。P<0.05为差异有统计学意义。
表示,采用夏皮罗-威尔克检验进行正态性检验,对于正态分布的连续变量,采用独立t检验进行统计学比较,对于非正态分布的连续变量,采用Mann-Whitney U检验来评估。计数资料以频数和百分比表示,采用皮尔逊卡方检验或Fisher精确检验来评估统计学差异。根据数据是否为正态分布,采用皮尔逊相关检验或斯皮尔曼相关检验来探讨参数之间的相关性。应用逐步线性回归分析HAMD-17的预测因素。P<0.05为差异有统计学意义。
2. 结果
2.1. 人口统计学和临床特征
MDD组与HC组在年龄、性别、受教育程度、BMI、吸烟史、饮酒量等方面差异均无统计学意义。两组间的家族史差异有统计学意义(P<0.05),如表1所示。
表 1. Comparison of the demographics of the HC group and those of the MDD group.
抑郁症组与健康对照组人口统计学信息比较
| Index | HC group (n=55) | MDD group (n=61) | t/χ2 | P |
| HC: healthy control; MDD: major depressive disorder; BMI: body mass index. | ||||
| Age/yr. | 15.35±0.84 | 15.08±1.33 | −1.285 | 0.202 |
| Sex/case (%) | 0.109 | 0.742 | ||
| Male | 15 (27.30) | 15 (24.60) | ||
| Female | 40 (72.70) | 46 (75.40) | ||
| Education/year | 9.39±1.20 | 9.39±1.68 | 0.246 | 0.806 |
| BMI/(kg/m2) | 20.12±2.74 | 20.99±3.66 | 1.476 | 0.143 |
| Smoking history/case (%) | 0.011 | 1.000 | ||
| Yes | 2 (3.60) | 2 (3.30) | ||
| No | 53 (96.40) | 59 (96.70) | ||
| Alcohol consumption/case (%) | 0.035 | 1.000 | ||
| Yes | 4 (7.30) | 5 (8.20) | ||
| No | 51 (92.70) | 56 (91.80) | ||
| Family history/case (%) | 6.717 | 0.014 | ||
| Yes | 0 (0) | 7 (11.50) | ||
| No | 55 (100) | 54 (88.50) | ||
2.2. MDD青少年治疗前后与健康青少年细胞因子水平的差异
如表2所示,基线时(治疗前)MDD组的IL-1β和IL-6水平高于HC组(P均<0.0001),而TNF-α水平低于HC组(P=0.006)。用药8周后,MDD组IL-1β、IL-6水平均较治疗前下降,而TNF-α水平较治疗前升高。MDD组治疗后IL-1β、TNF-α恢复到HC组水平(P>0.05),但IL-6仍高于HC组(P<0.05)。如表3所示,MDD组经8周治疗后,HAMD-17、CD-RISC总分、坚韧、相信直觉及控制得分均升高,而积极接受和精神影响得分无显著变化。
表 2. Comparison of cytokine levels between the HC group and the MDD group before and after treatment.
MDD患者治疗前后与健康对照血清炎症因子比较
| Index | MDD group (n=61) | HC group (n=55) | |
| Before treatment | After treatment | ||
| IL: interleukin; TNF: tumor necrosis factor; the other abbreviations are explained in the note to Table 1. * P<0.05, vs. HC group; # P<0.05, vs. after treatment in MDD group. | |||
| IL-1β | 55.76±11.43*, # | 45.19±8.49 | 42.49±9.92 |
| IL-6 | 30.87±3.25*, # | 29.06±5.87* | 26.15±7.93 |
| TNF-α | 44.97±11.19# | 48.78±7.96 | 49.37±7.23 |
表 3. Comparison of changes in depression levels before and after treatment in 61 MDD patients.
61例MDD患者治疗前后抑郁程度变化比较
| Index | Before treatment | After treatment | t/z | P |
| HAMD-17: 17-item Hamilton Depression Scale; CD-RISC: Connor-Davidson Resilience Scale; PC: perceived competence; TT: trust and tolerance; ACC: acceptance; CTRL: control; SPR: spirituality. | ||||
| HAMD-17 | 23.43±3.30 | 13.41±6.20 | 12.055 | <0.001 |
| CD-RISC | 30.02±15.15 | 37.44±19.89 | −3.556 | 0.001 |
| PC | 9.04±6.23 | 11.43±7.52 | −2.684 | 0.010 |
| TT | 7.24±4.51 | 9.30±5.39 | −3.399 | 0.001 |
| ACC | 7.22±3.35 | 8.11±4.41 | −1.776 | 0.082 |
| CTRL | 3.39±2.31 | 4.57±2.98 | −3.162 | 0.003 |
| SPR | 3.59±2.07 | 4.04±2.04 | −1.454 | 0.152 |
根据HAMD-17评分的变化,61例参与者被分为27例有应答者(44.3%)和34例无应答者(55.7%)。如表4所示,应答者和无应答者之间的基线期炎症因子无显著差异。
表 4. Comparison of baseline cytokine levels between responders and nonresponders to MDD treatment.
MDD患者应答组与无应答组的基线血清炎症因子比较
| Index | Responders (n=27) | Nonresponders (n=34) | t/z | P |
| MDD: major depressive disorder; IL: interleukin; TNF: tumor necrosis factor. | ||||
| IL-1β | 56.17±13.99 | 55.44±9.13 | 0.234 | 0.816 |
| IL-6 | 30.84±3.67 | 30.89±2.93 | −0.070 | 0.945 |
| TNF-α | 44.87±10.92 | 45.06±11.58 | −0.064 | 0.949 |
2.3. 炎症因子水平与抑郁严重程度的相关性
如表5所示,基线IL-1β、IL-6水平均与基线时HAMD-17评分呈中等强度正相关,而与基线时CD-RISC总分及其坚韧、相信直觉、积极接受和控制4个因子评分负相关。基线TNF-α水平仅与基线HAMD-17评分弱相关。基线IL-6水平与治疗后的CD-RISC总分及其相信直觉、积极接受、控制3个因子评分弱相关。治疗后的IL-6水平与治疗后的CD-RISC总分及其坚韧、相信直觉2个因子评分弱相关,而治疗前后的IL-1β、TNF-α水平与治疗前后的HAMD-17评分和CD-RISC总分及其5个因子评分均无相关性。
表 5. Correlation between cytokine levels and the severity of depression (r).
炎症因子水平与抑郁严重程度的相关性分析(r)
| Index | IL-1β0 | IL-60 | TNF-α0 | IL-1β8 w | IL-68 w | TNF-α8 w |
| IL: interleukin; TNF: tumor necrosis factor; the other abbreviations are explained in the note to Table 3. ** P<0.001, * P<0.05. | ||||||
| HAMD-170 | 0.536** | 0.414** | −0.194* | |||
| CD-RISC0 | −0.413** | −0.329** | 0.137 | |||
| PC0 | −0.416** | −0.339** | 0.167 | |||
| TT0 | −0.345** | −0.254** | 0.130 | |||
| ACC0 | −0.303** | −0.286** | 0.131 | |||
| CTRL0 | −0.347** | −0.315** | 0.055 | |||
| SPR0 | −0.171 | 0.009 | −0.030 | |||
| HAMD-178 w | 0.101 | 0.094 | −0.008 | 0.005 | −0.009 | 0.246 |
| CD-RISC8 w | −0.123 | −0.346** | −0.025 | 0.030 | 0.306* | −0.239 |
| PC8 w | −0.130 | −0.259 | −0.037 | −0.046 | 0.321* | −0.220 |
| TT8 w | −0.058 | −0.299* | −0.072 | 0.076 | 0.270* | −0.198 |
| ACC8 w | −0.108 | −0.334* | 0.071 | −0.023 | 0.244 | −0.206 |
| CTRL8 w | −0.104 | −0.286* | −0.090 | 0.068 | 0.205 | −0.232 |
| SPR8 w | −0.109 | −0.244 | 0.019 | −0.039 | 0.179 | −0.137 |
如表6所示,在逐步线性回归分析模型中,基线IL-1β、TNF-α水平和基线期积极接受评分是基线期HAMD-17评分的独立因素,而基线期间IL-1β、TNF-α水平对治疗后的HAMD-17评分影响无统计学意义。
表 6. Stepwise linear regression of the HAMD-17 scores.
HAMD-17的逐步线性回归
| Dependent variable | Predictive variable | B | SE | β | t | P |
| B: regression coefficient; SE: standard error; β: standard regression coefficient; the other abbreviations are explained in the note to Table 3. | ||||||
| HAMD-170 | IL-1β0 | 0.465 | 0.064 | 0.503 | 7.308 | <0.001 |
| TNF-α0 | −0.198 | 0.082 | −0.161 | −2.426 | 0.017 | |
| ACC0 | −1.069 | 0.194 | −0.382 | −5.505 | <0.001 | |
| HAMD-178 w | TT0 | −0.485 | 0.172 | −0.356 | −2.823 | 0.007 |
3. 讨论
本研究通过对比首发重度抑郁症青少年患者与健康青少年的血清炎症因子水平来识别预测舍曲林治疗青少年重度抑郁症的疗效的有效因子。
在本研究中通过提取MDD患者和健康对照组的静脉血,检测血清炎症标志物IL-1β、IL-6和TNF-α。结果发现青少年MDD患者血清中IL-1β和IL-6水平高于健康青少年,而基线期TNF-α水平低于健康青少年。既往许多研究表明,IL-1β和IL-6在 MDD患者中升高,并且和MDD的症状和治疗反应存在密切关系[16-18],这与本研究结果一致。在8周治疗后,MDD组的IL-1β和IL-6水平均下降,且青少年MDD患者治疗后IL-1β水平与健康青少年相比无明显差异,而TNF-α水平在治疗后有升高的趋势。有啮齿类动物研究提示舍曲林可以与小胶质细胞中的TNF-α和TNF受体1结合,阻断TNF触发的NF-κB信号通路及其下游促炎细胞因子的合成,能够有效抑制小胶质细胞产生TNF-α和自由基一氧化氮,从而实现舍曲林的抗炎症机制[19]。PÉREZ-SÁNCHEZ等[20]的研究显示,青少年MDD患者在基线期的IL-6和TNF-α水平高于健康对照组,且在为期8周的治疗观察中仅在第4周出现浓度下降。一项关注儿童和青少年MDD的荟萃分析显示,MDD患者外周TNF-α水平高于健康对照组,但差异没有统计学意义[21]。GABBAY等[22]的研究显示,伴有自杀行为的青少年MDD患者的外周TNF-α水平低于不伴自杀行为的MDD青少年。在一项成人首发MDD患者血浆细胞因子的研究中显示,IL-1β、IL-6和TNF-α在4周抗抑郁治疗后显著下降[23]。这些结果的异质性可能来源于MDD青少年与成年患者的区别,以及是否为首发未用药患者的差异,在青少年MDD的外周血促炎因子中,IL-1β、IL-6可能更多地参与了青少年MDD的发生发展NG等[24]的荟萃分析显示,患抑郁症老年人的IL-6高于对照组。BUSPAVANICH等[25]的一项在成人中的研究显示,抑郁发病较快的患者的血清中IL-2、IL-4、IL-6、IL-10、TNF-α和IFN-γ水平相较发病较慢的患者显著降低。本研究与成年MDD研究结果一致,青少年MDD也存在免疫系统功能失调。一项荟萃分析显示,应答者与无应答者的MDD患者在基线期的IL-1β、IL-6和TNF-α水平无明显差异,这与本研究的结果一致[26],在青少年MDD治疗中,治疗前后的外周血炎症水平存在差异,舍曲林改变了青少年MDD患者体内炎症水平,但基线期炎症因子水平与疗效无显著相关性,这可能与纳入检测的炎症因子较少、样本量小有关。本研究结果为青少年抑郁症患者的体内的异常细胞因子水平和免疫功能失衡提供了更多的证据,舍曲林已被证明可以缓解抑郁,并在免疫激活状态下恢复正常的细胞免疫功能,这进一步提示IL-1β、IL-6、TNF-α参与了青少年抑郁症的发病机制,但遗憾的是本研究未能检测到能够预测疗效的炎症因子。免疫系统与年龄的变化密切相关,受到内分泌、神经、消化、心血管等生理系统变化的影响[27],因此在MDD青少年免疫功能失调也可能反映了其他健康问题(如肥胖)潜在风险的增加,对青少年重度抑郁症患者的免疫功能随访以及躯体健康疾病监测存在必要性。
MDD患者经过8周治疗后,HAMD-17呈现下降趋势,而CD-RISC及其坚韧、相信直觉、控制3个因子评分呈现上升趋势,治疗后评分与治疗前评分相比差异有统计学意义。本研究发现治疗前IL-1β、IL-6水平与基线HAMD-17评分正相关,而与CD-RISC及其坚韧、相信直觉、积极接受和控制4个因子评分负相关,其中治疗前后的IL-6水平与治疗前后的CD-RISC及其相信直觉因子评分的相关系数检验均有统计学意义,可见IL-6水平与心理弹性和应激应对能力相关,提升应激时的心理应对能力可能有助于抑郁症的恢复。
本研究结合了横断面和纵向研究,对MDD组和对照组进行了年龄、性别、受教育程度的匹配,且纳入试验组的患者均为首次发病且未经治疗的青少年患者,控制了药物对基线期炎症水平的影响。本研究控制了潜在的混杂偏倚,排除了有其他影响情绪的精神疾病、急慢性炎症、使用免疫调节剂的患者。本研究仍存在一些不足之处,MDD亚组样本量相对较小,需要进一步研究来评估反应者和非反应者炎症水平差异。本研究主要涉及临床试验,炎症也不能单独解释抑郁症的发病,其作用机制需要进一步研究。
本研究显示,IL-1β和IL-6的升高可能是青少年抑郁症发病的生物标志物,舍曲林治疗可以降低IL-1β、IL-6水平,基线IL-1β、IL-6水平与舍曲林抗抑郁疗效无关。青少年MDD患者治疗后的应激应对能力和心理弹性水平较前提高,治疗前后的IL-6水平与治疗前后的CD-RISC及其相信直觉因子评分均为弱相关,这提示IL-6具有作为抑郁症疗效的分子生物标志物的进一步研究前景,但在本研究中尚不足以支持作为预测抗抑郁疗效的指标。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金面上项目(No. 81971286)资助
Contributor Information
娇娇 向 (Jiao-jiao XIANG), Email: Xiangjiaoj955@163.com.
利 况 (Li KUANG), Email: kuangli0308@163.com.
References
- 1.NEMEROFF C B The state of our understanding of the pathophysiology and optimal treatment of depression: glass half full or half empty? Am J Psychiatry. 2020;177(8):671–685. doi: 10.1176/appi.ajp.2020.20060845. [DOI] [PubMed] [Google Scholar]
- 2.MULLEN S Major depressive disorder in children and adolescents. Ment Health Clin. 2018;8(6):275–283. doi: 10.9740/mhc.2018.11.275. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.BEUREL E, TOUPS M, NEMEROFF C B The bidirectional relationship of depression and inflammation: double trouble. Neuron. 2020;107(2):234–256. doi: 10.1016/j.neuron.2020.06.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SLAVICH G M, GILETTA M, HELMS S W, et al Interpersonal life stress, inflammation, and depression in adolescence: testing social signal transduction theory of depression. Depress Anxiety. 2020;37(2):179–193. doi: 10.1002/da.22987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.KIECOLT-GLASER J K, DERRY H M, FAGUNDES C P Inflammation: depression fans the flames and feasts on the heat. Am J Psychiatry. 2015;172(11):1075–1091. doi: 10.1176/appi.ajp.2015.15020152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.OSIMO E F, BAXTER L J, LEWIS G, et al Prevalence of low-grade inflammation in depression: a systematic review and meta-analysis of CRP levels. Psychol Med. 2019;49(12):1958–1970. doi: 10.1017/S0033291719001454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.ROOHI E, JAAFARI N, HASHEMIAN F On inflammatory hypothesis of depression: what is the role of IL-6 in the middle of the chaos? J Neuroinflammation. 2021;18(1):45. doi: 10.1186/s12974-021-02100-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.SYED S A, BEUREL E, LOEWENSTEIN D A, et al Defective inflammatory pathways in never-treated depressed patients are associated with poor treatment response. Neuron. 2018;99(5):914–924. doi: 10.1016/j.neuron.2018.08.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.KOHLER C A, FREITAS T H, STUBBS B, et al Peripheral alterations in cytokine and chemokine levels after antidepressant drug treatment for major depressive disorder: systematic review and meta-analysis. Mol Neurobiol. 2018;55(5):4195–4206. doi: 10.1007/s12035-017-0632-1. [DOI] [PubMed] [Google Scholar]
- 10.COLASANTO M, MADIGAN S, KORCZAK D J Depression and inflammation among children and adolescents: a meta-analysis. J Affect Disord. 2020;277:940–948. doi: 10.1016/j.jad.2020.09.025. [DOI] [PubMed] [Google Scholar]
- 11.MCRAE A L, BRADY K T Review of sertraline and its clinical applications in psychiatric disorders. Expert Opin Pharmacother. 2001;2(5):883–892. doi: 10.1517/14656566.2.5.883. [DOI] [PubMed] [Google Scholar]
- 12.SHEEHAN D V, SHEEHAN K H, SHYTLE R D, et al Reliability and validity of the mini international neuropsychiatric interview for children and adolescents (MINI-KID) J Clin Psychiatry. 2010;71(3):313–326. doi: 10.4088/JCP.09m05305whi. [DOI] [PubMed] [Google Scholar]
- 13.WILLIAMS J B W A Structured interview guide for the hamilton depression rating scale. Arch Gen Psychiatry. 1988;45(8):742–747. doi: 10.1001/archpsyc.1988.01800320058007. [DOI] [PubMed] [Google Scholar]
- 14.KELLEY M E, CHOI K S, RAJENDRA J K, et al Establishing evidence for clinical utility of a neuroimaging biomarker in major depressive disorder: prospective testing and implementation challenges. Biol Psychiatry. 2021;90(4):236–242. doi: 10.1016/j.biopsych.2021.02.966. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.CONNOR K M, DAVIDSON J R T Development of a new resilience scale: the Connor-Davidson Resilience Scale (CD-RISC) Depress Anxiety. 2003;18(2):76–82. doi: 10.1002/da.10113. [DOI] [PubMed] [Google Scholar]
- 16.TING E Y, YANG A C, TSAI S J Role of Interleukin-6 in depressive disorder. Int J Mol Sci. 2020;21(6):2194. doi: 10.3390/ijms21062194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.LIU C S, ADIBFAR A, HERRMANN N, et al Evidence for inflammation-associated depression. Curr Top Behav Neurosci. 2017;31:3–30. doi: 10.1007/7854_2016_2. [DOI] [PubMed] [Google Scholar]
- 18.TANG M, LIU T, JIANG P, et al The interaction between autophagy and neuroinflammation in major depressive disorder: from pathophysiology to therapeutic implications. Pharmacol Res. 2021;168:105586. doi: 10.1016/j.phrs.2021.105586. [DOI] [PubMed] [Google Scholar]
- 19.DIONISIE V, FILIP G A, MANEA M C, et al The anti-inflammatory role of SSRI and SNRI in the treatment of depression: a review of human and rodent research studies. Inflammopharmacology. 2021;29(1):75–90. doi: 10.1007/s10787-020-00777-5. [DOI] [PubMed] [Google Scholar]
- 20.PÉREZ-SÁNCHEZ G, BECERRIL-VILLANUEVA E, ARREOLA R, et al Inflammatory profiles in depressed adolescents treated with fluoxetine: an 8-week follow-up open study. Mediators Inflamm. 2018;2018:4074051. doi: 10.1155/2018/4074051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.D'ACUNTO G, NAGEYE F, ZHANG J, et al Inflammatory cytokines in children and adolescents with depressive disorders: a systematic review and meta-analysis. J Child Adolesc Psychopharmacol. 2019;29(5):362–369. doi: 10.1089/cap.2019.0015. [DOI] [PubMed] [Google Scholar]
- 22.GABBAY V, KLEIN R G, GUTTMAN L E, et al A preliminary study of cytokines in suicidal and nonsuicidal adolescents with major depression. J Child Adolesc Psychopharmacol. 2009;19(4):423–430. doi: 10.1089/cap.2008.0140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.LAN X, ZHOU Y, WU F, et al The relationship between plasma cytokine levels and antidepressant response in patients with first-episode major depressive disorder. J Affect Disord. 2021;287:327–333. doi: 10.1016/j.jad.2021.03.036. [DOI] [PubMed] [Google Scholar]
- 24.NG A, TAM W W, ZHANG M W, et al IL-1beta, IL-6, TNF- alpha and CRP in elderly patients with depression or Alzheimer's disease: systematic review and meta-analysis. Sci Rep. 2018;8(1):12050. doi: 10.1038/s41598-018-30487-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.BUSPAVANICH P, ADLI M, HIMMERICH H, et al Faster speed of onset of the depressive episode is associated with lower cytokine serum levels (IL-2, -4, -6, -10, TNF-alpha and IFN-gamma) in patients with major depression. J Psychiatr Res. 2021;141:287–292. doi: 10.1016/j.jpsychires.2021.06.033. [DOI] [PubMed] [Google Scholar]
- 26.LIU J J, WEI Y B, STRAWBRIDGE R, et al Peripheral cytokine levels and response to antidepressant treatment in depression: a systematic review and meta-analysis. Mol Psychiatry. 2020;25(2):339–350. doi: 10.1038/s41380-019-0474-5. [DOI] [PubMed] [Google Scholar]
- 27.MULLER L, Di BENEDETTO S, PAWELEC G The immune system and its dysregulation with aging. Subcell Biochem. 2019;91:21–43. doi: 10.1007/978-981-13-3681-2_2. [DOI] [PubMed] [Google Scholar]


