Abstract
目的
比较精神分裂症(schizophrenia, SCZ)和重度抑郁症(major depressive disorder, MDD)患者的海马亚区在发病早期沿纵轴的结构性改变。
方法
纳入79例首发未治疗SCZ患者、48例首发未治疗MDD患者及79例健康对照(healthy control, HC),进行临床症状评估和头部磁共振成像,采用FreeSurfer软件测量海马及原始亚区体积,合并计算纵轴亚区体积,对上述指标进行组间比较并分析临床-纵轴亚区体积的相关性。
结果
与HC相比,SCZ患者海马后部体积缩小(左侧t=−2.69,P=0.01;右侧t=−2.90,P=0.004),MDD患者纵轴亚区体积无差异。SCZ患者的海马后部体积与阴性症状评分呈负相关(左侧r=−0.29,P=0.01;右侧r=−0.23,P=0.04)。
结论
海马后部缩小可能是早期鉴别SCZ和MDD的影像特征,并可能参与了SCZ发病早期的神经病理生理学机制。
Keywords: 精神分裂症, 重度抑郁症, 首发未治疗, 海马亚区
Abstract
Objective
To compare the structural changes along the longitudinal axis of hippocampus subfields between schizophrenia (SCZ) patients and major depressive disorder (MDD) patients in the early stage of their SCZ and MDD.
Methods
Seventy-nine first-episode drug-naïve patients with SCZ, 48 first-episode drug-naïve patients with MDD, and 79 healthy controls (HC) were recruited and underwent assessment of clinical symptoms and magnetic resonance imaging (MRI) of the head. Following the calculation of hippocampal and subfield volumes with FreeSurfer, the volume of longitudinal subfields were summed up. Inter-group comparison of these indicators was made with the data of different groups and the correlation between clinical symptoms and the volumes of longitudinal subfields was analyzed.
Results
Compared with HC, SCZ patients had smaller bilateral posterior hippocampus (left: t=−2.69, P=0.01; right: t=−2.90, P=0.004), while MDD patients exhibited no changes along the longitudinal axis of hippocampal subfields. In SCZ patients, the volume of bilateral posterior hippocampus was negatively correlated with the negative symptom scores of Positive and Negative Syndrome Scale (left: r=−0.29, P=0.01; right: r=−0.23, P=0.04).
Conclusion
The smaller posterior hippocampus may be an imaging feature for distinguishing SCZ from MDD and may have contributed to the neuropathophysiological mechanism of SCZ in the early stage of the onset of the disease.
Keywords: Schizophrenia, Major depressive disorder, First-episode drug-naïve, Hippocampal subfield
精神分裂症(schizophrenia, SCZ)和重度抑郁症(major depressive disorder, MDD)长期以来被认为是两种独立的重性精神障碍,给患者、家庭和社会带来沉重疾病负担。然而,近些年研究表明这两种疾病在基因表达[1]、风险因素[2-3]和临床症状[4-5]等方面具有部分重叠。神经影像学研究也报道了SCZ和MDD患者存在相似的脑结构性改变(如海马体积减小)[6-7]。然而,尚不明确海马萎缩是否在SCZ和MDD中参与了同样的神经病理生理学机制。
海马是边缘系统的重要脑区之一,由多个不同细胞结构和神经生理功能的亚区组成[8],但亚区划分的方法多样。基于解剖学标志,海马沿纵轴可分为前部和后部[9],具有特异的神经解剖连接和功能,参与不同的认知任务[10],体现了海马基因表达沿纵轴梯度分布的特点[11]。海马沿横轴又可分为阿蒙角(cornu Ammonis, CA)、齿状回(dentate gyrus, DG)和下托(subiculum, Sub)[8]。上述亚区划分可在头部磁共振成像(magnetic resonance imaging, MRI)图像上由自动化软件完成。FreeSurfer正是一款基于头部MRI的表面形态学分割软件,该软件在海马亚区的自动化分割中性能良好,可达到较高精确性和可重复性,被广泛应用在海马的结构性MRI研究中[12-13]。
目前关于SCZ和MDD海马亚区的结构性MRI研究,虽然主要集中在横轴亚区分析上[6-7],但已有研究发现,精神障碍高风险人群及患者的海马沿纵轴依然存在亚区特异性改变,并与认知障碍有关[14-15]。这为研究海马参与的精神疾病谱的致病机制提供了另一种分析思路,有助于多维度认识SCZ和MDD之间潜在的共同和特异性神经病理生理学特征,为影像鉴别疾病、寻找精准治疗的靶点提供证据。发病早期定义为从精神病前驱期至首次发作后5~10年。本项研究目的是基于MRI比较SCZ和MDD患者的海马亚区在发病早期是否沿纵轴发生了结构性改变。
1. 对象和方法
1.1. 受试对象
本研究回顾性纳入在四川大学华西医院就诊的SCZ患者79例、MDD患者48例和健康志愿者(healthy control, HC)79例。
患者纳入标准:①符合美国精神障碍诊断与统计手册第四版(Diagnostic and Statistical Manual of Mental Disorders [Fourth Edition], DSM-Ⅳ)的SCZ或MDD诊断标准;②首次发作,未接受过任何心理治疗,未服用过情绪稳定剂和抗精神病药物;③随访一年后的诊断与基线时一致,由两名精神科医生复核。HC在成都及周边县市招募,由精神科医师通过DSM-Ⅳ结构化临床访谈量表的非患者版本确认,HC及其一级亲属既往和当前均无精神疾病病史。
所有受试者均为汉族、右利手,年龄在18~50岁之间。受试者排除标准:①磁共振扫描禁忌症;②神经疾病或头部外伤史;③酒精或物质滥用;④严重系统性疾病,如心血管疾病、肝硬化等。
本研究通过四川大学华西医院生物医学伦理审查委员会的批准(2022审886),所有受试者对研究知情并签署了知情同意书。
1.2. 临床症状评估
SCZ组通过功能大体评定量表和阳性与阴性症状量表(Positive and Negative Syndrome Scale, PANSS)评估临床症状;MDD组通过汉密尔顿抑郁量表(17-item Hamilton Rating Scale for Depression, HDRS-17)评估临床症状。病程基于《诺丁汉起病症状量表》衡量。
1.3. MRI数据采集及分析
1.3.1. 图像采集
在临床症状评估的当天,受试者在GE 3T磁共振检查仪上接受头部MRI扫描,采集高空间分辨率3D-T1加权图像,主要参数如下:重复时间8.5 ms,恢复时间3.5 ms,翻转角12°,层厚1.0 mm,视野240 mm×240 mm,采集矩阵256×128。扫描156层,矩阵自动插值到512×512,体素分辨率为0.47 mm×0.47 mm。图像质量由神经放射医生评估。
1.3.2. 图像分析
利用FreeSurfer v7.1(http://surfer.nmr.mgh.harvard.edu/)分析3D-TI加权图像。首先,使用recon-all命令预处理图像,步骤包括颅骨剥离、组织分割、表面重建、配准和分割。其次,使用segmentHA_T1.sh命令分割海马亚区,亚区分割方法利用了四面体掩膜的概率图谱[13]。参考前人研究的分析方法[14-15],纳入15个FreeSurfer原始分割形成的最小海马亚区,即CA1头部、CA1体部、CA2/3头部、CA2/3体部、CA4头部、CA4体部、DG颗粒细胞层(granule cell layer, GCL)头部、GCL体部、分子层(molecular layer, ML)头部、ML体部、Sub头部、Sub体部、前下托(presubiculum, Presub)头部、Presub体部及海马尾。旁下托、伞、海马沟和海马-杏仁核移行区这四个非海马核心结构不纳入分析。为方便后续比较,我们与常见分割协议[16-17]保持一致,定义SUB前部为FreeSurfer软件分割得到的Presub头部,SUB后部为Presub体部(此处SUB为大写,以区分FreeSurfer原始分割定义的Sub)。
在FreeSurfer中提取海马总体积、15个亚区体积及颅内容积。合并并计算每一侧的海马纵轴亚区体积,包括海马前部及后部、CA前部及后部、DG前部及后部、SUB前部及后部。合并方法如下[14]:海马前部包括CA1头部、CA2/3头部、CA4头部、GCL头部、ML头部、Sub头部、Presub头部;海马后部包括CA1体部、CA2/3体部、CA4体部、GCL体部、ML体部、Sub体部、Presub体部、海马尾。CA前部包括CA1头部、CA2/3头部、ML头部、Sub头部;CA后部包括CA1体部、CA2/3体部、ML体部、Sub体部;DG前部包括CA4头部和GCL头部;DG后部包括CA4体部和GCL体部。
1.4. 统计学方法
1.4.1. 组间比较
使用SPSS v26(https://www.ibm.com/cn-zh/spss/)进行统计分析。比较人口学及临床特征的组间差异时,分类变量采用卡方检验;连续变量以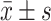 表示,采用Mann-Whitney U检验或Kruskal-Wallis H检验。3组间体积比较采用协方差分析,协变量包括年龄、性别、颅内容积。多重比较校正方法采用错误发现率(false discovery rate, FDR)。校正前有统计学差异的脑区均采用事后检验进行两两比较。
表示,采用Mann-Whitney U检验或Kruskal-Wallis H检验。3组间体积比较采用协方差分析,协变量包括年龄、性别、颅内容积。多重比较校正方法采用错误发现率(false discovery rate, FDR)。校正前有统计学差异的脑区均采用事后检验进行两两比较。
1.4.2. 相关分析
根据变量分布类型,计算皮尔森或斯皮尔曼系数评估海马及纵轴亚区体积和临床症状量表的相关性。此部分为探索性相关分析,结果未进行FDR校正。
2. 结果
2.1. 人口学资料及临床评估
SCZ组(n=79)平均年龄为(29.7±7.9)岁,MDD组(n=48)平均年龄为(32.4±8.0)岁,HC组(n=79)平均年龄为(31.1±7.8)岁。3组在性别、年龄及颅内容积上差异无统计学意义。SCZ组和MDD组在病程上差异无统计学意义。MDD组的受教育年限资料缺失,但SCZ组与HC组在受教育年限上差异无统计学意义。见表1。
表 1. Demographic data and clinical evaluation.
人口统计学资料及临床评估
| Demographic/clinical characteristic | SCZ (n=79) | MDD (n=48) | HC (n=79) | P |
| SCZ: schizophrenia; MDD: major depressive disorder; HC: healthy control; PANSS: Positive and Negative Syndrome Scale; GAF: global assessment of function; HDRS-17: 17-item Hamilton Rating Scale for Depression; NA: not available. | ||||
| (Male/female)/case | 36/43 | 21/27 | 31/48 | 0.71 |
| Age/yr. | 29.73±7.93 | 32.35±8.01 | 31.05±7.82 | 0.14 |
| Education/year | 12.46±3.75 | NA | 12.74±3.05 | 0.90 |
| Illness duration/month | 14.84±21.36 | 15.06±19.19 | NA | 0.54 |
| PANSS total | 89.19±16.13 | NA | NA | − |
| PANSS positive | 25.48±6.28 | NA | NA | − |
| PANSS negative | 17.87±7.51 | NA | NA | − |
| General psychopathology | 45.84±9.69 | NA | NA | − |
| GAF | 29.48±10.95 | NA | NA | − |
| HDRS-17 | NA | 22.63±4.15 | NA | − |
| Intracranial volume/mm3 | 1413638.90±200769.02 | 1466621.95±149362.73 | 1449728.96±134154.44 | 0.11 |
2.2. 体积比较
2.2.1. 海马总体积的组间差异
SCZ组海马总体积为左侧(3249.88±381.32) mm3,右侧(3324.76±418.63) mm3;MDD组海马总体积为左侧(3327.29±294.51) mm3,右侧(3431.36±297.91) mm3;HC组海马总体积为左侧(3343.93±268.12) mm3,右侧(3437.08±284.56) mm3。协方差分析显示左侧海马(F=1.72,P =0.18)及右侧海马(F=2.59,P=0.08)的体积在3组之间差异无统计学意义。
2.2.2. 海马前部及后部的组间差异
协方差分析显示3组在左侧海马后部(P=0.03)及右侧海马后部(P=0.01)的体积差异有统计学意义,其中左侧海马后部未能通过FDR校正(P=0.06),右侧海马后部通过FDR校正(P=0.03)。事后检验表明与HC组相比,SCZ组在左侧海马后部(t=−2.69,P=0.01)及右侧海马后部(t=−2.90,P=0.004)体积缩小,见表2。
表 2. Volume comparison of anterior and posterior hippocampus.
海马前部和后部的体积比较
| ROI | SCZ (n=79)/mm3 | MDD (n=48)/mm3 | HC (n=79)/mm3 |
| ROI: region of interests; SCZ: schizophrenia; MDD: major depressive disorder; HC: healthy control; Ant.: anterior; Pos.: posterior. * P<0.05, vs. HC. | |||
| Left | |||
| Ant. | 1464.06±188.92 | 1503.30±153.69 | 1485.89±139.67 |
| Pos. | 1575.36±192.56* | 1611.97±165.05 | 1649.75±137.61 |
| Right | |||
| Ant. | 1534.12±205.08 | 1574.53±155.29 | 1568.41±154.56 |
| Pos. | 1585.54±215.07* | 1650.28±154.68 | 1666.72±146.64 |
2.2.3. 海马亚区前部及后部的组间差异
协方差分析显示3组间在左侧CA后部(P=0.01)、左侧SUB前部(P=0.048)、右侧CA后部(P=0.04)及右侧DG后部(P=0.02)的体积差异有统计学意义,4个亚区均未能通过FDR校正。事后检验表明与HC组相比,SCZ组在左侧CA后部(t=−3.03,P=0.003)、右侧CA后部(t=−2.59,P=0.01)及右侧DG后部(t=−2.80,P=0.01)的体积缩小;与MDD组相比,SCZ组在左侧SUB前部(t=−2.46,P=0.02)的体积缩小。见表3。
表 3. Volume comparison of anterior and posterior hippocampal subfields.
海马前部和后部亚区的体积比较
| ROI | SCZ (n=79)/mm3 | MDD (n=48)/mm3 | HC (n=79)/mm3 |
| ROI: region of interests; SCZ: schizophrenia; MDD: major depressive disorder; HC: healthy control; CA: cornu Ammonis; DG: dentate gyrus; SUB: subiculum; ant.: anterior; pos.: posterior. * P<0.05, vs. HC; ** P<0.05, vs. MDD. | |||
| Left | |||
| CA ant. | 1077.98±138.77 | 1105.22±118.32 | 1089.61±105.96 |
| CA pos. | 623.72±74.06* | 636.54±63.69 | 657.33±62.55 |
| DG ant. | 251.25±36.14 | 255.67±27.95 | 259.51±26.82 |
| DG pos. | 232.62±30.67 | 239.00±25.39 | 241.92±19.62 |
| SUB ant. | 134.83±19.68** | 142.41±14.48 | 136.78±14.59 |
| SUB pos. | 166.62±30.27 | 168.88±25.07 | 168.15±26.65 |
| Right | |||
| CA ant. | 1134.40±154.52 | 1164.90±118.52 | 1156.32±118.84 |
| CA pos. | 643.56±82.05* | 660.22±70.56 | 675.21±66.88 |
| DG ant. | 263.28±39.76 | 268.82±29.49 | 273.57±27.78 |
| DG pos. | 237.39±32.62* | 242.53±23.61 | 250.07±25.01 |
| SUB ant. | 136.44±19.12 | 140.80±13.51 | 138.52±15.41 |
| SUB pos. | 150.23±32.51 | 154.62±22.97 | 153.86±20.64 |
2.3. 相关分析
在SCZ组,左侧海马后部(r=−0.29,P=0.01)、右侧海马后部(r=−0.23,P=0.04)、左侧CA后部(r=−0.23,P=0.04)及左侧SUB前部(r=−0.31,P=0.01)的体积与PANSS阴性症状评分呈负相关。
3. 讨论
本研究比较了SCZ患者和MDD患者的海马纵轴亚区的结构性异常,纳入了诊断明确的首发未治疗患者,受试者MRI数据采集与临床症状评估在时间上同步,避免了药物、数据采集间隔对研究结果的影响。较传统的基于体素的形态学方法相比,基于表面的形态学方法能够更精确地获取海马及其亚区体积。研究发现包括:与HC相比,SCZ患者双侧海马后部的体积缩小,MDD患者的海马沿纵轴分布的亚区体积无改变;在更细小亚区水平上,两组患者与HC的组间体积差异结果均未能通过FDR校正;SCZ患者的双侧海马后部体积与精神症状严重程度呈负相关。
本研究发现,在发病早期阶段,SCZ患者即表现出海马后部体积减小并与精神症状恶化有关;相比之下,首发未治疗MDD患者的海马并未出现显著结构异常。TU等[18]在一项大样本研究中纳入了较长病程的SCZ(平均病程13.2年)和MDD(平均病程6.7年)患者,发现与HC相比,SCZ组的整个海马缩小,MDD组未表现出体积改变。结合本研究的早期患者结果,笔者推测随着病程进展,SCZ患者的海马结构缺陷可能从海马后部向前累及到整体。另一项MDD患者的大规模荟萃研究表明,海马体积缩小主要出现在复发性和早发性患者中,在首发患者中无改变[19]。这些发现与本研究结果保持一致。OTA等[20]沿海马横轴比较了SCZ患者和MDD患者的海马亚区体积,发现SCZ患者比HC的CA1体积减小,MDD未检测到亚区改变。这可能与本研究中发现的SCZ患者左侧CA后部有体积减小趋势(结果未能通过FDR校正)一致。此外,有研究表明非首发MDD患者的海马亚区体积减小[7],但亦有研究表明MDD队列中海马尾的体积较HC增大[21],研究结果的不一致可能是由于用药情况不同导致,也可能与MDD疾病的固有异质性有关。上述研究和本研究结果综合提示,SCZ比MDD存在更严重的海马及亚区结构性缺陷[18, 22];海马后部结构在SCZ发病早期可能已受到损伤,可能是影像鉴别MDD的生物学标记;海马后部早期萎缩可能参与SCZ致病过程的重要环节,对该区域及时实施神经保护措施可能为疾病早期干预提供靶点。海马后部损伤在SCZ和MDD之间具有病种选择性,也说明了后部异常在两种疾病早期的神经病理特征上是不同的,这需要神经病理生理的基础研究来进一步佐证。
在首发未治疗SCZ患者中,海马后部的体积越小,PANSS阴性量表评分越高。BENETTI等[23]通过动态因果模型对任务态脑功能MRI图像进行分析,发现在延迟样本匹配任务中,SCZ高风险个体和首发患者均呈现出右侧海马后部与同侧额下回的内在连接受损。前期研究表明,海马后部与视觉和空间处理相关的大脑后部皮层相连接[10],参与了细节记忆[24],而SCZ的阴性症状(比如缺乏动力与快感)正与认知能力降低有关[25-27]。体视学研究[28]发现SCZ患者海马后部CA4区少突胶质细胞的平均数量减少,认为海马后部中不同亚区的功能连接紊乱。DTI研究也显示海马后部白质束的各向异性分数降低[29],该区域连通性异常可能导致认知障碍和临床阴性症状[30-31]。上述研究与本研究结果共同提示了SCZ患者海马后部的结构缺陷可能通过干扰海马与高级皮层的功能连接,进而破坏患者的认知功能。目前尚无研究发现MDD患者海马后部的结构改变,但GONG等[32]的研究表明MDD患者的左侧海马后部的整体功能连接密度与失眠症状相关,左侧海马前部的整体功能连接密度与非失眠的抑郁症状相关,说明MDD患者中海马前部和后部的功能可能不同。
本研究的局限之处有以下几点:①与大型神经影像研究相比,相对较小的样本量可能降低统计效能,研究结果仍需多中心大样本数据进一步验证。②在横断面设计中,海马体积与精神症状的相互关系并不代表因果关联,未来可以设计纵向研究来观察海马及亚区在疾病进程中的变化轨迹、与临床表现变化的时间关系。③相比结构性研究,结合脑功能的多模态成像分析可以更精确地分析海马的功能状态及结构异常对全脑功能网络的影响。④本研究未对认知领域受损的程度与维度进行更精细的测评,缺乏海马结构异常与认知损害程度的相关性分析。未来设计前瞻性研究时将纳入更多认知维度的临床量表工具。
本研究发现SCZ患者在发病早期沿海马纵轴出现了后部结构性损伤,并不局限于以横轴划分的某一亚区,MDD患者发病早期未发现海马及其亚区的结构异常。海马后部可能作为鉴别SCZ与MDD的磁共振影像学标记,该区结构的萎缩也可能参与了SCZ发病早期的神经病理生理学机制。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 82102000、No. 82120108014、No. 82071908)和四川省自然科学基金(No. 2022NSFSC1496)资助
Contributor Information
源 孙 (Yuan SUN), Email: sunyuan_mi@163.com.
娜 胡 (Na HU), Email: nahu_wch@163.com.
粟 吕 (Su LYU), Email: lusuwcums@tom.com.
References
- 1.LEE S H, RIPKE S, NEALE B M, et al Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nat Genet. 2013;45(9):984–994. doi: 10.1038/ng.2711. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.GILMAN S E, HORNIG M, GHASSABIAN A, et al Socioeconomic disadvantage, gestational immune activity, and neurodevelopment in early childhood. Proc Natl Acad Sci U S A. 2017;114(26):6728–6733. doi: 10.1073/pnas.1617698114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.STEIN A, PEARSON R M, GOODMAN S H, et al Effects of perinatal mental disorders on the fetus and child. Lancet. 2014;384(9956):1800–1819. doi: 10.1016/s0140-6736(14)61277-0. [DOI] [PubMed] [Google Scholar]
- 4.IANCU I, BODNER E, ROITMAN S, et al Impulsivity, aggression and suicide risk among male schizophrenia patients. Psychopathology. 2010;43(4):223–229. doi: 10.1159/000313520. [DOI] [PubMed] [Google Scholar]
- 5.Der-AVAKIAN A, MARKOU A The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 2012;35(1):68–77. doi: 10.1016/j.tins.2011.11.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.HU N, SUN H, FU G, et al Anatomic abnormalities of hippocampal subfields in never-treated and antipsychotic-treated patients with long-term schizophrenia. Eur Neuropsychopharmacol. 2020;35:39–48. doi: 10.1016/j.euroneuro.2020.03.020. [DOI] [PubMed] [Google Scholar]
- 7.RODDY D W, FARRELL C, DOOLIN K, et al The Hippocampus in Depression: More Than the Sum of Its Parts? Advanced Hippocampal Substructure Segmentation in Depression. Biol Psychiatry. 2019;85(6):487–497. doi: 10.1016/j.biopsych.2018.08.021. [DOI] [PubMed] [Google Scholar]
- 8.DUVERNOY H M, CATTIN F, RISOLD P Y, et al. The human hippocampus:functional anatomy, vascularization and serial sections with MRI. 4th. Berlin: Springer, 2013: 1-237.
- 9.WEISS A P, DEWITT I, GOFF D, et al Anterior and posterior hippocampal volumes in schizophrenia. Schizophr Res. 2005;73(1):103–112. doi: 10.1016/j.schres.2004.05.018. [DOI] [PubMed] [Google Scholar]
- 10.POPPENK J, EVENSMOEN H R, MOSCOVITCH M, et al Long-axis specialization of the human hippocampus. Trends Cogn Sci. 2013;17(5):230–240. doi: 10.1016/j.tics.2013.03.005. [DOI] [PubMed] [Google Scholar]
- 11.VOGEL J W, La JOIE R, GROTHE M J, et al A molecular gradient along the longitudinal axis of the human hippocampus informs large-scale behavioral systems. Nat Commun. 2020;11(1):960. doi: 10.1038/s41467-020-14518-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.WHELAN C D, HIBAR D P, Van VELZEN L S, et al Heritability and reliability of automatically segmented human hippocampal formation subregions. Neuroimage. 2016;128:125–137. doi: 10.1016/j.neuroimage.2015.12.039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.IGLESIAS J E, AUGUSTINACK J C, NGUYEN K, et al A computational atlas of the hippocampal formation using ex vivo, ultra-high resolution MRI: Application to adaptive segmentation of in vivo MRI. Neuroimage. 2015;115:117–137. doi: 10.1016/j.neuroimage.2015.04.042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.MCHUGO M, TALATI P, WOODWARD N D, et al Regionally specific volume deficits along the hippocampal long axis in early and chronic psychosis. Neuroimage Clin. 2018;20:1106–1114. doi: 10.1016/j.nicl.2018.10.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.SAHAKYAN L, MELLER T, EVERMANN U, et al Anterior vs Posterior Hippocampal Subfields in an Extended Psychosis Phenotype of Multidimensional Schizotypy in a Nonclinical Sample. Schizophr Bull. 2021;47(1):207–218. doi: 10.1093/schbul/sbaa099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.YUSHKEVICH P A, AMARAL R S, AUGUSTINACK J C, et al Quantitative comparison of 21 protocols for labeling hippocampal subfields and parahippocampal subregions in in vivo MRI: towards a harmonized segmentation protocol. Neuroimage. 2015;111:526–541. doi: 10.1016/j.neuroimage.2015.01.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.MUELLER S G, YUSHKEVICH P A, DAS S, et al Systematic comparison of different techniques to measure hippocampal subfield volumes in ADNI2. Neuroimage Clin. 2018;17:1006–1018. doi: 10.1016/j.nicl.2017.12.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.TU P C, CHANG W C, CHEN M H, et al Identifying common and distinct subcortical volumetric abnormalities in 3 major psychiatric disorders: a single-site analysis of 640 participants. J Psychiatry Neurosci. 2022;47(3):e230–e238. doi: 10.1503/jpn.210154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.SCHMAAL L, VELTMAN D J, Van ERP T G, et al Subcortical brain alterations in major depressive disorder: findings from the ENIGMA Major Depressive Disorder working group. Mol Psychiatry. 2016;21(6):806–812. doi: 10.1038/mp.2015.69. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.OTA M, SATO N, HIDESE S, et al Structural differences in hippocampal subfields among schizophrenia patients, major depressive disorder patients, and healthy subjects. Psychiatry Res Neuroimaging. 2017;259:54–59. doi: 10.1016/j.pscychresns.2016.11.002. [DOI] [PubMed] [Google Scholar]
- 21.MALLER J J, BROADHOUSE K, RUSH A J, et al Increased hippocampal tail volume predicts depression status and remission to anti-depressant medications in major depression. Mol Psychiatry. 2018;23(8):1737–1744. doi: 10.1038/mp.2017.224. [DOI] [PubMed] [Google Scholar]
- 22.YASUDA K, YAMADA S, UENISHI S, et al Hippocampal subfield volumes and cognitive function in schizophrenia and mood disorders. Neuropsychobiology. 2022;81(3):204–214. doi: 10.1159/000521102. [DOI] [PubMed] [Google Scholar]
- 23.BENETTI S, MECHELLI A, PICCHIONI M, et al Functional integration between the posterior hippocampus and prefrontal cortex is impaired in both first episode schizophrenia and the at risk mental state. Brain. 2009;132(Pt 9):2426–2436. doi: 10.1093/brain/awp098. [DOI] [PubMed] [Google Scholar]
- 24.HAYES J P, LABAR K S, MCCARTHY G, et al Reduced hippocampal and amygdala activity predicts memory distortions for trauma reminders in combat-related PTSD. J Psychiatr Res. 2011;45(5):660–669. doi: 10.1016/j.jpsychires.2010.10.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.LIN C H, HUANG C L, CHANG Y C, et al Clinical symptoms, mainly negative symptoms, mediate the influence of neurocognition and social cognition on functional outcome of schizophrenia. Schizophr Res. 2013;146(1/2/3):231–237. doi: 10.1016/j.schres.2013.02.009. [DOI] [PubMed] [Google Scholar]
- 26.FOUSSIAS G, SIDDIQUI I, FERVAHA G, et al Motivated to do well: an examination of the relationships between motivation, effort, and cognitive performance in schizophrenia. Schizophr Res. 2015;166(1/2/3):276–282. doi: 10.1016/j.schres.2015.05.019. [DOI] [PubMed] [Google Scholar]
- 27.FERVAHA G, ZAKZANIS K K, FOUSSIAS G, et al Motivational deficits and cognitive test performance in schizophrenia. JAMA Psychiatry. 2014;71(9):1058–1065. doi: 10.1001/jamapsychiatry.2014.1105. [DOI] [PubMed] [Google Scholar]
- 28.SCHMITT A, STEYSKAL C, BERNSTEIN H G, et al Stereologic investigation of the posterior part of the hippocampus in schizophrenia. Acta Neuropathol. 2009;117(4):395–407. doi: 10.1007/s00401-008-0430-y. [DOI] [PubMed] [Google Scholar]
- 29.WHITE T, KENDI A T, LEHÉRICY S, et al Disruption of hippocampal connectivity in children and adolescents with schizophrenia-a voxel-based diffusion tensor imaging study. Schizophr Res. 2007;90(1/2/3):302–307. doi: 10.1016/j.schres.2006.09.032. [DOI] [PubMed] [Google Scholar]
- 30.HARRISON P J The hippocampus in schizophrenia: a review of the neuropathological evidence and its pathophysiological implications. Psychopharmacology (Berl) 2004;174(1):151–162. doi: 10.1007/s00213-003-1761-y. [DOI] [PubMed] [Google Scholar]
- 31.RAJARETHINAM R, DEQUARDO J R, MIEDLER J, et al Hippocampus and amygdala in schizophrenia: assessment of the relationship of neuroanatomy to psychopathology. Psychiatry Res. 2001;108(2):79–87. doi: 10.1016/s0925-4927(01)00120-2. [DOI] [PubMed] [Google Scholar]
- 32.GONG L, XU R, LIU D, et al Abnormal functional connectivity density in patients with major depressive disorder with comorbid insomnia. J Affect Disord. 2020;266:417–423. doi: 10.1016/j.jad.2020.01.088. [DOI] [PubMed] [Google Scholar]


