Abstract
目的
通过分析人乳头瘤病毒(human papilloma virus,HPV)L1检测、程序性细胞死亡分子配体-1(programmed cell death ligand-1,PD-L1)检测联合阴道镜检查与宫颈病变发生发展的关系,以期明确其分流辅助诊断意义。
方法
将2018年1月−2020年1月于四川大学华西第二医院就诊的高危型(high risk,HR)-HPV感染患者260例纳入研究,收集到宫颈细胞学标本260例〔包括40例宫颈炎性细胞、40例轻度非典型增生的低级别鳞状上皮内瘤变(low-grade squamous intraepithilia lesions,LSIL)、80例中度和重度非典型增生的高级别鳞状上皮内瘤变(high-grade squamous intraepithilia lesions,HSIL)、100例宫颈癌细胞(cervical carcinoma cell,CCC)〕和宫颈组织学标本218例〔包括15例慢性宫颈炎组织、20例宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)1、32例CIN2、51例CIN3、100例宫颈癌(cervical cancer,CC)〕,其中202例患者行阴道镜检查。采用免疫细胞化学和免疫组织化学方法检测HPV L1蛋白和PD-L1蛋白的表达情况,采用qRT-PCR技术检测慢性宫颈炎组织和CC中PD-L1 mRNA水平。探讨HPV L1检测、PD-L1检测联合阴道镜检查在发现宫颈病变中的灵敏度、特异度、阳性预测值、阴性预测值等。
结果
①在宫颈细胞学组,HPV L1阳性表达率在宫颈炎性细胞、LSIL、HSIL、CCC中分别为82.50%、57.50%、11.25%、3.00%,阳性表达率逐渐降低(P<0.05)。在宫颈组织学组,HPV L1阳性表达率在慢性宫颈炎组织、CIN1、CIN2、CIN3和CC中分别为86.67%、65.00%、34.38%、11.76%和4.00%,阳性表达率逐渐降低(P<0.05)。②在宫颈细胞学组,PD-L1在宫颈炎性细胞、LSIL、HSIL和CCC中的阳性表达平均评分分别为0.25±0.12、1.05±0.67、1.39±0.11和2.14±0.17,阳性评分逐渐增加(P<0.05)。在宫颈组织学组,PD-L1在慢性宫颈炎组织、CIN1、CIN2、CIN3和CC中的阳性表达平均评分分别为0.28±0.24、1.21±0.79、1.56±0.26、1.80±0.24和2.10±0.19,阳性评分逐渐增加(P<0.05)。PD-L1 mRNA在慢性宫颈炎组织和CC中的相对表达量分别为1.02±0.04、1.81±0.22(P<0.05)。③诊断宫颈组织病变CIN2及以上的灵敏度和特异度,单独HPV L1检测为95.8%、47.2%,单独PD-L1检测为96.5%、32.8%,单独阴道镜检查为77.5%、70.8%,HPV L1/PD-L1联合检测为92.4%、64.5%,HPV L1/PD-L1检测联合阴道镜检查为71.6%、89.6%。诊断CIN3及以上的宫颈病变的灵敏度和特异度,HPV L1/PD-L1联合检测为71.9%、86.1%,HPV L1/PD-L1检测联合阴道镜检查为50.5%、100.0%。
结论
HPV L1/PD-L1检测联合阴道镜检查对CIN2及以上病变较单独HPV L1检测、单独PD-L1检测和单独阴道镜检查的特异度升高。HPV L1/PD-L1检测联合阴道镜检查对CIN3及以上病变具有重要的辅助诊断价值。
Keywords: HPV L1/PD-L1检测, 阴道镜检查, 宫颈癌前病变, 宫颈癌, 辅助诊断
Abstract
Objective
To explore the expression of human papilloma virus (HPV) L1 protein and programmed cell death ligand-1 (PD-L1) protein in cervical precancerous lesions and cervical cancer, to analyze the correlation between HPV L1 and PD-L1 expression tests combined with colposcopy and the occurrence and development of of cervical lesions, and to determine the significance of the combined examination for auxiliary differential diagnosis.
Methods
260 patients with high-risk HPV (HR-HPV) infection who were treated at West China Second University Hospital, Sichuan University from January, 2018 to January, 2020 were included in the study. 260 cervical cytology specimens were collected, of which 218 cervical histology specimens were collected, of which 202 cases underwent colposcopy. Among the 260 cervical cytology specimens, 40 were of cervical inflammatory cells, 40 were of low-grade squamous intraepithilia lesions (LSIL) with mild atypical hyperplasia, 80 were of high-grade squamous intraepithilia lesions (HSIL) with moderate and severe atypical hyperplasia, and 100 were of cervical carcinoma cells (CCC). Among the 218 cervical histology specimens, 15 were of chronic cervicitis tissue, 20 were of cervical intraepithelial neoplasia (CIN) 1, 32 were of CIN 2, 51 were of CIN 3, and 100 were of cervical cancer (CC). Among the 260 patients, 202 underwent colposcopy. Immunocytochemistry and immunohistochemistry were used to assess the expression of HPV L1 protein and PD-L1 protein, and real-time quantitative reverse transcription polymerase chain reaction (qRT-PCR) was used to assess the level of PD-L1 mRNA in chronic cervicitis tissues and CC. The sensitivity, specificity, positive predictive value and negative predictive value of HPV L1 and PD-L1 tests combined with colposcopy in the detection of cervical lesions were studied.
Results
①In the cervical cytology group, the positive rate of HPV L1 expression was 82.50%, 57.50%, 11.25%, and 3.00% in cervical inflammatory cells, low-grade squamous intraepithilia lesions (LSIL), high-grade squamous intraepithilia lesions (HSIL) and CCC, respectively, showing decreasing levels of positive expression rate (P<0.05). In the cervical histology group, the positive rate of HPV L1 expression was 86.67%, 65.00%, 34.38%, 11.76% and 4.00% in chronic cervicitis tissues, CIN 1 group, CIN 2 group, CIN 3 group and CC group, respectively, showing decreasing levels of positive expression (P<0.05). ②In the cervical cytology group, the average positive expression scores of PD-L1 in the cervical inflammatory cells, LSIL group, HSIL group, and CCC group were 0.25±0.12, 1.05±0.67, 1.39±0.11 and 2.14±0.17, respectively, showing increasing levels of positive expression scores (P<0.05). In the cervical histology group, the average positive expression scores of PD-L1 were 0.28±0.24, 1.21±0.79, 1.56±0.26, 1.80±0.24, and 2.10±0.19 in the chronic cervicitis tissue, CIN 1 group, CIN 2 group, CIN 3 group and CC group, respectively, showing increasing levels of positive expression scores (P<0.05). The relative expression ofPD-L1 mRNA in chronic cervicitis tissue and CC is 1.02±0.04 and 1.81±0.22, respectively (P<0.05). ③The sensitivity and specificity of diagnosis of cervical tissue CIN2 and abovelesions, HPV L1 detection alone was 95.8%, 47.2%, PD-L1 detection alone was 96.5%, 32.8%, colposcopy alone was 77.5%, 70.8%, HPV L1/PD-L1 tests combined detection was 92.4%, 64.5%, HPV L1/PD-L1 detection combined colposcopy was 71.6% and 89.6%, respectively. The sensitivity and specificity of the HPV L1/PD-L1 combined test for the diagnosis of CIN3 and above cervical lesions were 71.9% and 86.1%, HPV L1/PD-L1 combined with colposcopy were 50.5% and 100.0%, respectively.
Conclusion
The specificity of HPV L1/PD-L1 detection combined with colposcopy for CIN2 and above lesions is higher than that of HPV L1 detection alone, PD-L1 detection alone and colposcopy alone. HPV L1/PD-L1 detection combined with colposcopy detection for CIN3 and above lesions has an important auxiliary diagnostic value.
Keywords: PD-L1/HPV L1 detection, Colposcopy, Cervical precancerous lesions, Cervical cancer, Auxiliary diagnosis
宫颈癌(cervical cancer,CC)是全球最常见的第四大恶性肿瘤,是女性生殖系统最常见、死亡人数最多的恶性肿瘤[1]。高危型人乳头瘤病毒(high risk human papilloma virus,HR-HPV)的持续感染已被证实为宫颈癌的主要致病原因[2]。持续性的HR-HPV感染可能会发展成宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),最终可能发展至浸润型宫颈癌。低级别的CIN大部分可自然消退,但高级别的CIN具有癌变潜能,可能发展为浸润癌,被视为癌前病变。我国每年大约有新发病例13.5万,占全世界宫颈癌新发病例总数的28%,因宫颈癌死亡的人数每年约有5.3万例,占全部女性恶性肿瘤死亡人数的18.4%[3]。
HPV L1壳蛋白是HPV主要的结构蛋白,在早期HPV病毒的复制阶段表达,是HPV感染后诱发机体产生免疫反应的主要抗原[4]。HPV病毒DNA整合到宿主基因后,HPV L1蛋白表达缺失。HPV L1蛋白的缺失可使机体对感染细胞的免疫清除能力下降,不能有效地刺激免疫反应,CIN细胞逃脱机体细胞免疫系统的监视及清除功能,进而持续存在或导致肿瘤发生发展,引发宫颈病变或病变的进展[5]。程序性细胞死亡分子配体-1(programmed cell death ligand-1,PD-L1)是程序性细胞死亡分子-1(programmed cell death protein,PD-1)的第一配体,在免疫反应中起重要的负性调控作用[6]。PD-L1抑制T细胞的免疫活性及淋巴细胞的功能,逃避免疫监视,导致肿瘤发生免疫逃逸,促进肿瘤的发生、发展。通过免疫组织化学(IHC)评估的PD-L1表达水平是最可靠的预测性生物标志物[7]。宫颈癌筛查中,阴道镜检查在临床诊断、治疗、随访及临床研究等方面均有其独特的价值,其检查结果有助于筛选需要进一步明确检查以及治疗的患者,能够初步评估妇女宫颈早期病变。
既往临床检测宫颈病变采用巴氏细胞学,由于受涂片制作、取材、染色、读片水平等多因素影响,传统巴氏细胞学检测宫颈中度及以上CIN的灵敏度仅为65%左右[8]。单一的筛查模式不能适用于经济发展水平不同的地区。加强宫颈癌防治工作、建立宫颈癌的筛查体系及确诊不同级别宫颈癌前病变及宫颈癌是我国宫颈癌防治工作的重点及难点。到目前为止,临床上还没有十分有效的新型生物标志物来评估高危人群在宫颈癌中的发生、发展及转归风险。为提供更准确的宫颈癌筛查方式,本研究通过检测HPV L1蛋白、PD-L1在宫颈病变中的表达,探讨HPV L1检测、PD-L1检测联合阴道镜检查在宫颈癌前病变及宫颈癌中分流的辅助诊断价值,以期为宫颈病变早诊、早治提供更准确的依据,以避免过度诊断和治疗。
1. 材料与方法
1.1. 一般资料
将2018年1月−2020年1月于四川大学华西第二医院就诊的HR-HPV感染患者260例纳入研究,进行回顾性分析。收集其宫颈细胞学标本,根据宫颈细胞学结果进行分组,分为对照组和实验组:对照组40例,均诊断为宫颈炎性细胞;实验组220例,包括40例轻度非典型增生的低级别鳞状上皮内瘤变(low-grade squamous intraepithilia lesions,LSIL)、80例中度和重度非典型增生的高级别鳞状上皮内瘤变(high-grade squamous intraepithilia lesions,HSIL)、100例宫颈癌细胞(cervical carcinoma cell,CCC)。共收集到218例患者的宫颈组织学标本,根据组织学病理结果进行分组:对照组15例,为慢性宫颈炎组织;实验组203例,包括20例CIN1、32例CIN2、51例CIN3、100例CC。共202例患者行阴道镜检查,通过阴道镜活检或环形电切术(LEEP术)或手术取得宫颈组织,组织病理结果以最高级病变为最终结果。行PD-L1 mRNA检测的为拥有宫颈组织病理学结果的患者,各取20例慢性宫颈炎组织、CIN1、CIN2、CIN3和CC组织。所有病例于我院就诊前均未行宫颈相关手术、放疗及化疗。排除妊娠期和哺乳期、阴道感染性病变、HPV以外的其他病毒感染、自身免疫疾病和其他肿瘤史的患者。本研究经四川大学华西第二医院医学伦理委员会批准〔医学科研2019伦审批第(034)号〕,所有患者均知情同意。
1.2. 研究方法
1.2.1. HPV L1蛋白染色
宫颈细胞学样本和宫颈组织学样本采集后,运用CytoReact赛泰HPV L1染色试剂盒(赛泰公司,美国爱迪旺斯医疗科技有限责任公司)检测HPV L1壳蛋白。该试剂能够识别28种宫颈癌相关HPV病毒亚型的HPV L1壳蛋白,包括6、11、16、18、31、33、45、58、59、63等。严格按说明书操作步骤逐步操作。
1.2.2. PD-L1蛋白染色
收取细胞蜡块和组织蜡块,按4 µm连续切片,常规脱蜡、水化、抗原修复、封闭内源性过氧化物酶。滴加一抗(PD-L1单抗浓缩液,滴度 1∶250,福州迈新公司,产品编号:RMA-0732)37 ℃孵育60 min。PBS溶液冲洗。滴加生物素标记的山羊抗鼠二抗(biotin Goat anti-mouse IgG,Bio Legend公司,美国)37 ℃孵育30 min, 去除多余水分后滴加即用型EnVisionTMFLEX/HRP(SM802)2滴(100 μL),室温孵育20 min,PBS溶液冲洗。配制DAB显色液,取EnVisionTM FLEX SUBSTRATE BUFFER(SM8O3)1 mL,加EnVision™ FLEX DAB+(DM827)1滴,显色5~10 min,终止反应,苏木素复染,盐酸酒精返蓝,脱水透明封固。以PBS代替一抗作为空白对照。
1.2.3. PD-L1 mRNA表达的检测
使用TRIzol试剂(美国Invitrogen公司,产品编号:15596026)从宫颈组织中提取总RNA并进行定量。将1 μg RNA 进行反转录(反转录试剂盒购自TOYOBO公司,产品编号:FSQ-301)以合成cDNA。随后,在基因特异性引物的存在下,用SYBR Premix ExTq(日本TaKaRa公司,产品编号:RR420A)对cDNA和ROXⅡ的混合物进行实时荧光定量PCR(qRT-PCR)。最后,在高分辨率熔解曲线 PCR 仪(瑞士Roche公司,产品型号:Light Cycle 480)中根据PCR标准化方案定量转录PD-L1。用管家基因β-actin作为内部对照。引物序列:PD-L1,F 5′-TCACGGTTCCCAAGGACCTA-3′,R 5′-GCCAGAGGTAGTTCTGGGATG-3′,β-actin,F 5′-CCTTTGCCGATCCGCCG-3′,R 5′-AACATGATCTGGGTCATCTTCTCGC-3′,引物由上海吉凯基因合成。进入熔解曲线步骤,记录Ct值。通过将目的基因Ct值与管家基因β-actin相比,计算后获得2−ΔΔCt值,进行量化分析。
1.2.4. 结果判定
实验结果由2位具有副高及以上职称的病理医生独立阅片,结果判定均采用双盲法。细胞学中显微镜下有1个及以上细胞核红染即可诊断为HPV L1阳性,在高倍镜下每张切片随意取5个不同的视野,计数每个视野的细胞总数,计算HPV L1蛋白阳性率。在细胞膜或细胞质中出现淡黄色至棕褐色颗粒评定为PD-L1蛋白阳性显色,表达评分[9]具体如下:将阳性细胞百分比0%~25%、26%~50%、51%~75%、76%~100%分别计为0~3分。若细胞核无黄色颗粒样沉淀为阴性,评分为0分;若细胞核为淡黄色即为弱阳性细胞<10%,评分为1分;若细胞核为棕黄色即为阳性细胞≥10%,评分为2分;若细胞核为深棕褐色即为强阳性细胞≥10%,评分为3分。取5个视野评分的均值,PD-L1表达的总分为染色强度评分乘以阳性细胞百分比评分,总分≥2分被认为是阳性。
1.3. 统计学方法
计数资料以百分数和例数表示,组间比较用卡方检验;计量资料用
 表示,组间比较用t检验。α=0.05。
表示,组间比较用t检验。α=0.05。
2. 结果
2.1. 研究对象基本情况
本研究共纳入患者260例,全部为HR-HPV检测阳性。临床基本情况见表1。实验组与对照组以及实验组不同亚组间比较,平均年龄、体质量指数(body mass index,BMI)、平均孕次、平均产次、初次性生活年龄、吸烟史等方面差异均无统计学意义(P>0.05)。
表 1. Basic clinical information of 260 patients.
260例患者的临床基本情况
| Basic characteristic | Control group (n=40) | Experimental group | |||
| Total (n=220) | LSIL (n=40) | HSIL (n=80) | CCC (n=100) | ||
| Average age/yr. | 46.83±5.99 | 48.59±9.54 | 47.95±8.99 | 48.84±7.35 | 49.54±9.12 |
| Body mass index/(kg/m2) | 23.65±3.78 | 23.32±3.24 | 23.35±3.54 | 24.12±2.98 | 23.12±3.28 |
| The average pregnancy | 2.55±0.75 | 2.62±0.89 | 2.47±0.54 | 2.60±0.68 | 2.65±0.90 |
| The average labor | 1.43±0.60 | 1.35±0.52 | 1.29±0.45 | 1.32±0.54 | 1.47±0.48 |
| Age of the first sexual life/yr. | 18.98±2.24 | 19.24±2.35 | 19.59±2.68 | 19.38±2.42 | 18.87±2.39 |
| Smoking history/csae | |||||
| Yes | 10 | 32 | 9 | 11 | 12 |
| No | 30 | 188 | 31 | 69 | 88 |
2.2. HPV L1表达情况
HPV L1在宫颈上皮细胞核内出现红褐色粒状物融合成团块状即为阳性染色,若无细胞核红染即为阴性,见图1。HPV L1在宫颈炎性细胞、LSIL、HSIL和CCC中的阳性表达率分别为82.50%(33/40)、57.50%(23/40)、11.25%(9/80)和3.00%(3/100),阳性表达率逐步降低(P<0.05)。
图 1.
HPV L1 protein tests negative (A) and positive (B). ×400
HPV L1蛋白检测阴性(A)和阳性(B)。 ×400
在有宫颈组织学病理结果的218例患者中,慢性宫颈炎组织、CIN1、CIN2、CIN3和CC中HPV L1蛋白阳性表达率分别为86.67%(13/15)、65.00%(13/20)、34.38%(11/32)、11.76%(6/51)和4.00%(4/100),随着宫颈病变的进展,HPV L1蛋白阳性率逐渐降低(P<0.05)。
2.3. PD-L1表达情况
2.3.1. PD-L1蛋白表达与宫颈病变进展的关系
PD-L1在宫颈炎性细胞、LSIL、HSIL和CCC中的平均阳性评分分别为0.25±0.12、1.05±0.67、1.39±0.11和2.14±0.17,PD-L1表达阳性情况见图2。PD-L1在慢性宫颈炎组织、CIN1、CIN2、CIN3和CC中的平均阳性评分分别为0.28±0.24、1.21±0.79、1.56±0.26、1.80±0.24和2.10±0.19,PD-L1表达阳性情况见图3。PD-L1蛋白表达评分随着宫颈病变程度加重而增加,差异有统计学意义(P<0.05)。
图 2.

PD-L1 expression in cervical inflammatory cells (A), LSIL (B), HSIL (C) and CCC (D). ×400
PD-L1在宫颈炎性细胞(A)、LSIL(B)、HSIL(C)和CCC(D)中的表达。 ×400
图 3.
PD-L1 expressed on chronic inflammatory cervical tissue(A, CIN1 (B), CIN2 (C), CIN3 (D) and CC (E). ×400
PD-L1在宫颈慢性炎性组织(A)、CIN1(B)、CIN2(C)、CIN3(D)和CC(E)中的表达。 ×400
2.3.2. PD-L1 mRNA表达与宫颈病变进展的关系
各取20例慢性宫颈炎组织、CIN1、CIN2、CIN3和CC组织,其PD-L1 mRNA的相对表达量分别1.02±0.04、1.10±0.09、1.42±0.14、1.64±0.12和1.81±0.22,两两比较,慢性宫颈炎组与CIN1组及CIN3组与CC组对比,差异无统计学意义,其他组间差异均有统计学意义(P<0.05),CC组明显高于慢性宫颈炎组织,该结果和免疫组化测定结果相似,PD-L1 mRNA的相对表达量随宫颈病变程度加重而增加。
2.4. 单独和联合检测的诊断价值
2.4.1. 单独HPV L1检测
由表2可见,在202例行阴道镜检查的患者中,随着宫颈病变的进展,HPV L1的阳性表达率逐渐降低(P<0.05)。单独HPV L1检测诊断宫颈组织病变CIN2及以上的灵敏度为95.8%、特异度为47.2%、阳性预测值为89.3%、阴性预测值为52.7%、假阳性率为52.7%、假阴性率为4.2%。
表 2. The results of HPV L1 test alone or PD-L1 test alone were compared with the pathological results.
单独HPV L1检测或单独PD-L1检测结果与病理结果对照
| Histopathology | n | Positive expression of
HPV L1/case (%) |
Positive expression of PD-L1/score,
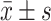
|
| *P<0.05, vs. former tissue. | |||
| Chronic cervicitis tissue | 11 | 9 (81.82) | 0.27±0.23 |
| CIN1 | 13 | 8 (61.54)* | 1.18±0.78 |
| CIN2 | 27 | 9 (33.33)* | 1.57±0.26 |
| CIN3 | 51 | 6 (11.76)* | 1.81±0.24 |
| CC | 100 | 4 (4.00)* | 2.08±0.18 |
2.4.2. 单独PD-L1检测
由表2可见,在202例行阴道镜检查的患者中,随着宫颈病变的进展,PD-L1阳性表达评分逐渐增加(P<0.05)。单独PD-L1检测诊断宫颈组织病变CIN2及以上的灵敏度为96.5%、特异度为32.8%、阳性预测值为78.1%、阴性预测值为67.2%、假阳性率为67.2%、假阴性率为3.5%。
2.4.3. 单独阴道镜检查
由表3可见,202例患者的阴道镜拟诊结果与组织病理学对比,其中诊断不足63例,占31.19%(63/202),诊断符合117例,占57.92%(117/202),过度诊断22例,占10.89%(22/202)。阴道镜拟诊结果与组织病理学诊断为CIN1的符合率为14.29%(6/42)、CIN2的符合率25.00%(5/20)、CIN3的符合率60.00%(18/30)、CC的符合率为87.37%(83/95)。单独阴道镜检查诊断宫颈组织病变CIN2及以上的灵敏度为77.5%、特异度为70.8%、阳性预测值为97.2%、阴性预测值为29.8%、假阳性率为16.7%、假阴性率为22.5%。
表 3. Comparison of tentative colposcopy results and histopathological results.
阴道镜拟诊结果与组织病理结果比较
| Results of
colposcopy |
Histopathology/case | |||||
| Chronic cervicitis | CIN1 | CIN2 | CIN3 | CC | Total | |
| Chronic cervicitis | 5 | 3 | 4 | 3 | 0 | 15 |
| CIN1 | 3 | 6 | 18 | 12 | 3 | 42 |
| CIN2 | 3 | 4 | 5 | 6 | 2 | 20 |
| CIN3 | 0 | 0 | 0 | 18 | 12 | 30 |
| CC | 0 | 0 | 0 | 12 | 83 | 95 |
| Total | 11 | 13 | 27 | 51 | 100 | 202 |
2.4.4. HPV L1/PD-L1检测联合阴道镜检查的诊断价值
见表4。对于诊断CIN2及以上的宫颈病变,HPV L1/PD-L1联合检测的灵敏度为92.4%,特异度为64.5%;HPV L1/PD-L1检测联合阴道镜检查的灵敏度为71.6%、特异度为89.6%。对于诊断CIN3及以上的宫颈病变,HPV L1/PD-L1联合检测的灵敏度为71.9%,特异度为86.1%;HPV L1/PD-L1检测联合阴道镜检查的灵敏度为50.5%、特异度为100.0%,见表5。
表 4. The diagnostic value of HPV L1/PD-L1 combined with colposcopy for cervical lesions of CIN 2 or higher classes.
HPV L1/PD-L1检测联合阴道镜检查对CIN2及以上宫颈病变的诊断价值
| Test | Sensitivity | Specificity | Positive predictive value | Negative predictive value |
| HPV L1 test alone | 95.8% | 47.2% | 89.3% | 52.7% |
| PD-L1 test alone | 96.5% | 32.8% | 78.1% | 67.2% |
| Colposcopy alone | 77.5% | 70.8% | 97.2% | 29.8% |
| HPV L1/PD-L1test | 92.4% | 64.5% | 97.7% | 35.4% |
| Triple inspection | 71.6% | 89.6% | 99.9% | 10.6% |
表 5. The diagnostic value of HPV L1/PD-L1 combined with colposcopy for cervical lesions of CIN 3 or higher classes.
HPV L1/PD-L1检测联合阴道镜检查对CIN3及以上宫颈病变的诊断价值
| Test | Sensitivity | Specificity | Positive predictive value | Negative predictive value |
| HPV L1 test alone | 84.9% | 72.2% | 84.4% | 28.6% |
| PD-L1 test alone | 84.7% | 50.0% | 80.8% | 56.9% |
| Colposcopy alone | 70.2% | 100.0% | 100.0% | 31.2% |
| HPV L1/PD-L1 test | 71.9% | 86.1% | 97.0% | 16.3% |
| Triple inspection | 50.5% | 100.0% | 100.0% | 5.1% |
3. 讨 论
研究发现,并不是所有HPV感染都能引起CIN及宫颈癌,大多数为亚临床感染。持续性的HR-HPV感染进而可发展为CIN,大部分低级别的CIN可自然消退,但高级别CIN可能发展为浸润癌[10]。CIN是宫颈癌防治的重要阶段,2014年WHO女性生殖器官肿瘤分类依据不同的发病机制、细胞成熟分化程度和进展为浸润癌的风险将宫颈鳞状上皮内瘤变分为LSIL和HSIL,而HSIL包括CIN2和CIN3[11]。目前在HSIL的分流中,HSIL的诊断与分级依然存在许多主观因素,从而影响临床治疗方案。因此,为临床提供一种简便、准确判断及预测宫颈病变的检测技术方法,为宫颈病变的早诊早治提供辅助诊断显得尤为重要。
HPV L1蛋白是HPV主要的衣壳蛋白,利用宿主细胞复制机制,HPV复制自身基因并且利用胞浆蛋白合成HPV L1和L2壳蛋白,与HPV裸核病毒组合[12],HPV L1表达和HPV病毒复制与感染早期密切相关[4],在病毒感染中发挥重要作用。在大多数情况下,HPV基因组整合到宿主基因组中后,病毒基因组的L1基因序列被完全保留[13],HPV L1蛋白表达缺失,不能激活免疫反应,失去清除病变细胞的能力,机体免疫系统不能产生抗体,继而发生免疫逃逸,导致宫颈病变的发生发展[14]。黄斌等[15]研究结果也表明HPV L1蛋白的阳性表达率随宫颈病变程度的加重而下降,与本研究结果一致,进一步指出HPV L1蛋白可以用于预测宫颈癌前病变的进展情况。
为了保护宿主免受任何潜在威胁,免疫系统演变为通过免疫检查点(immune checkpoints,iCP)对有害入侵者进行防御并有效消除了大多数病理微生物和有毒物质[16-17]。PD-1是新近出现的介导这些抑制性反馈的负性调节受体之一[18]。PD-L1被认为是共抑制受体PD-1的第一配体,位于9p24.1染色体的CD274基因编码上[19]。PD-L1抑制了T细胞的免疫活性及淋巴细胞的功能,避免了免疫监视,导致肿瘤发生免疫逃逸,促进了肿瘤的发生、发展[20]。PD-L1在宫颈癌中的诊断价值仍在研究中,既往研究发现PD-L1的表达与HPV阳性相关,并随CIN分级升高而升高,与宫颈癌的肿瘤转移也相关[21]。本研究结果表明宫颈病变细胞和组织中PD-L1的表达比宫颈炎性细胞和组织中的表达明显升高,在宫颈癌前及癌变中,PD-L1表达阳性平均评分随宫颈病变程度加重而升高,说明PD-L1在宫颈细胞和组织中的表达水平可间接反映宫颈病变的进展程度。
HPV L1的阳性表达率差异较大,受到取材、判读等因素的影响[4]。少数研究调查了PD-L1在宫颈癌中的表达,阳性率在30%~70%之间,这种差异较大的阳性率可能与以下几个因素有关:①使用不同的评分方法和定义阳性的临界点;②使用不同的抗体进行免疫组织化学研究,导致阳性染色细胞的数量不等及其染色情况不同;③免疫组织化学反应过程中组织的固定和抗原表位的稳定性;④PD-L1染色在肿瘤不同区域的异质性[22]。阴道镜检查作为宫颈癌筛查的重要检查,为宫颈癌的早期发现及诊断提供了极大的帮助。借助阴道镜放大技术的作用,能准确、清楚观察到宫颈表层改变情况,并且明确异常图像活检位置。但受到检查者本身、正常转化区和异常转化区混淆现象、宫颈管内病变不易被检查出、图像缺乏特异性、易发生假阳性等多因素等影响。临床经验丰富的医师操作和各项操作的规范性、有效性也与阴道镜检查准确率有关。单独阴道镜检查的高阴性预测值也说明单独阴道镜检测容易遗漏真正的宫颈病变患者,从而误诊或漏诊造成过度医疗[23]。每一种筛查方法都有不同的优缺点,单一的筛查方法不能准确的诊断宫颈癌前病变及宫颈癌,且不适用于经济发展水平不同的地区。本研究初步探讨HPV L1/PD-L1检测联合阴道镜检查用于宫颈病变筛查的价值,尤其适用于宫颈病变CIN3及以上的分流,减少了不必要的有创检查,减轻了患者负担,节约了医疗资源。本研究结果发现HPV L1/PD-L1检测联合阴道镜检查在宫颈病变组织诊断CIN2及以上的灵敏度为71.6%、特异度为89.6%,检出CIN3及以上病变的特异度为100%。说明三者联合检查能够更准确的筛查出HSIL中CIN3及以上的宫颈病变,降低误诊率,使真正需要治疗的高级别病变得到治疗。联合检查在发现宫颈病变中的灵敏度较单独检查降低,但特异度升高,提示联合检查可以降低误诊率,更适用于排查筛查宫颈病变,可以采取这种办法减少误诊的出现。联合检查可能在一定程度上弥补单独HPV L1检测、PD-L1检测和阴道镜检查的不足,进而优化对宫颈病变中HSIL分流处理。
综上,HPV L1表达水平随宫颈病变程度加重逐步降低,PD-L1蛋白的表达水平随宫颈病变程度加重逐步增加。HPV L1/PD-L1检测联合阴道镜检查对分流HSIL中CIN3及以上的宫颈病变具有一定的指导意义,HPV L1/PD-L1检测联合阴道镜检查对分流LSIL与HSIL需要进一步后续研究。
* * *
利益冲突 所有作者均声明不存在利益冲突
Contributor Information
古坡 罗 (Gu-po LUO), Email: 328360905@qq.com.
明蓉 郄 (Ming-rong XI), Email: qmrjzz@126.com.
References
- 1.BRAY F, FERLAY J, SOERJOMATARAM I, et al Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. doi: 10.3322/caac.21492. [DOI] [PubMed] [Google Scholar]
- 2.BOSCH F X, LORINCZ A, MUNOZ N, et al The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002;55(4):244–265. doi: 10.1136/jcp.55.4.244. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.陈惠祯, 蔡红兵. 子宫颈癌、子宫内膜癌、卵巢上皮癌手术方式的选择. 恩施: 第23届湖北省肿瘤学术大会, 2013.
- 4.FENG Y C, ZHANG Y, LIU C M, et al. Increased HPV L1 gene methylation and multiple infection status lead to the difference of cervical epithelial cell lesion in different ethnic women of Xinjiang, China. Medicine (Baltimore), 2017, 96(12): e6409[2020-04-01]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5371478/. doi: 10.1097/MD.0000000000006409.
- 5.SUN C, MEZZADRA R, SCHUMACHER T N Regulation and function of the PD-L1 checkpoint. Immunity. 2018;48(3):434–452. doi: 10.1016/j.immuni.2018.03.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.HANSEN J D, DU PASQUIER L, LEFRANC M P, et al The B7 family of immunoregulatory receptors: A comparative and evolutionary perspective. Mol Immunol. 2009;46(3):457–472. doi: 10.1016/j.molimm.2008.10.007. [DOI] [PubMed] [Google Scholar]
- 7.MENG Y, LIANG H, HU J, et al PD-L1 expression correlates with tumor infiltrating lymphocytes and response to neoadjuvant chemotherapy in cervical cancer. J Cancer. 2018;9(16):2938–2945. doi: 10.7150/jca.22532. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.COBUCCI R, MAISONNETTE M, MACEDO E, et al Pap test accuracy and severity of squamous intraepithelial lesion. Indian J Cancer. 2016;53(1):74–76. doi: 10.4103/0019-509X.180825. [DOI] [PubMed] [Google Scholar]
- 9.DIGGS L P, HSUEH E C. Utility of PD-L1 immunohistochemistry assays for predicting PD-1/PD-L1 inhibitor response. Biomark Res, 2017, 5: 12[2020-04-01]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5353958/. doi: 10.1186/s40364-017-0093-8.
- 10.SAHASRABUDDHE V V, PARHAM G P, MWANAHAMUNTU M H, et al Cervical cancer prevention in low- and middle-income countries: feasible, affordable, essential. Cancer Prev Res (Phila) 2012;5(1):11–17. doi: 10.1158/1940-6207.CAPR-11-0540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.NAYAR R, WILBUR D C The Pap test and Bethesda 2014. Cancer Cytopathol. 2015;123(5):271–281. doi: 10.1002/cncy.21521. [DOI] [PubMed] [Google Scholar]
- 12.TJALMA W A, DEPUYDT C E Cervical cancer screening: which HPV test should be used—L1 or E6/E7? Eur J Obstet Gynecol Reprod Biol. 2013;170(1):45–46. doi: 10.1016/j.ejogrb.2013.06.027. [DOI] [PubMed] [Google Scholar]
- 13.LEE H, LEE K J, JUNG C K, et al Expression of HPV L1 capsid protein in cervical specimens with HPV infection. Diagn Cytopathol. 2008;36(12):864–867. doi: 10.1002/dc.20922. [DOI] [PubMed] [Google Scholar]
- 14.YOSHIDA T, SANO T, KANUMA T, et al Immunochemical analysis of HPV L1 capsid protein and p16 protein in liquid-based cytology samples from uterine cervical lesions. Cancer. 2008;114(2):83–88. doi: 10.1002/cncr.23366. [DOI] [PubMed] [Google Scholar]
- 15.黄 斌, 李瑞珍, 刘志红, 等 HPV L1壳蛋白在宫颈脱落细胞中的表达及临床意义. 华中科技大学学报(医学版) 2009;38(6):824–828. [Google Scholar]
- 16.SADREDDINI S, BARADARAN B, AGHEBATI-MALEKI A, et al Immune checkpoint blockade opens a new way to cancer immunotherapy. J Cell Physiol. 2019;234(6):8541–8549. doi: 10.1002/jcp.27816. [DOI] [PubMed] [Google Scholar]
- 17.AKINLEYE A, RASOOL Z Immune checkpoint inhibitors of PD-L1 as cancer therapeutics. J Hematol Oncol. 2019;12:92[2020-04-03]. https://doi.org/10.1186/s13045-019-0779-5. doi: 10.1186/s13045-019-0779-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.VINCENT-FABERT C, ROLAND L, ZIMBER-STROBL U, et al Pre-clinical blocking of PD-L1 molecule, which expression is down regulated by NF-kappaB, JAK1/JAK2 and BTK inhibitors, induces regression of activated B-cell lymphoma. Cell Commun Signal. 2019;17:89[2020-04-03]. https://doi.org/10.1186/s12964-019-0391-x. doi: 10.1186/s12964-019-0391-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.LOHARAMTAWEETHONG K, SUPAKATITHAM C, VINYUVAT S, et al. Prognostic significance of PD-L1 protein expression and copy number gains in locally advanced cervical cancer. Asian Pac J Allergy Immunol, 2020, 12: 1758835920963001[2020-04-01]. https://doi.org/10.1177/1758835920963001.
- 20.XU-MONETTE Z Y, ZHANG M, LI J, et al. PD-1/PD-L1 blockade: have we found the key to unleash the antitumor immune response? Front Immunol, 2017, 8: 1597[2020-04-01]. https://doi.org/10.3389/fimmu.2017.01597.
- 21.YANG W, LU Y P, YANG Y Z, et al Expressions of programmed death (PD)-1 and PD-1 ligand (PD-L1) in cervical intraepithelial neoplasia and cervical squamous cell carcinomas are of prognostic value and associated with human papillomavirus status. J Obstet Gynaecol Res. 2017;43(10):1602–1612. doi: 10.1111/jog.13411. [DOI] [PubMed] [Google Scholar]
- 22.REDDY O L, SHINTAKU P I, MOATAMED N A Programmed death-ligand 1 (PD-L1) is expressed in a significant number of the uterine cervical carcinomas. Diagn Pathol. 2017;12:45[2020-04-03]. https://doi.org/10.1186/s13000-017-0631-6. doi: 10.1186/s13000-017-0631-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.曹泽毅. 子宫颈癌. 北京: 人民卫生出版社, 2017: 169-204.




