Abstract
目的
探讨Caspase活性和凋亡抑制因子1(CAAP1)对人肝癌细胞SMMC-7721增殖、迁移和侵袭的影响。
方法
构建CAAP1的过表达载体pcDNA3/CAAP1和敲降载体pSilencer 2.1-U6 neo/shR-CAAP1(shR-CAAP1),并进行鉴定。SMMC-7721分为4组:pcDNA3/CAAP1组、pcDNA3对照组、shR-CAAP1组和pSilencer对照组。SMMC-7721培养后,将CAAP1的过表达载体pcDNA3/CAAP1(pcDNA3/CAAP1组)和敲降载体shR-CAAP1(shR-CAAP1组)以及它们的对照(pcDNA3对照组、pSilencer对照组)分别转染到SMMC-7721中,48 h后进行后续实验。实时定量PCR(qRT-PCR)检测各组细胞中CAAP1 mRNA的表达水平,Western blot检测CAAP1、cleaved Caspase-3蛋白的表达水平;CCK-8实验检测各组细胞的增殖,细胞集落形成实验比较各组细胞集落形成能力;划痕实验比较各组细胞运动能力,Transwell小室检测各组细胞的迁移和侵袭;流式细胞术检测各组细胞的凋亡。纳入TCGA数据库CAAP1低表达的患者75例、CAAP1高表达的患者295例随访48个月的数据,Kaplan-Meier生存曲线比较不同CAAP1表达水平对肝癌患者总生存(OS)的影响。
结果
双酶切鉴定表明CAAP1过表达载体pcDNA3/CAAP1和敲降载体shR-CAAP1构建成功;qRT-PCR和Western blot结果提示pcDNA3/CAAP1能够使SMMC-7721细胞中CAAP1 mRNA和蛋白表达水平增加(与pcDNA3对照组相比,P<0.05),而shR-CAAP1使CAAP1 mRNA和蛋白表达水平降低(与pSilencer对照组相比,P<0.05)。与pcDNA3对照组比较,pcDNA3/CAAP1组SMMC-7721细胞的增殖能力、克隆形成能力、运动能力、迁移和侵袭能力增加,而细胞的凋亡受到抑制(均P<0.05);与pSilencer对照组相比较,shR-CAAP1组SMMC-7721细胞的增殖能力、克隆形成能力、运动能力、迁移和侵袭能力降低,而细胞凋亡增加(P<0.05)。TCGA数据库分析表明CAAP1低表达时肝癌患者的OS优于CAAP1高表达者。
结论
CAAP1能够促进肝癌细胞SMMC-7721增殖、迁移和侵袭,并抑制其凋亡。
Keywords: CAAP1, 肝癌, 增殖, 迁移, 侵袭
Abstract
Objective
To investigate the effect of caspase activity and apoptosis inhibitor 1 (CAAP1) on the proliferation, migration and invasion of hepatoma cell SMMC-7721.
Methods
pcDNA3/CAAP1, the overexpression vector of CAAP1, and pSilencer 2.1-U6 neo/shR-CAAP1, the knockdown vector, were constructed and examined. The experiment included 4 groups of SMMC-7721 cells, pcDNA3/CAAP1 group, pcDNA3 control group, shR-CAAP1 group and pSilencer control group. After the SMMC-7721 cells were cultured, the overexpression vector pcDNA3/CAAP1 (the pcDNA3/CAAP1 group), knockdown vector shR-CAAP1 (the shR-CAAP1 group) and their controls (pcDNA3 control group and pSilencer control group) were transfected into SMMC-7721 cells respectively, and the follow-up experiments were carried out 48 h later. The mRNA expression of CAAP1 in each group was examined with qRT-PCR. The protein expression level of CAAP1 and cleaved Caspase-3 were checked with Western blot. The proliferation of cells was examined with CCK-8. The colony formation ability and the motility of cells in each group were assessed with colony formation assay and wound-healing assay, respectively. The migration and invasion of cells were examined with Transwell cell chamber and the apoptosis of cells was examined with flow cytometry. The data of 75 patients with low expression of CAAP1 and 295 patients with high expression of CAAP1 were downloaded from TCGA database and the data of 48 months follow-up were analyzed. Kaplan-Meier survival curve was used to compare the correlation between different levels of CAAP1 expression and overall survival (OS) of hepatocellular carcinoma (HCC) patients.
Results
Double enzyme digestion analysis showed that the overexpression vector pcDNA3/CAAP1 and knockdown vector shR-CAAP1 were constructed successfully. qRT-PCR and Western blot results showed that pcDNA3/CAAP1 increased the mRNA and protein expression level of CAAP1 in SMMC-7721 cells (in comparison with the pcDNA3 control group, P<0.05), while shR-CAAP1 decreased the mRNA and protein expression of CAAP1 (in comparison with the pSilencer control group,P<0.05). Compared with pcDNA3 control group, the proliferation, colony formation ability, motility, migration and invasion of SMMC-7721 cells in the pcDNA3/CAAP1 group were increased, while the apoptosis of SMMC-7721 cells was inhibited (all P<0.05). Compared with the pSilencer control group, the proliferation, colony formation ability, motility, migration and invasion ability of SMMC-7721 cells in the shR-CAAP1 group decreased, while the apoptosis increased (all P<0.05). TCGA database analysis showed that HCC patients with lowCAAP1 expression had better OS than that of HCC patients with high CAAP1 expression.
Conclusion
CAAP1 can promote the proliferation, migration and invasion of SMMC-7721 cells while it inhibit their apoptosis.
Keywords: CAAP1, Hepatoma, Proliferation, Migration, Invasion
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内位列第三的常见恶性肿瘤,占原发性肝癌的85%~90%[1-3]。尽管近年来肝癌的治疗已有新突破,但晚期肝癌患者的预后仍然较差,至今尚无有效的治疗方法[4]。目前肝细胞癌的5年生存率不超过20%[5],肝癌的治疗涉及多个基因的表达调控,需要进一步的研究来明确肝癌的发生机制,开发新的治疗方法。Caspase活性和凋亡抑制因子1(Caspase activity and apoptosis inhibitor 1,CAAP1)也称为C9orf82蛋白,是一种表达广泛且进化高度保守的蛋白,也是一个潜在的凋亡相关信号转导因子,具有强大的抗凋亡功能[6]。研究表明敲低肺癌细胞和乳腺癌细胞中CAAP1的表达后细胞凋亡增加,这与Caspase-10的表达增加及其活性增强有关[7],因此抑制CAAP1的表达可能通过促进肿瘤细胞凋亡而抑制肿瘤细胞的增殖。到目前为止,关于CAAP1对肝癌作用影响的研究相对较少。本研究拟探讨CAAP1对人肝癌细胞SMMC-7721增殖、迁移和侵袭的作用,为肝癌的早期诊断和治疗提供实验依据。
1. 材料与方法
1.1. 细胞系及主要试剂
人肝癌细胞SMMC-7721购自中国科学院上海细胞库;实验所用质粒pcDNA3、pSilencer 2.1-U6 neo由天津医科大学生命科学实验中心汤华教授惠赠;实时定量PCR(qRT-PCR)引物以及CAAP1-114-BamHⅠ和CAAP1-1199-XhoⅠ引物由通用生物系统(安徽)有限公司合成;Trizol Reagent、Lipofectamine2000 Reagent、Opti-MEM细胞培养基、qRT-PCR试剂盒、DEPC水、琼脂糖、ECL显色试剂盒购自美国Invitrogen公司;胎牛血清购自美国BI公司;DMEM培养基、抗青霉素链霉素双抗混合液、PBS缓冲液、胰酶(含0.02%EDTA)和二甲基亚砜购自美国GIBCO公司;CCK-8试剂盒、质粒小提中量试剂盒购自庄盟生物有限公司;逆转录试剂盒购自上海生工生物工程有限公司;限制型内切酶BamHⅠ、Hind Ⅲ和XhoⅠ购自美国NEB公司;HiScript ⅡQRT SuperMix试剂盒购自南京诺唯赞生物科技有限公司;SDS-PAGE凝胶试剂盒、Tween-20购自上海碧云天公司;兔源抗CAAP1、GAPDH单克隆抗体购自美国Abcam公司;HRP标记抗兔二抗购自美国KPL公司。
1.2. 实验方法
1.2.1. CAAP1过表达和敲降载体的构建
以BamHⅠ和XhoⅠ为限制性内切酶位点,将扩增后的CAAP1序列连接到pcDNA3质粒载体中,构建过表达质粒载体pcDNA3/CAAP1;以BamHⅠ和Hind Ⅲ为限制性内切酶位点,将扩增的CAAP1 shRNA连接到pSilencer 2.1-U6 neo质粒载体中,构建CAAP1的敲降质粒pSilencer 2.1-U6 neo/shR-CAAP1(简称为shR-CAAP1),质粒扩增后进行酶切,酶切产物经0.8%琼脂糖凝胶电泳鉴定,pcDNA3/CAAP1质粒载体的酶切产物大小为1 050 bp,shR-CAAP1质粒载体的酶切产物大小为300 bp。扩增的CAAP1 shRNA由金唯智生物科技有限公司测序(Sanger法测序)鉴定重组质粒的正确性。引物由通用生物系统(安徽)有限公司设计合成,序列如下:CAAP1-114-BamHⅠ F:5′-GCGGGATCCATGACGGGGAAAAAGTCCTCC-3′;CAAP1-1199-XhoⅠ R:5′-GCTCAGCTCGAGGGCTGGCTTTTTTATATCACC-3′;shR-CAAP1 F:5′-GATCCAACCTGAAGGTTTGGAATTAACTCGAGTTAATTCCAAACCTTCAGGTTTTTTTGA-3′;shR-CAAP1 R:5′-AGCTTCAAAAAAACCTGAAGGTTTGGAATTAACTCGAGTTAATTCCAAACCTTCAGGTTG-3′。
1.2.2. 细胞培养及转染
人肝癌细胞SMMC-7721接种于含有10%胎牛血清(FBS)、100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基中,置于37 ℃、体积分数5% CO2的细胞培养箱中培养。实验分组为:pcDNA3/CAAP1组、pcDNA3对照组、shR-CAAP1组和pSilencer对照组。细胞培养至70%左右汇合度时,用Lipofectamine TM 2000试剂将CAAP1的过表达载体pcDNA3/CAAP1(pcDNA3/CAAP1组)和敲降载体shR-CAAP1(shR-CAAP1组)以及它们的对照(pcDNA3对照组、pSilencer对照组)分别转染到SMMC-7721细胞中,细胞转染48 h后进行后续实验。
1.2.3. qRT-PCR检测肝癌细胞SMMC-7721中CAAP1的表达水平
4组细胞转染48 h后,Trizol法提取细胞总RNA,用Oligo(dT)引物对cDNAs进行RT反应。采用SYBR Premix Ex-Taq试剂进行PCR分析,各组分按说明书配置好体系进行qRT-PCR反应,反应条件:95 ℃预变性3 min,95 ℃变性12 s,58 ℃退火40 s,72 ℃延伸30 s,45个循环,每组设3个重复。上下游引物序列如下:内参基因β-actin F:5′-CGTGACATTAAGGAGAAGCTG-3′,R:5′-CTAGAAGCATTTGCGGTGGAC-3′;CAAP1 F:5′-GCCGTGGAATGTAAAGAAGTATG-3′,R:5′-ATGACACAGTCAGGTCCAGT-3′。以2−ΔΔCt法计算CAAP1的相对表达量。
1.2.4. Western blot检测肝癌细胞SMMC-7721中CAAP1、cleaved Caspase-3的表达水平
转染48 h后收集4组细胞,用RIPA裂解缓冲液(1% Nonidet P-40、1% Triton X-100、1 mmol/L MgCl2、0.1% SDS和10 mmol/L Tris HCl,pH 7.4)提取细胞总蛋白。然后取适量蛋白样本与5×SDS上样缓冲液按体积比1∶5混匀,煮沸5 min使蛋白质变性。样本冷却后进行10% SDS-聚丙烯酰胺凝胶电泳并转移到聚偏二氟乙烯膜上,并在5%脱脂乳中封闭1 h。洗膜后,用稀释的多克隆抗体CAAP1(1∶500)、cleaved Caspase-3(1∶200)和GAPDH(1∶2 000)4 ℃过夜孵育,然后用TBS-T洗膜3次,在室温下与二抗孵育2 h。加入ECL显影液中显影,放入Gel-Pro凝胶成像系统中曝光、拍照,使用ImageJ软件获得各组的积分光密度(IOD)值,并以GAPDH为内参照,计算各条带与内参条带IOD的比值为该蛋白的相对表达量。
1.2.5. CCK8法检测肝癌细胞SMMC-7721的增殖情况
将4组细胞接种到96孔板上,密度为5×103个细胞/孔。分别于转染后0、24、48、72、96 h向各孔内加入10 μL CCK-8溶液。培养3 h后,测量450 nm处每孔的光密度(OD450)值,以反映细胞的增殖情况。OD450值正比于细胞的增殖能力。
1.2.6. 细胞集落形成实验
4组细胞转染后48 h,以每孔800个SMMC-7721细胞的密度将细胞接种于12孔板中。培养15 d后,用结晶紫染色,计数50个及50个以上细胞所形成的集落。以pcDNA3对照组、pSilencer对照组的集落形成计数为1,计算其他2组相对于各自对照组的细胞集落形成率。
1.2.7. 划痕实验检测细胞的运动能力
4组SMMC-7721细胞以8×104/孔的密度接种于24孔细胞培养板中,转染后0 h用微量移液管尖端进行划痕处理,PBS冲洗细胞3次,然后加入新鲜培养基。24 h后通过显微照片评估划痕间隙宽度,试验重复3次。细胞运动能力=(实验组迁移距离−对照组迁移距离)/对照组迁移距离。距离以μm为单位。式中对照组为pcDNA3对照组或pSilencer对照组。
1.2.8. Transwell小室检测细胞迁移和侵袭能力
使用Transwell小室进行迁移(无基质凝胶)和侵袭(有基质凝胶)分析。4组细胞转染48 h后,以5×104/孔或1×105/孔的密度接种至Transwell小室的上室,并加入200 μL无血清培养基。下室中加入20% FBS的培养基进行迁移试验或加入30% FBS的培养基进行侵袭试验。培养48 h后,用棉签擦掉上室细胞,结晶紫染色,显微镜计数。细胞迁移率=〔(实验组迁移细胞数−对照组迁移细胞数)/对照组迁移细胞数〕×100%,细胞侵袭率=〔(实验组侵袭细胞数−对照组侵袭细胞数)/对照组侵袭细胞数〕×100%。式中对照组为pcDNA3对照组或pSilencer对照组。
1.2.9. 流式细胞术检测细胞凋亡
4组SMMC-7721细胞转染48 h后收集细胞,3 000×g离心5 min,PBS洗涤2次,使用Annexin V-FITC试剂盒,上流式细胞仪对细胞进行分析,每个样品至少分析1×105个细胞,实验重复3次。细胞凋亡率(%)=早期细胞凋亡率+晚期细胞凋亡率。
1.2.10. TCGA数据库分析CAAP1对患者总生存(OS)的影响
通过TCGA数据库下载肝癌相关基因表达数据和临床信息数据,根据CAAP1的表达水平的受试者操作特征(ROC)曲线的约登指数判断的临界值,分为低表达组和高表达组,通过Kaplan-Meier生存曲线比较不同CAAP1表达水平的OS。
1.3. 统计学方法
本实验均进行3次重复,计量资料实验数据分析结果采用
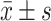 表示,组间比较采用单因素方差分析,两组间的差异进行t检验,P<0.05为差异有统计学意义。
表示,组间比较采用单因素方差分析,两组间的差异进行t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. CAAP1过表达和敲降载体的构建及酶切产物鉴定
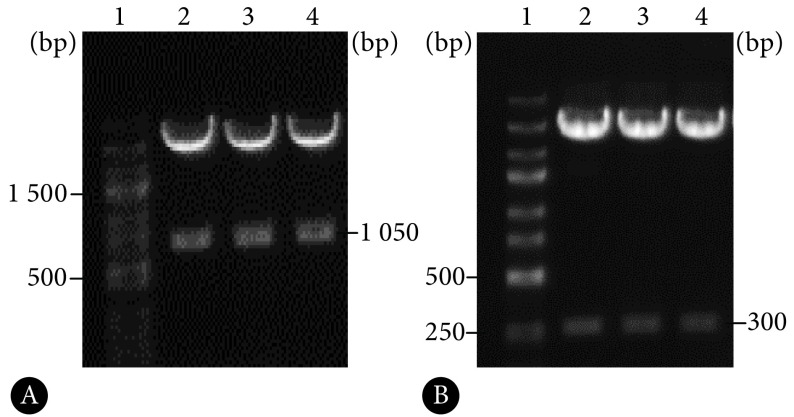
过表达载体pcDNA3-CAAP1和敲降载体shR-CAAP1扩增后进行酶切鉴定,如图1A所示,第2、3、4泳道的酶切产物大小为1 050 bp,图1B中第2、3、4泳道的酶切产物大小为300 bp,与测序结果一致,说明CAAP1的过表达载体和敲降载体均构建成功。
图 1.
Agarose gel electrophoresis of CAAP1 overexpression plasmids (A) and knockdown plasmids (B) enzyme-digested products
CAAP1过表达载体pcDNA3-CAAP1(A)和敲降载体shR-CAAP1(B)酶切产物的琼脂糖凝胶电泳
1: DNA marker; 2,3,4: Enzyme-digested products of plasmids.
2.2. CAAP1过表达和敲降质粒有效性验证
如图2所示,CAAP1 过表达后,SMMC-7721细胞中CAAP1的mRNA和蛋白水平均升高,差异有统计学意义(P<0.05);而在SMMC-7721细胞中敲降CAAP1 表达后细胞中CAAP1的mRNA 和蛋白水平均降低,差异有统计学意义(P<0.05)。
图 2.
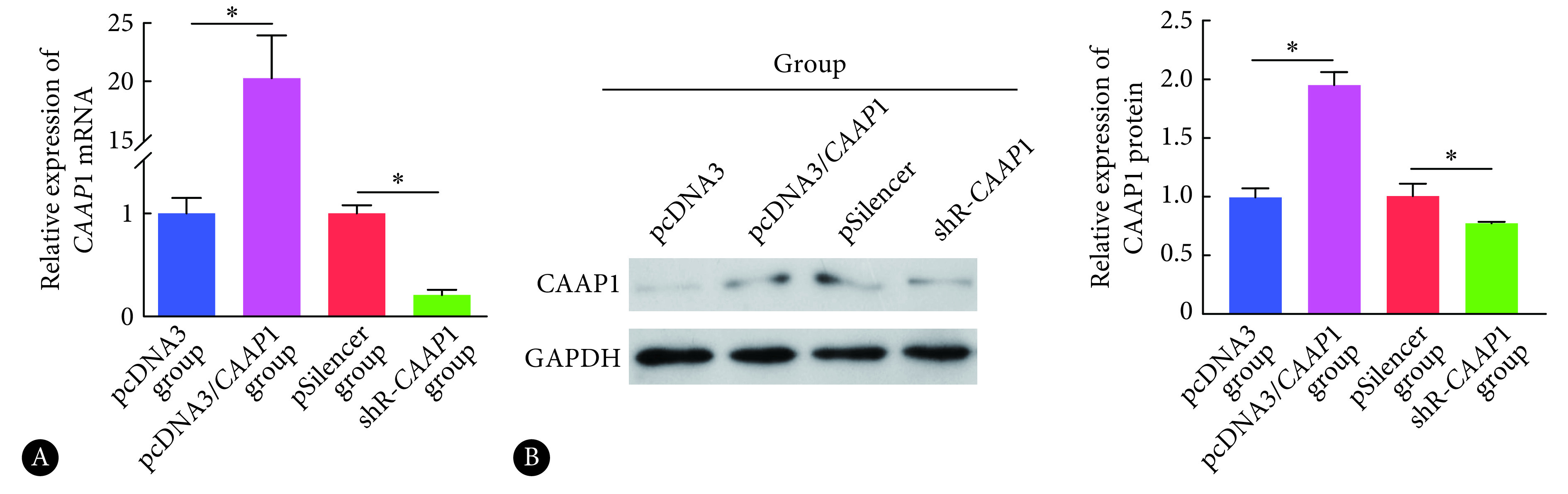
The relative expression level of CAAP1 mRNA (A) and protein (B) in SMMC-7721
SMMC-7721细胞中CAAP1 mRNA(A)和蛋白(B)的表达水平
*P<0.05,n=3.
2.3. CAAP1对肝癌细胞增殖的影响
如图3A所示,CCK-8实验结果表明,在SMMC-7721细胞中过表达CAAP1后,48 h、72 h和96 h时细胞增殖能力增强,而通过shRNA降低CAAP1表达后,48 h、72 h和96 h时细胞的增殖能力减弱,差异均有统计学意义(P<0.05)。细胞集落形成实验结果显示,与对照组相比,转染CAAP1后细胞的集落形成能力增加了56%(P<0.05);而降低CAAP1表达后,细胞的集落形成能力减弱了44%(P<0.05)(图3B)。提示CAAP1能够促进肝癌细胞SMMC-7721的增殖能力。
图 3.
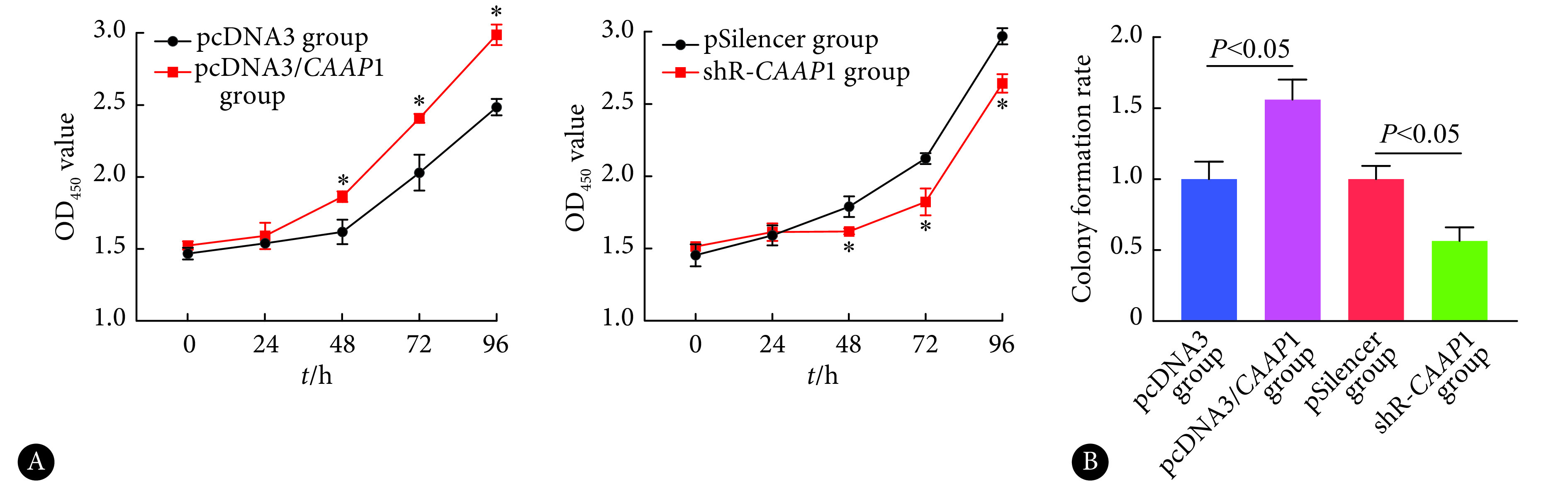
The effection of CAAP1 on the proliferation of SMMC-7721 cells
CAAP1对SMMC-7721细胞增殖能力的影响
A: Proliferation activity was detected by CCK8 assay; B: Cell colony formation was detected by colony formation assay. *P<0.05, vs. pcDNA3 or pSilencer group.n=3.
2.4. CAAP1对肝癌细胞运动、迁移、侵袭能力的影响
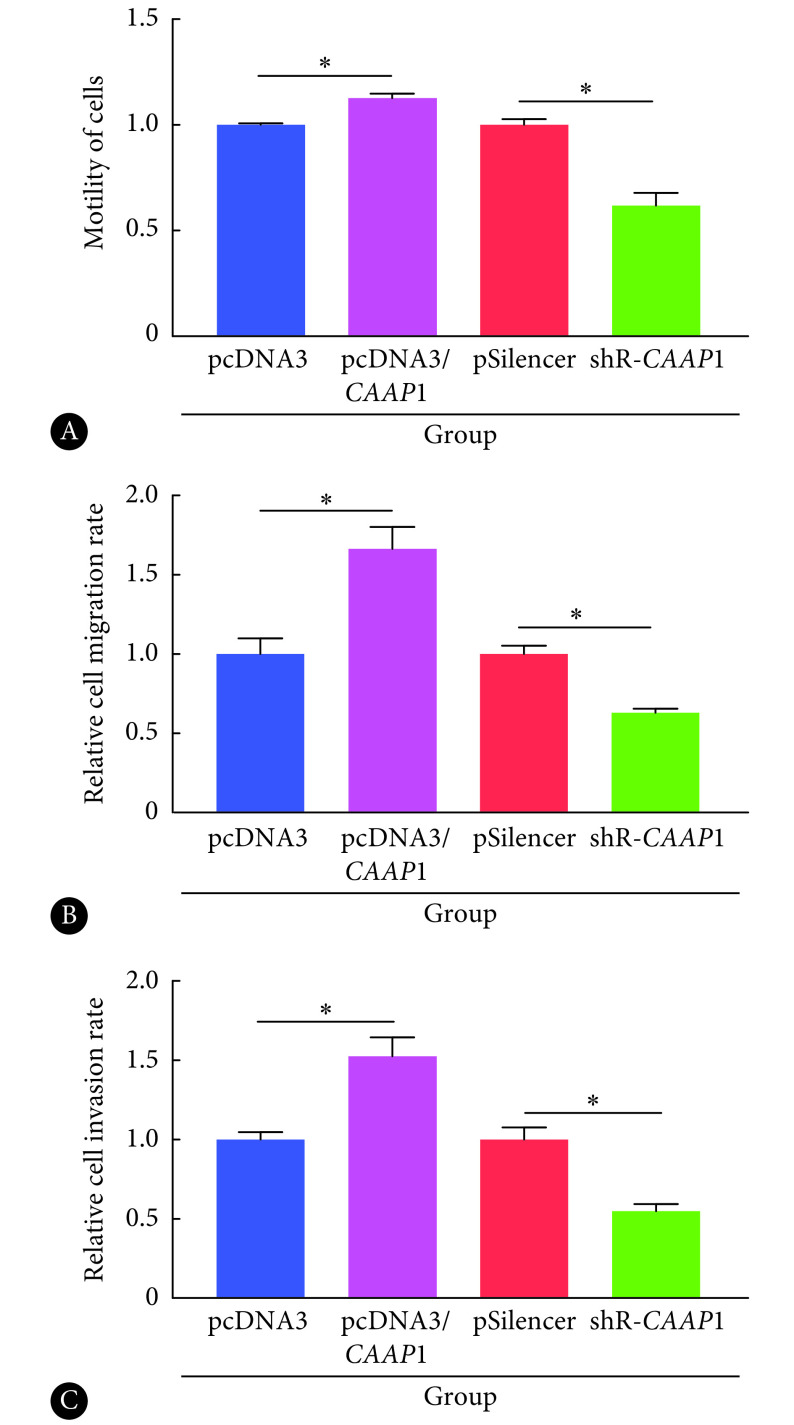
过表达CAAP1后SMMC-7721细胞的细胞运动、迁移和侵袭能力增加,与对照组相比,差异有统计学意义(P<0.05);而降低CAAP1的表达后,SMMC-7721细胞的细胞运动、迁移和侵袭能力降低,与对照组相比,差异均有统计学意义(P<0.05)。表明CAAP1能够促进肝癌细胞SMMC-7721的迁移和侵袭(图4)。
图 4.
The effection of CAAP1 on the motility, migration and invasion of SMMC-7721 cells
CAAP1对SMMC-7721细胞运动、迁移和侵袭能力的影响
A: Motility of cells was detected by scratch assay; B: Migration activity was detected by Transwell assay; C: Invasion activity was detected by Transwell assay. *P<0.05,n=3.
2.5. CAAP1对肝癌细胞凋亡的影响
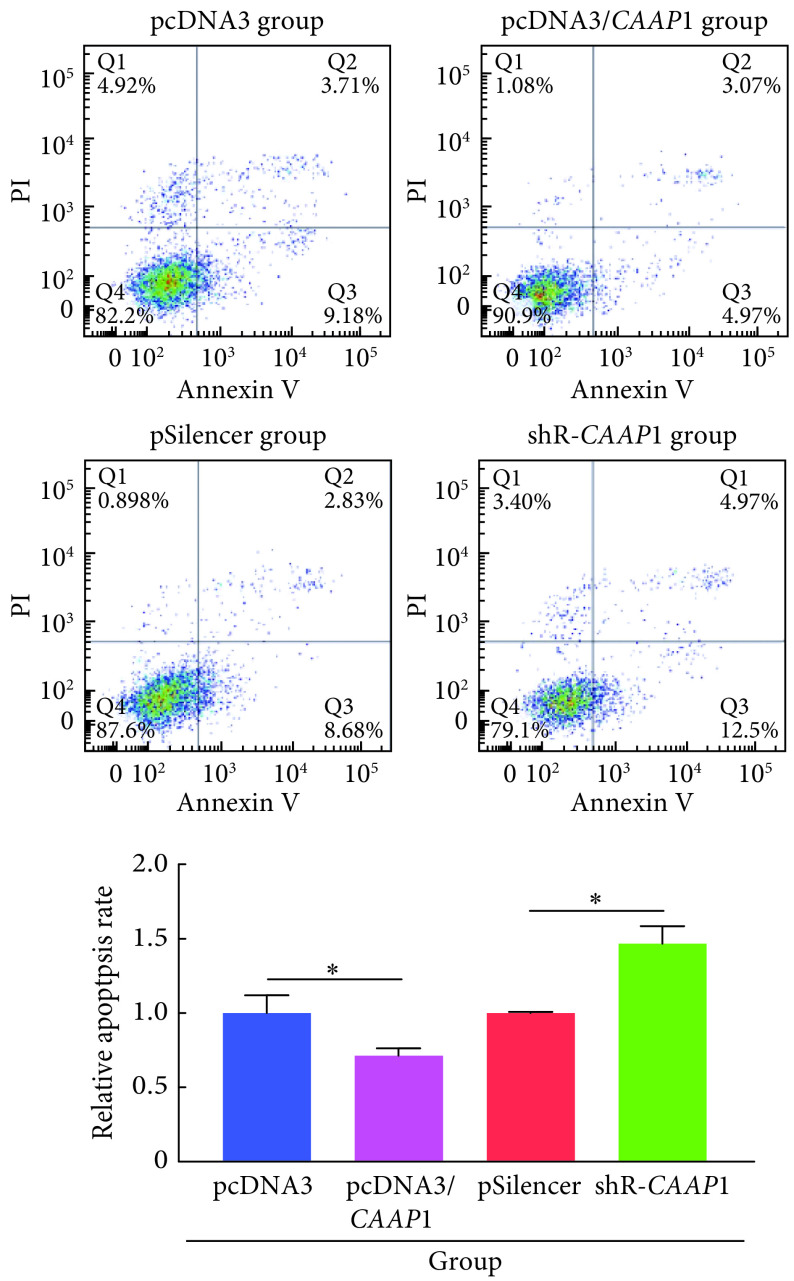
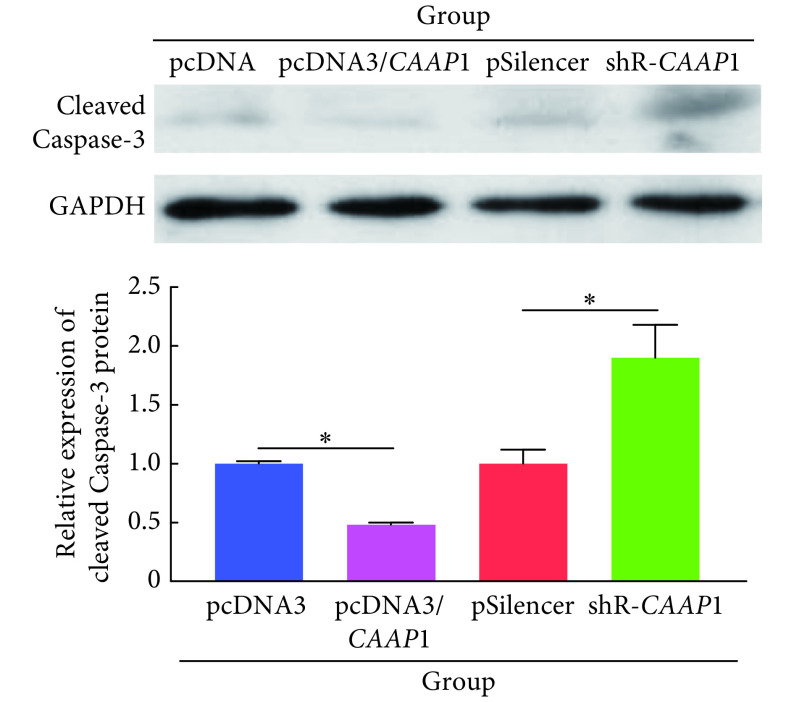
如图5所示,过表达CAAP1使细胞的凋亡率减少了29%,而敲降CAAP1使细胞的凋亡率增加了47%,差异均有统计学意义(P<0.05)。如图6所示,细胞中过表达CAAP1后cleaved Caspase-3蛋白表达减少了52%,与对照组相比,差异有统计学意义(P<0.05),敲降CAAP1后cleaved Caspase-3蛋白水平增加了90%,与对照组相比,差异有统计学意义(P<0.05)。提示CAAP1能够抑制肝癌细胞的凋亡。
图 5.
Apoptosis rate checked by flow cytometry
流式细胞术检测各组细胞凋亡
*P<0.05,n=3.
图 6.
Protein expressions of cleaved Caspase-3 by Western blot
Western blot 检测cleaved Caspase-3表达
*P<0.05,n=3.
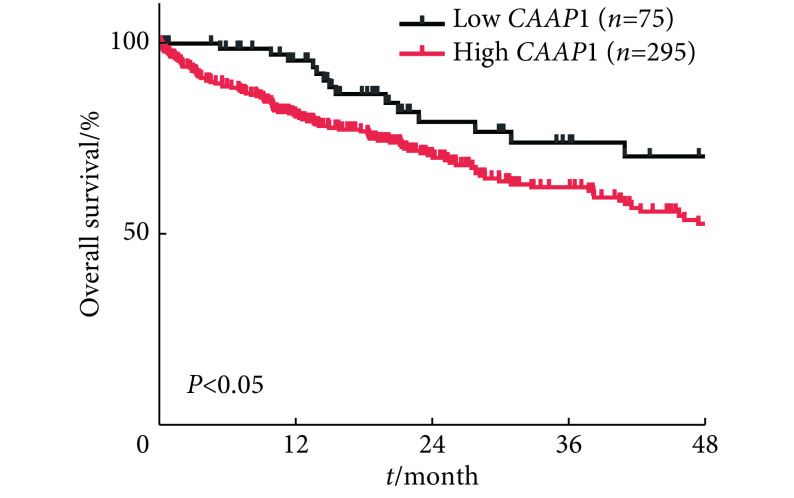
2.6. CAAP1对肝癌患者OS的影响
TCGA分析肝癌患者组织中CAAP1对患者总生存(OS)的影响,入组时CAAP1低表达的患者75例,CAAP1高表达的患者295例,到第48个月随访时,CAAP1低表达组剩余存活的病例人数19例,CAAP1高表达组剩余存活的病例人数51例。结果表明CAAP1低表达组的OS优于高表达组,差异有统计学意义(P<0.05)(图7)。
图 7.
Overall survival (OS) curve of hepatocellular carcinoma patients with differential expression of CAAP1
CAAP1差异表达的肝癌患者的OS曲线
3. 讨论
HCC具有高转移率、高复发率的特点,是一种具有很强侵袭和迁移的原发性肝癌。肝癌的发展往往具有慢性肝病背景,如慢性病毒性乙型肝炎和丙型肝炎,酒精性和非酒精性脂肪性肝炎以及肝硬化,肝癌在全球范围内的发病率呈上升趋势[8-9]。肝细胞癌的早期缺乏明显的症状,大多数患者诊断为肝细胞癌时已是中晚期,目前还没有建立有效的治疗方法,只有少数患者能够进行手术切除或进行肝移植[10]。全球每年大约有100万人死于肝细胞癌,我国每年肝癌的新发病例占全球的55%[11-12]。因此发现肝细胞癌有效的检测和治疗手段是当今面临的重要问题。
CAAP1是公认的凋亡相关基因,其在每个正常人(成人和胎儿)和人类起源的肿瘤组织中都有不同程度的表达,有保守的结构域,在不同物种间高度保守。生物信息学预测分析,CAAP1的中心区与死亡效应结构域结构相似,从而暗示其可能在细胞凋亡中发挥作用[6]。CAAP1发挥作用需要相互依赖的Caspase激活网络[5]。Caspase-3属于半胱氨酸蛋白酶Caspase家族,Caspase-3的激活在凋亡信号的传递中发挥关键作用,与真核细胞凋亡密切相关,被认为是促进细胞凋亡的蛋白[13]。但是关于CAAP1与肝癌关系的研究还未见报道。
本研究发现,转染pcDNA3/CAAP1质粒的细胞中CAAP1的mRNA和蛋白表达水平均升高,而转染shR-CAAP1的细胞中CAAP1的mRNA和蛋白表达水平均降低,表明pcDNA3/CAAP1和shR-CAAP1可以有效的升高或降低肝癌细胞SMMC-7721中CAAP1的mRNA和蛋白表达水平。本研究还发现,CAAP1过表达后肝癌细胞中cleaved Caspase-3的表达水平和细胞凋亡率均降低。CAAP1可能通过抑制cleaved Caspase-3表达而抑制凋亡。在YANG等[14]的研究中,Snhg3/miR-196/CAAP1调节环路维持着海马细胞功能的相对平衡。新发现的长链非编码RNA小核仁RNA宿主基因3(Snhg3)在海马细胞中充当miR-196的海绵,而CAAP1是miR-196的功能靶基因,CAAP1上调在海马细胞中具有抗凋亡作用。CAAP1是一种核蛋白,它能够调控接触拓扑异构酶Ⅱ(Topo Ⅱ)后DNA双链断裂(DSB)修复的速度[15],DSB通过放松缠绕的DNA来改变DNA拓扑结构。通过生物学信息分析得到CAAP1启动子有MKL1的结合位点(CArG box),MKL1可通过上调CAAP1的表达进而促进胃癌细胞的自噬并抑制其凋亡,可能是因为CAAP1作为抗凋亡蛋白下调Caspase-3蛋白的表达,抑制了细胞凋亡,但同时又可增强胃癌细胞的自噬能力[16-17],结合本实验的结果,我们认为这些可能是进一步研究CAAP1抑制肝癌细胞凋亡机制的线索。
本研究发现,CAAP1过表达可促进肝癌细胞的增殖、相对迁移距离、迁移率和侵袭率,而抑制CAAP1的表达后,得到了相反的结果。CHEN的团队也发现[18],CAAP1能够抑制脑微血管内皮细胞(bEnd.3)的凋亡。此外,利用TCGA数据库分析,揭示了肝癌组织中CAAP1 高表达的肝癌患者OS差。因此,CAAP1可能是肝癌的一个候选预后生物标记物。
综上所述,当细胞中CAAP1表达增加时,细胞增殖、迁移和侵袭能力显著增强而细胞的凋亡受到抑制;而当利用shRNA敲降细胞中CAAP1的表达时,细胞增殖、迁移和侵袭能力受到抑制而细胞的凋亡增加。这些结果提示,CAAP1作为一个促癌因子,可能与肝癌的发生发展密切相关,为CAAP1与肝癌的关系提供了新的认识。但本研究还有一些不足之处,尚未通过动物实验说明CAAP1在体内的作用,后续将继续跟进相关研究,进一步探索过表达CAAP1促进肝癌细胞生长增殖、迁移和侵袭而抑制肝癌细胞凋亡的机制。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学青年基金资助项目(No. 81201281)、河北省自然科学基金项目(No. C2012401037)、2020年政府资助临床医学优秀人才培养项目(冀财预复[2020]397号)、河北省省属高等学校基本科研业务费研究项目(No. JQN2020005)和河北省唐山市科学技术研究与发展计划(No. 19130204C)资助
References
- 1.SIEGEL R L, MILLER K D, JEMAL A Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7–30. doi: 10.3322/caac.21590. [DOI] [PubMed] [Google Scholar]
- 2.QU Z, WU J, WU J, et al. Exosomes derived from HCC cells induce sorafenib resistance in hepatocellular carcinoma both in vivo and in vitro. J Exp Clin Cancer Res, 2016, 35(1): 159[2020-06-30]. https://doi.org/0.1186/s13046-016-0430-z.
- 3.GROHMANN M, WIEDE F, DODD G T, et al Obesity drives STAT-1-dependent NASH and STAT-3-dependent HCC. Cell. 2018;175(5):1289–1306. doi: 10.1016/j.cell.2018.09.053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.ZHANG Z F, FENG X S, CHEN H, et al. Prognostic significance of synergistic hexokinase-2 and beta2-adrenergic receptor expression in human hepatocelluar carcinoma after curative resection. BMC Gastroenterol, 2016, 16(1): 57[2020-06-30]. https://doi.org/10.1186/s12876-016-0474-8.
- 5.HARTKE J, JOHNSON M, GHABRIL M The diagnosis and treatment of hepatocellular carcinoma. Semin Diagn Pathol. 2017;34(2):153–159. doi: 10.1053/j.semdp.2016.12.011. [DOI] [PubMed] [Google Scholar]
- 6.ZHANG Y, JOHANSSON E, MILLER M L, et al. Identification of a conserved anti-apoptotic protein that modulates the mitochondrial apoptosis pathway. PLoS One, 2011, 6(9): e25284[2020-06-30]. https://doi.org/10.1371/journal.pone.0025284.
- 7.ASLAM M A, ALEMDEHY M F, PRITCHARD C E, et al. Towards an understanding of C9orf82 protein/CAAP1 function. PLoS One, 2019, 14(1): e0210526[2020-06-30]. https://doi.org/10.1371/journal.pone.0210526.
- 8.SHIANI A, NARAYANAN S, PENA L, et al. The role of diagnosis and treatment of underlying liver disease for the prognosis of primary liver cancer. Cancer Control, 2017, 24(3): 1073274817729240[2020-06-30]. https://doi.org/10.1177/1073274817729240.
- 9.VARGAS J I, ARRESE M, SHAH V H, et al. Use of statins in patients with chronic liver disease and cirrhosis: current views and prospects. Curr Gastroenterol Rep, 2017, 19(9): 43[2020-06-30]. https://doi.org/10.1007/s11894-017-0584-7.
- 10.WALLACE M C, PREEN D, JEFFREY G P, et al The evolving epidemiology of hepatocellular carcinoma: a global perspective. Expert Rev Gastroenterol Hepatol. 2015;9(6):765–779. doi: 10.1586/17474124.2015.1028363. [DOI] [PubMed] [Google Scholar]
- 11.LIU X, LI J, YU Z, et al MiR-935 promotes liver cancer cell proliferation and migration by targeting SOX7. Oncol Res. 2017;25(3):427–435. doi: 10.3727/096504016X14747300207374. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.SANDBOTHE M, BUURMAN R, REICH N, et al The microRNA-449 family inhibits TGF-β-mediated liver cancer cell migration by targeting SOX4. J Hepatol. 2017;66(5):1012–1021. doi: 10.1016/j.jhep.2017.01.004. [DOI] [PubMed] [Google Scholar]
- 13.KLIONSKY D J, ABDELMOHSEN K, ABE A, et al Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition) Autophagy. 2016;12(1):1–222. doi: 10.1080/15548627.2015.1100356. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.YANG Q, WU M F, ZHU L H, et al. Long non-coding RNA Snhg3 protects against hypoxia/ischemia-induced neonatal brain injury. Exp Mol Pathol, 2020, 112: 104343[2020-06-30]. https://doi.org/10.1016/j.yexmp.2019.104343.
- 15.WIJDEVEN R H, PANG B, ZANDEN S Y, et al Genome-wide identification and characterization of novel factors conferring resistance to topoisomerase Ⅱ poisons in cancer. Cancer Res. 2015;75(19):4176–4187. doi: 10.1158/0008-5472.CAN-15-0380. [DOI] [PubMed] [Google Scholar]
- 16.张慧敏, 王君, 刘美君, 等 MKL1靶向CAAP1促进胃癌细胞的自噬并抑制凋亡 . 生物技术. 2019;29(5):441–450. doi: 10.16519/j.cnki.1004-311x.2019.05.0074. [DOI] [Google Scholar]
- 17.ZHANG H, LI H, WANG G, et al MKL1/miR-5100/CAAP1 loop regulates autophagy and apoptosis in gastric cancer cells . Neoplasia. 2020;22(5):220–230. doi: 10.1016/j.neo.2020.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.CHEN J Y, CHEN H, LI T, et al LncRNA LncOGD-1006 alleviates OGD-induced ischemic brain injury regulating apoptosis through miR-184-5p/CAAP1 axis . Eur Rev Med Pharmacol Sci. 2020;24(23):12324–12333. doi: 10.26355/EURREV_202012_24025. [DOI] [PubMed] [Google Scholar]