Abstract
目的
探讨眼外肌受累甲状腺相关眼病(TAO)的临床特征。
方法
收集2009年9月–2020年1月在四川大学华西医院眼眶病专科门诊就诊,经CT和/或MRI证实眼外肌受累的2 170例TAO患者的病例资料,回顾性分析其一般情况、病史、临床表现及影像学特征。
结果
2 170例TAO患者中,男性932例,女性1 238例;年龄6~85岁,平均(46.95±13.06)岁。甲状腺功能亢进1 684例(77.60%);甲状腺癌13例(0.59%);甲状腺功能减退80例(3.69%);甲状腺功能正常393例(18.11%)。眼球突出(55.25%)和复视(33.09%)是主要的就诊原因,眼球运动受限(83.46%)是最常见的体征。122例患者无眼睑征,仅眼外肌受累,平均年龄为(53.24±13.07)岁。2 170例TAO患者共有3 799只眼眼外肌受累,单眼541例,双眼1 629例;单条眼肌受累1 204眼(31.69%),多条眼肌受累2 595眼(68.31%)。眼外肌受累频率由高到低依次为下、上、内、外直肌。行MRI增强扫描的1 014例患者中,71.99%显示为活动期;临床活动性评分(CAS)为非活动期的775例患者,有69.03%在MRI上显示为活动期。
结论
眼外肌受累TAO患者有其特异的临床表现,CT、MRI均能用于眼外肌受累的辅助诊断。MRI可以评估眼外肌的病变阶段,而且比CAS更敏感。
Keywords: 甲状腺相关眼病, 眼外肌, 临床分析, 磁共振
Abstract
Objective
To explore the clinical features of thyroid-associated ophthalmopathy (TAO) with extraocular muscle involvement.
Methods
The data of 2170 TAO patients who were seen at the Orbital Disease Clinic, West China Hospital, Sichuan University from September, 2009 to January, 2020 were collected retrospectively. The extraocular muscle involvement of these patients was confirmed by CT or MRI. Their general condition, medical history, clinical manifestations and imaging features were analyzed retrospectively.
Results
Among the 2170 TAO patients, 932 were male and 1238 were female. The mean (±SD) age of all the patients was (46.95±13.06) years, ranging between 6 and 85. 1684 patients (77.60%) suffered from hyperthyroidism, 13 patients (0.59%) had thyroid cancer, 80 patients (3.69%) had hypothyroidism, and 393 patients (18.11%) had normal thyroid function. Proptosis (55.25%) and diplopia (33.09%) were the main reasons for their visits to the clinic, and restricted eye movements (83.46%) was the most common sign. 122 patients with a mean age of (53.24±13.07) years did not show any eyelid sign and had only extraocular muscle involvement. The 2170 TAO patients had a total of 3799 eyes of extrocular muscle involvement, with 541 patients experiencing monocular involvement and 1629 patients, binocular involvement; 1204 eyes (31.69%) had a single extrocular muscle involved and 2595 eyes (68.31%) had multiple extrocular muscles involved. Inferior rectus was the most commonly involved muscle, followed by superior rectus, medial rectus, and lateral rectus in descending order of involvement frequency. Of the 1014 patients who underwent enhanced MRI, 71.99% were shown to be in the active phase. 69.03% of the 775 patients identified as being in inactive phase according to their clinical activity score (CAS) were shown to be in the active phase according to their MRI results.
Conclusion
TAO patients with extraocular muscle involvement have their own specific clinical manifestations. CT and MRI can both be used to assist in the diagnosis of extraocular muscle involvement. MRI can be used to assess the pathological stage of extraocular muscles and is more sensitive than CAS.
Keywords: Thyroid associated ophthalmoathy, Extraocular muscles, Clinical analysis, Magnetic resonance imaging
甲状腺相关眼病(thyroid-associated ophthalmopathy,TAO)是一种与甲状腺功能异常相关的自身免疫性疾病,是临床上最常见的眼眶病[1-2]。其临床症状包括眼睑挛缩、闭合不全、突眼、复视等,严重者并发角膜及视神经损伤,严重影响患者的视力和生活质量[3]。美国甲状腺协会按临床症状及严重程度将TAO分为0~6级,眼外肌受累者为4级[4]。研究表明,眼外肌受累TAO患者临床表现具有一定的特异性[5-7],但目前国内尚无相关的大数据分析。我们对2009年9月–2020年1月于四川大学华西医院眼眶病专科门诊就诊,经CT和/或MRI检查证实眼外肌受累的2 170例TAO患者的临床资料进行回顾性分析。总结如下。
1. 资料和方法
1.1. 临床资料
本研究经四川大学华西医院伦理委员会审核通过(2019年审73号)。回顾性分析2009年9月–2020年1月于我院眼眶病专科门诊就诊,经CT和/或MRI检查证实眼外肌受累的TAO患者的临床资料,包括患者一般情况、眼病和甲状腺疾病病史、临床症状、体征、影像检查情况。
纳入标准:经过眼科及甲状腺功能检查诊断为TAO,排除其他疾病,且CT和/或MRI检查示眼外肌受累。
排除标准:TAO患者无CT和MRI检查或CT/MRI检查示眼外肌未受累。
1.2. 相关检查
1.2.1. 眼部检查
视力(国际标准视力表,矫正视力),眼压(非接触式眼压计测量),眼球突出度 (Hertel眼球突度计),外眼,眼前节,眼底及眼球运动。
1.2.2. 影像检查
2009–2014年收治的患者主要行CT检查,2015–2020年收治的患者主要行MRI检查。纳入患者中1 156例行眼眶CT扫描;876例行眼眶MRI增强扫描;138例转诊患者在外院行CT后转入我院后再行MRI增强扫描。
1.2.3. 甲状腺功能检查
抽取患者外周静脉血进行甲状腺功能检查。包括游离三碘甲状腺原氨酸(FT3)、游离甲状腺酸(FT4)、促甲状腺激素(TSH)、促甲状腺激素受体抗体、甲状腺过氧化物酶抗体和甲状腺球蛋白抗体等。
1.3. TAO诊断标准
根据BARTLEY提出的TAO诊断标准[8],如有眼睑挛缩,应合并以下指标之一:甲状腺功能异常或调节异常;眼球突出;1/4眼外肌受累;视神经功能障碍。如无眼睑退缩,则必须有甲状腺功能异常或调节异常且合并以下一个临床体征:眼球突出;视功能障碍;1/4眼外肌受累。
甲状腺功能异常或调节异常:FT3、FT4、TSH增高或降低;促甲状腺激素受体抗体、甲状腺过氧化物酶抗体和甲状腺球蛋白抗体阳性。
眼睑挛缩:上睑缘位于角巩膜缘上方为上睑挛缩;下眼睑位于下方角巩膜缘以下,下方巩膜暴露(露白)为下睑挛缩。
眼球突出:眼球突出度大于14 mm或两眼突出度相差2 mm则为眼球突出[9]。
视神经功能障碍:影像学检查示TAO患者眶尖视神经挤压,伴有视力下降、视野异常、色觉和光感度受损、视觉诱发电位异常、相对性瞳孔传入障碍、视乳头水肿或者萎缩等视觉功能损害,并排除其他疾病导致视功能损害[10]。
1.4. 临床活动性评分(clinical activity score,CAS)
采用Mourits评分法,眼球后疼痛、眼球转动痛、眼睑发红、眼睑肿胀、球结膜充血、球结膜水肿、泪阜肿胀,每项计1分共计7分。CAS≥3分为活动期,CAS<3分为非活动期[11]。
1.5. MRI判断眼外肌的分期
采用T1加权成像(T1-weighted image,T1WI)增强扫描脂肪抑制序列,取4条眼外肌信号强度最高的一条,取同侧颞肌为参照,明显强化为活动期,否则为非活动期。
1.6. 统计学方法
计量资料以
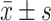 表示,组间比较采用两独立样本t检验;计数资料构成比之间的比较采用独立样本列联表χ2检验。P<0.05为差异有统计学意义。
表示,组间比较采用两独立样本t检验;计数资料构成比之间的比较采用独立样本列联表χ2检验。P<0.05为差异有统计学意义。
2. 结果
2.1. 一般情况
共纳入2 170例眼外肌受累TAO患者,男性932例,女性1 238例。年龄6~85岁,平均(46.95±13.06)岁。病程1周~30年,平均(14.94±30.99)个月。单侧眼外肌受累者541例(24.93%),其中男性259例,女性282例,男∶女=1∶1.088;双侧眼外肌受累者1 629例(75.07%),其中男性673例,女性956例,男∶女=1∶1.42,双侧眼外肌受累患者中女性比例高于单侧眼外肌受累患者(χ2=7.134,P=0.008)。单侧眼外肌受累患者年龄为(47.03±12.48)岁,双侧眼外肌受累患者年龄为(46.93±13.25)岁,差异无统计学意义(t=0.168,P=0.867)。单侧眼外肌受累患者病程为(12.38±26.42)个月,双侧眼外肌受累患者病程为(15.80±32.33)个月,差异有统计学意义(t=−2.44,P=0.015)。
2.2. 甲状腺功能状态及治疗情况
甲状腺功能正常393例(18.11%),甲状腺功能异常1 777例(81.89%),甲状腺功能亢进1 684例(77.60%),甲状腺癌13例(0.59%),甲状腺功能减退80例(3.69%)。单侧眼外肌受累患者甲状腺功能异常的比率更小(P<0.05)。单侧眼外肌受累患者与双侧眼外肌受累TAO患者,甲状腺异常病程分别为(46.52±71.28)个月和(33.03±55.24)个月,差异有统计学意义(表1)。
表 1. Thyroid dysfunction and treatment in TAO patients with unilateral or bilateral ophthalmic muscle involvement.
单双侧眼肌受累患者甲状腺功能异常及治疗情况
| Item | Total (n=2170) | Monocular (n=541) | Binocular (n=1629) | P |
| Thyroid dysfunction/case (%) | ||||
| Hyperthyroidism | 1684 (77.60) | 349 (64.51) | 1335 (81.95) | <0.001 |
| Hypothyroidism | 80 (3.69) | 17 (3.14) | 63 (3.87) | |
| Thyroid cancer | 13 (0.56) | 4 (0.74) | 9 (0.55) | |
Duration of thyroid disease in months (
 )
)
|
35.53±58.77 | 46.52±71.28 | 33.03±55.24 | 0.003 |
| Treatment of hyperthyroidism/case (%) | ||||
| Radioiodine | 738 (43.82) | 147 (42.12) | 591 (44.27) | 0.770 |
| Anti-thyroid drugs | 937 (55.64) | 200 (57.31) | 737 (55.21) | |
| Thyroidectomy | 9 (0.53) | 2 (0.57) | 7 (0.52) |
2.3. 临床表现
居前三位的就诊原因为,眼球突出(1 199例,55.25%)、复视(718例,33.09%)、眼睑肿胀(622例,28.66%)。其他就诊原因还包括,流泪、眼部胀痛、视力下降、眼部异物感等。与双侧眼外肌受累患者相比,单侧眼外肌受累患者复视比例更高,差异有统计学意义(P<0.05)。双侧眼外肌受累患者主诉眼球突出、流泪、畏光的比例高于单侧眼外肌受累患者,差异有统计学意义(P<0.05),见表2。
表 2. Clinic manifestations of 2170 TAO patients.
2170例患者临床表现
| Clinic features | Extraocular muscle involvement/case (%) | P | ||
| Total (n=2170) | Monocular (n=541) | Binocular (n=1629) | ||
| DON:Dysthyroid optic neuropathy. | ||||
| Symptoms proptosis | 1199 (55.25) | 259 (47.87) | 940 (57.70) | <0.001 |
| Diplopia | 718 (33.09) | 238 (43.99) | 480 (29.47) | <0.001 |
| Lid swelling | 622 (28.66) | 139 (25.69) | 483 (29.65) | 0.078 |
| Epiphora | 382 (17.60) | 62 (11.46) | 320 (19.64) | <0.001 |
| Eye pain | 295 (13.59) | 66 (12.20) | 229 (14.06) | 0.275 |
| Blurring of vision | 261 (12.03) | 59 (10.91) | 202 (12.40) | 0.354 |
| Foreign body sensation | 170 (7.83) | 37 (6.84) | 133 (8.16) | 0.320 |
| Photophobia | 120 (5.53) | 16 (2.96) | 104 (6.38) | 0.003 |
| Physical sign | ||||
| Lid lag | 1557 (71.75) | 374 (69.13) | 1183 (72.62) | 0.118 |
| Lid swelling | 1461 (67.33) | 293 (54.16) | 1168 (71.70) | <0.001 |
| Upper eyelid retraction | 1459 (67.24) | 346 (63.96) | 1113 (68.32) | 0.061 |
| lower eyelid retraction | 262 (12.07) | 48 (8.87) | 214 (13.14) | <0.001 |
| Lagophthalmos | 364 (16.77) | 55 (10.17) | 309 (18.97) | <0.001 |
| Conjunctival congestion | 468 (21.57) | 74 (13.68) | 394 (24.19) | <0.001 |
| Chemosis | 403 (18.57) | 66 (12.20) | 337 (20.69) | <0.001 |
| corneal involvement | 215 (9.91) | 39 (7.21) | 176 (10.80) | 0.015 |
| Proptosis | 2026 (93.36) | 467 (86.32) | 1559 (95.70) | <0.001 |
| Restrictive dyskinesia | 1811 (83.46) | 459 (84.84) | 1352 (83.00) | 0.316 |
| Strabismus | 380 (17.51) | 141 (26.06) | 239 (14.67) | <0.001 |
| DON | 36 (1.66) | 8 (1.48) | 28 (1.72) | 0.705 |
| TAO activity active | 457 (21.06) | 70 (12.94) | 387 (23.76) | <0.001 |
眼睑征包括:上睑迟落(71.75%)、上睑肿胀(67.33%)、上睑挛缩(67.24%)、下睑退缩(12.07%)、眼睑闭合不全(16.77%)。经Hertel突眼计测量2 026例(93.36%)伴有眼球突出;1 811例(83.46%)眼球运动受限;380例(17.51%)伴有限制性斜视。36例(1.66%)并发压迫性视神经病变,均表现为增粗的眼外肌在眶尖挤压视神经。457例(21.06%)CAS≥3,表现为活动期。限制性斜视在单侧眼外肌受累患者更多见,而与眼眶炎症相关的症状如眼睑肿胀、结膜充血、水肿等在双侧眼外肌受累患者更多,差异有统计学意义(P<0.05)。
有262例TAO患者虽然临床上表现为单眼受累,但影像学检查示双眼眼外肌均受累。122例TAO患者在影像学上显示眼外肌受累,而无眼睑征,其中男性64例(52.46%),女性58例(47.54%),男∶女=1.10∶1;年龄为22~79岁,平均年龄(53.24±13.07)岁;病程1周~30年,平均(14.41±38.04)个月,就诊时主诉:复视73例(59.83%),眼球突出37例(30.33%),其他12例(9.84%)。
2.4. 影像学表现
2.4.1. 眼外肌受累情况
单侧眼外肌受累患者,67.47%为单条眼外肌受累;双侧眼外肌受累患者,25.75%为单条眼外肌受累,差异有统计学意义(P<0.001)(表3)。眼外肌受累部位频率由高到低依次为下直肌3 377眼(88.89%)、上直肌2 353眼(61.94%)、内直肌2 007眼(52.83%)、外直肌1 110眼(29.22%)。受累眼外肌呈梭形,肌腹增粗,肌腱正常(图1)。
表 3. Distribution of TAO extraocular muscle involvement in 2170 cases (3 799 eyes).
2170例(3 799眼)TAO患者眼外肌受累分布情况
| Distribution | Number of involved extraocular muscles/eye (%) | ||||
| One | Two | Three | Four | Total | |
| Monocular | 365 (67.47) | 103 (19.04) | 55 (10.17) | 18 (3.33) | 541 |
| Binocular | 839 (25.75) | 835 (25.63) | 806 (24.74) | 778 (23.88) | 3 258 |
| Total | 1 204 (31.69) | 938 (24.69) | 861 (22.66) | 796 (20.95) | 3 799 |
| χ 2 | 358.959 | 10.837 | 56.214 | 118.326 | |
| P | <0.001 | 0.001 | <0.001 | <0.001 | |
图 1.
Orbital CT images of patients with TAO
TAO患者眼眶CT图像
A: Coronal scan showed enlargement of the four extraocular muscles of bilateral sides; B: Axial scan demonstrated the fusiform enlargement of medial and lateral rectus.
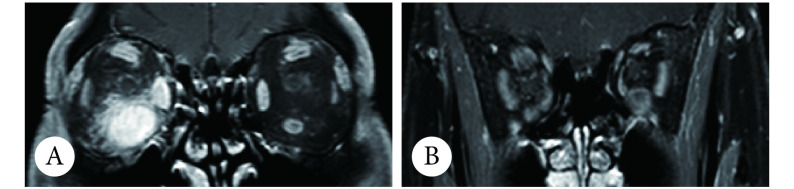
1 014例TAO患者行眼眶MRI增强扫描,将眼外肌T1WI增强后脂肪抑制信号对比同侧颞肌,730例(71.99%)明显强化,为活动期(图2A);284例(28.01%)无明显强化,非活动期(图2B);病程分别为(12.58±27.44)个月和(17.93±40.00)个月,差异有统计学意义(t=2.046,P=0.041)。775例患者CAS<3,其中535例(69.03%)MRI评估为活动期(图3),240例(30.97%)为非活动期;239例患者CAS≥3,其中195例(81.59%)MRI评估为活动期,44例(18.41%)为非活动期。
图 2.
Contrast-enhanced T1-weighted FSE fat-suppressed coronal MR image
MRI T1WI增强扫描脂肪抑制序列冠状位
A: The inferior rectus muscle was enlarged with increased signal of right eye, indicative of active TAO; B: The enlargement of four rectus muscles without increased signal on bilateral sides, indicative of non-active TAO.
图 3.
Enhanced MRI T1WI scan in TAO patients with upper eyelid retraction of left eye clinically assessed as being inactive (A) showing enlargement of superior and inferior rectus muscles with increased signal of left eye, which is indicative of active TAO in the superior and inferior muscles (B)
左眼上睑挛缩,临床评估为非活动期(A)的TAO患者MRI T1WI增强扫描显示左眼上、下直肌肌腹增粗,明显强化,眼外肌处于炎症活动期(B)
2.4.2. 眼眶的其他改变
眶脂肪增生547例(25.21%)(图4A),泪腺肿大293例(13.50%)(图4B);眼上静脉扩张147例(6.77%);眶尖视神经受压245例(11.29%)(图4C,4D)。具体见表4。
图 4.
Other orbital changes in TAO patients
TAO患者眼眶的其他改变
A: Coronal CT scan showed that bilateral extraocular muscles are enlarged and adipose increased;B: Contrast-enhanced T1-weighted FSE fat-suppressed coronal MR image demonstrated englargement of lacrimal glands with increased signal;C: Coronal CT image showed a thickened extraocular muscle pressing against the optic nerve at the orbital apex;D : Axial CT image showed that extraocular muscles pressing against the optic nerve at the orbital apex.
表 4. Other changes in TAO patients with extraocular muscle involvement found on images.
影像上发现的眼外肌受累TAO患者的其他改变
| Changes | Extraocular muscle involvement/case (%) | |||
| Total | Monocular | Binocular | P | |
| Orbital fat volume increase | 547 (25.21) | 125 (23.11) | 422 (25.91) | 0.194 |
| Lacrimal gland enlargement | 293 (13.50) | 64 (11.83) | 229 (14.06) | 0.189 |
| Enlarged superior ocular vein | 147 (6.77) | 35 (6.47) | 112 (6.88) | 0.745 |
| Orbital apex optic nerve compression | 245 (11.29) | 45 (8.32) | 200 (12.28) | 0.012 |
3. 讨论
本研究中,我们分析了2 170例经影像学检查证实眼肌受累的TAO患者,平均年龄为46岁,与MURAKAMI等[7]的研究相似。本组患者中有24.93%的患者为单侧眼外肌受累,与既往研究结果相似[12],单侧或双侧眼外肌受累患者均以女性多见,但男性在单侧眼外肌受累的比例更高。与双侧眼外肌受累患者相比,单侧眼外肌受累患者的病程更短,其原因与出现复视有关。
甲状腺功能状态与TAO的发病及严重程度密切相关,文献报道80%~90%的TAO患者伴有甲状腺功能异常[13]。本组眼外肌受累TAO患者有81.89%伴有甲状腺功能异常,以甲状腺功能亢进为主。既往报道,甲状腺功能正常的患者多表现为单眼受累[14]。在本组患者中,甲功异常患者和甲功正常患者均以双侧眼外肌受累为主,但甲功正常组单侧眼外肌受累比例更高。
93.36%眼外肌受累TAO患者伴有眼球突出。眼外肌增粗、球后脂肪组织增生,是造成TAO患者眼球突出的主要原因。危昆桥等[15]根据眼球突出情况及眼外肌与球后脂肪组织受累情况将TAO分为4种亚型:无眼外肌受累及眶脂肪组织增生;眶脂肪组织增生明显,眼外肌受累不明显;眼外肌受累明显,眶脂肪组织增生不明显;同时有眼外肌受累及眶脂肪组织增生。本组部分患者除眼外肌增粗外,在影像上还观察到眼眶脂肪组织增生和泪腺肿大,共同作用导致眼球突出。
眼球运动受限和复视是TAO患者眼外肌受累的主要临床症状。在本组研究中83.46%的患者伴有眼球运动受限,33.09%的患者伴有复视。与双眼眼外肌受累的患者相比,单眼眼外肌受累患者复视的发生率更高。LAURBERG等[16]指出复视的严重程度,与双眼眼外肌受累的对称性存在相关关系,双眼眼外肌受累不对称的患者出现复视的概率更大。
压迫性视神经病变是TAO最严重的的并发症,若不及时治疗可能导致永久性的视力损伤[17]。目前普遍认为多条增粗的眼外肌在眶尖压迫视神经,是主要致病原因[18]。本组共有36例患者并发压迫性视神经病变,影像上均表现为眼外肌明显增粗,在眶尖压迫视神经。影像学检查能为压迫性视神经病变的诊断,提供最直观的证据
本组有262例患者临床表现为单眼受累,CT或MRI示双眼眼外肌受累。在临床诊疗中应结合影像学检查全面分析双眼受累情况,避免遗漏。有122例TAO患者无任何眼睑症状,以男性患者多见,平均年龄为53岁,复视是主要的就诊原因。这部分患者不能根据临床表现作出诊断,影像学检查可了解眼眶组织的改变情况,排出其他眼病,对TAO的诊断具有重要意义。
CT和MRI均对眼外肌的形态改变有较好的成像效果。我们观察到受累的眼外肌具以下特性:①肌腹增粗,肌腱和肌止点多正常,边界清楚呈梭形;②单侧受累患者以单条眼外肌受累为主,双侧受累患者以多条眼外肌受累为主;③眼外肌受累频率由高到低依次为下、上、内、外直肌。
眼外肌的病理改变分为两个阶段:早期为活动期,眼外肌淋巴细胞浸润,血管扩张、糖胺聚糖聚性水肿。在此阶段通过糖皮质激素或放疗能减轻炎症反应,防止疾病进一步恶化。后期非活动期眼外肌纤维化,对抗炎治疗无明显反应[3]。临床上常采用CAS评估TAO的分期,其主要通过临床症状和体征进行计分。但早期、隐匿的眼外肌炎症,并不会出现明显的临床症状,此时仅依靠CAS难以做出正确的评价,这时就需要辅助影像学检查。增粗的眼外肌在CT上主要表现为中等密度影,不能对疾病分期提供信息。MRI对软组织具有较高的分辨率,通过MRI评估眼外肌信号的改变情况,可对TAO进行分期[19- 20]。T2WI信号强度与组织的含水量呈正比。在急性炎症活动期眼外肌水肿,T2WI信号增高;在稳定期眼外肌纤维化,眼外肌信号降低。但眼眶脂肪组织在T2WI上呈高信号背景,可能会对眼外肌病理状态的评估造成干扰。T1WI增强扫描脂肪抑制序列,在注入对比剂后,结合脂肪组织抑制技术,进一步放大了眼外肌的病理改变,对评估TAO分期更敏感[21- 22]。在本研究中共1 014例TAO患者也根据增强MRI,T1WI增强扫描脂肪抑制序列评估眼外肌的炎症情况,有730例(71.99%)眼外肌在T1WI增强扫描脂肪抑制序列上显示为高信号,表明眼外肌处于炎症活动期。活动期患者的平均病程在12个月左右,而非活动期患者为17个月左右,符合TAO的病程特点。有775例TAO患者CAS<3,但535例(69.03%)在MRI上表现为活动期。TACHIBANA的研究也发现CAS为非活动期的患者,57.14%在MRI上显示为活动期。抗炎治疗后,这部分患者临床症状好转,眼外肌信号降低[23]。与CAS相比,MRI对TAO分期的敏感性更高。对于病程较短、CAS评分较低的患者,可以结合MRI联合评估疾病的分期。接下来将进一步结合病程、CAS评分评估MRI对治疗效果的预测。
CT和MRI均可用于辅助诊断TAO。CT价格便宜、速度快,主要通过眼外肌、眶脂肪组织的形态改变诊断TAO,对骨质的显像效果好,可用于眶减压术前评估患者眼眶骨质结构,但不能对疾病的分期提供额外的信息,还具有电离辐射。MRI多方位成像能清楚的显示眼眶的解剖结构,对眼眶软组织的分辨率高于CT。不仅能用于辅助诊断TAO,对疾病的分期还具有显著的优势。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科技计划项目(No. 2018SZ0128)及四川大学华西医院临床研究孵化项目(No. 2018HXFH024)资助
Contributor Information
梅 杨 (Mei YANG), Email: 929837592@qq.com.
为民 何 (Wei-min HE), Email: hewm888@hotmail.com.
References
- 1.MARINÒ M, IONNI I, LANZOLLA G, et al Orbital diseases mimicking Graves' orbitopathy: A long-standing challenge in differential diagnosis. J Endocrinol Invest. 2020;43(4):401–411. doi: 10.1007/s40618-019-01141-3. [DOI] [PubMed] [Google Scholar]
- 2.BAHN R S Graves’ ophthalmopathy. N Engl J Med. 2010;362(8):726–738. doi: 10.1056/NEJMra0905750. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.BARTALENA L, BALDESCHI L, BOBORIDIS K, et al The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy Guidelines for the management of graves’ orbitopathy. Eur Thyroid J. 2016;5(1):9–26. doi: 10.1159/000443828. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.VAN DYK H J L Orbital Graves' disease. Ophthalmology. 1981;88(6):479–483. doi: 10.1016/s0161-6420(81)34998-7. [DOI] [PubMed] [Google Scholar]
- 5.REGENSBURG N I, WIERSINGA W M, BERENDSCHOT T T, et al Do subtypes of graves’ orbitopathy exist? Ophthalmology. 2011;118(1):191–196. doi: 10.1016/j.ophtha.2010.04.004. [DOI] [PubMed] [Google Scholar]
- 6.WIERSINGA W M, REGENSBURG N I, MOURITS M P Differential involvement of orbital fat and extraocular muscles in Graves’ ophthalmopathy. Eur Thyroid J. 2013;2(1):14–21. doi: 10.1159/000348246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.MURAKAMI Y, KANAMOTO T, TSUBOI T, et al Evaluation of extraocular muscle enlargement in dysthyroid ophthalmopathy. Nippon Ganka Gakkai Zasshi. 2000;104(1):34–38. [PubMed] [Google Scholar]
- 8.BARTLEY G B, GORMAN C A Diagnostic criteria for Graves’ ophthalmopathy. Am J Ophthalmol. 1995;119(6):792–795. doi: 10.1016/s0002-9394(14)72787-4. [DOI] [PubMed] [Google Scholar]
- 9.王钰娇, 何为民 甲状腺相关眼病403例临床分析. 中华眼科杂志. 2013;(49):685–690. doi: 10.3760/cma.j.issn.0412-4081.2013.08.004. [DOI] [Google Scholar]
- 10.BLANDFORD A D, ZHANG D, CHUNDURY R V, et al Dysthyroid optic neuropathy: update on pathogenesis, diagnosis, and management. Expert Rev Ophthalmol. 2017;12(2):111–121. doi: 10.1080/17469899.2017.1276444. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.MOURITS M P, KOORNNEEF L, WIERSINGA W M, et al Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: A novel approach. Br J Ophthalmol. 1989;73(8):639–644. doi: 10.1136/bjo.73.8.639. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.KASHKOULI M B, KAGHAZKANANI R, HEIDARI I, et al Bilateral versus unilateral thyroid eye disease. Indian J Ophthalmol. 2011;59(5):363–366. doi: 10.4103/0301-4738.83612. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.HIROMATSU Y, EGUCHI H, TANI J, et al Graves’ ophthalmopathy: epidemiology and natural history. Intern Med. 2014;53(5):353–360. doi: 10.2169/internalmedicine.53.1518. [DOI] [PubMed] [Google Scholar]
- 14.PONTO K A, BINDER H, DIANA T, et al Prevalence, phenotype, and psychosocial well-being in euthyroid/hypothyroid thyroid-associated orbitopathy. Thyroid. 2015;25(8):942–948. doi: 10.1089/thy.2015.0031. [DOI] [PubMed] [Google Scholar]
- 15.危昆桥, 魏锐利, 马晓晔 甲状腺相关眼病眼眶CT定量测量及亚型分析. 中华实用眼科. 2014;32(2):161–165. doi: 10.3760/cma.j.issn.1006-4443.2014.02.018. [DOI] [Google Scholar]
- 16.LAURBERG P, BERMAN D C, PEDERSEN I B, et al Double vision is a major manifestation in moderate to severe Graves’ orbitopathy, but it correlates negatively with inflammatory signs and proptosis. J Clin Endocrinol Metab. 2015;100(5):2098–2105. doi: 10.1210/jc.2014-4557. [DOI] [PubMed] [Google Scholar]
- 17.WANG Y, TOOLEY A A, MEHTA V J, et al Thyroid orbitopathy. Int Ophthalmol Clin. 2018;58(2):137–179. doi: 10.1097/iio.0000000000000219. [DOI] [PubMed] [Google Scholar]
- 18.SAEED P, TAVAKOLI RAD S, BISSCHOP P Dysthyroid optic neuropathy. Ophthalmic Plast Reconstr Surg. 2018;34(4S Suppl 1):S60–S67. doi: 10.1097/iop.0000000000001146. [DOI] [PubMed] [Google Scholar]
- 19.HIROMATSU Y, EGUCHI H, TANI J Management of Graves' ophthalmopathy by using orbital magnetic resonance imaging. Nihon Rinsho. 2012;70(11):1932–1937. [PubMed] [Google Scholar]
- 20.SIAKALLIS L C, UDDIN J M, MISZKIEL K A Imaging investigation of thyroid eye disease. Ophthalmic Plast Reconstr Surg. 2018;34(4S Suppl 1):S41–S51. doi: 10.1097/iop.0000000000001139. [DOI] [PubMed] [Google Scholar]
- 21.TORTORA F, CIRILLO M, FERRARA M, et al Disease activity in Graves' ophthalmopathy: Diagnosis with orbital MR imaging and correlation with clinical score. Neuroradiol J. 2013;26(5):555–564. doi: 10.1177/197140091302600509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.POLITI L S, GODI C, CAMMARATA G, et al Magnetic resonance imaging with diffusion-weighted imaging in the evaluation of thyroid-associated orbitopathy: getting below the tip of the iceberg. Eur Radiol. 2014;24(5):1118–1126. doi: 10.1007/s00330-014-3103-3. [DOI] [PubMed] [Google Scholar]
- 23.TACHIBANA S, MURAKAMI T, NOGUCHI H, et al Orbital magnetic resonance imaging combined with clinical activity score can improve the sensitivity of detection of disease activity and prediction of response to immunosuppressive therapy for Graves’ ophthalmopathy. Endocr J. 2010;57(10):853–861. doi: 10.1507/endocrj.k10e-156. [DOI] [PubMed] [Google Scholar]