Abstract
目的
探讨金丝桃苷(Hyperin)对雷公藤苷(TG)诱导的早发性卵巢功能不全(POI)小鼠卵巢储备的改善作用及机制。
方法
以成年雌性BALB/c小鼠为研究对象,随机分为对照组、POI模型组和Hyperin治疗组,每组40只。雷公藤苷40 mg/kg,每日2次,灌胃2周,构建POI小鼠模型,Hyperin治疗组于造模后给予Hyperin 75 mg/(kg·d),灌胃4周。称取小鼠体质量,计算性腺指数。HE染色观察卵巢组织学改变,计算各级卵泡数量。ELISA法检测血清雌二醇(E2)、促卵泡生成素(FSH)、抗苗勒管激素(AMH)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的水平。RT-qPCR和Western blot分别检测卵巢颗粒细胞中核因子E2相关因子2(Nrf-2)、血红素氧化酶-1(HO-1)、Caspase3、Bcl-2、Bax的mRNA和蛋白水平,Western blot检测颗粒细胞中磷酸化磷脂酰肌醇-3-羟激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)的蛋白水平。H2DCFDA探针法检测颗粒细胞活性氧簇(ROS)水平。TUNEL法检测颗粒细胞凋亡水平。
结果
与POI模型组相比,Hyperin治疗组小鼠体质量和性腺指数均上升(P<0.05);卵巢病理损伤减轻,各级卵泡数和黄体数均增加(P<0.05);血清E2、AMH、SOD、CAT水平升高,FSH水平降低(P<0.05);卵巢颗粒细胞中的Nrf-2、HO-1、p-PI3K、p-Akt、Bcl-2表达上升,Caspase3、Bax表达下降(P<0.05);ROS水平降低(P<0.05);TUNEL显示颗粒细胞凋亡降低(P<0.05)。
结论
Hyperin通过Nrf-2/HO-1抗氧化应激和PI3K/Akt抗凋亡途径改善TG诱导的POI小鼠卵巢储备功能的下降。
Keywords: 卵巢储备, 早发性卵巢功能不全, 金丝桃苷, 雷公藤苷, 小鼠
Abstract
Objective
To investigate the effect and mechanism of hyperin on the improvement of ovarian reserve of tripterygium glycosides (TG)-induced primary ovarian insufficiency (POI) in mice.
Methods
Adult female BALB/c mice were used as research subjects and were randomly assigned to the control group, POI model group and hyperin treatment group, with 40 mice in each group. TG was given at 40 mg/kg twice a day by gavage for 2 weeks to create the POI mouse model. Mice in the hyperin treatment group were given hyperin at 75 mg/(kg·d) by gavage for 4 weeks after the model was established. The body mass of the mice was weighed and the gonadal index was calculated. Ovarian histological changes were observed by HE staining, and the number of follicles at all levels was calculated. Serum estradiol (E2), follicle-stimulating hormone (FSH), anti-mullerian hormone (AMH), superoxide dismutase (SOD) and catalase (CAT) were assessed with ELISA. The mRNA and protein levels of nuclear factor (erythroid-derived 2)-related factor 2 (Nrf-2), heme oxygenase-1 (HO-1), Caspase3, Bcl-2 and Bax in ovarian granulosa cells were measured by RT-qPCR and Western blot. The protein levels of phosphorylated phosphatidylinositol 3-hydroxy kinase (p-PI3K) and phosphorylated protein kinase B (p-Akt) were measured by Western blot. The reactive oxygen species (ROS) levels in granulosa cells were determined by H2DCFDA. The apoptosis of granulosa cells was examined by TUNEL assay.
Results
Compared with mice in the POI model group, the body mass and gonadal index of hyperin-treated mice increased (all P<0.05). The pathological damage of the ovary decreased, and the number of follicles at all levels and corpora lutea increased (allP<0.05). Serum E2, AMH, SOD and CAT levels increased, and FSH level decreased (all P<0.05). At the molecular level, the expression of Nrf-2, HO-1, p-PI3K, p-Akt and Bcl-2 in ovarian granulosa cells increased, while the expression of Caspase3 and Bax decreased (allP<0.05). ROS level decreased (P<0.05). TUNEL assay showed reduced apoptosis of granulosa cells (P<0.05).
Conclusion
Hyperin improved ovarian reserve in TG-induced POI mice through Nrf-2/HO-1antioxidant stress response and the anti-apoptotic effect of PI3K/Akt pathways.
Keywords: Ovarian reserve, Primary ovarian insufficiency, Hyperin, Tripterygium glycosides, Mice
早发性卵巢功能不全(primary ovarian insufficiency,POI)是以原始卵泡过早衰竭、月经不规律、性类固醇激素缺乏和40岁以下女性不孕症为特征的综合征[1]。POI在40岁以下女性中发病率约1%,30岁以下发病率约0.1%[2],呈逐年上升趋势。POI可致不孕,临床自然妊娠率仅约为5%~10%[3],严重影响女性生殖健康。新近研究表明,氧化应激可能是导致POI的潜在原因。氧化应激诱导的颗粒细胞凋亡被认为是卵泡闭锁的重要原因[4]。
金丝桃苷(Hyperin)是补肾中药菟丝子种子中主要的黄酮类化合物,被认为是菟丝子的主要生物活性成分[5]。药理学研究表明,其具有抗氧化、抗抑郁、抗炎等作用,对肝损伤、心脑缺血、高血压、冠心病等多种疾病具有一定的治疗效果[6]。Hyperin是菟丝子雌激素样作用的主要质量标志物[7]。本课题组前期研究发现,金丝桃苷-淫羊藿苷可以通过上调CYP17、CYP19促进卵巢颗粒细胞分泌雌二醇(estradiol,E2)和孕酮(progesterone,P)[8]。因此,本研究在建立POI小鼠模型的基础上,观察Hyperin对卵巢储备的影响,以及探索可能的作用途径,为中药提取物Hyperin防治POI提供实验依据。
1. 材料与方法
1.1. 材料
120只动情周期正常的SPF级雌性BALB/c小鼠,日龄8周,体质量19~23 g,未交配,购自浙江维通利华实验动物技术有限公司〔动物许可证号SCXK(浙)2019-0001〕。雷公藤苷(tripterygium glycosides,TG)粉末购自浙江绍兴得恩德制药有限公司,加入0.05%羧甲基纤维素钠溶解,配成质量浓度为4 g/L的混悬液。金丝桃苷粉末购自国家食品药品监督管理局,加入0.05%羧甲基纤维素钠溶解,配成质量浓度为7.5 g/L的混悬液。孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)均购自北京Solarbio科技公司。E2、促卵泡生成素(follicle-stimulating hormone,FSH)和抗苗勒管激素(anti-mullerian hormone,AMH)试剂盒分别购自美国Cayman Chemicals公司、美国Novus Biologicals公司和中国Cloud-Clone公司,超氧化物歧化酶(superoxidedismutase,SOD)和过氧化氢酶(catalase,CAT)试剂盒均购自南京建成生物研究所。RNA提取试剂和反转录试剂盒购自日本TaKaRa公司。PCR试剂盒购自中国Vazyme公司。兔抗小鼠核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf-2)、血红素氧化酶-1(heme oxygenase-1,HO-1)、磷酸化磷脂酰肌醇-3-羟激酶(phosphorylated phosphatidylinositol 3-hydroxy kinase,p-PI3K)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、Bcl-2、Caspase3和Bax一抗购自美国Santa Cruz公司,兔抗小鼠GAPDH一抗和山羊抗兔二抗均购自美国Cell Signaling Technology公司,PBS缓冲液和DMEM/F12培养液均购自Thermo Fisher Scientific公司,一步法TUNNEL染色试剂盒购自碧云天生物技术公司,H2DCFDA染色剂购自Med Chem Express公司。
1.2. POI小鼠模型制备和分组处理
本动物实验过程遵循我国《实验动物福利伦理审查指南(GB/T 35892 2018)》提出的原则与要求。小鼠适应性喂养1周后,随机分为3组:对照组、POI模型(TG)组和Hyperin治疗(TG+Hyperin)组(n=40)。参照文献[9]建立POI小鼠模型。TG组和TG+Hyperin组小鼠均予TG混悬液40 mg/kg,每日2次,灌胃2周,同时对照组小鼠予生理盐水40 mg/kg,每日2次,灌胃2周。造模成功后,TG+Hyperin组小鼠予Hyperin混悬液75 mg/(kg·d),灌胃4周,同时对照组和TG组小鼠予生理盐水75 mg/(kg·d),灌胃4周。期间观察小鼠动情周期变化。末次灌胃结束后,3组小鼠中各随机挑选8只,称重后处死,备取卵巢和子宫组织。各组的其余32只小鼠,腹腔注射PMSG 10 U/只,48 h后腹腔注射hCG 10 U/只,注射hCG 13 h后处死。体式镜下TB针划破输卵管壶腹部,收集包括卵子的颗粒细胞团,透明质酸酶消化后过滤、离心、培养,提取卵巢颗粒细胞。每组32只小鼠卵巢颗粒细胞随机分为4组,每组8只。分别行实时荧光定量PCR(RT-qPCR)、Western blot、活性氧簇(reactive oxygen species,ROS)水平检测以及TUNNEL凋亡检测。
1.3. 动情周期的观察
每日9:00,使用阴道涂片方法,取小鼠阴道分泌物用生理盐水稀释放入96孔细胞板,光学显微镜下观察小鼠阴道分泌物细胞形态,直接观察动情周期变化。观察标准:①动情前期:大多数为椭圆形有核上皮细胞,偶见少量白细胞和角化细胞;②动情期:大多数为片状无核角化上皮细胞,或间有少量白细胞和有核上皮细胞;③动情后期:白细胞、有核上皮细胞、片状角化上皮细胞均有,且比例无明显差异;④动情间期:见大量白细胞和少量黏液。①②③④按序出现,若顺序错乱,或某一期持续存在,则认为是动情周期紊乱。动情周期紊乱比例(%)=动情周期紊乱的小鼠数量/小鼠总数量×100%。
1.4. 性腺指数测定
取出子宫和双侧卵巢组织,剔除脂肪后称重。卵巢指数以双侧卵巢湿重/体质量计算;子宫指数以子宫湿重/体质量计算。其中,湿重单位为mg,体质量单位为g,卵巢指数和子宫指数单位均为mg/g。
1.5. 卵巢组织HE染色
小鼠卵巢组织固定于体积分数为4%的多聚甲醛中,石蜡包埋后,5 μm连续切片,常规方法进行HE染色。光学显微镜下阅片,根据卵泡数量统计方法[10],计算卵巢中各级卵泡和黄体的数量。
1.6. ELISA法检测血清性激素和抗氧化物水平
颈椎脱臼法处死小鼠,眼眶取血。按照试剂盒说明书操作,ELISA法检测血清性激素E2、FSH、AMH,抗氧化物SOD、CAT的水平。
1.7. RT-qPCR检测颗粒细胞中相关基因表达
卵巢颗粒细胞中分离出总RNA,逆转录成cDNA,以cDNA为模板,采用RT-qPCR法检测卵巢颗粒细胞中Nrf-2、HO-1、Bcl-2、Bax和Caspase3的mRNA表达水平。反应体系:SYBG mix 5 μL,引物1 μL(含上游引物和下游引物,浓度各为10 μmol/L),cDNA 1 μL,双蒸水 3 μL,总体系为20 μL。按试剂盒说明书检测各孔的荧光值,并获得Ct值。每个样本设3复孔,以GAPDH为内参,采用2−ΔΔCt法计算各组样本目的基因的相对表达量。特异性引物由金斯瑞生物科技股份有限公司合成,序列见表1。
表 1. Specific primer sequence.
特异性引物序列
| Gene | Sequence (5′→3′) | Length of products/bp |
| Nrf-2 | F:TCTTGGAGTAAGTCGAGAAGTGT | 244 |
| R:GTTGAAACTGAGCGAAAAAGGC | ||
| HO-1 | F:AAGCCGAGAATGCTGAGTTCA | 441 |
| R:GCCGTGTAGATATGGTACAAGGA | ||
| Bcl-2 | F:ATGCCTTTGTGGAACTATATGGC | 152 |
| R:GGTATGCACCCAGAGTGATGC | ||
| Bax | F:TGAAGACAGGGGCCTTTTTG | 104 |
| R:AATTCGCCGGAGACACTCG | ||
| Caspase3 | F:TGGTGATGAAGGGGTCATTTATG | 834 |
| R:TTCGGCTTTCCAGTCAGACTC | ||
| GAPDH | F:CTCATGACCACAGTCCATGC | 155 |
| R:TTCAGCTCTGGGATGACCTT |
1.8. Western blot检测颗粒细胞中相关蛋白表达
提取卵巢颗粒细胞中蛋白,测蛋白浓度。每组取等量蛋白,行SDS-PAGE分离,浓缩胶浓度为5%,分离胶为12%。将目的蛋白转至PVDF膜上。在含5%脱脂奶粉的TBST溶液中室温封闭2 h后,分别加入1∶1 000稀释的兔抗小鼠Nrf-2、HO-1、p-PI3K、p-Akt、Bcl-2、Bax和Caspase3一抗抗体,4 ℃孵育过夜。次日洗膜,加入1∶1 000稀释的HRP标记的山羊抗兔二抗,室温孵育1 h,洗膜后用增强化学发光法显色,曝光成像。用凝胶成像仪拍照并测定各显色条带的灰度值,以目的蛋白/GAPDH蛋白的比值作为目的蛋白的相对表达量。
1.9. H2DCFDA法检测颗粒细胞内ROS水平
将收集的颗粒细胞加入DMEM/F12培养液中,加入10 μL 10 μmol/L的H2DCFDA染色液避光培养,37 ℃培养30 min。培养后收集各组细胞,加入体积分数为4%的多聚甲醛进行固定30 min,PBS洗涤2次,加入Hoechst染色5 min,50%甘油封片后共聚光下观察。使用Image J软件进行相对荧光强度比较。
1.10. TUNEL法检测颗粒细胞凋亡水平
收集卵巢颗粒细胞,加入PBS,洗涤2次,500 ×g离心10 min后加入体积分数为4%的多聚甲醛4 ℃固定1 h。固定后500×g离心10 min,弃上清。加入PBS洗涤1次后,加入含体积分数0.3%Triton X-100的PBS,室温孵育5 min。离心后加入TUNEL检测液,37 ℃避光孵育1 h。PBS清洗,加入Hoechst染色5 min,PBS洗涤2遍,50%甘油封片后共聚焦显微镜下观察,计数每个视野下平均凋亡细胞的数量。
1.11. 统计学方法
数据以
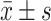 表示。组间差异比较采用单因素方差分析、Bonferroni检验和t检验,P<0.05为差异有统计学意义。
表示。组间差异比较采用单因素方差分析、Bonferroni检验和t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. Hyperin对小鼠动情周期的影响
对照组小鼠均表现为每5~6 d出现一次规律的动情周期。TG干预后的小鼠动情周期紊乱比例逐渐上升,2周达高峰,后保持稳定。Hyperin治疗后,小鼠动情周期紊乱比例下降。在用药2周后比例明显下降(图1)。
图 1.
Effect of hyperin on the estrous cycle in TG-induced POI mice (n=40)
Hyperin对TG诱导的POI小鼠动情周期的影响(n=40)
*P<0.05, vs. TG group and TG+Hyperin group at the same time point; #P<0.05, vs. TG+Hyperin group at the same time point.
2.2. Hyperin对小鼠性腺指数的影响
结果见图2。TG诱导后,小鼠的体质量、卵巢湿重、子宫湿重、卵巢指数、子宫指数下降(P均<0.05)。Hyperin治疗4周后,卵巢湿重、子宫湿重、卵巢指数、子宫指数上升(P均<0.05),但与对照组相比仍偏低(P均<0.05)。
图 2.

Effect of hyperin on the body mass, gonadal mass and gonadal index of TG-induced POI mice (n=8,
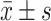 )
)
Hyperin对TG诱导的POI小鼠体质量、性腺质量及性腺指数的影响(n=8,
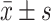 )
)
*P<0.05.
2.3. Hyperin对卵巢各级卵泡数量的影响
结果见图3、图4。TG诱导后导致原始卵泡、窦前卵泡、窦状卵泡、成熟卵泡、黄体数量下降(P均<0.05)。Hyperin治疗4周后,原始卵泡、窦前卵泡、窦状卵泡、黄体数量上升(P均<0.05),但与对照组相比仍较低(P均<0.05)。
图 3.

Representative picture of ovarian histology stained with hematoxylin and eosin (HE) in different groups of the study. ×40
各组小鼠卵巢组织HE染色图片。×40
Control group in which standard ovarian structure is evident (A). TG group in which severe ovarian damage is apparent (B). The TG group treated with hyperin in which there was an improvement in the ovarian structure (C and D). Orange, blue, green, red and yellow arrows are pointed at primordium follicle, preantral follicle, antral follicle, preovulatory follicle and corpus luteum, respectively.
图 4.

Effect of hyperin on the the number of follicles at all levels and corpus luteum in the ovary of TG-induced POI mice (n=8,
 )
)
Hyperin对TG诱导的POI小鼠卵巢各级卵泡和黄体数量的影响(n=8,
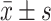 )
)
*P<0.05.
2.4. Hyperin对小鼠血清性激素水平的影响
结果见图5。TG诱导后的POI小鼠,血清E2和AMH水平下降,FSH水平升高(P均<0.05)。Hyperin治疗4周后,血清E2和AMH水平上升(P均<0.05),但AMH仍低于对照组(P均<0.05);FSH水平与TG组比较则无明显变化(P>0.05)。
图 5.

Effect of hyperin on the serum E2, FSH, and AMH levels in TG-induced POI mice (n=8,
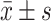 )
)
Hyperin对TG诱导的POI小鼠血清E2、FSH和AMH的影响(n=8,
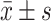 )
)
*P<0.05.
2.5. Hyperin对小鼠血清抗氧化物指标的影响
结果见图6。TG诱导后的POI小鼠,血清SOD和CAT水平降低(P均<0.05)。Hyperin治疗4周后血清SOD和CAT水平上升(P均<0.05),但仍低于对照组(P均<0.05)。
图 6.
Effect of hyperin on the serum SOD and CAT in TG-induced POI mice (n=8,
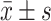 )
)
Hyperin对TG诱导的POI小鼠血清SOD和CAT的影响(n=8,
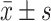 )
)
*P<0.05.
2.6. Hyperin对颗粒细胞中氧化应激相关因子的影响
结果见图7。Western blot和RT-qPCR显示,TG诱导后的POI小鼠,Nrf-2和HO-1蛋白和mRNA表达下调(P均<0.05);Hyperin处理4周后,Nrf-2和HO-1蛋白和mRNA表达上调(P均<0.05),但仍低于对照组(P均<0.05)。
图 7.
Effect of hyperin on the protein (A, B) and mRNA (C) expression levels of Nrf-2 and HO-1 in the granule cells of TG-induced POI mice (n=8,
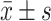 )
)
Hyperin对TG诱导的POI小鼠颗粒细胞中Nrf-2 和 HO-1蛋白(A,B)和mRNA(C)表达的影响(n=8,
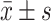 )
)
*P<0.05.
2.7. Hyperin对颗粒细胞中ROS水平的影响
结果见图8。对照组ROS水平1.05±0.05,TG诱导后的POI小鼠,ROS水平2.63±0.15,较对照组上升(P<0.05)。Hyperin处理4周后,ROS水平1.66±0.08,较TG组下降,但仍高于对照组(P均<0.05)。
图 8.
Detection of ROS levels in granular cells by H2DCFDA. ×200
H2DCFDA法检测颗粒细胞内ROS水平。×200
A: Control group; B: TG group; C: TG+Hyperin group; a: H2DCFDA; b: Hoechst; c: Merge.
2.8. Hyperin对颗粒细胞中凋亡相关因子的影响
结果见图9。Western blot和RT-qPCR显示,TG诱导后的POI小鼠,p-PI3K、p-Akt和Bcl-2蛋白表达下调,Caspase3和Bax蛋白表达上调(P均<0.05);Bcl-2 mRNA表达下调,Caspase3和Bax mRNA表达上调(P均<0.05)。Hyperin治疗4周后,p-PI3K、p-Akt和Bcl-2蛋白表达上调,Caspase3和Bax蛋白表达下调(P均<0.05);Bcl-2 mRNA表达上调,Caspase3和Bax mRNA表达下调(P均<0.05)。
图 9.
Effect of hyperin on the protein levels (A, B) of p-PI3K, p-Akt, Bcl-2, Bax and Caspase3, and mRNA expression levels (C) of Bcl-2, Bax and Caspase3 in the granule cells of TG-induced POI mice (n=8,
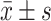 )
)
Hyperin对TG诱导的POI小鼠颗粒细胞中p-PI3K、p-Akt、Bcl-2、Bax和Caspase3蛋白水平(A,B)以及Bcl-2、Bax和Caspase3 mRNA(C)表达的影响(n=8,
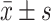 )
)
*P<0.05.
2.9. Hyperin对颗粒细胞凋亡水平的影响
结果见图10。TUNNEL法检测显示,每个视野下,对照组凋亡的颗粒细胞为(2.40±1.35)个,TG诱导后的POI小鼠,凋亡的颗粒细胞为(11.60±2.74)个,较对照组增加(P<0.01),Hyperin处理4周后,凋亡的颗粒细胞为(5.15±1.57)个,较TG组下降,但仍高于对照组(P均<0.05)。
图 10.
Detection of apoptosis levels in granular cells by TUNEL. ×200
TUNEL法检测颗粒细胞凋亡水平。×200
A: Control group; B: TG group; C: TG+Hyperin group; a: TUNEL; b: Hoechst; c: Merge.
3. 讨论
近年来研究发现,氧化应激参与了POI的发生发展。颗粒细胞和卵母细胞暴露于高浓度氧分子或氧的化学衍生物,引起细胞损伤,阻断囊状卵泡中卵子的发育,病理性的加速凋亡,窦前卵泡提前闭锁等,最终导致原始卵泡的减少甚至耗竭,卵巢储备急剧下降,生殖机能下降。本研究结果显示,小鼠予TG 80 mg/(kg·d)灌胃14 d,动情周期紊乱比例提高,体质量和性腺指数降低,卵巢切片显示间质水肿及纤维化、卵泡颗粒细胞层排列松散紊乱等病理性改变,各级卵泡数和黄体数均降低,血清性激素E2、AMH水平降低,FSH水平升高,POI小鼠造模成功。且TG组在造模停药后的4周,各方面均保持稳定状态,这些与POI的临床表现吻合,证明了模型的稳定性。血清抗氧化物SOD、CAT水平降低,颗粒细胞中的Nrf-2、HO-1表达降低,ROS水平上升。提示存在氧化应激,与前人研究结果一致[11]。
目前尚无有效方法恢复卵巢功能,优化的治疗方案仍在探索中。既往众多临床研究显示补肾类中药具有促进卵泡发育且药源天然的优势。菟丝子甘、温,归肾、肝、脾经,具有滋补肝肾、固精缩尿、安胎、明目、止泻之功效,在《神农本草经》中被列为上品。Hyperin是菟丝子的主要生物活性成分,既往研究显示其对肝细胞、肾细胞、心肌细胞等具有抗氧化、抗炎、抗凋亡等作用。本研究在预实验中分别使用Hyperin 25 mg/(kg·d)灌胃4周、50 mg/(kg·d)灌胃4周、75 mg/(kg·d)灌胃2周和75 mg/(kg·d)灌胃4周,前3个剂量组相关指标与POI模型组差异均无统计学意义,故最终我们选择Hyperin 75 mg/(kg·d)灌胃4周。本研究结果显示,使用Hyperin 75 mg/(kg·d)灌胃4周治疗后,POI小鼠体质量和性腺指数均上升,卵巢病理损伤减轻,各级卵泡数和黄体数均增加,血清E2、AMH、SOD、CAT水平升高,FSH水平降低,卵巢颗粒细胞中的Nrf-2、HO-1、p-PI3K、p-Akt、Bcl-2表达上升,ROS水平降低,Caspase3和Bax表达下降,TUNEL显示细胞凋亡水平降低。提示Hyperin通过Nrf-2/HO-1抗氧化应激和PI3K/Akt抗凋亡途径改善TG诱导的POI小鼠的卵巢储备,增强卵巢功能。
ROS的堆积,产生氧化应激,改变线粒体形态和功能,使线粒体基因(mitochondrial DNA,mtDNA)突变,导致呼吸链部分解偶联,进而ATP合成减少, 恶性循环的方式使mtDNA突变呈指数样增加,加速ROS的产生,则纺锤体不稳定、染色体异常、端粒缩短,进而影响卵母细胞质量[12]。在氧化应激原作用下,Nrf2与Keap1解偶联后转入核内,启动下游HO-1等抗氧化基因及Ⅱ相解毒酶的表达,同时产生SOD、CAT等抗氧化酶,发挥抗氧化损伤能力[13-14]。TG诱导后制造了POI小鼠氧化应激状态,血清SOD、CAT水平降低,颗粒细胞中的Nrf-2、HO-1表达降低,ROS水平升高。经Hyperin治疗后,血清SOD、CAT水平升高,颗粒细胞中的Nrf-2、HO-1表达升高,ROS水平降低。揭示了Hyperin的抗氧化功效,与之前研究报道Hyperin治疗顺铂诱导急性肾损伤和肝损伤的氧化应激的结果一致[15-17]。
总卵巢储备包括非生长卵泡(原始卵泡)和周期性募集的生长卵泡,是反映卵巢功能的良好指标。TG干预后,原始卵泡、窦前卵泡、窦状卵泡减少,AMH降低,Hyperin治疗后各级卵泡数均上升,使得AMH升高,因为AMH主要由原始卵泡、窦前卵泡和窦状卵泡分泌。也说明了AMH是预测卵巢储备功能的敏感指标和最佳指标[18]。FSH由垂体前叶促性腺激素分泌,部分通过抑制素B和雌二醇的负反馈调节,属于“间接测量”结果[19]。E2是卵泡颗粒细胞在FSH刺激下产生的。因此,FSH和E2本身随周期波动大。可能由于Hyperin治疗仍未完全增强POI小鼠发育中窦卵泡的功能,或者颗粒细胞受损后FSH受体缺失,所以FSH并未显著降低。而Hyperin治疗增强了部分颗粒细胞功能,所以E2上升,但由于E2、FSH本身随周期波动大,所以仍然要结合月经周期中相对稳定又敏感的AMH评价。总体分析,Hyperin治疗后E2、AMH上升,但FSH仍较正常小鼠高,AMH仍较正常小鼠低,提示改善了一部分卵巢功能,但卵巢仍处于功能受损状态。这与HE染色的病理表现和各级卵泡数目变化相符合。
卵巢的基础功能单位是颗粒细胞,颗粒细胞在闭锁卵泡中的凋亡早于卵母细胞和膜细胞,是卵泡闭锁的发起者[20]。POI的大鼠实验发现[11]PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路对促进颗粒细胞增殖分化,抗颗粒细胞凋亡,促进原始卵泡存活发育,以及调节卵母细胞的生长,发挥着重要作用。PI3K在磷酸化后,与活化的磷酸化酪氨酸残基生长因子作用,形成p-PI3Kp85a,导致二聚体构象改变、激活,进而磷酸化Akt,从而抑制细胞凋亡[21]。氧化应激下,过多的ROS激活线粒体凋亡通路,线粒体膜氧化磷酸化和产生ATP的能力被攻击破坏,基质中钙离子水平降低,细胞质中钙离子水平增加,导致细胞凋亡[22]。研究显示Bcl-2家族成员严密调控细胞凋亡,Bax蛋白可与Bcl-2形成同二聚体,同二聚体增加,线粒体通透性增加,加速细胞凋亡;反之Bcl-2蛋白含量增高,Bcl-2/Bax异二聚体增多,则抑制细胞凋亡。Caspase家族中介导细胞凋亡的最下游分子Caspase3,是凋亡信号传导中起决定作用的关键分子,其表达量可直接反映细胞凋亡情况[23]。Bax和Bcl-2分别促进和抑制细胞色素C的释放,从而分别刺激和阻碍Caspase3裂解和激活[24]。同时,PI3K/Akt通路在颗粒细胞ROS堆积时,调节叉头框蛋白O1(forkhead box O1,FOXO1)的核/胞质穿梭以应对氧化应激损伤[25]。本研究发现,TG干预后p-PI3K、p-Akt表达下降,促凋亡因子Bax、Caspase3表达增加,抗凋亡因子Bcl-2表达下降,导致了颗粒细胞凋亡,各级卵泡数减少,卵巢储备降低。而Hyperin治疗后,逆转了这些改变,降低了Caspase3表达,提高了p-PI3K、p-Akt和Bcl-2的表达,降低了Bax的表达,减少卵巢颗粒细胞凋亡,增加了各级卵泡数,改善卵巢储备。TUNNEL法检测亦体现了该趋势。
综上所述,本研究发现中药菟丝子提取物Hyperin能够改善TG诱导的小鼠POI的卵巢储备,其机制可能与Hyperin通过Nrf-2/HO-1抗氧化应激和PI3K/Akt抗凋亡有关。本研究结果为中药应用于POI的防治提供了实验依据。后续将通过沉默Nrf-2/HO-1和PI3K/Akt通路关键基因,进一步深入研究Hyperin的作用靶点,为中医药防治POI提供实验依据。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81873333)、江苏省卫健委临床医学中心资助项目(No. YXZXB2016006)和江苏省中医院院级课题(No. Y18068)资助
Contributor Information
蔚蓉 马 (Wei-rong MA), Email: doctorma2012@126.com.
勇 谈 (Yong TAN), Email: xijun1025@163.com.
References
- 1.DE VOS M, DEVROEY P, FAUSER B C Primary ovarian insufficiency. Lancet. 2010;376(9744):911–921. doi: 10.1016/S0140-6736(10)60355-8. [DOI] [PubMed] [Google Scholar]
- 2.ZHANG X, HAN T, YAN L, et al Resumption of ovarian function after ovarian biopsy/scratch in patients with premature ovarian insufficiency. Reprod Sci. 2019;26(2):207–213. doi: 10.1177/1933719118818906. [DOI] [PubMed] [Google Scholar]
- 3.JANKOWSKA K Premature ovarian failure. Prz Menopauzalny. 2017;16(2):51–56. doi: 10.5114/pm.2017.68592. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.YANG H, XIE Y, YANG D, et al Oxidative stress-induced apoptosis in granulosa cells involves JNK, p53 and Puma. Oncotarget. 2017;8(15):25310–25322. doi: 10.18632/oncotarget.15813. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.夏宇成, 张兰, 陈宇洁, 等 种子类药材菟丝子提取工艺研究. 安徽医药. 2019;23(4):724–727. [Google Scholar]
- 6.LIU L, MI Z, HU Q, et al One-step synthesis of fluorescent carbon dots for sensitive and selective detection of hyperin. Talanta. 2018;186:315–321. doi: 10.1016/j.talanta.2018.04.065. [DOI] [PubMed] [Google Scholar]
- 7.孙向明, 宋辉, 阎新佳, 等 菟丝子雌激素样作用质量标志物的筛选及含量测定. 中草药. 2020;51(10):2671–2679. [Google Scholar]
- 8.NIE X, SHENG W, HOU D, et al Effect of Hyperin and Icariin on steroid hormone secretion in rat ovarian granulosa cells. Clin Chim Acta. 2019;495:646–651. doi: 10.1016/j.cca.2018.05.004. [DOI] [PubMed] [Google Scholar]
- 9.袁苑, 陈燕霞, 马堃, 等 探索建立雷公藤多苷致早发性卵巢功能不全肾虚血瘀证的小鼠模型. 中国中药杂志. 2019;44(9):1895–1903. [Google Scholar]
- 10.MYERS M, BRITT K L, WREFORD N G, et al Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 2004;127(5):569–580. doi: 10.1530/rep.1.00095. [DOI] [PubMed] [Google Scholar]
- 11.LI N, LIU L Mechanism of resveratrol in improving ovarian function in a rat model of premature ovarian insufficiency. J Obstet Gynaecol Res. 2018;44(8):1431–1438. doi: 10.1111/jog.13680. [DOI] [PubMed] [Google Scholar]
- 12.SASAKI H, HAMATANI T, KAMIJO S, et al. Impact of oxidative stress on age-associated decline in oocyte developmental competence. Front Endocrinol, 2019, 10: 811[2020-03-15]. https://doi.org/10.3389/fendo.2019.00811.
- 13.WU C T, DENG J S, HUANG W C, et al. Salvianolic acid c against acetaminophen-induced acute liver injury by attenuating inflammation, oxidative stress, and apoptosis through inhibition of the Keap1/Nrf2/HO-1 signaling. Oxid Med Cell Longev, 2019, 2019: 9056845[2020-03-15]. https://doi.org/10.1155/2019/9056845.
- 14.YU Y, YANG Y, YANG M, et al Hydrogen gas reduces HMGB1 release in lung tissues of septic mice in an Nrf2/HO-1-dependent pathway. Int Immunopharmacol. 2019;69:11–18. doi: 10.1016/j.intimp.2019.01.022. [DOI] [PubMed] [Google Scholar]
- 15.CHAO C S, TSAI C S, CHANG Y P, et al Hyperin inhibits nuclear factor kappa B and activates nuclear factor E2-related factor-2 signaling pathways in cisplatin-induced acute kidney injury in mice. Int Immunopharmacol. 2016;40:517–523. doi: 10.1016/j.intimp.2016.09.020. [DOI] [PubMed] [Google Scholar]
- 16.WU L, LI Q, LIU S, et al Protective effect of hyperoside against renal ischemia-reperfusion injury via modulating mitochondrial fission, oxidative stress, and apoptosis. Free Radic Res. 2019;53(7):727–736. doi: 10.1080/10715762.2019.1623883. [DOI] [PubMed] [Google Scholar]
- 17.NIU C, MA M, HAN X, et al Hyperin protects against cisplatin-induced liver injury in mice. Acta Cir Bras. 2017;32(8):633–640. doi: 10.1590/s0102-865020170080000005. [DOI] [PubMed] [Google Scholar]
- 18.KRUSZYŃSKA A, SŁOWIŃSKA-SRZEDNICKA J Anti-Müllerian hormone (AMH) as a good predictor of time of menopause. Prz Menopauzalny. 2017;16(2):47–50. doi: 10.5114/pm.2017.68591. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.BENSON R C Clinical gynecologic endocrinology and infertility. Eur J Obstet Gyn R B. 2005;63(2):203–203. doi: 10.1001/jama.1994.03520160095055. [DOI] [Google Scholar]
- 20.CANUGOVI C, MAYNARD S, BAYNE A C, et al The mitochondrial transcription factor a functions in mitochondrial base excision repair. DNA Repair. 2010;9(10):1080–1089. doi: 10.1016/j.dnarep.2010.07.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.KANG M H, KIM J S, SEO J E, et al BMP2 accelerates the motility and invasiveness of gastric cancer cells via activation of the phosphatidylinositol 3-kinase (PI3K)/Akt pathway. Exp Cell Res. 2010;316(1):24–37. doi: 10.1016/j.yexcr.2009.10.010. [DOI] [PubMed] [Google Scholar]
- 22.TIWARI M, PRASAD S, SHRIVASTAV T G, et al Calcium signaling during meiotic cell cycle regulation and apoptosis in mammalian oocytes. J Cell Physiol. 2017;232(5):976–981. doi: 10.1002/jcp.25670. [DOI] [PubMed] [Google Scholar]
- 23.MIRZAYANS R, ANDRAIS B, KUMAR P, et al. The growing complexity of cancer cell response to DNA-damaging agents: caspase 3 mediates cell death or survival. Int J Mol Sci, 2016, 17(5): 708[2020-03-23]. https://doi.org/10.3390/ijms17050708.
- 24.WANG J, LIU X, ZHENG H, et al Morusin induces apoptosis and autophagy via JNK, ERK and PI3K/Akt signaling in human lung carcinoma cells. Chem Biol Interact. 2020;331:109279[2021-05-05]. https://doi.org/10.1016/j.cbi.2020.109279. doi: 10.1016/j.cbi.2020.109279. [DOI] [PubMed] [Google Scholar]
- 25.SHEN M, LIU Z, LI B, et al. Involvement of FoxO1 in the effects of follicle-stimulating hormone on inhibition of apoptosis in mouse granulosa cells. Cell Death Dis, 2014, 5(10): e1475[2020-03-23]. https://www.nature.com/articles/cddis2014400.doi:10.1038/cddis.2014.400.








