Abstract
目的
验证化学发光免疫法(CLIA)检测肾素、醛固酮的性能及筛查原发性醛固酮增多症(原醛症)的价值。
方法
根据美国临床实验室标准化协会相关文件验证CLIA检测肾素、醛固酮的精密度、线性范围和携带污染率。纳入91例疑似原醛症的患者,分别采用CLIA、放射免疫法(RIA)检测肾素和醛固酮,比较两种方法的相关性和对原醛症的筛查价值。
结果
CLIA法检测肾素、醛固酮的精密度、线性范围和携带污染率均符合要求。在疑似原醛症患者中,CLIA法和RIA法检测出的肾素、醛固酮和醛固酮/肾素(ARR)水平的相关系数分别为0.901、0.861、0.847(P均<0.001)。患者立位状态下,ARR为5.636 (ng/dL)/(ng/L)时,CLIA法筛查原醛症灵敏度为79.1%,特异度为93.7%;ARR为14.084 (ng·dL-1)/〔ng·(mL·h)-1〕时,RIA法筛查原醛症灵敏度为93.0%,特异度为83.3%。卧位状态下,ARR为5.640 (ng/dL)/(ng/L)时,CLIA法筛查原醛症灵敏度为97.7%,特异度为81.2%;ARR为33.494 (ng·dL-1)/〔ng·(mL·h)-1〕时,RIA法筛查原醛症灵敏度为95.3%,特异度为70.8%。
结论
CLIA法检测肾素、醛固酮的性能均满足临床要求,立位ARR初筛原醛症的特异性相比卧位ARR更高,敏感性较低。
Keywords: 化学发光免疫法, 原发性醛固酮增多症, 肾素, 醛固酮
Abstract
Objective
To evaluate the performance of chemiluminescence immunoassay (CLIA) in examining renin and aldosterone and to determine its value for screening for primary aldosteronism (PA).
Methods
According to the relevant documents of Clinical and Laboratory Standards Institute (CLSI), we verified the precision, linear range and carryover rate of examining renin and aldosterone with CLIA. The study included 91 suspected PA patients, using two methods, CLIA and radioimmunoassay (RIA), to examine renin and aldosterone levels in order to compare the correlation between the two methods and their value for PA screening.
Results
The precision, linear range and carryover rate of examining renin and aldosterone with CLIA met the requirements. In patients with suspected PA, the correlation coefficients of renin, aldosterone and aldosterone-to-renin ratio (ARR) assessed by CLIA and RIA were 0.901, 0.861 and 0.847 respectively (all P<0.001). When the patients were in the upright position and the ARR was 5.636 (ng/dL)/(ng/L), the CLIA method had 79.1% sensitivity and 93.7% specificity for PA screening; when ARR was 14.084 (ng·dL-1)/(ng·[mL·h]-1), the RIA method had 93.0% sensitivity and 83.3% specificity for PA screening. When the patients were in the supine position, and the ARR was 5.640 (ng/dL)/(ng/L), the CLIA method had 97.7% sensitivity and 81.2% specificity for PA screening; when ARR was 33.494 (ng·dL-1)/(ng·[mL·h]-1), RIA had 95.3% sensitivity and 70.8% specificity for PA screening .
Conclusion
The performance of the CLIA kit in assessing the concentration of renin and aldosterone meets the clinical requirements. Regarding preliminary PA screening, upright-position ARR had higher specificity, but lower sensitivity compared with supine-position ARR.
Keywords: Chemiluminescence immunoassay, Primary aldosteronism, Renin, Aldosterone
原发性醛固酮增多症(primary aldosteronism,PA)主要表现为肾上腺皮质自主分泌过量醛固酮,肾素-血管紧张素系统受到抑制。醛固酮的生理功能主要表现为保钠排钾,可引起水钠潴留,故PA患者临床表现多为高血压、高醛固酮和低肾素,伴或不伴低钾。高血压患者中PA患病率约占5%~10%[1]。在我国,新诊断高血压患者中PA患病率至少可达4%[2]。相比于原发性高血压,PA患者靶器官损害更加明显,发生心血管疾病和代谢相关疾病的风险更高,因此对PA进行早期诊疗有重要的临床意义[3]。
研究显示,目前仅有不足1%的PA患者能被早期确诊并且能接受合理的治疗,这一方面是由于临床上对PA的认识不足,另一方面是该疾病的诊疗费用高,加重了患者的经济负担[4]。研究发现,利用放射免疫法(radioimmunoassay, RIA)检测醛固酮/肾素水平(aldosterone-to-renin ratio, ARR)可将PA的检出率提高5~15倍,将醛固酮瘤的检出率提高1.3~6.3倍[5]。与RIA法相比,化学发光免疫法(chemiluminescence immunoassay, CLIA)检测肾素、醛固酮浓度易于自动化,操作简便、检测快捷、可重复性好,无放射性污染[6]。本研究根据美国临床实验室标准化协会相关文件,以RIA法为对照,对CLIA法定量检测肾素、醛固酮进行性能验证,并评估其对PA的筛查效力,旨在为CLIA法检测肾素、醛固酮水平应用于临床提供参考依据。
1. 材料与方法
1.1. 一般资料
本研究前瞻性连续性地选取2019年7月−2020年9月因高血压于四川大学华西医院入院就诊、疑似PA的患者共计123例,最终纳入91例(PA 43例,非PA 48例),排除32例。PA初筛患者纳入标准:高血压合并肾上腺占位(CT或MRI发现结节、肿瘤等);高血压伴低血钾;持续性高血压>160/100 mmHg(1 mmHg=0.133 kPa)、难治性高血压;高血压合并阻塞性呼吸睡眠暂停;高血压且有早发性高血压家族史或早发脑血管意外家族史;PA患者的一级亲属且患有高血压。排除标准:初筛实验肾素、醛固酮检测结果不全;筛查时用药影响肾素、醛固酮的检测,导致结果不准确。PA确诊标准为初筛试验阳性结合确诊试验卡托普利试验和/或卧立位盐水负荷试验阳性,其中自发的低血钾合并肾素低于检测下限、醛固酮浓度>20 ng/dL患者无需进行确诊试验。最终诊断需结合患者临床表现、实验室结果、肾上腺影像学检查和术后病理,由临床医生明确诊断[7-8]。本研究通过了四川大学华西医院伦理委员会审查(2019年审556号)。
1.2. 检测方法
1.2.1. 检测指标
CLIA法采用迈瑞CL6000i全自动发光仪检测血浆醛固酮水平(pg/mL)和直接肾素水平(pg/mL);RIA法采用天津九鼎医学生物工程有限公司试剂盒检测血清醛固酮水平(ng/dL)和北京北方生物技术研究所有限公司试剂盒检测血浆肾素活性〔ng/ (mL·h)〕,ARR通过醛固酮水平/肾素活性计算得到,CLIA法计算所得单位为(ng/dL)/(ng/L),RIA法计算所得单位为(ng·dL-1)/〔ng·(mL·h)-1〕。
1.2.2. 样本采集和检测
患者检测前降压方案可调整为α受体阻滞剂,必要时联合非二氢吡啶类或二氢吡啶类钙拮抗剂,其他降压药停药2~4周(利尿剂、含甘草药物、复方降压药至少停药4周,血管紧张素酶抑制剂、血管紧张素Ⅱ受体拮抗剂、β受体阻滞剂、非甾体类抗炎药等至少停药2周),并保持正常饮食状态,如出现低血钾应纠正至正常或接近正常水平。
采血:患者夜间卧床休息7~8 h后于次日清晨抽取3管卧位静脉血,其中2管为乙二胺四乙酸(EDTA)抗凝血,分别用于RIA法检测肾素活性和CLIA法同时检测肾素和醛固酮浓度;1管促凝管用于RIA法检测醛固酮。采血后嘱患者起床站立或者慢走,但不能进行剧烈活动,2 h后同样抽取3管立位静脉血,用法同上。
检测:CLIA法检测肾素、醛固酮浓度时采血管应常温送检,离心后上机,6 h内完成检测。RIA法检测肾素活性的采血管需冰水送检,低温离心后血浆加入酶抑制剂置于低温冰箱(−15 ℃以下)中保存,待测;检测醛固酮应离心后存放于2~8 ℃并于24 h内完成测定。
1.3. 性能验证
精密度:参考美国临床实验室标准化协会(CLSI) EP5-A2文件,取高浓度(H)、低浓度(L)两个水平的质控品分别重复测定20次,计算均值(
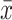 )、标准差(s)与变异系数(CV),CV≤1/4允许总误差(TEA)说明检测系统批内精密度可接受;两水平质控品连续测定20 d,计算
)、标准差(s)与变异系数(CV),CV≤1/4允许总误差(TEA)说明检测系统批内精密度可接受;两水平质控品连续测定20 d,计算
 、s与CV,CV≤1/3 TEA,则认为批间精密度可接受。
、s与CV,CV≤1/3 TEA,则认为批间精密度可接受。
线性范围:参考CLSI EP6-A文件,选择接近厂家试剂说明书提供的线性范围上限和下限的高(H)、低浓度(L)标本,按照不同比例(L、9L+1H、8L+2H、7L+3H、6L+4H、5L+5H、4L+6H、3L+7H、2L+8H、1L+9H和H)混匀得到不同浓度梯度样本,分别从低到高、再从高到低进行测定,计算每个样本检测值的平均值,通过直线回归法对实测浓度值(y)和理论值(x)进行统计分析,得直线回归方程y=bx+a,若b(斜率)在0.97~1.03范围内,R2>0.95,则厂家提供线性范围可接受;若b不在0.97~1.03范围内,R2>0.95,舍去高或低值组数据,另作回归统计,直至r和b符合要求,则该范围为线性范围。
携带污染率:参考CLSI H57-A文件,取高(H)、低浓度(L)样本各一份,将高浓度样本分成10份,低浓度样本分成11份,21份样本按顺序:L1、L2、L3、H1、H2、L4、H3、H4、L5、L6、L7、L8、H5、H6、L9、H7、H8、L10、H9、H10和L11连续测定。计算紧跟在高值后低值(H-L)的平均值和紧跟在低值后低值(L-L)的平均值,携带污染率=(H-L)的平均值−(L-L)的平均值,携带污染率<3倍(L-L)的s则验证通过。
临床应用评价:对疑似PA的高血压患者进行卧立位的肾素、醛固酮浓度水平的检测,以临床诊断结果为金标准,比较CLIA法和RIA法检测的相关性和对PA的筛查价值。
1.4. 统计学方法
符合正态分布的计量资料采用
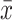 ±s表示,非正态分布计量资料则通过中位数(P25,P75)表示;两组间的连续型变量比较符合正态分布的使用t检验,非正态分布使用秩和检验;分类资料比较采用卡方检验。相关性分析中符合正态分布的计量资料采用Pearson相关分析,符合非正态分布的计量资料采用Spearman秩相关分析。诊断价值分析采用受试者工作特征曲线(ROC曲线)分析,取约登指数最大值为最佳截断点(cut-off值),Z检验比较ROC曲线下面积(AUC)。P<0.05为差异有统计学意义。
±s表示,非正态分布计量资料则通过中位数(P25,P75)表示;两组间的连续型变量比较符合正态分布的使用t检验,非正态分布使用秩和检验;分类资料比较采用卡方检验。相关性分析中符合正态分布的计量资料采用Pearson相关分析,符合非正态分布的计量资料采用Spearman秩相关分析。诊断价值分析采用受试者工作特征曲线(ROC曲线)分析,取约登指数最大值为最佳截断点(cut-off值),Z检验比较ROC曲线下面积(AUC)。P<0.05为差异有统计学意义。
2. 结果
2.1. CLIA法试剂盒的性能验证
2.1.1. 精密度
肾素和醛固酮的高、低水平批内精密度CV均小于1/4 TEA(6.25%),批间精密度CV小于1/3 TEA(8.33%),都在可接受范围内,具体结果见表1。
表 1. Verification of precision.
精密度验证结果
| Index | Intra assay | Inter assay | |||||
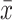
|
s | CV/% |

|
s | CV/% | ||
| Renin/(ng/L) | |||||||
| Low value | 28.64 | 0.29 | 1.02 | 18.63 | 0.54 | 2.88 | |
| High value | 62.66 | 0.64 | 1.02 | 63.50 | 1.54 | 2.43 | |
| Aldosterone/(ng/dL) | |||||||
| Low value | 17.13 | 0.28 | 1.62 | 15.07 | 0.68 | 4.53 | |
| High value | 29.80 | 0.42 | 1.41 | 36.21 | 1.29 | 3.57 | |
2.1.2. 线性范围
选取肾素高水平(554.33 ng/L)、低水平(0.015 ng/L)的样本,醛固酮高水平(243.62 ng/dL)、低水平(0.00 ng/dL)的样本按照比例稀释后的实测值和理论值线性关系如图1所示。对于肾素和醛固酮,厂家提供的线性范围可接受,即肾素的线性范围为0.5~500 ng/L,醛固酮的线性范围为1.45~200 ng/dL。
图 1.

Verification of the linear range of renin (A) and aldosterone (B) concentrations
肾素(A)、醛固酮(B)浓度线性范围验证
2.1.3. 携带污染率
肾素H-L的平均值为0.016,L-L的平均值为0.012,携带污染率为0.004,3倍L-L的s为0.013;醛固酮H-L的平均值为0.05,L-L的平均值为0.204,携带污染率为−0.154,3倍L-L的s为0.871,两者携带污染率均小于3倍L-L的s,说明结果可以接受。
2.2. 纳入患者一般资料
本研究纳入91例高血压患者中有43例(47.25%)PA患者,48例(52.75%)非PA患者。PA组和非PA组相比,收缩压和血钾值差异有统计学意义(P<0.05),PA组表现为收缩压更高、血钾值更低。两组在性别构成、年龄、体质量指数(BMI)、舒张压上的差异无统计学意义(P>0.05)(表2)。
表 2. General information of PA group and non-PA group.
PA组和非PA组的一般资料
| Group | Total (male/female)/case | Age/yr. | BMI/(kg/m2) | SBP/mmHg | DBP/mmHg | Serum K+/(mmol/L) |
| 1 mmHg=0.133 kPa. * P<0.05, vs. non-PA group. | ||||||
| PA | 43 (18/25) | 49.93±10.45 | 24.20±3.27 | 155.28±17.93 | 98.77±14.74 | 3.33±0.49 |
| Non-PA | 48 (26/22) | 46.15±14.36 | 25.20±4.30 | 144.67±22.55* | 93.54±14.94 | 3.86±0.49* |
2.3. 临床应用评价
2.3.1. CLIA法和RIA法检测的相关性分析
将CLIA法和RIA法得到的肾素、醛固酮及ARR比值结果的相关性进行比较发现(图2),CLIA法和RIA法检测的相关系数分别为0.901、0.861、0.847,P均<0.001。两种方法检测所得的3个指标均具有相关性。
图 2.

Correlation between CLIA and RIA
CLIA法和RIA法检测的相关性
A: Renin; B: Aldosterone (ALD); C: ARR.
2.3.2. 不同体位下CLIA、RIA对PA患者筛查价值的比较
2.3.2.1. 患者立位时两种方法对PA的筛查价值
立位时,CLIA法和RIA法检测所得ARR初筛PA的AUC分别为0.944(95%CI:0.903,0.985)和0.914(95%CI:0.850,0.977)(P=0.293 8),诊断效能见图3。ARR为5.636 (ng/dL)/(ng/L)时,CLIA法检测的灵敏度为79.1%,特异度为93.7%;ARR为14.084 (ng·dL−1)/〔ng·(mL·h)−1〕时,RIA法灵敏度为93.0%,特异度为83.3%。立位状态下CLIA法ARR值筛查PA可能的切点值见表3。
图 3.
ROC curves of ARR measured by CLIA and RIA in diagnosing PA in the upright position
立位时,CLIA法和RIA法检测的ARR值对PA的诊断价值ROC图
表 3. Cut-off point and screening efficiency of ARR for PA patients measured by CLIA in the upright position.
立位时,CLIA法检测ARR对PA患者筛查的切点及诊断效能
| Cut-off ARR/([ng/dL]/[ng/L]) | Sensitivity/% | Specificity/% | Youden index |
| 3.202 | 83.7 | 81.2 | 0.649 |
| 3.608 | 81.4 | 85.4 | 0.668 |
| 5.636 | 79.1 | 93.7 | 0.728 |
2.3.2.2. 患者卧位时两种方法对PA的筛查价值
卧位时,CLIA法和RIA法计算所得ARR初筛PA的AUC分别为0.946(95%CI:0.902,0.990)和0.898(95%CI:0.831,0.964)(P=0.088 9),其诊断效能见图4。ARR为5.640 (ng/dL)/(ng/L)时,CLIA法检测的灵敏度为97.7%,特异度为81.2%;ARR为33.494 (ng·dL−1)/〔ng·(mL·h)−1〕时,RIA法的灵敏度为95.3%,特异度为70.8%。我们提供了卧位下CLIA法ARR值初筛PA可能的切点值,具体结果见表4。
图 4.
ROC curves of ARR measured by CLIA and RIA in diagnosing PA in the lying position
卧位时,CLIA法和RIA法检测的ARR值对PA的诊断价值ROC图
表 4. Cut-off point and diagnostic efficiency of ARR for PA patients measured by CLIA in the lying position.
卧位时,CLIA法检测ARR在PA患者中的切点及诊断效能
| Cut-off ARR/([ng/dL]/[ng/L]) | Sensitivity/% | Specificity/% | Youden index |
| 5.640 | 97.7 | 81.2 | 0.789 |
| 5.882 | 95.3 | 83.3 | 0.786 |
| 6.287 | 93.0 | 85.4 | 0.784 |
3. 讨论
本研究对CLIA法检测肾素、醛固酮进行了性能验证,其精密度、线性范围和携带污染率均符合临床要求。在疑似PA患者中,CLIA和RIA法检测所得的肾素和醛固酮水平有良好的相关性,卧立位ARR值对PA的诊断价值相当,提示CLIA法对肾素、醛固酮的检测可应用于临床。
目前肾素、醛固酮的检测方法主要有RIA法、CLIA法和质谱法。RIA法需要手工操作,且携带放射性污染,质谱法虽然是检测金标准,但是成本和技术要求均比较高,CLIA法更安全、方便快捷[9]。本研究发现,CLIA法检测肾素、醛固酮具有较高的精密度和较低的携带污染率;其线性范围与厂家提供一致,可满足临床需求。有研究发现,进口CLIA法试剂盒检测醛固酮水平与质谱法有较好的相关性,而国产的化学发光检测系统与质谱法的相关性参差不齐,RIA法与质谱法相比相关性欠佳[10]。由于RIA法是检测肾素、醛固酮水平的传统方法,本研究做了国产CLIA法和RIA法检测肾素、醛固酮及ARR相关性比较,两种方法的相关性较好。
研究表明,醛固酮/肾素浓度可有效替代醛固酮/肾素活性用于PA初筛[11-12]。LI等[13]的meta分析研究结果进一步证实了醛固酮/肾素浓度初筛PA的有效性,并指出ARR筛查PA总体的敏感性为0.89(95%CI:0.84,0.93)、特异性为0.96(95%CI:0.95,0.98),曲线下面积为0.985,纳入文献的切点值范围为26.35~59.66 (ng/L)/(ng/L)。欧洲内分泌学会临床实践指南基于单位换算推荐ARR切点值为立位3.7 (ng/dL)/(mU/L)或5.7 (ng/dL)/(ng/L)[7]。本研究表示,当患者处于立位时,CLIA法测定的ARR用于筛查PA的最佳切点值为5.636 (ng/dL)/(ng/L);卧位状态下,CLIA法检测的ARR最佳切点值为5.640 (ng/dL)/(ng/L)。由于各地纳入患者标准和数量不同、使用不同试剂盒厂家导致检测指标可参考范围以及单位有所差异,故初筛PA尚未形成统一的ARR切点值值[14]。实验室应当结合文献研究和当地具体情况制定合适的ARR切点值[15]。
本研究在基于CLIA法试剂盒的精密度、线性范围和携带污染率均符合临床要求的情况下,与RIA法进行对应指标检测的相关性比较,针对不同体位进行了ARR对PA的筛查价值分析。对照组除了原发性高血压组人群以外,我们还纳入了部分除PA以外的继发性高血压,包括继发性醛固酮增多症、库欣综合征、阻塞性睡眠呼吸暂停低通气综合征等人群。不足之处在于,由于PA的分型较难,需结合生化、影像学检查和肾上腺静脉采血(adrenal vein sampling,AVS)进行综合分析,其中AVS既是有创操作且价格昂贵,因此没有进一步区分在特发性醛固酮增多症和醛固酮腺瘤患者中肾素、醛固酮和ARR水平以及合适的切点值。
本研究结果显示,CLIA法试剂盒检测肾素、醛固酮达到临床要求,在PA的初筛过程中其检测结果和RIA法相比有良好的相关性,筛查价值相当。CLIA法采用立位ARR值初筛PA的特异度高,但是灵敏度低于卧位ARR,可根据实际情况选择卧立位ARR值筛查PA。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科学技术厅重点研发项目(No. 2020YFS0096)资助
Contributor Information
稚 刘 (Zhi LIU), Email: 1793689219@qq.com.
振梅 安 (Zhen-mei AN), Email: azmhxnfm@163.com.
References
- 1.ADLIN E V Subclinical primary aldosteronism. Ann Intern Med. 2017;167(9):673–674. doi: 10.7326/M17-2237. [DOI] [PubMed] [Google Scholar]
- 2.XU Z, YANG J, HU J, et al Primary aldosteronism in patients in China with recently detected hypertension. J Am Coll Cardiol. 2020;75(16):1913–1922. doi: 10.1016/j.jacc.2020.02.052. [DOI] [PubMed] [Google Scholar]
- 3.MONTICONE S, D’ASCENZO F, MORETTI C, et al Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2018;6(1):41–50. doi: 10.1016/S2213-8587(17)30319-4. [DOI] [PubMed] [Google Scholar]
- 4.FUNDER J W Primary aldosteronism as a public health issue. Lancet Diabetes Endocrinol. 2016;4(12):972–973. doi: 10.1016/S2213-8587(16)30272-8. [DOI] [PubMed] [Google Scholar]
- 5.MULATERO P, STOWASSER M, LOH K C, et al Increased diagnosis of primary aldosteronism, including surgically correctable forms, in centers from five continents. J Clin Endocrinol Metab. 2004;89(3):1045–1050. doi: 10.1210/jc.2003-031337. [DOI] [PubMed] [Google Scholar]
- 6.王芳, 康金锁, 邹玉宝, 等 化学发光免疫法检测醛固酮和肾素浓度及对原发性醛固酮增多症的诊断价值的评价. 中国循环杂志. 2016;31(6):606–609. doi: 10.3969/j.issn.1000-3614.2016.06.020. [DOI] [Google Scholar]
- 7.FUNDER J W, CAREY R M, MANTERO F, et al The management of primary aldosteronism: case detection, diagnosis, and treatment: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2016;101(5):1889–1916. doi: 10.1210/jc.2015-4061. [DOI] [PubMed] [Google Scholar]
- 8.中华医学会内分泌学分会 原发性醛固酮增多症诊断治疗的专家共识(2020版) 中华内分泌代谢杂志. 2020;36(9):727–736. doi: 10.3760/cma.j.cn311282-20200615-00444. [DOI] [Google Scholar]
- 9.李元美, 任艳, 陈涛, 等. 原发性醛固酮增多症诊断与研究进展. 四川大学学报(医学版), 2020,51(3):267-277.
- 10.郑枫凡, 宋颖, 杨淑敏, 等 不同方法检测血醛固酮浓度的一致性比较. 中华内分泌代谢杂志. 2019;35(11):934–938. doi: 10.3760/cma.j.issn.1000-6699.2019.11.003. [DOI] [Google Scholar]
- 11.GLINICKI P, JESKE W, BEDNAREK-PAPIERSKA L, et al The ratios of aldosterone/plasma renin activity (ARR) versus aldosterone/direct renin concentration (ADRR) J Renin Angiotensin Aldosterone Syst. 2015;16(4):1298–1305. doi: 10.1177/1470320313519487. [DOI] [PubMed] [Google Scholar]
- 12.BURRELLO J, MONTICONE S, BUFFOLO F, et al Diagnostic accuracy of aldosterone and renin measurement by chemiluminescent immunoassay and radioimmunoassay in primary aldosteronism. J Hypertens. 2016;34(5):920–927. doi: 10.1097/HJH.0000000000000880. [DOI] [PubMed] [Google Scholar]
- 13.LI X, GOSWAMI R, YANG S, et al. Aldosterone/direct renin concentration ratio as a screening test for primary aldosteronism: a meta-analysis. J Renin Angiotensin Aldosterone Syst, 2016, 17(3): 1470320316657450[2020-01-07]. https://journals.sagepub.com/doi/10.1177/1470320316657450. doi:10/gcdwzm
- 14.LIBIANTO R, FULLER P J, YOUNG M J, et al Primary aldosteronism is a public health issue: challenges and opportunities. J Hum Hypertens. 2020;34(7):478–486. doi: 10.1038/s41371-020-0336-2. [DOI] [PubMed] [Google Scholar]
- 15.DENIMAL D, DUVILLARD L 2016 endocrine society guidelines update for the diagnosis of primary aldosteronism: are the proposed aldosterone-to-renin ratio cut-off values relevant in the era of fully automated immunoassays? Ann Clin Biochem. 2016;53(6):714–715. doi: 10.1177/0004563216645364. [DOI] [PubMed] [Google Scholar]




