Abstract
目的
探讨慢性乙型肝炎病毒(HBV)感染诱发肝癌所涉及的内在机制。
方法
对稳定过表达HBV前S1抗原(preS1)的L02、HepG2和Huh7细胞进行流式细胞术、实时荧光定量和裸鼠成瘤等实验来评估preS1在HBV相关性肝癌发生中的作用。
结果
preS1诱导细胞肿瘤干细胞(CSCs)相关因子和表面标志分子的表达上调,增强细胞的裸鼠成瘤能力;过表达preS1可以下调细胞表面组织相容性复合体Ⅰ(MHC-Ⅰ)的表达;在细胞培养过程中加入γ干扰素(IFN-γ)可以恢复细胞表面MHC-Ⅰ的表达,降低细胞的裸鼠成瘤能力。
结论
preS1是HBV的一个致癌因子,通过下调肝细胞表面MHC I促进肝癌产生。
Keywords: 乙型肝炎病毒, 肝癌, HBV前S1抗原, 组织相容性复合体Ⅰ, γ干扰素
Abstract
Objective
To explore the internal mechanism of hepatocellular carcinoma (HCC) induced by chronic hepatitis B virus (HBV) infection.
Methods
L02, HepG2 and Huh7 cells stably overexpressing HBV preS1 antigen were analyzed by flow cytometry, qRT-PCR and tumorigenesis in nude mice to evaluate the effect of preS1 antigen in HBV-related hepatocarcinogenesis.
Results
Our results showed that the expression of cancer stem cell (CSCs) related factors and cell surface markers in preS1 overexpressing cells were up-regulated, and the tumorigenicity of these cells was enhanced in nude mice. In addition, preS1 overexpression could down-regulate the expression of major histocompatibility complex Ⅰ (MHC-Ⅰ). The expression of MHC-Ⅰ on the cell surface could be restored by adding interferon gamma (IFN-γ) in the process of cell culturing and the tumorigenicity of cells in nude mice could thus be reduced.
Conclusion
Based on the above results, we believe that preS1 is a carcinogen of HBV and that it promotes the formation of liver cancer through down regulating MHC-Ⅰ on the surface of hepatocytes.
Keywords: Hepatitis B virus, Hepatocellular carcinoma, preS1 antigen of HBV, Histocompatibility complex Ⅰ (MHC-Ⅰ), Interferon gamma (IFN-γ)
近年来,肝细胞癌(hepatocellular carcinoma, HCC)的发病率呈逐年上升的趋势[1]。乙型肝炎病毒(hepatitis B virus, HBV)慢性感染是导致HCC发生的主要原因之一。据统计,53%的HCC均与HBV慢性感染直接相关[2]。HBV表面抗原(hepatitis B surface antigen, HBsAg)阳性的患者发展成为HCC的风险要比正常人群高25~37倍[3]。根据已有研究结果分析,许多因素都与HBV相关性肝癌的发生密切相关,比如HBV基因组的整合[4],HBV感染所导致的炎症反应[5],HBV感染导致宿主细胞基因组结构失稳等[6]。除此之外,研究者还发现HBV表达的某些组分(例如HBs或HBx蛋白)可以影响细胞内信号的传导,诱导肝癌的发生[7-8]。由此可见,HBV相关性肝癌的发生涉及众多过程,其发生机制仍有待进一步深入探索。
癌症干细胞(cancer stem cells, CSCs)在肿瘤的发生和转移中起着重要作用。通过基因芯片分析临床HCC样本、肿瘤细胞系和转基因小鼠发现,HCC中的CSCs与正常的肝脏干细胞具有一定的相似之处[9]。在正常干细胞中表达的关键因子如Kruppel-like factor 4(Klf-4)、Nanog homeobox protein(Nanog)、cellular myelocytomatosis oncogene(c-Myc)和Octamer-binding transcription factor 4(Oct-4)同样在肿瘤干细胞中高表达[10],而且参与了肿瘤发生的关键过程。在肝癌发生的研究中,CD90常被用做鉴定肝癌干细胞的表面标志物[11]。原癌蛋白CD117(又称c-kit)属于血小板衍生生长因子(platelet-derived growth factor, PDGF)受体家族,在多种人类恶性肿瘤中表达[12],也是常用的癌症干细胞表面标志分子。
我们在前期研究中发现,HBV前S1抗原(preS1)激活Wnt信号通路促进肝癌干细胞产生[13-14]。在本研究中,我们进一步探索preS1在HCC发生过程中的作用,观察稳定过表达preS1的肝细胞生长状态和CSCs相关转录因子及表面标志表达的变化,并通过体内外实验观察γ干扰素(interferon-γ, IFN-γ)对细胞表面组织相容性复合体Ⅰ(major histocompatibility complex Ⅰ, MHC-Ⅰ)表达水平和HepG2成瘤能力的影响,从一个新的视角阐述HBV相关性肝癌的发生机制,也将为临床防治慢性乙型肝炎导致的HCC奠定理论基础。
1. 材料和方法
1.1. 细胞系和细胞培养
肝癌细胞系HepG2、Huh7和正常肝细胞系L02由武汉大学病毒学国家重点实验室吴建国课题组惠赠。HepG2、Huh7和L02细胞使用添加了FBS(100 mL/L, Gibco Life Technologies, USA)和双抗(100 U/mL penicillin, 50 U/mL streptomycin, Gibco Life Technologies, USA)的DMEM培养基培养。
HepG2、Huh7和L02细胞使用慢病毒系统构建稳定过表达preS1细胞系。构建完成的稳定过表达细胞系的培养方法与原来的细胞保持一致。细胞培养过程中如果添加IFN-γ(CAA31639, R&D Systems®, USA),则剂量为50 ng/mL。
1.2. 载体构建
慢病毒载体pWPXLD购自Addgene公司(Addgene plasmid # 12258),并在ef1α启动子和GFP基因中间插入PmeⅠ、BstBⅠ酶切位点和一段T2A序列。使用引物preS1,sense: gcc gTT TAA ACA Tgg gAg gTT ggT CTT CCA和antisense: gccTTC gAA ggC CTg Agg ATg ACT gTC T从pHBV1.3载体上扩增preS1基因序列,经过PmeⅠ、BstBⅠ酶切后插入到慢病毒载体中。构建完成的载体使用测序确认基因序列正确插入。
1.3. 慢病毒包装和细胞感染
使用Lipofectamine® 3000(Thermo Fisher Scientific, USA)将构建好的慢病毒载体及辅助质粒转染至HEK293T细胞(每个6 cm细胞培养皿转染12 µg慢病毒载体质粒、6 µg pMD2G辅助质粒和12 µg psPAX2质粒)。细胞培养48 h和72 h分别收集细胞培养上清,并使用0.45 μm的针头滤器过滤备用。
细胞感染前,先将HepG2、Huh7和L02细胞接种于12孔板(每孔1×104细胞)。慢病毒空载体pWPXLD包装的病毒感染细胞用于构建对照组,插入preS1基因序列的慢病毒载体pWPXLD-preS1包装的病毒感染细胞用于构建实验组。各孔细胞加入1 mL慢病毒孵育24 h后,换取新鲜培养基,并扩大培养。
1.4. 流式细胞分析和分选
慢病毒感染的细胞使用MoFlo流式细胞仪(Beckman Coulter, USA)分选出GFP阳性的细胞,经过扩大培养构建稳定过表达preS1的细胞系L02-preS1-GFP、HepG2-preS1-GFP和Huh7-preS1-GFP,以及对应的对照细胞系L02-GFP、HepG2-GFP和Huh7-GFP。
经过流式分选的稳定过表达细胞系培养1周后,用于流式细胞分析:重悬的单细胞使用荧光标记的流式抗体染色:CD90-APC(clone 5E10, ebioscience, 1∶100),CD117-APC(clone 104D2, ebioscience, 1∶100),β2M-APC(clone 2M2, Biolegend, 1∶100);获得的流式数据使用CytExpert(Beckman Coulter, USA)软件进行分析。
1.5. 荧光定量
L02-preS1-GFP和HepG2-preS1-GFP细胞,以及对应的对照细胞L02-GFP和HepG2-GFP培养1周后,使用TRIzol试剂(Invitrogen)提取细胞总RNA逆转录获得cDNA。荧光定量分析使用BIO-RAD CFX96荧光定量PCR仪、SYBR RT-PCR kits (ROCHE, USA)荧光定量PCR试剂盒进行。具体的PCR体系为:10 μL SYBR Green PCR master Mix,5 μL稀释的cDNA模板,上下游引物(1 μmol/L)各5 μL。具体的PCR程序为:95 ℃预变性3 min; 扩增45个循环:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s;绘制熔解曲线:65 ℃至95 ℃,每上升0.5 ℃采集信号;16 ℃保持。荧光定量中使用的引物由Primer Premier 5.0软件设计,序列如下:Klf4 sense: 5′-ATT ACC CAT CCT TCC TgC CC-3′, Klf4 antisense: 5′-CAC GAT CgT CTT CCC CTC TT-3′; Sox2 sense: 5′-AgC TCg CAg ACC TAC ATg AA-3′, Sox2 antisense: 5′-Tgg AgT ggg Agg AAg Agg TA-3′; Nanog sense: 5′-ACC CAg CTg TgT gTA CTC AA-3′, Nanog antisense: 5′-CTg CgT CAC ACC ATT gCT AT-3′; c-Myc sense: 5′-ATT CTC TgC TCT CCT CgA Cg-3′, c-Myc antisense: 5′-AgC CTg CCT CTT TTC CAC A-3′; Oct4 sense: 5′-AgA ACA TgT gTA AgC TgC gg-3′, Oct4 antisense: 5′-ggT TCg CTT TCT CTT TCg gg-3′; GAPDH sense: 5′-TCg Tgg AAg gAC TCA TgA CC-3′, GAPDH antisense: 5′-ATg ATg TTC Tgg AgA gCC CC-3′。具体方法和数据分析参照已发表文献[13]。
1.6. 裸鼠成瘤
五周龄BALB/cA-nu雌性裸鼠(20.5~24.4 g)购自北京华阜康生物科技股份有限公司。使用HepG2-GFP和L02-GFP作对照,我们对常规培养和IFN-γ刺激的HepG2-preS1-GFP和L02-preS1-GFP细胞进行了裸鼠腋下成瘤实验(6只/组)。裸鼠在SPF级无菌层流动物房中饲养1周后,腋下接种5×106个PBS重悬的细胞。从第6天开始,每隔3 d使用游标卡尺测量肿瘤大小(肿瘤体积=最短直径2×最长直径/2 ,式中直径单位为mm,体积单位为mm3)。接种3周后处死小鼠,剥取肿瘤进行测量。本研究动物实验均严格按照湖北医药学院动物实验伦理委员会的相关规定进行。
1.7. 统计学方法
两组间计量资料比较采用LSD分析,组间计数资料比较采用χ2检验,多因素分析采用二元logistic回归分析。P<0.05为差异有统计学意义。
2. 结果
2.1. 稳定过表达preS1改变L02和HepG2细胞的显微形态
通过流式细胞仪分选GFP阳性细胞,我们纯化并扩大培养了所构建的稳定过表达细胞系。在培养的过程中我们发现,稳定过表达preS1的L02细胞显微形态和生长状态均发生了明显的改变。与对照组L02-GFP相比,L02-preS1-GFP细胞在生长过程中出现了很多凸起的克隆,与生长在饲养层细胞上的胚胎干细胞非常类似(图1 左,红色箭头所示部分)。HepG2细胞来源于恶性肿瘤组织,在稳定过表达preS1之后,HepG2-preS1-GFP细胞形态和生长状态并没有L02-preS1-GFP细胞改变得明显,但是与对照组HepG2-GFP相比较也可以看到凸起的细胞克隆(图1 右,红色箭头所示部分)。
图 1.
Microscopic images of L02-preS1-GFP/HepG2-preS1-GFP cells and L02-GFP/HepG2-GFP cells, the controls
L02-preS1-GFP/HepG2-preS1-GFP细胞及其对照L02-GFP/HepG2-GFP细胞的显微图片
The upper picture shows the morphology of cells in the fluorescence field, and the lower picture shows the morphology of cells in the ordinary white light field. The red arrows indicate the changes of cell growth morphology after overexpression of preS1. Scale bar = 50 μm.
2.2. 稳定过表达preS1促进L02、HepG2和Huh7细胞中CSCs的产生
流式细胞分析结果(图2)显示:在正常肝细胞L02中过表达preS1之后,CD90阳性细胞的比例从0.57%上升到2.23%,CD117阳性细胞的比例从2.23%上升到40.95%;在肝癌细胞HepG2和Huh7中过表达preS1之后,CD90阳性细胞的比例从11.07%和8.84%分别上升到16.85%和13.00%,CD117阳性细胞的比例从6.59%和4.96%分别上升到21.19%和14.82%。
图 2.

The effect of preS1 overexpression on the expression of CSCs surface marker (CD90 and CD117) was analyzed by flow cytometry
流式细胞术分析过表达preS1对CSCs表面标志(CD90和CD117)表达水平的影响
我们进一步使用实时荧光定量分析了CSCs相关的转录因子基因(Klf4、Sox2、Nanog、c-Myc、Oct4)表达量变化。结果显示,无论是在HepG2细胞或是L02细胞中过表达preS1均可以显著上调CSCs关键转录因子基因的表达(图3)。
图 3.

qRT-PCR was used to analyze the expression changes of CSCs-related factorsin preS1 overexpressing cells
qRT-PCR分析preS1过表达对细胞CSCs相关的因子表达的影响
n=3. *P<0.05, **P<0.01, ***P<0.001, vs. HepG2-GFP or L02-GFP.
2.3. 稳定过表达preS1可以降低L02和HepG2细胞表面MHC-Ⅰ的表达水平
我们使用流式抗体检测细胞表面MHC-Ⅰ轻链β2M的表达水平发现,过表达preS1可以降低L02、HepG2和Huh7细胞表面MHC-Ⅰ的表达水平(图4,上)。同时,流式分析结果显示IFN-γ可以上调细胞表面MHC-Ⅰ表达水平,使过表达perS1的细胞MHC-Ⅰ的表达水平恢复至对照组的水平(图4,下)。
图 4.
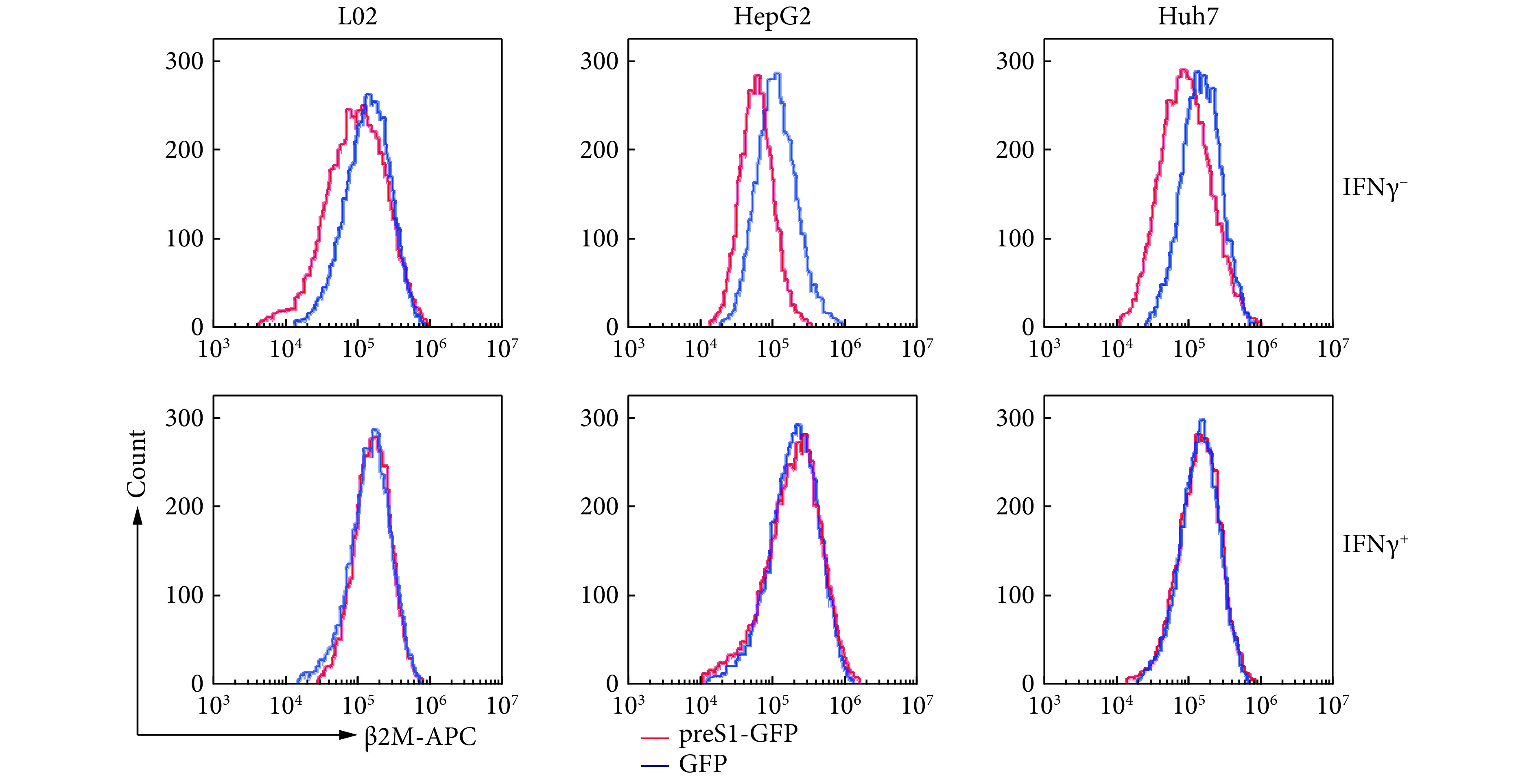
The effect of preS1 overexpression on cell surface expression of MHC-Ⅰ was exmained with flow cytometry
流式细胞术分析过表达preS1对细胞表面MHC-Ⅰ表达水平的影响
2.4. 稳定过表达preS1抗原可以增强HepG2细胞的裸鼠成瘤能力
裸鼠成瘤实验结果(图5)显示,裸鼠接种常规培养和IFN-γ刺激的HepG2-preS1-GFP和HepG2-GFP细胞均形成了肿瘤。而L02-GFP和L02-preS1-GFP在裸鼠中成瘤效果并不稳定。我们进行了两次L02-GFP和L02-preS1-GFP细胞裸鼠成瘤实验,仅有一次L02-preS1-GFP细胞在6只裸鼠中产生了2个肿瘤,L02-GFP细胞在所有的裸鼠成瘤实验中均未产生肿瘤(未展示数据和图片)。除此之外,虽然HepG2-preS1-GFP和HepG2-GFP细胞在裸鼠中均可以形成肿瘤,但是相同时间内HepG2-preS1-GFP细胞形成的肿瘤组织要大于HepG2-GFP细胞。肿瘤生长曲线也显示HepG2-preS1-GFP细胞形成的肿瘤生长速度要快于HepG2-GFP细胞。而IFN-γ刺激之后,HepG2-preS1-GFP和HepG2-GFP细胞在裸鼠体内的成瘤能力减弱。
图 5.
The effect of preS1 overexpression and IFN-γ treatment on the tumorigenicity of hepatoma cells in nude mice
过表达preS1或IFN-γ处理对肝癌细胞裸鼠成瘤能力的影响
n=6. *P<0.05, **P<0.01, HepG2-GFP (IFNγ−) vs. HepG2-GFP (IFNγ+); ***P<0.001, HepG2-preS1-GFP (IFNγ−) vs. HepG2-preS1-GFP (IFNγ+).
3. 讨论
在亚洲和非洲,60%的HCC与HBV感染相关,20%与HCV相关,其余部分与其他危险因素相关,如酒精和黄曲霉毒素[15]。肝癌被称之为“癌中之王”,治疗困难,死亡率高。癌症是由不同的细胞群体组成的,研究人员已经证实CSCs对于癌症的发生起着至关重要的作用。更重要的是,CSCs对包括化疗和放疗在内的传统癌症治疗方式更具抵抗力,这解释了为何经常会有癌症复发临床案例[16]。研究表明,HBV促进了CSCs的产生,并在HCC发生中发挥了重要作用[17]。然而,HBV相关性肝癌发生过程中CSCs产生的机制尚不清楚,HBV表达的各种抗原对肝癌发展的影响在很大程度上未被发现。
本研究发现,过表达preS1的正常肝细胞L02被诱导产生CSCs类细胞,过表达preS1的肝癌细胞HepG2、Huh7也表现出更加明显的癌化特性。这说明preS1在正常肝细胞向癌化肝细胞的转换过程中起着一定的作用。过表达preS1的正常肝细胞L02-preS1-GFP细胞裸鼠成瘤能力并不稳定,意味着这种正常肝细胞向癌化肝细胞的转换并不完全。因此,在HBV相关性肝癌的发生中,应该还有其他因子,如HBx等,产生了重要的作用。
曾有报道土拨鼠肝炎病毒(woodchuck hepatitis virus, WHB)表面抗原preS2可以降低MHC-Ⅰ的表达量[18],但是HBV表面抗原preS1是否有同样的作用尚不明了。研究报道,表达HBV的肝癌细胞系HepG2.2.15细胞表面MHC-Ⅰ的表达量低于对照HepG2[19]。在肝癌的发生过程中,除了细胞内部开始表达癌化相关因子外,细胞表面MHC-Ⅰ表达量降低则对于新生肿瘤细胞逃避免疫杀伤至关重要。本研究发现,过表达preS1的L02、HepG2和Huh7细胞表面MHC-Ⅰ的表达水平均有不同程度的下降。这在一定程度上阐明了HBV相关性肝癌发生的内在机制。因为IFN-γ可以增加细胞表面MHC-Ⅰ的表达[20],因此我们尝试验证IFN-γ能否逆转preS1对MHC-Ⅰ的下调作用。结果证实,IFN-γ的处理可以抵消preS1过表达所引起的MHC-Ⅰ的表达下调。
综上所述,本研究证实了HBV感染肝细胞表达的preS1可以激活CSCs相关因子的表达和下调细胞表面MHC-Ⅰ的表达,而IFN-γ的处理可以逆转preS1过表达所引起的MHC-Ⅰ的表达下调。这些结果对于临床防治HBV相关性肝癌具有积极的指导意义。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81902066、No. 82002149)资助
Contributor Information
晶晶 饶 (Jing-jing RAO), Email: 13703348@qq.com.
志新 刘 (Zhi-xin LIU), Email: lzx20022456@126.com.
References
- 1.MULLATH A, KRISHNA M Hepatocellular carcinoma—Time to take the ticket. World J Gastrointest Surg. 2019;11(6):287–295. doi: 10.4240/wjgs.v11.i6.287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.TORRESI J, TRAN B M, CHRISTIANSEN D, et al HBV-related hepatocarcinogenesis: The role of signalling pathways and innovative ex vivo research models . BMC Cancer. 2019;19(1):707. doi: 10.1186/s12885-019-5916-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.PONZETTO A, SRINIVASAN R S. Risk factors for hepatocellular carcinoma. Hepatology, 2017, 65(3): 1074[2022-02-20]. https://doi.org/10.1002/hep.28854. doi: 10.1002/hep.28854.
- 4.YANG L, YE S, ZHAO X, et al Molecular characterization of HBV DNA integration in patients with hepatitis and hepatocellular carcinoma. J Cancer. 2018;9(18):b3225–3235. doi: 10.7150/jca.26052. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.XU Z, ZHAI L, YI T, et al Hepatitis B virus X induces inflammation and cancer in mice liver through dysregulation of cytoskeletal remodeling and lipid metabolism. Oncotarget. 2016;7(43):70559–70574. doi: 10.18632/oncotarget.12372. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.PONZETTO A, SRINIVASAN R S. Risk factors for hepatocellular carcinoma. Hepatology. 2017, 65(3): 1074[2022-02-20]. https://doi.org/10.1002/hep.28854.
- 7.ZONG L, PENG H, SUN C, et al Breakdown of adaptive immunotolerance induces hepatocellular carcinoma in HBsAg-tg mice. Nat Commun. 2019;10(1):221. doi: 10.1038/s41467-018-08096-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.MAO X, TEY S K, KO F C F, et al C-terminal truncated HBx protein activates caveolin-1/LRP6/β-catenin/FRMD5 axis in promoting hepatocarcinogenesis. Cancer Lett. 2019;444:60–69. doi: 10.1016/j.canlet.2018.12.003. [DOI] [PubMed] [Google Scholar]
- 9.REYA T, MORRISON S J, CLARKE M F, et al Stem cells, cancer, and cancer stem cells. Nature. 2001;414(6859):105–111. doi: 10.1038/35102167. [DOI] [PubMed] [Google Scholar]
- 10.MONK M, HOLDING C Human embryonic genes re-expressed in cancer cells. Oncogene. 2001;20(56):8085–8091. doi: 10.1038/sj.onc.1205088. [DOI] [PubMed] [Google Scholar]
- 11.KUMAR A, BHANJA A, BHATTACHARYYA J, et al Multiple roles of CD90 in cancer. Tumour Biol. 2016;37(9):11611–11622. doi: 10.1007/s13277-016-5112-0. [DOI] [PubMed] [Google Scholar]
- 12.FATRAI S, VAN SCHELVEN S J, UBINK I, et al Maintenance of clonogenic KIT(+) human colon tumor cells requires secretion of stem cell factor by differentiated tumor cells. Gastroenterology. 2015;149(3):692–704. doi: 10.1053/j.gastro.2015.05.003. [DOI] [PubMed] [Google Scholar]
- 13.LIU Z X, DAI X C, WANG T C, et al Hepatitis B virus PreS1 facilitates hepatocellular carcinoma development by promoting appearance and self-renewal of liver cancer stem cells. Cancer Lett. 2017;400:149–160. doi: 10.1016/j.canlet.2017.04.017. [DOI] [PubMed] [Google Scholar]
- 14.袁杰, 熊希, 李云静, 等 HBV表面抗原preS1激活Wnt信号通路导致肝癌发生的机制研究. 中国人兽共患病学报. 2019;35(10):922–927. [Google Scholar]
- 15.ARZUMANYAN A, REIS H M, FEITELSON M A Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma. Nat Rev Cancer. 2013;13(2):123–135. doi: 10.1038/nrc3449. [DOI] [PubMed] [Google Scholar]
- 16.FERRANDINA G, PETRILLO M, BONANNO G, et al Targeting CD133 antigen in cancer. Expert Opin Ther Targets. 2009;13(7):823–837. doi: 10.1517/14728220903005616. [DOI] [PubMed] [Google Scholar]
- 17.DE MARTEL C, MAUCORT-BOULCH D, PLUMMER M, et al World-wide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma. Hepatology. 2015;62(4):1190–200. doi: 10.1002/hep.27969. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.WANG J, MICHALAK T I Inhibition by woodchuck hepatitis virus of class Ⅰ major histocompatibility complex presentation on hepatocytes is mediated by virus envelope pre-S2 protein and can be reversed by treatment with gamma interferon. J Virol. 2006;80(17):8541–8553. doi: 10.1128/JVI.00830-06. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.CHEN Y, CHENG M, TIAN Z Hepatitis B virus down-regulates expressions of MHC class Ⅰ molecules on hepatoplastoma cell line. Cell Mol Immunol. 2006;3(5):373–378. doi: 10.1038/s41598-018-34155-7. [DOI] [PubMed] [Google Scholar]
- 20.ZHOU F Molecular mechanisms of IFN-gamma to up-regulate MHC class Ⅰ antigen processing and presentation. Int Rev Immunol. 2009;28(3/4):239–260. doi: 10.1080/08830180902978120. [DOI] [PubMed] [Google Scholar]




