Abstract
目的
建立高效液相色谱轨道阱质谱对生物检材中34种常见毒品及代谢物的筛查方法。
方法
尿样和血样经乙酸乙酯提取后,氮吹浓缩和复溶;毛发样品依次用水和丙酮振荡洗涤、晾干后剪成约1 mm,置冷冻研磨仪中粉碎,甲醇提取,过滤后,滤液供仪器分析。色谱分析采用Hypersil Gold PFP色谱柱(2.1 mm×100 mm,3 µm)分离,甲醇-5 mmol/L乙酸铵溶液作为流动相,梯度洗脱,流速为400 μL/min。质谱分析采用电喷雾正负离子交替模式,使用一级母离子全扫描和数据依赖的二级子离子扫描(Full MS/dd-MS2)模式,采用Xcalibur4.0软件分别对仪器和数据进行控制和采集,利用TraceFinder3.3软件进行筛查识别。
结果
血样、尿样和发样的34种常见毒品及其代谢物方法检出限分别为3.30~10700 ng/L、4.43~5440 ng/L和0.0350~4.21 μg/kg。在5.0、10、20 μg/L加标水平下,日内精密度为3.50%~6.00%,日间精密度为4.18%~9.90%。采集了尿样、血样和发样共1125份生物检材,采用该方法进行筛查分析,阳性样本中有87.9%为男性,96.7%的吸毒者吸食单一毒品,3.3%吸毒者吸食混合毒品,吸食毒品种类从高到低依次为甲基苯丙胺(75.8%)、海洛因(18.5%)、氯胺酮(2.4%)、其他毒品(3.3%)。与高效液相色谱三重四极杆质谱分析结果比较,该方法能同时识别出更多毒品、实现回顾性分析。
结论
建立的方法简便、灵敏度良好,适用于生物检材中常见毒品及代谢物的筛查分析。
Keywords: 液相色谱轨道阱质谱, 筛查, 生物检材, 毒品
Abstract
Objective
To establish a high-performance liquid chromatography orbital trap mass spectrometry (HPLC-Obitrap MS) method for screening 34 common drugs and metabolites in biological samples.
Methods
The target analytes in urine and blood samples were extracted with ethyl acetate, concentrated by nitrogen blowing and redissolved. The hair samples were washed with water and acetone, dried and cut into bits of about 1 mm, and then crushed in a freezing grinder. The analytes were extracted with methanol, and after filtration, the filtrate was used for instrumental analysis. Hypersil Gold PFP (2.1 mm×100 mm, 3 µm) column was used for chromatographic separation. Methanol and 5 mmol/L ammonium acetate solution were used as mobile phase with gradient elution at a flow rate of 400 μL/min. Mass spectrometry was done by electrospray positive and negative ion alternation mode. The data were collected using Full MS and Full MS/dd-MS2 mode. Xcalibur 4.0 software was used to control instruments and to collect data, and TraceFinder 3.3 was used for screening and identification.
Results
The method's detection limits for 34 drugs and their metabolites in blood, urine and hair samples were 3.30-10700 ng/L, 4.43-5440 ng/L, 0.0350-4.21 μg/kg, respectively. The intra-day and inter-day precisions of the spiked samples at the levels of 5.0, 10, and 20 μg/L were 3.50%-6.00% and 4.18%-9.90%, respectively. A total of 1125 biological samples of urine, blood and hair were collected and screened. The results showed that 96.7% of the drug users were taking a single drug, while 3.3% were mixed drug users. The main types of drug of abuse were methamphetamine (75.8%), heroin (18.5%), ketamine (2.4%) and other drugs (3.3%), and 87.9% of the positive samples were from male users. Compared with the results of high-performance liquid chromatography triple quadrupole mass spectrometry, this method can be used to identify more types of drugs in one run and to conduct retrospective analysis.
Conclusion
The method established in the study is simple and sensitive and is well suited for the screening of common drugs and metabolites in biological samples.
Keywords: Liquid chromatography orbital trap mass spectrometry, Screening, Biological samples, Drugs
毒品是指国家规定管制的能够使人形成瘾癖的包含麻醉药品、镇定药物和精神活性物质等毒物。毒品通过作用于中枢神经系统,让吸食者产生强烈的快感,具有严重的致幻性和成瘾性[1-2]。在《吸毒成瘾认定办法》2017修订版中,成瘾认定须经血液、尿液和唾液等人体生物样本检测证明其体内含有毒品成分,同时把毛发中检测出毒品成分作为认定标准之一。这说明血液、唾液、毛发等生物检材中毒品的分析,在吸毒以及吸毒成瘾认定中发挥着重要的作用,其中毛发作为生物检材可以补充涉毒人员吸毒史的信息[3-4]。
生物检材中毒品及其代谢物的检测方法主要采用质谱检测,包括气相色谱质谱法[5-7]和液相色谱质谱法(liquid chromatography-mass spectrometry, LC-MS)[8-11],相关行业标准主要采用三重四极杆质谱、MRM模式进行分析,毒物的定性需要采用标准品逐一进行比对筛查,筛查效率较低,当遇到未纳入的毒品或新兴毒品时,容易导致筛查失败[12]。一些吸毒者为了追求更强烈的刺激、减少副作用以及出于经济考虑等原因,常常滥用多种毒品[13-14],若单纯采用靶向分析,可能会发生漏检,加之新型毒品不断涌现,标准品的制备滞后,毒品市场上未知的新型毒品与已知的常见毒品混杂,给毒品鉴定带来了挑战[15-16]。
目前,非靶向筛查分析已成为国内外化合物鉴定研究的发展趋势[17-19],MassBank、METLIN、mzCloud等高分辨二级质谱信息数据库的出现,以及多种计算机软件包的创建,为非靶向筛查中的应用提供了强大的技术支持。高分辨质谱是非靶向筛查最常用的技术,基于高分辨质谱的筛查,具有高精确度的质荷比(m/z)测定,可采用SCAN模式和特有的Full MS/dd-MS2数据模式,在没有标准品条件下对样品中的未知物进行识别分析,还可实现未纳入数据库的毒品和新兴毒品筛查,以及回顾性分析。基于此,本文以常用的生物检材为研究基质,建立34种常见毒品及其代谢物的液相色谱-四极杆串联Orbitrap高分辨质谱筛查方法,在完善色谱质谱信息的同时,对筛查识别标准进行了探讨,并将方法应用于涉毒人员的生物检材分析。
1. 材料与方法
1.1. 仪器与试剂
1.1.1. 仪器
UltiMate 3000超高效液相色谱仪(赛默飞,美国);Q-ExactiveTM Plus四极杆-静电场轨道阱高分辨质谱仪(赛默飞,美国);Milli-Q超纯水系统( Merck,德国):电阻率 18.2 MΩ∙cm;Vortex Genius 3型旋涡混合器(IKA,德国);CF-RX Ⅱ多用途离心机(Hitachi,日本);KQ-500DA数控型超声波清洗仪(昆山市超声仪器有限公司,中国);冷冻研磨仪( SPEX Sample Prep,美国)。
1.1.2. 试剂
1.0 mg/mL单乙酰吗啡(6-acetylmorphine)、吗啡(morphine)、可待因(ketamine)、甲基苯丙胺(methamphetamine)、苯丙胺(amphetamine)、3,4-亚甲双氧甲基苯丙胺(3,4-methylenedioxymethamphetamine, MDMA)、可卡因(cocaine)、氯胺酮(ketamine)、9-四氢大麻酚(delta-9-Tetrahydrocannabinol, THC)、哌替啶(meperidine)、硝西泮(nitrazepam)、地西泮(diazepam)、阿普唑仑(alprazolam)、劳拉西泮(lorazepam)、美沙酮(methadone)、氯氮平(clozapine)、海洛因(heroin)、氟硝西泮(flunitrazepam)、曲马多(tramadol)、芬太尼(fentanyl)、甲卡西酮(methcathinone)、麻黄碱(ephedrine)、艾司唑仑(estazolam)、苯巴比妥(phenobarbital)、巴比妥(barbital)、异戊巴比妥(amobarbital)、3,4-亚甲二氧基安非它明〔3,4-(Methylenedioxy)aniline, MDA〕、罂粟碱(papaverine)、麦角酸二乙基酰胺(lysergic acid diethylamide, LSD)、γ-羟基丁酸(γ-Hydroxybutyric acid)、苯甲酰爱康宁(benzoylecognine)、氯硝西泮(clonazepam)、咪达唑仑(midazolam)、咖啡因(caffeine)标准储备液(Cerilliant公司,美国)。标准应用液:将相应的标准储备溶液用甲醇稀释成质量浓度为0.010 mg/mL的标准应用液。
甲醇、乙腈(LC-MS级,Thermo Fisher Scientific公司,美国);乙酸铵(LC-MS级,Sigma-Aldrich公司,美国);丙酮、乙醚、二氯甲烷、乙酸乙酯(分析纯,天津市科密欧化学试剂有限公司);盐酸、氢氧化钠(分析纯,成都科龙试剂有限公司)。
1.2. 采样与保存
采用抗凝真空采血管采集血液,采集后放入−80 ℃保存;尿样采集后放入塑料离心管,于−80 ℃保存;采集后脑枕部的发段用于分析,采集后用铝箔纸包好,放于纸质信封内, 室温干燥通风处保存。
1.3. 样品处理
取血液或尿液样品1.0 mL,用1 mol/L盐酸溶液调节pH至3~4,加入3.0 mL乙酸乙酯涡旋混合提取约2 min,4000 r/min离心2 min使之分层,转移出乙酸乙酯提取液;剩余检材用10% NaOH溶液调节pH至11~12,加入乙酸乙酯3.0 mL涡旋混合提取约2 min,离心使之分层,转移出乙酸乙酯提取液。合并取液,氮气吹干,残余物中加入200 μL甲醇-5 mmol/L乙酸铵溶液(50∶50,V/V)复溶,经0.22 μm有机系针头过滤器过滤后进样分析。
毛发样品依次用适量的水和丙酮振荡洗涤两次,晾干后剪成约1 mm段,置冷冻研磨仪中粉碎,称取毛发粉末约20 mg,加入甲醇400 μL,超声15 min,经0.22 μm有机系针头过滤器过滤后进样分析。
1.4. 色谱质谱条件
1.4.1. 色谱条件
色谱柱为接有Hypersil Gold PFP保护柱(2.1 mm×10 mm,3 µm,Thermo Fisher Scientific,美国)的Hypersil Gold PFP色谱柱(2.1 mm×100 mm,3 µm,Thermo Fisher Scientific,美国);流动相由甲醇(A)和5 mmol/L乙酸铵溶液(B)组成,梯度洗脱程序如下:0~0.5 min,5% A;0.5~10 min,5%~95% A;用95% A保持5 min;流速400 μL/min;进样量5 μL。自动进样器和色谱柱分别保持在6 ℃和40 ℃。
1.4.2. 质谱条件
电喷雾电离源(electrospray ionization, ESI),正负离子交替模式,参数设置如下:鞘气流速:45 a.u.,辅助气流速:15 a.u.,吹扫气流速:0 a.u.,离子透镜电压频率:55 ,喷雾电压:3 kV,毛细管温度和辅助气热源温度:250 ℃。采用Xcalibur 4.0软件分别对仪器和数据进行控制和采集,利用TraceFinder 3.3软件进行识别。
实验采用Full MS/dd-MS2模式对数据进行采集。包含列表设置为“开”,以确保对目标分析物的dd-MS2采集优先于样品基质。Full MS扫描模式参数设置如下:扫描范围:m/z 100~500,分辨率:70 000, 自动增益控制目标(AGC target):3×106,最大注入时间:100 ms。dd-MS2扫描模式参数设置如下:分辨率:17 500,AGC target:1×105,最大注入时间:50 ms,循环计数:10,TopN:10,隔离窗口:m/z 1.4。强度阈值:5×103,峰值触发:0.5~10 s,动态排除:10 s。
1.4.3. 待测物识别
识别参数包括前体离子和产物离子、同位素模式匹配分数、保留时间。识别标准:m/z的质量误差<5×10−6、强度阈值>5×103;产物离子(存在至少1个碎片离子,强度阈值>1 000、m/z的质量误差<5×10−6);同位素模式(拟合阈值>80%、质量误差<5×10−6、强度偏差<20%);保留时间误差<0.3 min。
2. 结果与讨论
2.1. 色谱质谱条件的确认
实验参考SF/Z JD0107005-2016[20]和SF/Z JD0107025-2018[21]方法,采用混合标准溶液,以甲醇和5 mmol/L乙酸铵溶液作为流动相,进行梯度洗脱,使得各待测毒品能得到有效分离,确定色谱条件见1.4.1。34种毒品及代谢物中有碱性和酸性化合物,因此实验采用ESI正负离子交替模式进行分析。待测毒品及代谢物在Full MS扫描模式下检测到离子[M+H]+和[M-H]−,分别选取该两种离子作为前体离子,再选定色谱条件分别对ESI源的参数进行了优化,优化后的ESI参数见1.4.2。采用阶形归一化碰撞能量(NCE)20、30、40 对前体离子进行碰撞以获得不同碰撞能量下的混合产物离子。
2.2. 样品前处理方法优化
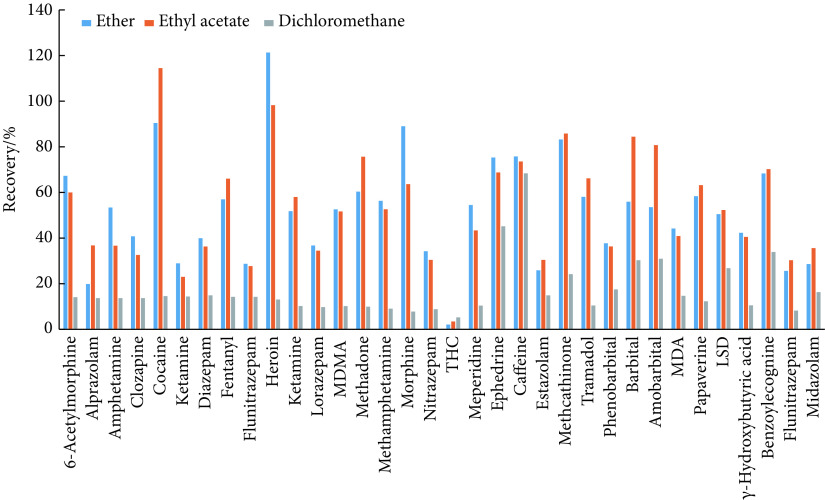
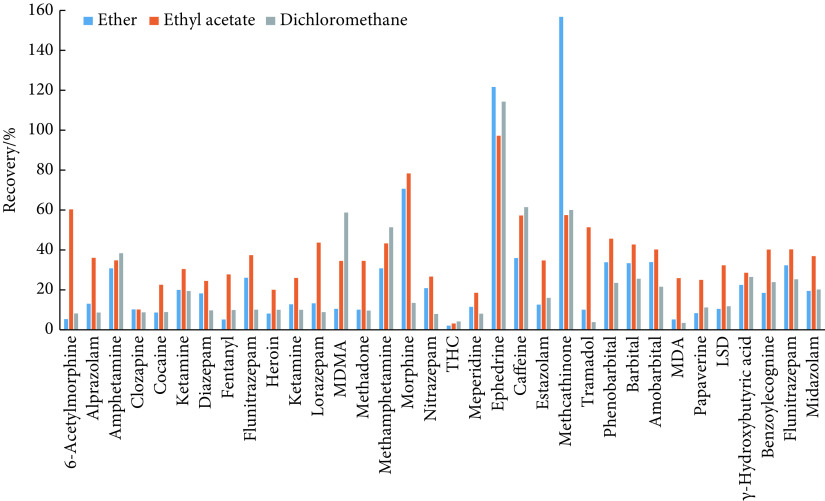
参考 SF/Z JD0107014-2015[22]、SF/Z JD0107005-2016[20]和SF/Z JD0107025-2018[21]方法,采用液液萃取在酸性和碱性条件下进行血样和尿样萃取净化,甲醇提取作为头发的样品前处理,为了避免氮吹步骤可能带来的污染和损失,省略了头发前处理中的氮吹步骤。在上述基础上,分别采用乙醚、乙酸乙酯和二氯甲烷对尿液和血液的液液萃取剂进行了优化,结果见图1和图2。结果可见,采用乙酸乙酯萃取的样品回收率更好,因此实验选择乙酸乙酯进行血样和尿样的萃取净化。其余步骤参考上述行业标准。
图 1.
Recoveries from urine samples purified with different extraction reagents
不同萃取剂进行尿样净化的回收率
MDMA: 3,4-Methylenedioxymethamphetamine; THC: Delta-9-Tetrahydrocannabinol; MDA: 3,4-(Methylenedioxy) aniline; LSD: Lysergic acid diethylamide.
图 2.
Recoveries from blood samples purified with different extraction reagents
不同萃取剂进行血样净化的回收率
MDMA, THC, MDA, LSD: The same denotations as those in Fig 1.
对萃取溶剂乙酸乙酯的加入量进行了考察,调节pH值后,加入1~5 mL乙酸乙酯进行萃取、浓缩和复溶。结果发现,当乙酸乙酯加入量大于2 mL,各毒品可提取完全。因此实验采用3 mL乙酸乙酯进行提取。
2.3. 识别标准的设置
各待测毒品的识别参数见表1。采用上述优化好的色谱质谱和样品前处理条件,分别对低浓度和高浓度加标样品进行分析,各待测毒品前体离子和碎片离子的质量误差均小于5×10−6,同位素模式分数变化为92%~99%,保留时间的波动在±0.25 min范围内。
表 1. Identification information of 34 kinds of common drugs and metabolites.
34种常见毒品及代谢物识别信息
| Chemical name | Molecular formula | Precursor ion
(m/z) |
Retention time/min | Daughter ions
(m/z) |
| MDMA, THC, MDA, LSD: The same denotations as those in Fig 1. | ||||
| 6-Acetylmorphine | C19H21NO4 | 328.154 33 | 7.20 | 211.074 74, 165.069 88, 193.064 06 |
| Morphine | C17H19NO3 | 286.143 77 | 5.33 | 201.090 85, 165.069 88, 153.069 88, 191.085 53, 91.054 63 |
| Heroin | C21H23NO5 | 370.16490 | 8.48 | 211.075 40, 268.133 21, 328.154 33 |
| Amphetamine | C9H13N | 136.112 08 | 6.66 | 91.054 33, 109.010 93, 65.039 34 |
| Methamphetamine | C10H15N | 150.127 73 | 7.29 | 91.054 23, 119.085 53, 136.111 53 |
| Ketamine | C13H16ClNO | 238.09877 | 7.54 | 125.015 30, 179.061 94, 207.057 12 |
| Cocaine | C17H21NO4 | 304.154 33 | 9.40 | 182.117 56, 82.065 13, 105.033 86 |
| MDMA | C11H15NO2 | 194.117 56 | 8.09 | 163.075 36, 135.044 06, 133.064 79, 222.115 10 |
| THC | C21H30O2 | 315.231 86 | 10.04 | 193.121 81, 93.069 88, 135.116 52, 123.043 98 |
| Meperidine | C15H21NO2 | 248.164 51 | 9.46 | 174.127 61, 220.133 21, 70.065 13 |
| Codeine | C18H21NO3 | 300.158 81 | 6.93 | 199.075 36, 65.069 88, 215.106 66 |
| Nitrazepam | C15H11N3O3 | 282.087 32 | 7.35 | 236.094 40, 268.084 20, 207.091 28, 180.080 40 |
| Diazepam | C16H13ClN2O | 285.078 92 | 8.18 | 154.041 80, 193.088 60, 257.083 40, 233.132 48 |
| Alprazolam | C17H13ClN4 | 309.090 15 | 7.80 | 281.071 43, 205.076 02, 274.121 30 |
| Lorazepam | C15H10Cl2N2O2 | 321.019 21 | 7.28 | 275.013 73, 229.052 70 |
| Methadone | C21H27NO | 310.216 54 | 13.98 | 265.158 57, 105.033 49 |
| Clozapine | C18H19ClN4 | 327.137 10 | 9.74 | 270.079 25, 192.068 00 |
| Flunitrazepam | C16H12FN3O3 | 314.093 55 | 7.68 | 268.100 52, 239.097 90 |
| Tramadol | C16H25NO2 | 264.195 43 | 9.30 | 58.065 89 |
| Fentanyl | C22H28N2O | 337.227 44 | 9.95 | 188.143 38, 105.069 88 |
| Methcathinone | C10H13NO | 164.069 90 | 7.04 | 146.096 43, 131.072 95, 105.069 88 |
| Ephedrine | C10H15NO | 166.122 64 | 6.25 | 148.112 80, 117.069 88, 133.088 60, 115.054 40, 91.054 67 |
| Estazolam | C16H11ClN4 | 295.074 50 | 7.40 | 267.055 39, 205.075 61, 138.010 27 |
| Phenobarbital | C12H12N2O3 | 231.077 52 | 4.84 | 184.950 09, 188.070 61, 85.003 25, 144.081 83 |
| Barbital | C8H12N2O3 | 183.076 41 | 3.23 | 140.071 64, 94.915 50 |
| Amobarbital | C11H18N2O3 | 225.124 47 | 6.36 | 182.118 58, 136.112 85 |
| MDA | C11H17NO | 180.101 68 | 8.05 | 163.075 21, 135.044 06, 133.064 79, 105.070 24 |
| Papaverine | C20H21NO4 | 340.15433 | 8.41 | 202.085 72, 324.121 95, 171.067 87 |
| LSD | C20H25N3O | 324.207 00 | 7.21 | 223.123 00, 180.080 80, 153.069 80, 281.164 80 |
| γ-Hydroxybutyric acid | C4H8O3 | 103.040 07 | 9.06 | 51.023 72, 95.049 45 |
| Benzoylecognine | C16H19NO4 | 290.138 70 | 8.52 | 168.10190, 105.03350 |
| Clonazepam | C15H10ClN3O3 | 316.04830 | 7.15 | 214.041 80, 169.064 50, 152.061 70, 241.052 70 |
| Midazolam | C18H13ClFN3 | 326.085 48 | 8.65 | 291.115 91, 244.032 04, 209.063 23 |
| Caffeine | C8H10N4O2 | 195.087 65 | 4.63 | 138.066 36, 110.071 27 |
根据KELLMANN等[23]的研究,质量误差为5×10−6时即可提供很高的选择性并降低假阳性,且加标样品中目标待测物的质量误差均低于5×10−6,因此实验将前体离子和产物离子的质量误差窗口设为<5×10−6。同时,实验将前体离子质谱峰的强度阈值设为5×103、信噪比(S/N)阈值设为5,能够排除大部分噪声干扰。样品基质干扰和仪器稳定性是导致保留时间微小飘移的主要原因,实验将保留时间误差窗口设为±0.3 min。当允许质量误差设为5×10−6、允许强度偏差设为20%时,设定同位素匹配分数标准为软件默认值90%。上述识别标准亦可作为新兴毒品非靶向筛查的参考。
2.4. 方法指标考察
筛查主要为定性分析,用于吸毒状态或吸毒成瘾认定,检出限须达到SF/Z JD0107014-2015[22]、SF/Z JD0107005-2016[20]和SF/Z JD0107025-2018[21] 标准方法规定的要求。采用空白样品进行测定,以三倍S/N计算方法检出限(method detection limit, MDL),结果见表2,筛查灵敏度能满足毒品分析要求。以取自志愿者的5份混合样为基底,通过向样品加入一定量的待测毒品标准配制出5.0、10、20 μg/L三种水平的加标样品,每个加标样品均同一天重复测定6次以考察方法的日内精密度,并连续测定5 d以考察方法的日间精密度,精密度以各毒品响应值的相对标准偏差(relative standard deviations, RSDs)评价。日内精密度为3.50%~6.00%,日间精密度为4.18%~9.90%。
表 2. MDL of 34 kinds of common drugs and metabolites.
34种常见毒品及代谢物的MDL
| Chemical name | Urine/(ng/L) | Blood/(ng/L) | Hair/(μg/kg) |
| MDMA, THC, MDA, LSD: The same denotations as those in Fig 1. | |||
| 6-Acetylmorphine | 3.41×102 | 4.26×102 | 0.0686 |
| Morphine | 7.25×102 | 9.70×102 | 0.0723 |
| Heroin | 51.60 | 2.52×102 | 0.1360 |
| Amphetamine | 1.00×102 | 1.53×102 | 0.8880 |
| Methamphetamine | 15.50 | 2.48×102 | 0.1450 |
| Ketamine | 9.70 | 21.70 | 0.0596 |
| Cocaine | 9.50 | 48.30 | 0.1110 |
| MDMA | 10.90 | 24.90 | 0.1160 |
| THC | 84.10 | 2.21×102 | 1.1700 |
| Meperidine | 10.30 | 12.50 | 0.0368 |
| Codeine | 17.10 | 37.40 | 0.0887 |
| Nitrazepam | 67.70 | 21.50 | 0.0923 |
| Diazepam | 16.90 | 25.00 | 0.0577 |
| Alprazolam | 12.10 | 12.40 | 0.0490 |
| Lorazepam | 1.08×102 | 66.30 | 0.3150 |
| Methadone | 1.95 | 9.70 | 0.0573 |
| Clozapine | 31.30 | 31.30 | 0.0449 |
| Flunitrazepam | 22.60 | 7.170 | 0.0469 |
| Tramadol | 4.56 | 5.25 | 0.0557 |
| Fentanyl | 4.43 | 3.30 | 0.0350 |
| Methcathinone | 2.78×103 | 2.32×103 | 3.9800 |
| Ephedrine | 4.40×102 | 2.89×102 | 0.8110 |
| Estazolam | 15.60 | 13.60 | 0.0455 |
| Phenobarbital | 4.16×102 | 3.31×102 | 2.0900 |
| Barbital | 5.44×103 | 1.07×104 | 4.2100 |
| Amobarbital | 99.60 | 1.99×102 | 0.9440 |
| MDA | 13.80 | 19.20 | 0.1230 |
| Papaverine | 10.20 | 25.80 | 0.0576 |
| LSD | 38.20 | 29.00 | 0.1060 |
| γ-Hydroxybutyric acid | 1.16×103 | 8.10×102 | 3.0300 |
| Benzoylecognine | 44.00 | 1.65×102 | 0.4320 |
| Clonazepam | 27.10 | 8.610 | 0.0698 |
| Midazolam | 13.50 | 11.40 | 0.0886 |
| Caffeine | 73.50 | 23.50 | 0.1530 |
2.5. 实际样品的分析
于2019年期间,采集了四川省涉毒人群尿样、血样和发样共1 125份,采用上述建立的方法进行了毒品筛查。根据检测结果,96.7%的吸毒者吸食单一毒品,3.3%吸毒者吸食混合毒品。吸食混合毒品中,甲基苯丙胺(冰毒)和海洛因占比最大(70%)。
吸食毒品种类从高到低依次为甲基苯丙胺(75.8%)、海洛因(18.5%)、氯胺酮(2.4%),零星可见MDMA、美沙酮、THC、氯硝西泮、麻黄碱、可待因、曲马多阳性个例。甲基苯丙胺、海洛因代谢物、氯胺酮的质谱图见图3。男性和女性阳性检出样本分别占总样品数的87.9%和12.1%,一定程度上说明吸毒人群主要为男性。
图 3.
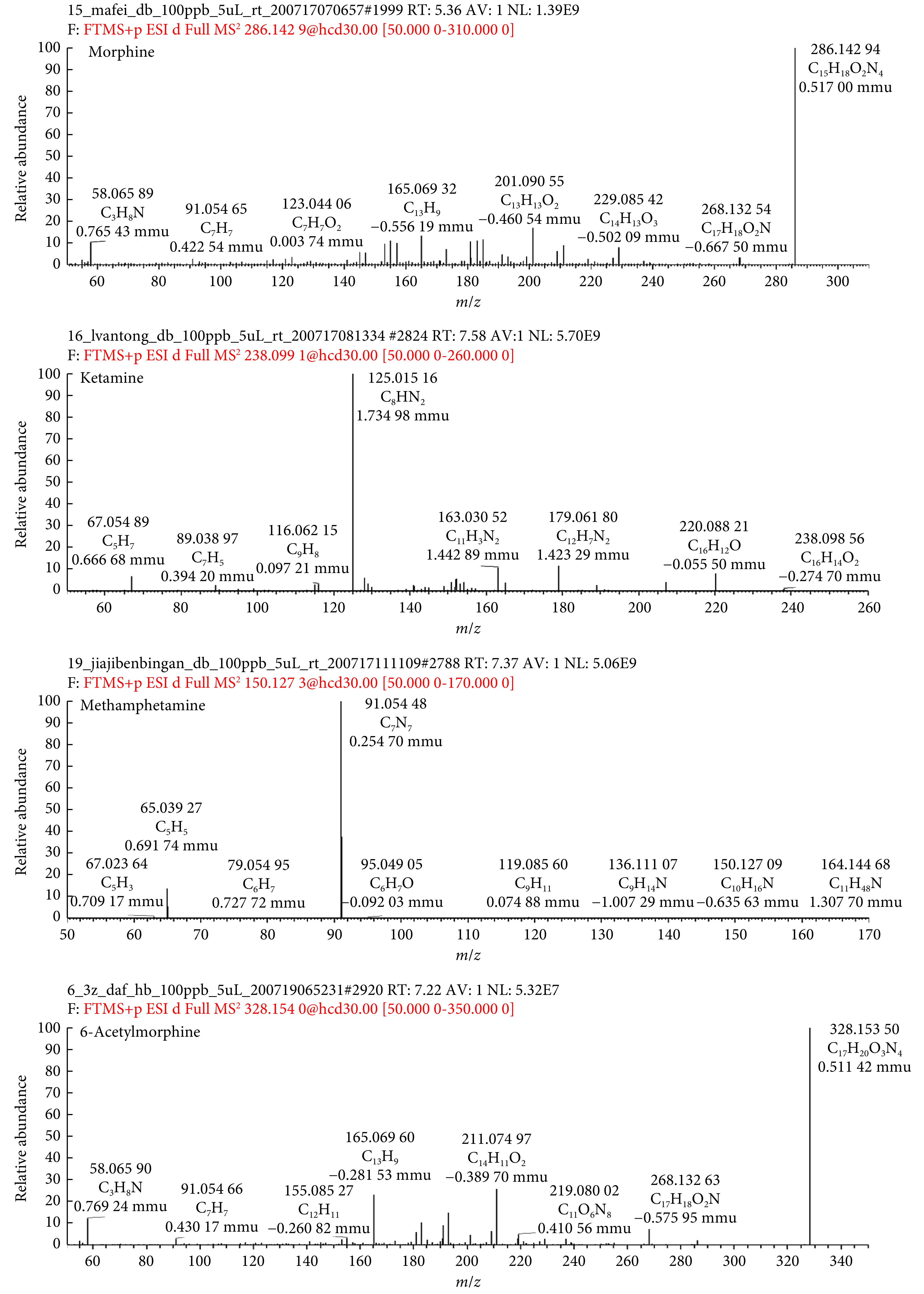
Mass spectrums of methamphetamine, heroin metabolites, and ketamine
甲基苯丙胺、海洛因代谢物、氯胺酮的质谱图
3. 结论
本研究采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱技术,建立了生物检材中常见毒品及代谢物的筛查方法,前处理采用液液萃取提取目标化合物,操作简便易行。通过建立数据库和识别标准,可实现无需标准品对常见毒品及代谢物同时进行定性筛查,亦可通过高分辨质谱特有的Full MS/dd-MS2数据采集模式进行回顾性分析。数据库信息可直接用于其他实验室的毒品非靶向筛查,但受限于轨道阱质谱仪配置价格昂贵,故不能广泛开展这一筛查技术。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科技厅重点研发项目(No. 2020YFS0056)资助
Contributor Information
觅 杨 (Mi YANG), Email: 2067355116@qq.com.
晓莉 邹 (Xiao-li ZOU), Email: zouxl_1113@163.com.
References
- 1.马艳君, 邱云亮 苯丙胺类毒品的神经毒性研究进展. 毒理学杂志. 2017;31(4):308–313. [Google Scholar]
- 2.皮明山, 吴钰祥, 茹琴, 等 常见毒品对大脑神经元损伤的研究进展. 神经损伤与功能重建. 2014;9(1):63–67. [Google Scholar]
- 3.SHIMA N, SASAKI K, KAMATA T, et al Hair testing for drugs in the field of forensics. Yakugaku Zasshi. 2019;139(5):705–713. doi: 10.1248/yakushi.18-00166-4. [DOI] [PubMed] [Google Scholar]
- 4.张素静, 刘晓云, 卓先义 头发毒品检测作为戒毒监控方法的建议. 中国药物依赖性杂志. 2017;26(4):267–269. [Google Scholar]
- 5.BRETTELL T A, LUM B J Analysis of drugs of abuse by gas chromatography-mass spectrometry (GC-MS) Methods Mol Biol. 2018;1810:29–42. doi: 10.1007/978-1-4939-8579-1_3. [DOI] [PubMed] [Google Scholar]
- 6.彭山珊. 尿液中常见毒品GC-MS定性分析结果判定方法研究. 北京: 中国人民公安大学, 2020.
- 7.XU F, LIU L Simultaneous determination of free methamphetamine, pethidine, ketamine and tramadol in urine by dispersive liquid-liquid microextraction combined with GC-MS. Forensic Sci Res. 2017;4(2):188–194. doi: 10.1080/20961790.2017.1377386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.SHIN Y, KONG T Y, CHEONG J C, et al. Simultaneous determination of 75 abuse drugs including amphetamines, benzodiazepines, cocaine, opioids, piperazines, zolpidem and metabolites in human hair samples using liquid chromatography-tandem mass spectrometry. Biomed Chromatogr, 2019, 33(9): e4600[2021-03-14]. https://doi.org/10.1002/bmc.4600.
- 9.KONG T Y, KIM J H, KIM J Y, et al Rapid analysis of drugs of abuse and their metabolites in human urine using dilute and shoot liquid chromatography-tandem mass spectrometry. Arch Pharm Res. 2017;40(2):180–196. doi: 10.1007/s12272-016-0862-1. [DOI] [PubMed] [Google Scholar]
- 10.FRANCO DE OLIVEIRA S C W S E, ZUCOLOTO A D, DE OLIVEIRA C D R, et al A fast and simple approach for the quantification of 40 illicit drugs, medicines, and pesticides in blood and urine samples by UHPLC-MS/MS. J Mass Spectrom. 2019;54(7):600–611. doi: 10.1002/jms.4369. [DOI] [PubMed] [Google Scholar]
- 11.MUSILE G, MAZZOLA M, SHESTAKOVA K, et al. A simple and robust method for broad range screening of hair samples for drugs of abuse using a high-throughput UHPLC-Ion Trap MS instrument. J Chromatogr B Analyt Technol Biomed Life Sci, 2020, 1152: 122263[2021-03-14]. https://doi.org/10.1016/j.jchromb.2020.122263.
- 12.TAMAMA K Advances in drugs of abuse testing. Clin Chim Acta. 2021;514:40–47. doi: 10.1016/j.cca.2020.12.010. [DOI] [PubMed] [Google Scholar]
- 13.陈建华, 张鹏, 曲一泓, 等 服用新型混合毒品中毒死亡1例. 法医学杂志. 2018;34(6):617–618. doi: 10.12116/j.issn.1004-5619.2018.06.008. [DOI] [Google Scholar]
- 14.ZHU B, MENG L, ZHENG K Inspection and analysis of mixed drugs recently seized in China. Forensic SciInt. 2014;242:e44–e47. doi: 10.1016/j.forsciint.2014.07.013. [DOI] [PubMed] [Google Scholar]
- 15.吕金峰. 新精神活性物质类新型毒品相关问题研究. 兰州: 甘肃政法大学, 2019.
- 16.LIU L, WHEELER S E, VENKATARAMANAN R, et al Newly emerging drugs of abuse and their detection methods: An ACLPS critical review. Am J ClinPathol. 2018;149(2):105–116. doi: 10.1093/ajcp/aqx138. [DOI] [PubMed] [Google Scholar]
- 17.WANG Y, LUO C, YANG M, et al. Target quantification and semi-target screening of halogenated carboxylic acids in drinking water using ultra-high performance liquid chromatography-quadrupole orbitrap high-resolution mass spectrometry. J Chromatogr A, 2020, 1614: 460710[2021-10-20]. https://doi.org/10.1016/j.chroma.2019.460710.
- 18.KNOLHOFF A M, CROLEY T R Non-targeted screening approaches for contaminants and adulterants in food using liquid chromatography hyphenated to high resolution mass spectrometry. J Chromatogr A. 2016;1428:86–96. doi: 10.1016/j.chroma.2015.08.059. [DOI] [PubMed] [Google Scholar]
- 19.KIND T, TSUGAWA H, CAJKA T, et al Identification of small molecules using accurate mass MS/MS search. Mass Spectrom Rev. 2018;37(4):513–532. doi: 10.1002/mas.21535. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.中华人民共和国司法部司法鉴定管理局. 血液、尿液中 238 种毒(药)物的检测液相色谱-串联质谱法: SF/Z JD0107005-2016. [2016-09-22]. http://www.moj.gov.cn/pub/sfbgw/zwfw/zwfwbgxz/202101/1565870205956007711.pdf.
- 21.中华人民共和国司法部司法鉴定管理局. 毛发中 15 种毒品及代谢物的液相色谱-串联质谱检验方法: SF/Z JD0107025-2018. [2018-11-08]. http://www.moj.gov.cn/pub/sfbgw/zwfw/zwfwbgxz/202101/1565870933139062879.pdf.
- 22.中华人民共和国司法部司法鉴定管理局. 血液和尿液中 108 种毒(药)物的气相色谱-质谱检验方法: SF/Z JD0107014-2015. [2015-11-20]. http://www.moj.gov.cn/pub/sfbgw/zwfw/zwfwbgxz/202101/1565869778272044576.pdf.
- 23.KELLMANN M, MUENSTER H, ZOMER P, et al Full scan MS in comprehensive qualitative and quantitative residue analysis in food and feed matrices: How much resolving power is required? J Am Soc Mass Spectr. 2009;20(8):1464–1476. [Google Scholar]