Abstract
目的
对一个血小板减少伴桡骨缺失(TAR)综合征家系进行遗传学病因分析及产前诊断。
方法
采用染色体微阵列分析(CMA)、荧光定量聚合酶链反应(qPCR)和Sanger测序对一个TAR综合征家系进行基因突变分析。提取先证者、父母及姐姐4名家系成员的基因组DNA,行CMA、qPCR和Sanger测序,明确致病突变后对胎儿行产前诊断。
结果
先证者1q21.1存在378 kb杂合缺失,内含RBM8A等基因,RBM8A基因还存在c.-21G>A突变,上述突变分别遗传自父母。产前羊水CMA显示胎儿1q21.1存在378 kb微缺失,基因检测未见RBM8A基因c.-21G>A突变。
结论
RBM8A基因1q21.1杂合性缺失和c.-21G>A是本例TAR综合征家系的遗传学病因,为本家系的遗传咨询及产前诊断提供了依据。
Keywords: RBM8A基因 , 血小板减少伴桡骨缺失(TAR)综合征, 1q21.1微缺失
Abstract
Objective
To analyze the potential genetic cause of thrombocytopenia-absent radius (TAR) syndrome in a family and provide prenatal diagnosis for them.
Methods
Genetic mutation analysis of the sporadic family with TAR syndrome was performed with chromosome microarray analysis (CMA), quantitative polymerase chain reaction (qPCR) and Sanger sequencing. DNA samples were collected from 4 members of the family, including the proband, her parents and her sister. CMA, qPCR and Sanger sequencing were performed to determine the pathogenic mutation and prenatal diagnosis of the fetus was made accordingly.
Results
The proband had a 378 kb genomic heterozygous deletion in 1q21.1, which contained RBM8A and other genes. c.-21G>A mutation was also found in theRBM8A of the proband. The above-mentioned microdeletion and mutation were inherited from the mother and father, respectively. Prenatal CMA suggested that the fetus carried a 378 kb microdeletion in 1q21.1, and DNA testing did not find c.-21G>A mutation.
Conclusion
The heterozygous deletion in 1q21.1 and RBM8A: c.-21G>A is considered to be the genetic etiology of TAR syndrome in the family. The study provides information for subsequent family genetic counseling and prenatal diagnosis.
Keywords: RBM8A , Thrombocytopenia-absent radius (TAR) syndrome, 1q21.1 microdeletion
先天性桡骨缺失畸形较为罕见,发病率仅1/100 000[1],常见于染色体异常及一些遗传综合征,如:18-三体综合征、21-三体综合征、Holt-Oram综合征、VACTERL畸形、血小板减少伴桡骨缺失综合征(thrombocytopenia-absent radius syndrome,简称TAR综合征)等。其中TAR综合征的桡骨缺失畸形独具特征,表现为:双侧桡骨缺失,拇指内收屈曲畸形[2],常伴尺骨短缩畸形、肱骨发育不全等。TAR综合征的血小板数量一般低于50×109L-1(正常范围150×109~350×109L−1),导致的出血常发生在1~2岁的婴幼儿,颅内出血是主要的死亡原因。随着年龄增长,血小板数量可逐渐上升甚至接近正常水平,出血的风险随之下降[3]。TAR综合征的致病基因长期不明,直到2012年10月,ALBERS等[4]对55名TAR综合征患者进行遗传学检测,明确了RBM8A基因是TAR综合征的致病基因,并发现由1q21.1微缺失(包含RBM8A基因)和RBM8A基因5'UTR区(c.-21G>A)或内含子(c.67+32G>C)构成的复合杂合突变是热点突变,RBM8A功能缺失性突变使mRNA转录水平降低,编码产物Y14蛋白下调,从而导致TAR综合征的发生。
TAR综合征在世界不同地区均有报道,主要发生在欧洲[4-5]、美国[2]、非洲[6]。我国只有数例[3, 7-8]的个案报道,尚无基因诊断的报道。本研究收集了一个TAR综合征家系基因检测结果资料,明确了其致病突变,完成了产前诊断。
1. 对象与方法
1.1. 对象
咨询者,女,37岁,G4P2,孕19周,因不良孕产史2015年10月来我院遗传咨询。咨询者及其丈夫均体健,未见明显相关表型。第一胎,女,出生后发现双侧前臂缺失,双足并趾,出生后8 d去世,由于时间久远,未行遗传学检测,缺乏基因诊断;第二胎,女,7岁,健康,未见明显相关表型;第三胎,2012年7月孕中期三维B超发现胎儿双侧桡骨缺失,未见其他超声异常表型。孕妇与家属商量后引产,引产时留取羊水样本,行染色体芯片检测,提示存在1q21.1微缺失。
1.2. 方法
1.2.1. 遗传咨询
鉴于夫妇有二次表型相同的不良孕产史,再发风险高,建议明确先证者遗传学病因,并在此基础上行产前诊断。
本研究获得了浙江大学医学院附属妇产科医院伦理委员会审批(审批号:IRB-20200130-R)通过,家系成员均签署了知情同意书。
1.2.2. 样本采集
EDTA抗凝管采集咨询者及其丈夫、女儿(第二胎)外周血各5 mL。在超声介导下行羊膜腔穿刺术[9],采集孕妇羊水10 mL。
1.2.3. DNA提取
采用QIAGEN公司QIAamp DNA Blood Mini Kit(货号51106)与QIAamp DNA Mini Kit(货号51304),按说明书操作,提取外周血与羊水样本基因组DNA,Nanodrop测定浓度,4 ℃保存备用。
1.2.4. 染色体微阵列分析(CMA)
采用美国Affymetrix公司CytoScan HD芯片分别对第三胎和第四胎羊水样本提取的DNA行全基因组拷贝数变异(CNV)分析,查阅相关国际公共数据库,如DGV、DECIPHER、OMIM数据库对检测结果进行致病性分析。
1.2.5. 实时荧光定量PCR(qPCR)
针对RBM8A基因设计3对特异引物(表1),同时针对内参基因β-globin设计引物,引物由上海生工生物工程股份有限公司合成。对先证者及其家系成员进行同组qPCR,4复孔平行实验,采用2-ΔΔCt相对定量法分析家系成员目标基因相对拷贝数(RCN),实际拷贝数为RCN的2倍。
表 1. Primer sequences and PCR product size.
引物序列及扩增产物大小
| Gene | Primer sequence (5′-3′) | Product size |
| RBM8A-1F | TGCGATCTGTTCAAGATGGCCA | 408 bp |
| RBM8A-1R | GAATCTCTAATCCACCCAAGACC | |
| RBM8A-q1F | TCGGTCGTAAGGATGGGAATC | 106 bp |
| RBM8A-q1R | CCTCCAGTCTTAGTGCCTTCC | |
| RBM8A-q2F | GCTTTCCAGTAATGGAGATTGAGTC | 93 bp |
| RBM8A-q2R | ACTTTCCCAAATGCCTTGTATCTAG | |
| RBM8A-q3F | CTAGTACTCAGGTTCAGATGCTC | 128 bp |
| RBM8A-q3R | TCTGAGTGCAGTGGAGAGACAC | |
| β-globin-F | ACACAACTGTGTTCACTAGC | 110 bp |
| β-globin-R | CAACTTCATCCACGTTCACC |
1.2.6. RBM8A基因突变位点检测
针对c.-21G>A与c.67+32G>C设计引物(表1),进行PCR扩增,Sanger测序。RBM8A基因采用NM_005105.4转录本。引物由上海生工生物工程股份有限公司合成。PCR反应试剂:康为世纪公司2×Goldstar Best Master Mix (Dye)(货号CW0656)。反应体系:2×扩增缓冲液15 μL,上下游引物(20 μmol/L)各0.6 μL,DNA模板约60 ng,ddH2O补足至30 μL。反应条件:95 ℃10 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min;16 ℃恒温。PCR产物送上海华大基因科技有限公司测序。
2. 结果
2.1. 致病基因突变筛查结果
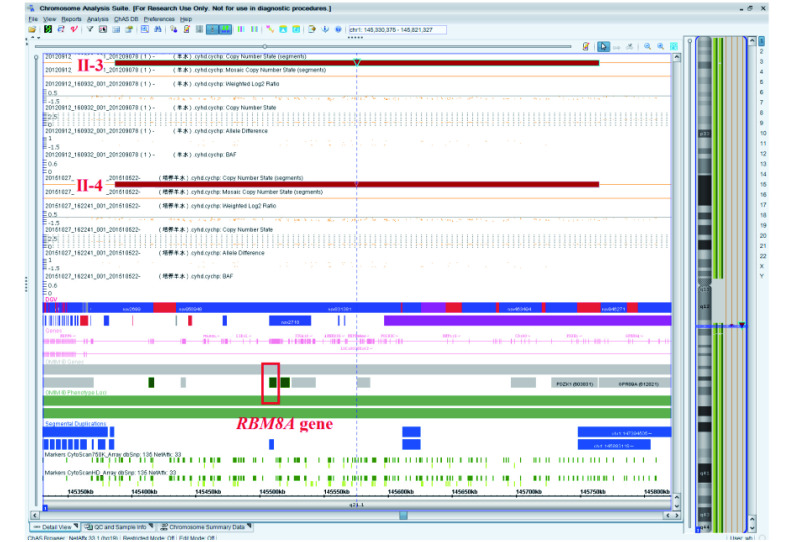
先证者(第三胎,Ⅱ-3)行CMA,结果(图1)显示先证者1q21.1存在378 kb微缺失(arr[GRCh37]1q21.1(145,387,023-145,764,679)x1)。该缺失区段包含RBM8A等3个基因。其中RBM8A基因为TAR综合征的致病基因,其表型包括先天性增殖障碍性血小板减少和两侧桡骨缺失,与本家系先证者的超声影像特征及第一胎出生后表型特征一致。针对RBM8A基因,行qPCR验证显示(图2)先证者(Ⅱ-3)RCN为0.5,提示存在1q21.1微缺失,与CMA结果一致。
图 1.
CMA results of the proband (Ⅱ-3) and the fetus (Ⅱ-4)
先证者(Ⅱ-3)与第四胎(Ⅱ-4) CMA结果
图 2.
qPCR results of RBM8A of the family members
本家系成员RBM8A基因qPCR的检测结果
Ⅰ-1: The proband’s father, RCN=0.5; Ⅰ-2: The proband’s mother, RCN=1; Ⅱ-2: The proband’s sister, RCN=1; Ⅱ-3: The proband, RCN=0.5. q1, q2, q3 represent the three detection sites respectively.
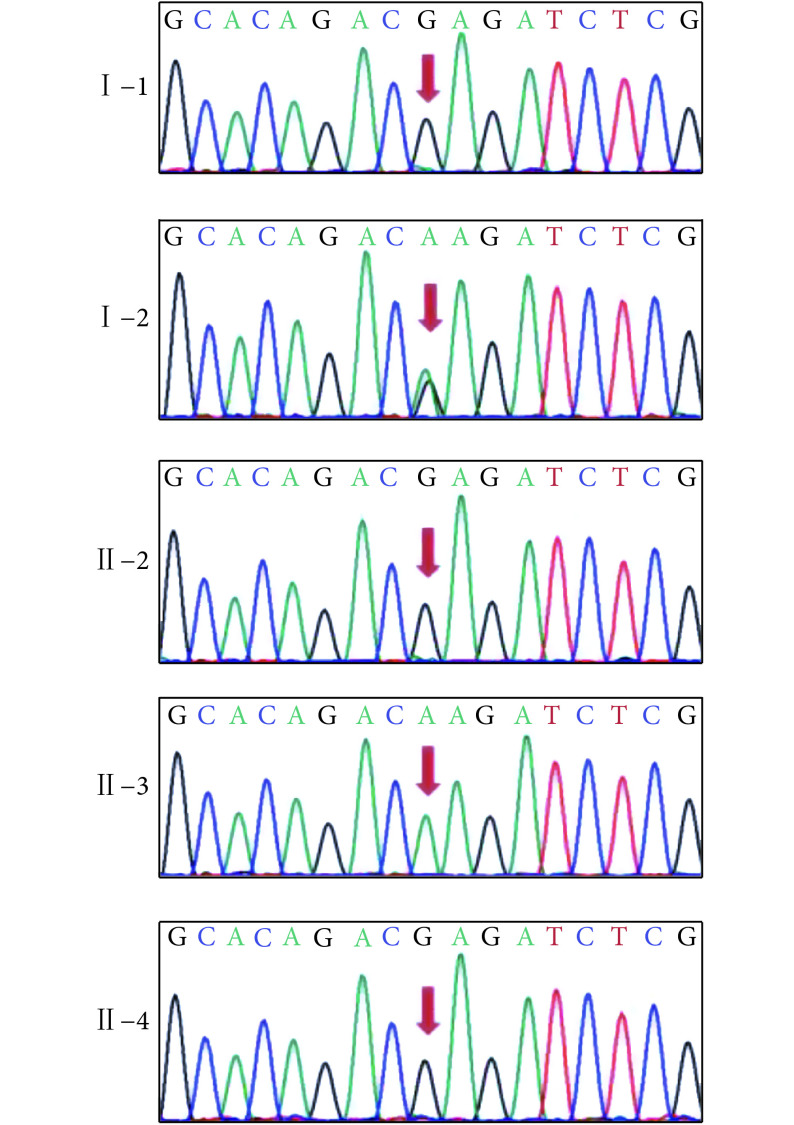
文献报道TAR综合征多由于1q21.1微缺失和两种突变(c.-21G>A与c.67+32G>C)之一复合杂合引起[4]。对先证者进行已知突变位点筛查,结果(图3)提示先证者(Ⅱ-3)存在c.-21G>A突变(5'UTR SNP c.-21G>A),未检出c.67+32G>C突变(Intronic SNP c.67+32G>C)。
图 3.
Sanger sequence of RBM8A: c.-21G>A
本家系RBM8A基因c.-21G>A突变 Sanger测序结果
2.2. 产前诊断
第四胎(Ⅱ-4)羊水样本DNA进行CMA,显示存在1q21.1微缺失,未检出c.-21G>A突变(图3),提示Ⅱ-4为1q21.1杂合性缺失携带者,发生TAR综合征相关表型风险小。胎儿超声扫描未发现桡骨缺失。胎儿出生后随访提示孩子健康,未发现相关表型。基因诊断结果与胎儿表型一致。
2.3. 家系分析
咨询者(Ⅰ-2)存在c.-21G>A突变,未检出1q21.1微缺失;丈夫(Ⅰ-1)存在1q21.1微缺失,未检测出c.-21G>A突变。第二胎(Ⅱ-2)未检出1q21.1微缺失和c.-21G>A突变。先证者存在1q21.1微缺失和c.-21G>A突变分别遗传自父母,符合常染色体隐性遗传病的遗传特征(图4)。
图 4.
Pedigree of the proband with TAR syndrome
TAR综合征患者的家系图与检测结果
3. 讨论
TAR综合征是一种罕见的常染色体隐性遗传性疾病。以血小板数量减少合并桡骨缺失,拇指内收屈曲畸形,伴或不伴有其他骨骼异常(如肱骨、膝关节或髋关节等)缺失为特点。在1959年首先由GROSS和SHAW等提出,在1969年由JUDITH HALL定义。血小板减少通常在出生后的最初几年出现出血症状,随着年龄的增长,发生率逐渐下降。需与婴儿时期各种伴有血小板减少疾病相鉴别,尤其是Fanconi贫血[2],两者均为遗传性疾病,发病早。TAR综合征患者必有桡骨缺失,骨髓增生活跃,外周血白细胞大多升高,少数白细胞正常范围。除骨骼异常和血小板减少外,也可合并心脏异常(10%)、肾脏异常(7%)[10],20%的病例出现与牛奶不耐受有关的血性腹泻或肠炎[10]。Fanconi贫血则表现为骨髓增生不良,全血细胞减少,血小板减少呈进行性加重,桡骨缺失并非诊断必备条件。
2007年KLOPOCKI等[11],通过对30例TAR综合征患者和他们的家庭成员应用高分辨率微阵列为基础的比较基因组杂交(aCGH)技术,确定了TAR综合征与1q21.1的微缺失有关。他同时发现仅存在一个等位基因的微缺失不足以引起表型异常,猜测TAR综合征患者可能需要同时存在一个等位基因缺失和另一等位基因点突变或微缺失。2012年ALBERS等[4]在55例TAR综合征病例中证实51例存在1q21.1微缺失,其中39例同时存在RBM8A基因的5′UTR突变c.-21G>A,12例同时存在RBM8A基因的第一个内含子突变c.67+32G>C,另2例未见微缺失,但存在功能缺失性突变(1例无义突变与1例移码突变),且患者同时存在5′UTR突变c.-21G>A,从而明确了TAR综合征由RBM8A基因功能缺失性突变与非编码SNP突变导致。
RBM8A基因编码外显子连接复合物(EJC)亚基Y14[12]。Y14主要调节细胞功能,例如核转录和特定转录物的亚细胞定位,翻译增强,无义介导的mRNA衰变(NMD)和剪接。在小鼠肢体形成初期,调节RBM8A基因的转录因子存在瞬时表达,从而解释了TAR综合征患者的骨骼异常。在斑马鱼中,降低RBM8A基因的表达,则会导致死亡,说明EJC在脊椎动物胚胎发育中起着重要作用。
随后,又有多名TAR综合征患者检出了RBM8A基因突变,迄今已有100例报道,均符合功能缺失性突变与非编码SNP复合杂合遗传模式,其中微缺失与c.-21G>A复合杂合突变70例[4, 13-19],微缺失与c.67+32G>C复合杂合突变27例[4, 17, 20],无义突变与c.-21G>A 复合杂合突变2例[4, 16],移码突变与c.-21G>A 复合杂合突变1例[4]。
值得注意的是,c.-21G>A与c.67+32G>C突变的等位基因频率较高,分别为1.945%与0.335%(TOPMED数据库),在常规的突变致病性分析过程中极易将其评估为非致病性突变。事实上,上述两种突变在TAR综合征患者中的等位基因频率分别为36.5%(73/200)与13.5%(27/200),显著高于其在普通人群中的等位基因频率,提示其致病性。这启示我们在分析突变致病性时不能只考虑一般规律,也要结合特定疾病的特质,如其突变谱、致病机制以及文献报道的特殊情况等综合考量。
此外,虽然TAR患者均有桡骨缺失伴血小板减少的临床表现,但MANUKJAN等[17]发现1q21.1微缺失与c.-21G>A复合杂合的患者血小板数量明显低于1q21.1微缺失与c.67+32G>C复合杂合的患者,提示不同的调控SNP可能对血小板减少程度的影响不同。
本研究报道一个桡骨缺失家系咨询者胎儿(先证者)超声提示存在特异性骨骼异常,引产后检测发现其存在1q21.1微缺失与RBM8A: c.-21G>A复合杂合突变。针对5′UTR SNP c.-21G>A突变查阅数据库,先证者基因型和表型基本符合(PP4);突变与疾病在家系中共分离(PP1);c.-21G>A突变的等位基因频率较高,为1.945%(TOPMED数据库),HGMD数据库(2020.2)推测该突变为疾病相关的多态性;有报道在多名患者中检出,提示该突变会影响RBM8A基因功能[4](PS3)。Clinvar数据库推测其为致病或可能致病。根据ACMG指南(2015年),该突变可评级为“可能致病”,明确了其遗传学原因。咨询者第四胎经产前基因诊断确认其存在1q21.1微缺失,但未检出c.-21G>A突变,仅为缺失携带者;同时胎儿超声未发现桡骨缺失,出生后随访也未见相关临床表型,其基因型与表型一致,建议未来婚育时遗传咨询。此外,该对夫妻再生育时可选择单基因病胚胎植入前遗传学检测(PGT-M),降低妊娠患儿的风险。
综上所述,本研究明确了该家系的遗传学原因,为其产前基因诊断及PGT提供了分子基础。本家系是国内首个完成基因诊断,也是国内第一例完成产前基因诊断的TAR综合征家系。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
浙江省重点研发计划(No. 2019C02025)资助
Contributor Information
丽 丁 (Li DING), Email: wenzi-052@163.com.
旻岳 董 (Min-yue DONG), Email: dongmy@zju.edu.cn.
References
- 1.LAHIJI F A, ASGARI F, MIRZAEE F, et al Clinical and functional results of radial club hand with centralization and pollicization using the second metacarpus: A clinical case series. Int J Surg Case Rep. 2019;6:285–290. doi: 10.1016/j.ijscr.2019.07.076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.HALL J G, LEVIN J, KUHN J P, et al Thrombocytopenia with absent radius (TAR) Medicine. 1969;48(6):411–439. doi: 10.1097/00005792-196948060-00001. [DOI] [PubMed] [Google Scholar]
- 3.张文英, 房春晓, 叶铁真 血小板减少伴桡骨缺失综合征一例. 中华儿科杂志. 2010;48(8):633–634. doi: 10.3760/cma.j.issn.0578-1310.2010.08.018. [DOI] [Google Scholar]
- 4.ALBERS C A, PAUL D S, SCHULZE H, et al Compound inheritance of a low-frequency regulatory SNP and a rare null mutation in exon-junction complex subunit RBM8A causes TAR syndrome. Nat Genet. 2012;44(4):435–439, S1-2. doi: 10.1038/ng.1083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.PEREIRA E, REGALO A, CASEIRO L, et al Thrombocytopenia and absent radius (TAR) syndrome in pregnancy. BMJ Case Rep. 2015;2015:bcr2015212088[2021-06-07]. https://doi.org/10.1136/bcr-2015-212088. doi: 10.1136/bcr-2015-212088. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.ALAGBE O A, ALAGBE A E, ONIFADE E O, et al Thrombocytopenia with absent radii (TAR) syndrome in a female neonate: A case report. Pan Afr Med J. 2019;33:181. doi: 10.11604/pamj.2019.33.181.13928. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.吕超伟, 蔡尤墨 血小板减少伴桡骨缺如综合征1例报告. 福建医药杂志. 1996;3:132–133. [Google Scholar]
- 8.PANG H, YU X, KIM Y M, et al Disorders associated with diverse, recurrent deletions and duplications at 1q21.1. Front Genet. 2020;11:577[2021-06-13]. https://doi.org/10.3389/fgene.2020.00577. doi: 10.3389/fgene.2020.00577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.刘蓓, 杨艳梅, 严恺, 等 Ⅰ型神经纤维瘤一家系的基因检测及产前诊断. 浙江大学学报(医学版) 2019;48(4):367–372. [Google Scholar]
- 10.BRODIE S A, RODRIGUEZ-AULET J P, GIRI N, et al 1q21.1 deletion and a rare functional polymorphism in siblings with thrombocytopenia-absent radius-like phenotypes. Cold Spring Harb Mol Case Stud. 2019;5(6):a004564[2021-06-07]. https://doi.org/10.1101/mcs.a004564. doi: 10.1101/mcs.a004564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.KLOPOCKI E, SCHULZE H, STRAUSS G, et al Complex inheritance pattern resembling autosomal recessive inheritance involving a microdeletion in thrombocytopenia-absent radius syndrome. Am J Hum Genet. 2007;80(2):232–240. doi: 10.1086/510919. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.CHUANG T W, LEE K M, TARN W Y Function and pathological implications of exon junction complex factor Y14. Biomolecules. 2015;5(2):343–355. doi: 10.3390/biom5020343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.BOTTILLO I, CASTORI M, DE BERNARDO C, et al Prenatal diagnosis and post-mortem examination in a fetus with thrombocytopenia-absent radius (TAR) syndrome due to compound heterozygosity for a 1q21.1 microdeletion and a RBM8A hypomorphic allele: a case report. BMC Res Notes. 2013;6:376[2021-06-13]. https://doi.org/10.1186/1756-0500-6-376. doi: 10.1186/1756-0500-6-376. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.PAPOULIDIS I, OIKONOMIDOU E, ORRU S, et al Prenatal detection of TAR syndrome in a fetus with compound inheritance of an RBM8A SNP and a 334-kb deletion: A case report. Mol Med Rep. 2014;9(1):163–165. doi: 10.3892/mmr.2013.1788. [DOI] [PubMed] [Google Scholar]
- 15.TASSANO E, GIMELLI S, DIVIZIA M T, et al Thrombocytopenia-absent radius (TAR) syndrome due to compound inheritance for a 1q21.1 microdeletion and a low-frequency noncoding RBM8A SNP: A new familial case. Mol Cytogenet. 2015;8:87[2021-06-13]. https://doi.org/10.1186/s13039-015-0188-6. doi: 10.1186/s13039-015-0188-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.WAESPE N, DHANRAJ S, WAHALA M, et al The clinical impact of copy number variants in inherited bone marrow failure syndromes. NPJ Genom Med. 2017;2:18[2021-06-07]. https://doi.org/10.1038/s41525-017-0019-2. doi: 10.1038/s41525-017-0019-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.MANUKJAN G, BÖSING H, SCHMUGGE M, et al Impact of genetic variants on haematopoiesis in patients with thrombocytopenia absent radii (TAR) syndrome. Br J Haematol. 2017;179(4):606–617. doi: 10.1111/bjh.14913. [DOI] [PubMed] [Google Scholar]
- 18.CHANDLER N, BEST S, HAYWARD J, et al Rapid prenatal diagnosis using targeted exome sequencing: a cohort study to assess feasibility and potential impact on prenatal counseling and pregnancy management. Genet Med. 2018;20(11):1430–1437. doi: 10.1038/gim.2018.30. [DOI] [PubMed] [Google Scholar]
- 19.TRAVESSA A M, DIAS P, SANTOS A, et al Upper limb phocomelia: A prenatal case of thrombocytopenia-absent radius (TAR) syndrome illustrating the importance of chromosomal microarray in limb reduction defects. Taiwan J Obstet Gynecol. 2020;59(2):318–322. doi: 10.1016/j.tjog.2020.01.024. [DOI] [PubMed] [Google Scholar]
- 20.MIERTUŠ J, MALTESE P E, HÝBLOVÁ M, et al Expanding the phenotype of thrombocytopenia absent radius syndrome with hypospadias. J Biotechnol. 2020;311:44–48. doi: 10.1016/j.jbiotec.2020.02.011. [DOI] [PubMed] [Google Scholar]